CausasArriba
1) infiltración o compresión tumoral de diferentes estructuras, o complicaciones (p. ej. fracturas patológicas de vértebras a consecuencia de metástasis)
2) procesos que acompañan a la enfermedad neoplásica, p. ej. caquexia tumoral (causa frecuente del dolor miofascial)
3) tratamiento oncológico (p. ej. plexopatías por radioterapia, síndromes dolorosos tras mastectomía, neuropatías tras quimioterapia)
4) otros coexistentes (p. ej. cefalea, dolor coronario).
TratamientoArriba
Principios generales de la farmacoterapia (según la OMS)
1. Administrar los medicamentos VO, y si no es posible (debido a náuseas, vómitos, trastornos de la deglución o de la absorción), VSc, iv. (especialmente en enfermos con acceso venoso) o por vía transdérmica. En enfermos agonizantes, incapaces de deglutir, cambiar la vía de administración de VO a VSc, no iniciar terapia transdérmica.
2. En caso de dolor persistente administrar los medicamentos de forma regular (y no solo al intensificarse el dolor), a intervalos dependientes de la farmacocinética del medicamento. El enfermo también debe disponer de preparados de liberación inmediata para usarlos en caso de dolor irruptivo (el que aparece a pesar del tratamiento regular pautado).
3. Individualizar el tratamiento en función del tipo de dolor (somático, visceral, neuropático, óseo, mixto) y de su etiología y administrar fármacos a las dosis que permitan aliviar el dolor hasta niveles aceptables para el enfermo.
4. Prestar atención a los detalles, p. ej. ajustar la administración de la primera y la última dosis de analgésico al patrón del sueño del enfermo.
5. Se debe preparar un esquema de tratamiento analgésico detallado para el enfermo y sus allegados, que debe incluir los nombres de medicamentos, razones para su uso, dosificación e intervalos de administración, así como los posibles efectos adversos. Puede ser de utilidad la escalera analgésica →fig. 24.1-1. En caso de dolores de baja intensidad, iniciar el tratamiento con paracetamol y/o antinflamatorios no esteroideos (AINE), si no hay contraindicaciones. Si el efecto no es satisfactorio, pasar al siguiente nivel. En enfermos con dolor oncológico de mayor intensidad, utilizar un opioide generalmente ya desde el principio de la terapia, independientemente del mecanismo que causa el dolor. En cada nivel de la escalera analgésica considerar las indicaciones para administrar coadyuvantes y medicamentos que minimizan los efectos indeseables. En el 2.º y 3.er nivel de la escalera analgésica, considerar la continuación de analgésicos no opioides, ya que pueden potenciar la acción analgésica del opioide. En el 3.er nivel de la escalera analgésica, considerar la continuación de AINE, siempre y cuando existan indicaciones para ello (p. ej. dolor óseo). La decisión sobre continuar con un fármaco no opioide debe basarse en la evaluación del efecto analgésico y la tolerancia al tratamiento. No se recomienda usar paracetamol simultáneamente con opioides potentes, ya que esto no mejora el efecto analgésico en pacientes con neoplasias.
Analgésicos no opioides
1. Paracetamol: actúa rápidamente (15-30 min) y su acción es corta (hasta 4-6 h). No sobrepasar 15 mg/kg (1 g) por dosis VO/iv.; se puede repetir máx. 4 × d. La dosis máxima diaria en adultos sin riesgo elevado de hepatotoxicidad es de 4 g (en pacientes mayores 3 g, y según algunos expertos 2 g). El riesgo de hepatotoxicidad es alto en enfermos con caquexia que no reciben alimentación y en alcohólicos, entre otros.
2. AINE: son los fármacos con mayor efecto analgésico para los dolores nociceptivos de origen inflamatorio, óseo y miofascial. Evaluar el riesgo de reacciones adversas circulatorias, digestivas y nefrológicas. Considerar la profilaxis de las complicaciones digestivas →Enfermedad ulcerosa gástrica y duodenal.
PERSPECTIVA LATINOAMERICANA
El metamizol (dipirona) en algunos países (p. ej. en Chile) es un analgésico no opioide utilizado frecuentemente en el tratamiento del dolor neoplásico. Sin embargo, debido al riesgo de agranulocitosis causado por su uso, está retirado en algunos países (este riesgo es bajo y similar al de otros AINE: de un 0,03-0,5 % en pacientes europeos, mientras que la incidencia de pacientes hispanos está alrededor de 0,38/1 000 000 de habitantes/año). Es un analgésico y antipirético eficaz, sin actividad antinflamatoria significativa. La eficacia analgésica de dosis altas (hasta 6,0 g/24 h) es mayor que de dosis menores (3,0 g/24 h) y es semejante a la eficacia de 60 mg/24 h de morfina VO.
Opioides menores
1. Codeína: en caso de usar un preparado que contiene solo codeína iniciar con 10-20 mg VO cada 4-6 h (algunos administran 10-30 mg cada 4-6 h). En caso necesario aumentar la dosis gradualmente hasta máx. 240 mg/d.
2. Dihidrocodeína: VO desde 60 mg cada 12 h. Si es necesario aumentar progresivamente hasta 120 mg cada 12 h.
3. Tramadol: generalmente dosis inicial de 25-50 mg cada 8-6-4 h VO en una formulación de liberación inmediata. En pacientes mayores, con caquexia y/o trastornos de la función renal comenzar con 12,5-25 mg. En caso de necesidad aumentar gradualmente la dosis en un 30-50 % cada 24 h, hasta máx. 400 mg/d. En personas >75 años, incluso con función renal y hepática buena, no sobrepasar 300 mg/d. Administrar las preparaciones de liberación prolongada cada 12 h. Produce menos estreñimiento que la codeína y la dihidroxicodeína, pero con frecuencia produce náuseas y/o vómitos al inicio del tratamiento. Además, inhibe la recaptación de serotonina y asociado a otros medicamentos que aumentan el nivel de la serotonina puede producir el síndrome serotoninérgico. No administrar con inhibidores de la MAO ni durante los siguientes 14 días después de su interrupción ni con antidepresivos tricíclicos ni inhibidores de la recaptación de serotonina. Tampoco en la insuficiencia renal terminal (TFGe ≤10 ml/min/1,73 m2) ni en enfermos con antecedentes de epilepsia (por un mayor riesgo de convulsiones). Modificar el manejo en función del grado de insuficiencia hepática y renal.
4. Pequeñas dosis de morfina (≤30 mg/d), oxicodona (≤20 mg/d) o hidromorfona (≤4 mg/d). La EAPC (2012) los considera opioides de 2.º nivel de la escalera analgésica. Ejemplo: morfina en la preparación de liberación inmediata en pequeñas dosis iniciales (p. ej. 2,5 mg cada 4 h VO) en un enfermo con dolor y disnea (opioide de elección para mitigar la disnea).
PERSPECTIVA LATINOAMERICANA
En Chile, la guía clínica Alivio del Dolor por Cáncer Avanzado y Cuidados Paliativos del MINSAL (2011) recomienda la dosis inicial de codeína de 30 mg cada 4-6 h y la dosis máxima de 360 mg.
La dihidrocodeína y hidromorfona no están dosponibles en Argentina y Chile.
Opioides mayores
1. Morfina: la titulación de la dosis por vía oral debe realizarse utilizando preparaciones de liberación inmediata (se recomienda en especial en casos con dolor mal controlado, debido a su rápido efecto) o controlada. El efecto analgésico de preparados de liberación inmediata comienza a los 30 min y dura ~4 h. Iniciar con dosis baja y aumentarla gradualmente →tabla 24.1-1. No aumentar la dosis una vez controlado el dolor. Si aparecen efectos indeseables difíciles de controlar → considerar el cambio de tratamiento (interrumpir la administración de morfina y usar otro opioide o disminuir la dosis de morfina y añadir otros medicamentos, usar métodos no farmacológicos, etc.). Habitualmente se alcanza la dosis regular en las primeras 48 h. Durante el período de titulación con morfina de liberación inmediata, administrada VO cada 4 h, se puede considerar aumentar la dosis antes de acostarse en un 50 % para asegurar un control del dolor hasta la mañana y evitar despertar al enfermo en horas nocturnas para administrar otra dosis. Después de establecer la dosis diaria eficaz con fármacos de liberación inmediata se puede cambiar a la preparación de liberación controlada (administrar cada 12 h), o a otro opioide mayor en dosis equivalente y de liberación prolongada →más adelante. Asegurar siempre la disponibilidad de dosis de rescate (generalmente en forma de morfina de liberación inmediata en una dosis titulada individualmente, en general 1/10-1/6 de la dosis diaria calculada como equivalente en relación al opioide administrado regularmente). En algunos enfermos, el efecto analgésico de la morfina de liberación controlada puede ser más corto. En este caso, si la preparación se ha administrado cada 12 horas, se debe repartir la dosis diaria en 3 tomas, es decir cada 8 horas. Si hay que cambiar la vía de administración VO a VSc → disminuir la dosis diaria en 2-3 veces y administrar en infusión continua o en dosis divididas cada 4 h. En la insuficiencia renal se pueden acumular metabolitos activos de la morfina → es preferible utilizar otro opioide (buprenorfina, fentanilo o metadona). Si esto no es posible (p. ej. enfermo con insuficiencia renal leve o moderada y con disnea, en cuyo caso la morfina es el opioide de elección) → reducir la dosis, aumentar los intervalos entre las siguientes dosis, opcionalmente administrar solo en caso de necesidad o considerar cambiar la vía de administración a parenteral y monitorizar estrictamente el tratamiento.
PERSPECTIVA LATINOAMERICANA
En Chile está disponible solución de morfina de 20 mg/ml en gotas y jarabe, no existe la formulación de liberación inmediata en comprimidos.
En Argentina existen comprimidos de liberación inmediata de 10 mg y de 30 mg, y también se utilizan las soluciones magistrales (0,1-4 %). Los comprimidos de liberación controlada son de 10, 30 y 60 mg.
2. Oxicodona: fármaco alternativo a la morfina, con el que también se puede iniciar el tratamiento con opioide mayor, generalmente después de interrumpir los opioides menores a dosis máximas. Presentaciones:
1) comprimidos recubiertos
2) preparación de liberación controlada (cuidado: las preparaciones tienen un patrón distinto de liberación de la sustancia activa). La oxicodona se utiliza frecuentemente después de un tratamiento inicial con morfina, tomando la conversión 1,5-2:1 (p. ej. 15 mg/d de morfina VO → 10 mg/d de oxicodona).
Dosificación inicial al introducir la oxicodona como el primer opioide mayor luego de interrumpir las dosis máximas de opioides menores (cuando no se sospecha metabolismo lento por CYP2D6) →tabla 24.1-1):
1) En preparado de liberación inmediata 5 mg cada 4-6 h. Enfermos con caquexia, mayores, con leves trastornos de la función hepática o renal desde 2,5 mg cada 6 h.
2) En preparado de liberación controlada p. ej. desde 10 mg cada 12 h. Enfermos con caquexia, mayores, con leves trastornos de la función hepática o renal desde 5 mg cada 12 h.
En caso de iniciar el tratamiento con oxicodona sin la administración previa de opioides menores (es decir, dosis bajas de oxicodona, 2.º nivel de la escalera analgésica), administrar el fármaco en forma de preparado de liberación inmediata (p. ej. a partir de 2,5 mg cada 4-6 h) o de liberación controlada (p. ej. a partir de 5 mg cada 12 h).
Para el tratamiento del dolor irruptivo en enfermos tratados con oxicodona, al principio se pueden aprovechar las preparaciones de morfina u oxicodona de liberación inmediata (si no es eficaz, considerar fentanilo transmucoso). Existe una presentación oral de liberación prolongada para el uso crónico compuesta de oxicodona con naloxona (dosis diaria de máx. 160 mg/80 mg), en la cual la naloxona disminuye los trastornos intestinales causados por los opioides. Evitar la naloxona en enfermos con disfunción hepática.
PERSPECTIVA LATINOAMERICANA
En Chile no hay formulación de oxicodona de liberación inmediata para titular la dosis VO, solo está disponible en forma de ampollas.
En Argentina la oxicodona comercialmente existe en forma de comprimidos de 5 mg y también se hacen preparaciones magistrales. Se dispone de comprimidos recubiertos de liberación controlada de 10, 20 y 40 mg.
La preparación compuesta de oxicodona con naloxona no está cubierta por seguro GES en Chile.
3. Fentanilo (sistema terapéutico transdérmico; los parches no deben ser cortados): se utiliza cuando los opioides menores son ineficaces y están indicados opioides mayores. Puede ser administrado con precaución a enfermos con insuficiencia renal y en diálisis. Se debe titular la dosis utilizando una preparación de morfina de liberación inmediata →más arriba. Pautas para el cambio de morfina oral por fentanilo transdérmico →tabla 24.1-2. También existen tabletas orales transmucosas, sublinguales y preparaciones intranasales para los casos de dolor irruptivo. Las dosis de rescate por vía transmucosa requieren ser tituladas de forma separada. Por la posibilidad de existencia de trazas de sustancias ferromagnéticas en el parche, hay que retirarlo antes de realizar una RMN y colocarlo de nuevo después.
PERSPECTIVA LATINOAMERICANA
El fentanilo transmucoso está disponible en Chile y Argentina en forma de comprimidos de disolución bucal de 100, 200, 400, 600 y 800 µg. Las preparaciones intranasales no están disponibles en Argentina.
El fentanilo transdérmico está disponible en Chile y Argentina en forma de parches de 25 µg/h y 50 µg/h. Tiene una acción residual al retirar el parche de hasta 17 h.
4. Buprenorfina: sistema terapéutico transdérmico indicado en el dolor estable. Se puede titular la dosis p. ej. utilizando una preparación de morfina de liberación inmediata (→más arriba); dosis inicial de 17,5-35 µg/h o una adecuadamente calculada en el caso de cambio de un opioide mayor a buprenorfina transdérmica; dosis máx. 140 µg/h. Cambio de la morfina VO por buprenorfina transdérmica →tabla 24.1-3. La buprenorfina puede ser administrada en enfermos con insuficiencia renal y en diálisis.
En ~10 % de los enfermos que cambian de morfina a fentanilo o a buprenorfina se presenta un síndrome de abstinencia que dura algunos días, principalmente bajo la forma de trastornos gastrointestinales. Normalmente, la administración de dosis adicionales de morfina, en caso de necesidad, elimina estos síntomas. Si se requiriera despegar el parche, recordar que se mantienen unos niveles sanguíneos significativos durante ≥24-30 h. Por la posibilidad de existencia de trazas de sustancias ferromagnéticas en el parche, hay que retirarlo antes de realizar una RMN y colocarlo de nuevo después.
PERSPECTIVA LATINOAMERICANA
En Chile está disponible en parches de 5, 10, 20 y 35 µg/h, mientras que en Argentina en parches de 5, 10 y 20 µg/h.
5. Tapentadol: agonista del receptor opioide µ e inhibidor de la recaptación de noradrenalina (MOR-NRI). Su complejo mecanismo de acción explica no solo su efecto analgésico beneficioso, sobre todo en el dolor neuropático, sino también una menor intensidad y frecuencia de efectos adversos limitados al tracto digestivo (en comparación con opioides típicos). La dosis máxima es de 250 mg 2 × d.
PERSPECTIVA LATINOAMERICANA
En Chile está disponible en comprimidos de 50 mg de liberación inmediata a administrar cada 4-6 h, y de 50 y 100 mg de liberación controlada a tomar cada 12
En Argentina no está disponible comercialmente. Dosis máxima 500 mg/d.
6. Metadona: opioide utilizado sobre todo si se necesita cambiar un opioide mayor (por lo general morfina o fentanilo) por otro a consecuencia de efectos secundarios no tolerados o por desarrollar tolerancia. Puede ser utilizado en la insuficiencia renal y en diálisis. Debido a su farmacocinética (vida media larga, entre otros), el tratamiento con metadona debe ser controlado por un especialista.
PERSPECTIVA LATINOAMERICANA
En Argentina está disponible en comprimidos de 5, 10 y 40 mg, y también se utilizan preparados magistrales.
En Chile está disponible en comprimidos de 10 mg, y ampollas de 10 mg.
7. Indicaciones de inicio del tratamiento con opioides mayores: la titulación de los opioides mayores tras pasar el 2.º nivel de la escalera analgésica se realiza generalmente con preparados orales de liberación inmediata o de liberación modificada. Con este propósito se suele utilizar la morfina, opcionalmente la oxicodona. En la titulación, la elección entre los preparados de morfina de liberación inmediata o controlada depende en gran medida de la preferencia del enfermo, pero también de la situación clínica.
1) La titulación clásica (→tabla 24.1-1) con morfina de liberación inmediata parece estar particularmente indicada en enfermos que padecen dolor mal controlado (el efecto analgésico aparece a los 30 min de la administración del medicamento y dura ~4 h).
2) Cuando los opioides menores a dosis máximas son insuficientes (valorar la posibilidad de metabolismo lento por CYP2D6 →tabla 24.1-1) y el dolor empeora muy lentamente, cambiar el opioide por uno mayor al utilizar un preparado de liberación controlada (y no inmediata); p. ej. morfina 20 mg (10-30 mg) VO cada 12 h, oxicodona 10 mg cada 12 h. Siempre hay que asegurar la posibilidad de administrar dosis de rescate de un opioide mayor (por lo general de morfina) de liberación inmediata y en caso de necesidad (basándose en el número de dosis de emergencia) aumentar la dosis regular del opioide. El ritmo con el que se aumenta la dosis regular depende de la farmacocinética (p. ej. para la morfina de liberación controlada administrada cada 12 h, con frecuencia no mayor de 48-72 h).
3) En caso de dolor muy intenso, puede estar indicada una rápida titulación de un opioide mayor, habitualmente administrado por vía parenteral, p. ej. morfina iv. 1-2 mg cada 10 min (en situaciones extremas se puede reducir el intervalo entre las siguientes dosis iv. hasta 5 min), opcionalmente 2-5 mg Vsc cada 30 min (en situaciones extremas se puede reducir el intervalo entre las siguientes dosis Vsc hasta 20 min) hasta que se logre un alivio notable del dolor o hasta la aparición de efectos indeseables (somnolencia). Continuación del tratamiento: infusión continua iv./VSc o en forma fraccionada VSc/VO. Es necesario vigilar al paciente de forma estricta y asegurar la disponibilidad de naloxona. En enfermos con una grave alteración de la perfusión periférica (p. ej. deshidratación, shock, enfriamiento) la absorción de los medicamentos administrados de forma subcutánea puede estar retardada, y en caso de mejorar la perfusión se puede producir una absorción repentina de la dosis disponible en el tejido subcutáneo.
8. Actuación en caso de efectos adversos de los opioides
1) Somnolencia durante el día: generalmente se presenta al inicio del tratamiento con opioides o después de un importante aumento de la dosis y desaparece en algunos días. Si la somnolencia no cede o empeora → reducir la dosis del opioide hasta la mínima que evite la reaparición del dolor. A continuación se deben tener en cuenta otras causas de somnolencia (p. ej. otros medicamentos, deshidratación, insuficiencia renal, hipercalcemia) y en caso de confirmarlas hay que tomar las medidas adecuadas. Si la somnolencia se mantiene, puede estar indicado el cambio a otro opioide (→más adelante).
2) Náuseas y vómitos: pueden aparecer en los primeros días del inicio del opioide y por lo general ceden espontáneamente. Debe advertirse al enfermo la posibilidad de aparición de náuseas y vómitos de tipo temprano, y definir conjuntamente el manejo de dichos síntomas (p. ej. el uso de fármacos antieméticos de forma regular durante un corto período de tiempo, o de manera ad hoc, algunos expertos recomiendan un antiemético en los primeros días del uso de opioides). Administrar metoclopramida VO/VSc, siempre vigilando la tolerancia y los efectos secundarios, a dosis de 10 mg 3 × d (máx. 30 mg/d, hasta 5 días; salvo los casos de uso de tramadol) o haloperidol, inicialmente en infusión continua VSc 0,5-1,5 mg/d o VO/VSc por la noche y en caso de necesidad, no más frecuentemente que cada 2 h y, a continuación, titular la dosis adecuadamente; el rango de dosis diarias es de 0,5-5 mg. Si el fármaco no resulta eficaz → considerar cambiar el haloperidol por levomepromazina; iniciar desde 3,125-6,25 mg/d VSc y gradualmente ir aumentando la dosis, evitando el efecto sedativo (las dosis únicas de 1,25-2,5 mg pueden resultar eficaces). Considerar la administración de otros antieméticos. Siempre descartar otras causas de las náuseas, pero si se mantienen → considerar cambiar a otro fármaco de este grupo.
PERSPECTIVA LATINOAMERICANA
La levomepromazina está disponible en Chile solo en forma oral, mientras que en Argentina existen ampollas de 25 mg, comprimidos de 2 y 25 mg y solución oral al 1 %.
3) Estreñimiento: es el efecto adverso más común. Habitualmente, además del tratamiento no farmacológico se deben administrar laxantes profilácticamente y de forma regular →tabla 1.19-1.
4) Otros: sequedad de boca, prurito, retención de orina, sudoración, alteración de las funciones cognitivas y de la concentración, neurotoxicidad esporádica (con mioclonías, confusión e hiperalgesia), supresión de la secreción de LH, FSH, ACTH y GH, hiperalgesia opioide.
La rotación de opioides se realiza en casos de efectos secundarios intolerables y resistentes al tratamiento, o en caso de desarrollar tolerancia a un determinado opioide. Debido a una incompleta tolerancia cruzada entre opioides, disminuir la dosis inicial del segundo opioide en relación al valor calculado basado en las tablas de equivalencia analgésica (se disminuye la dosis inicial en un 25-75 %; la reducción aumenta de manera proporcional a la dosis de opioide utilizada previamente y también es mayor cuando el cambio se debe a falta de efecto analgésico, al desarrollo de tolerancia al opioide anterior o a hiperalgesia opioide). Consultar con un especialista en medicina paliativa o en medicina del dolor.
9. Sobredosis de opioides utilizados con fines terapéuticos: la bradipnea <8-10/min, pupilas puntiformes con reacción débil a la luz y la alteración de la conciencia son efectos preocupantes. En estos casos, derivar al enfermo al hospital (si se encuentra en casa), interrumpir la siguiente dosis del opioide, hidratar correctamente para aumentar la diuresis, garantizar la permeabilidad de la vía aérea y el acceso a oxigenoterapia. En caso de depresión del centro respiratorio administrar naloxona iv. En una situación de compromiso vital inminente (p. ej. enfermo inconsciente con inspiraciones y espiraciones aisladas o que no respira) la dosis inicial suele ser de 0,4 mg. En otras situaciones utilizar dosis menores (para prevenir la reaparición del dolor y el síndrome agudo de abstinencia): 0,02-0,1 mg iv. cada ~2 min hasta la recuperación de la función respiratoria. Recordar que puede ser necesario administrar dosis adicionales de naloxona iv., si el opioide se sigue absorbiendo. Esto se refiere particularmente a los opioides transdérmicos. Debido a la fuerte afinidad de la buprenorfina al receptor opioide, en caso de sobredosis, las dosis de naloxona iv. deben ser significativamente mayores y administradas por más tiempo.
PERSPECTIVA CHILENA
El MINSAL de Chile recomienda administrar naloxona a dosis de 0,04 mg iv. cada 2 min hasta recuperar la frecuencia respiratoria.
Coadyuvantes
Medicamentos que, sin ser analgésicos, en ciertos tipos de dolor muestran actividad analgésica o potencian la acción de los analgésicos. Se utilizan principalmente para el dolor neuropático.
1. Fármacos antiepilépticos
1) Gabapentina: registrada para el tratamiento del dolor neuropático, bien tolerada, no tiene interacciones medicamentosas significativas. Inicialmente 200-300 mg (100 mg en enfermos mayores o caquécticos) por la tarde; aumentar la dosis en 300 mg/d cada 2-3 días (100 mg en pacientes mayores o caquécticos), dependiendo del efecto. La somnolencia es el efecto adverso que con mayor frecuencia dificulta la titulación de la dosis. En los enfermos más jóvenes, sin caquexia, sin insuficiencia renal y que no reciben medicamentos de acción depresora sobre el SNC, se puede aumentar la dosis de forma rápida (en unos pocos días) hasta 300 mg 3 × d. La dosis máxima es de 1200 mg 3 × d. Corregir la dosis en casos de insuficiencia renal y en enfermos dializados.
2) Pregabalina: registrada para el tratamiento del dolor neuropático, bien tolerada, no tiene interacciones medicamentosas significativas. Comenzar con 75 mg 2 × d; si hay necesidad, ir aumentando progresivamente cada 3-7 días →150 mg 2 × d →225 mg 2 × d →300 mg 2 × d (dosis máx.). En pacientes débiles, caquécticos y mayores (geriátricos) comenzar con 25-50 mg 2 × d y con precaución ir aumentando la dosis. Corregir la dosis en casos de la insuficiencia renal y en enfermos dializados.
3) Carbamazepina: inicialmente 50-100 mg 2 × d; aumentar la dosis de forma lenta y progresiva hasta un máx. de 800-1200 mg/d. Recordar que puede producir numerosos efectos adversos e interacciones medicamentosas significativas.
4) Ácido valproico: menor efecto analgésico, pero mejor tolerado, con interacciones medicamentosas menos frecuentes. Comenzar con 150-200 mg (a veces a dosis menores; en preparado de liberación prolongada) por la noche, si es necesario aumentar la dosis progresivamente, administrando el fármaco 2 × d, hasta un máx. de 1500 mg/d.
2. Fármacos antidepresivos: se ha demostrado la eficacia de la duloxetina, la venlafaxina y de los antidepresivos tricíclicos en el tratamiento del dolor neuropático oncológico. El esquema de aumento de dosis depende del efecto y de los efectos indeseables (administrar por la noche): inicialmente 10 mg (sobre todo en enfermos mayores o caquécticos), después de 3-7 días 25 mg, luego en caso de necesidad ir aumentando la dosis en 25 mg/d cada 1-2 semanas. Por lo general en el tratamiento del dolor neuropático no se sobrepasa la dosis diaria de 100 mg (en personas >65 años no se recomiendan dosis de >75 mg/d).
PERSPECTIVA CHILENA
En cuanto a los tricíclicos, el fármaco más utilizado de este grupo en Chile es la amitriptilina (no administrar con tramadol por riesgo aumentado de convulsiones).
3. Otros coadyuvantes (de segunda elección o utilizados en indicaciones específicas): antagonistas del receptor MNDA (ketamina, dextrometorfano), bloqueadores de los canales de sodio (lidocaína iv.), clonidina, baclofeno, además de bifosfonatos, denosumab y glucocorticoides, usados en el dolor óseo. En varios tipos de dolor neuropático periférico resultan eficaces: la lidocaína en parches (especialmente en caso de alodinia concomitante) y la capsaicina en parches y en gel.
PERSPECTIVA LATINOAMERICANA
En Chile la capsaicina solamente está disponible en crema dérmica.
En Argentina no están disponibles la lidocaína en parches ni la capsaicina tópica (excepto como preparado magistral).
Tratamiento no farmacológico
1. El bloqueo y los procedimientos neurodestructivos (neurólisis, termolesión, criolesión, procedimientos neuroquirúrgicos) se deben considerar cuando el tratamiento farmacológico es inefectivo, no tolerado o imposible, el tipo de dolor constituye una indicación para este tipo de tratamiento, el paciente está de acuerdo con un procedimiento invasivo al que puede ser candidato.
1) neurólisis del plexo celíaco, indicada para el dolor oncológico por neoplasias de páncreas, estómago, hígado, vesícula biliar, intestinos, riñón, metástasis retroperitoneales o por distensión de la cápsula hepática y esplénica
2) bloqueos y neurólisis del plexo hipogástrico, en neoplasias, otros síndromes dolorosos de órganos pélvicos, calambres rectales dolorosos
3) bloqueos y neurólisis del ganglio estrellado, del segmento lumbar del tronco simpático, del ganglio impar de Walter
4) bloqueos centrales (subaracnoideos y epidurales) con técnica continua: se realizan en especial cuando los opioides sistémicos son poco efectivos o cuando se producen efectos adversos difíciles de controlar
5) bloqueos del sistema nervioso periférico, inyecciones en los puntos de activación, neurólisis del nervio intercostal.
2. Radioterapia: método de elección en el dolor localizado por metástasis óseas (en las metástasis óseas múltiples y diseminadas es posible la administración de un radioisótopo iv., p. ej. estroncio). A veces se emplea para el dolor neuropático, habitualmente localizado en la pelvis (tumores del área presacra, infiltración del plexo lumbosacro), en el miembro superior o en el hombro (tumor de Pancoast, metástasis en los ganglios axilares, cervicales y supraclaviculares).
3. Tratamiento quirúrgico. P. ej. en el dolor neuropático yatrogénico: resección de un neuroma, anastomosis de un nervio seccionado; en la compresión de la médula espinal: descompresión y estabilización de la columna; en el dolor óseo metastásico: estabilización profiláctica del hueso o equipo ortopédico conservador, o técnicas mínimamente invasivas como la vertebroplastia o la cifoplastia.
4. Electroestimulación nerviosa transcutánea (TENS): sobre todo en el dolor posoperatorio y en el dolor crónico no neoplásico.
5. Fisioterapia (masajes, ejercicios, terapia física): disminuye sobre todo el dolor miofascial o previene su aparición.
6. Terapia ocupacional (enseña al paciente a desenvolverse sin dolor y a disminuir la atención al dolor) y métodos psicológicos.
Situaciones especialesArriba
Dolor neuropático
Dolor relacionado con una lesión o enfermedad que afecta al sistema somatosensorial, p. ej. en el curso de la infiltración tumoral, de síndromes paraneoplásicos, después del tratamiento oncológico (p. ej. síndrome tras toracotomía o mastectomía, polineuropatía después de la quimioterapia, plexopatía después de la radioterapia), como consecuencia de caquexia (p. ej. mononeuropatías por compresión), y en el curso de enfermedades concomitantes (p. ej. herpes zóster, diabetes mellitus, uremia, después de un ACV).
Tratamiento:
1) dolor periférico neuropático puro por lesión del nervio periférico (p. ej. neuralgia herpética, síndrome doloroso por mastectomía) →fig. 24.1-2
2) dolor neuropático mixto oncológico; debido a la patogenia compleja, el tratamiento se inicia de acuerdo con la escalera analgésica y se añaden coadyuvantes, o simultáneamente, pero solo cuando se obtiene el mejor efecto posible pero insuficiente del opioide →fig. 24.1-3.
Dolor óseo
Se presenta generalmente en las metástasis óseas (a veces no se descubre el factor desencadenante). Inicialmente puede ser transitorio, pero normalmente se intensifica y se vuelve crónico. El dolor puede ser espontáneo o estar causado por el movimiento o por el desplazamiento del peso corporal. Es frecuente el dolor oseo local. Tratamiento →fig. 24.1-4.
Dolor miofascial
Dolor localizado en un músculo o referido. Frecuente en enfermos con neoplasias malignas en estadio avanzado, en pacientes caquécticos o inmovilizados. Se caracteriza por la presencia de puntos gatillo (área del músculo que no se relaja, debido al trastorno de la función de los canales de calcio, perceptible a la palpación como hipersensible, duro, nódulo fusiforme o en banda). Los puntos gatillo también pueden localizarse en la piel, tejido subcutáneo, ligamentos, tejido cicatricial postquirúrgico. La presión sobre un punto gatillo produce una sensación dolorosa con o sin dolor referido. Se localiza con mayor frecuencia en la región paraespinal, principalmente en el segmento lumbar, sacro y sobre los glúteos y también en la cabeza, cuello, parte anterior del tronco y en los miembros. La eliminación del punto gatillo alivia la sensación dolorosa. El enfermo describe el dolor referido como constante, sordo, de intensidad variable; generalmente disminuye después de la eliminación del punto gatillo. El dolor localizado en un músculo por lo general se intensifica al usar el músculo, lo que se relaciona con una discreta limitación de la amplitud del movimiento (menor uso de la extremidad), y hay una sensación de debilitamiento muscular. Se comprueba una fatigabilidad fácil y tensión del músculo implicado. Tratamiento: en personas en buen estado general utilizar la farmacoterapia solo cuando sea necesario, por un corto período de tiempo. Intentar restaurar una correcta longitud y fuerza muscular, postura y amplitud de movimiento en las articulaciones mediante ejercicios (estiramiento regular de los músculos), tratamiento de los puntos gatillo y el control de los factores desencadenantes. En los cuidados paliativos con frecuencia esto no es posible, así que el tratamiento sintomático se vuelve más importante: bloqueos de los puntos gatillo mediante infiltraciones de analgésicos locales (bupivacaína) o de glucocorticoides. Enfriamiento local del músculo con el punto gatillo con estiramiento pasivo simultáneo; fisioterapia (p. ej. masajes, ejercicios); psicoterapia (relajación, meditación); en caso necesario usar AINE y miorrelajantes.
Dolor irruptivo
Aumento repentino del dolor a pesar de un tratamiento adecuado del dolor principal. El dolor irruptivo se puede confirmar solo cuando se cumplen los dos criterios siguientes:
1) dolor constante o crónico de ≥12 h al día, o dolor que se presentaría si el paciente no recibiera analgésicos con regularidad
2) se consigue controlar el dolor constante (o que dura ≥12 h al día) de forma satisfactoria. De esta manera, para establecer el diagnóstico es necesario asegurarse de que el tratamiento del dolor constante es óptimo y que no se trata, p. ej., un aumento de la intensidad del dolor previo a la siguiente dosis del fármaco opioide (p. ej. antes de la siguiente administración de la preparación de morfina de liberación controlada utilizada cada 12 horas), o cuando las dosis administradas del opioide son demasiado pequeñas (se debe optimizar el tratamiento regular). Es esencial diferenciar el dolor irruptivo idiopático (independiente del estímulo) del incidental, producido por determinados estímulos conocidos como procedimientos diagnósticos o terapéuticos, o por una situación previsible (movimiento) o difícil de predecir (tos). Se debe intentar determinar el mecanismo del dolor irruptivo y tratar de actuar de forma específica. En el dolor paroxístico neuropático ante todo se debe optimizar el tratamiento regular (p. ej. asociar coadyuvantes). En el dolor incidental por metástasis óseas considerar la radioterapia, el tratamiento con radioisótopos, el tratamiento quirúrgico, el uso de equipos ortopédicos y también procedimientos mínimamente invasivos como la vertebroplastia o la cifoplastia.
La farmacoterapia del dolor irruptivo se basa en el uso de dosis de rescate de un medicamento administrado de forma inmediata para mitigar el dolor irruptivo o prevenir su aparición. Por lo general se utiliza una preparación de liberación inmediata y de acción lo más corta posible. A veces es suficiente el metamizol, un AINE o paracetamol, pero suele requerirse un opioide, generalmente morfina oral de liberación inmediata. La dosis de rescate en general está en el rango de 1/10-1/6 (o un 10-20 %) de la dosis diaria del opioide administrado regularmente, tomando en cuenta la equivalencia de la dosis (recordar que las dosis de rescate deben ser tituladas individualmente).
En caso de dolor incidental previsible utilizar profilácticamente p. ej. morfina de liberación inmediata VO 30-60 min antes del estímulo desencadenante de dolor. Para el dolor idiopático administrar el medicamento cuando se presente. Si el dolor irruptivo, sobre todo idiopático, no se alivia de forma satisfactoria por morfina VO de liberación inmediata, considerar el fentanilo transmucoso. Las dosis de emergencia de fentanilo no guardan relación con las dosis del opioide administrado regularmente, por lo que deben titularse aparte comenzando con la dosis más baja.
La mejor forma de aliviar el dolor irruptivo (en algunos enfermos, especialmente en el medio hospitalario) puede ser la administración parenteral del opioide.
TABLAS Y FIGURASArriba
Tabla 24.1-1. Titulación clásica de la dosis de morfina de liberación inmediata tras interrumpir el opioide menor (2.º nivel de la escalera analgésica)
|
1. Suspender el opioide menor.
2. Comenzar con la dosis de morfina de 5-10 mg (a veces 5 mg) cada 4 h VO (en personas mayores, en mal estado general y/o caquécticos 2,5-5 mg). En pacientes de edad avanzada aumentar los intervalos entre las dosis hasta 6 h, a veces hasta 8 h. Para establecer la dosis considerar si el paciente no es un metabolizador lento debido a la actividad de la CYP2D6 (pues la codeína no surte efecto analgésico y el efecto del tramadol es mucho más débil). En estos casos la dosis inicial de morfina debe ser menor, como en los casos sin tratamiento opioide previo. La eficacia de la morfina VO se evalúa mejor durante el período de efecto analgésico máximo, es decir, a los 60-90 min de la administración. Si hasta este momento el efecto no es satisfactorio, no es esperable una mejoría posterior.
3. Indicar las dosis adicionales de morfina en caso de persistir el dolor, generalmente iguales al 50-100 % de la dosis administrada regularmente cada 4 h.
4. Si el efecto analgésico no es suficiente y el enfermo recibe >2 dosis de rescate adicionales por día, aumentar las dosis en ≤25-50 % cada 1-2 días (basándose en la evaluación del efecto analgésico y en la suma de las dosis adicionales) hasta alcanzar un control satisfactorio del dolor, controlando la aparición de efectos adversos.
5. Después de determinar los requerimientos de morfina de liberación inmediata, pasar a morfina de liberación controlada en forma de morfina VO o, dependiendo de la situación, a oxicodona VO de liberación controlada, al fentanilo transdérmico o a la buprenorfina transdérmica (si se cambia el principio activo, es necesario realizar la conversión a dosis equivalentes).
6. Recordar las dosis de emergencia, p. ej. en el caso de morfina de liberación inmediata, individualizadas; generalmente 1/10-1/6 de la dosis diaria (teniendo en cuenta las dosis equivalentes). |
|
Nota: en caso de introducir morfina (y de cualquier otro opioide) explicar al enfermo los motivos de esta decisión. Preguntar su opinión y grado de aceptación de estos fármacos. Si el paciente tiene dudas y expresa miedo, tratar de indagar en mayor profundidad y conversar sobre el tema. Aclarar al enfermo y a sus allegados los efectos adversos que se pueden presentar y cómo actuar ante su aparición (se recomienda aportar información escrita).
Instruir al paciente a evaluar la intensidad del dolor y a registrarla en un diario. |
Tabla 24.1-2. Inicio del tratamiento con fentanilo transdérmico después de finalizar la titulación con morfina oral
|
1. Convertir la dosis diaria oral de morfina a fentanilo (p. ej. tomando la conversión 150:1a, 90 mg de morfina oral corresponde a 0,6 mg de fentanilo transdérmico = 25 µg/h) y seleccionar un parche que durante un día libere aproximadamente la misma cantidad de fentanilob.
2. Tras la colocación del primer parche, la concentración analgésica eficaz no se alcanza hasta transcurridas 12 h. Por ello, durante la transición de:
1) morfina oral de liberación inmediata → proseguir con las dosis regulares de morfina a la colocación del parche, a las 4 h y a las 8 h
2) morfina oral de liberación controlada durante 12 h → administrar la última dosis de morfina en el momento de la colocación del parche
3. En caso de necesidad indicar al paciente la administración de dosis de rescate de morfina de liberación inmediata.
4. Al tercer día de la colocación del primer parche sumar las dosis de morfina rápida de rescate empleadas y evaluar la necesidad de modificar la dosis de fentanilo. Un eventual cambio a parche con dosis mayores no debe realizarse hasta después de aplicar 1 o 2 parches.
5. Debido al menor efecto sobre el estreñimiento del fentanilo respecto a la morfina, se recomienda reducir la dosis de laxantes a la mitad y titular la dosis posteriormente.
6. Cambiar los parches cada 72 h.
7. Recordar las dosis de emergencia de los opioides de liberación inmediata (generalmente morfina) que alcanzan ~1/6c de la dosis diaria de fentanilo (tomando en cuenta la conversión). P. ej. al usar un parche de 25 µg/h la dosis de rescate de morfina VO de liberación inmediata generalmente alcanza 10 mg (si se usa la conversión 1:100) o 15 mg (si se usa la conversión 1:150). A veces es suficiente una dosis menor. |
|
a Por ficha técnica se recomienda la conversión 150:1 o 100:1, dependiendo de la situación clínica (→características del producto). El Palliative Care Formulary 7 recomienda 100:1.
b Nota: dependiendo de las indicaciones para cambiar de opioide, se debe tener en cuenta la disminución de la dosis inicial del segundo opioide en relación al valor calculado basado en las tablas de equivalencia analgésica (se disminuye la dosis inicial en un 25-75 %; la reducción aumenta de manera proporcional a la dosis de opioide utilizada previamente y también es mayor cuando el cambio del opioide se debe a la falta del efecto analgésico, al desarrollo de tolerancia al opioide anterior o a hiperalgesia opioide). Los expertos polacos (2017) también recuerdan que en pacientes con edemas periféricos y/o ascitis no se debe hacer una simple conversión de la dosis de la morfina, que es un opioide hidrófilo, a los opioides lipófilos, ya que en este caso las dosis altas de morfina pueden derivarse de un gran volumen de distribución.
c Según Palliative Care Formulary 7 |
Tabla 24.1-3. Inicio del tratamiento con buprenorfina transdérmica después de finalizar la titulación con la morfina oral
|
1. Convertir la dosis diaria de morfina oral a buprenorfina, tomando la conversión promedio 100:1a; elegir un parche que durante un día libere aproximadamente la misma cantidad de buprenorfina (p. ej. una dosis de morfina de 84 mg corresponde a 35 µg/h de buprenorfina)b.
2. La concentración analgésica se alcanza a las 12-24 h de la colocación del primer parche y sigue aumentando durante 32-54 h. Continuar con morfina durante las primeras ≥12 h. Se puede utilizar:
1) preparación de liberación inmediata VO en el momento de la colocación del parche, a las 4 y a las 8 h
2) preparación de liberación controlada que asegura un efecto durante 12 h al colocar el parche.
3. En caso de necesidad indicar al paciente la administración de dosis de rescate de morfina de liberación inmediata.
4. Evaluar el requerimiento de dosis de rescate al 4.º día de la colocación del parchec. Dado el largo período para lograr el equilibrio farmacológico (>9 d) de preferencia no aumentar la dosis de la buprenorfina antes de 7 días (después del segundo parche).
5. Debido al menor efecto sobre el estreñimiento de la buprenorfina respecto a la morfina, se recomienda reducir la dosis de laxantes a la mitad y titular la dosis posteriormente.
6. Cambiar los parches cada 72-96 h (de acuerdo con la ficha técnica; en caso de preparaciones que permiten la aplicación cada 96 h)d. Para minimizar el riesgo de equivocación se pueden fijar los días y las horas (p. ej. lunes 8:00, jueves 20:00).
7. Recordar las dosis de emergencia de los opioides de liberación inmediata (generalmente morfina) que alcanzan 1/10-1/6e de la dosis diaria de buprenorfina (en conversión a morfina). P. ej. al usar un parche de 35 µg/h la dosis de rescate de morfina VO de liberación inmediata generalmente alcanza 5-10 mg (si se usa la conversión 75:1) o 7,5-15 mg (si se usa la conversión 100:1). A veces es suficiente una dosis menor. |
|
a El Palliative Care Formulary propone la conversión 100:1; la European Association for Palliative care 75:1 y la ficha técnica 75-115:1.
b Nota: dependiendo de las indicaciones para cambiar de opioide, se debe tener en cuenta la disminución de la dosis inicial del segundo opioide en relación al valor calculado basado en las tablas de equivalencia analgésica (se disminuye la dosis inicial en un 25-75 %; la reducción aumenta de manera proporcional a la dosis de opioide utilizada previamente y también es mayor cuando el cambio del opioide se debe a la falta del efecto analgésico, al desarrollo de tolerancia al opioide anterior o a hiperalgesia opioide). Los expertos polacos (2017) también recuerdan que en pacientes con edemas periféricos y/o ascitis no se debe hacer una simple conversión de la dosis de morfina, que es un opioide hidrófilo, a los opioides lipófilos, ya que en este caso las dosis altas de morfina pueden derivarse de un gran volumen de distribución.
c Teniendo en cuenta las diferencias en la farmacocinética entre distintas preparaciones, dicha descripción se refiere a la preparación de buprenorfina que permite usarla cada 96 h.
d Los parches del preparado genérico deben cambiarse cada ≤72 h.
e Según Palliative Care Formulary 6; según las recomendaciones polacas (2017) 10-20 %. |
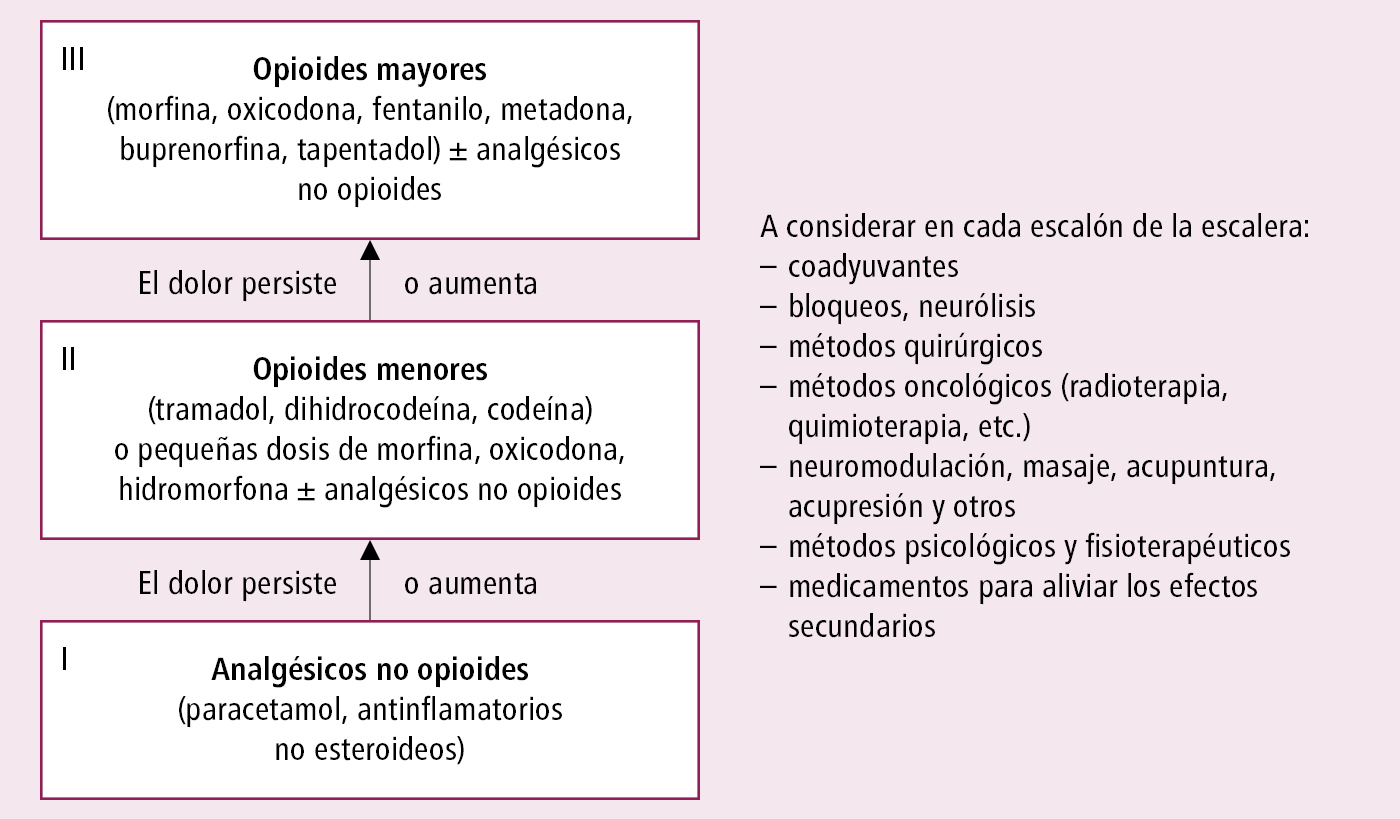
Fig. 24.1-1. Escalera analgésica de la OMS en combinación con otras técnicas de tratamiento del dolor
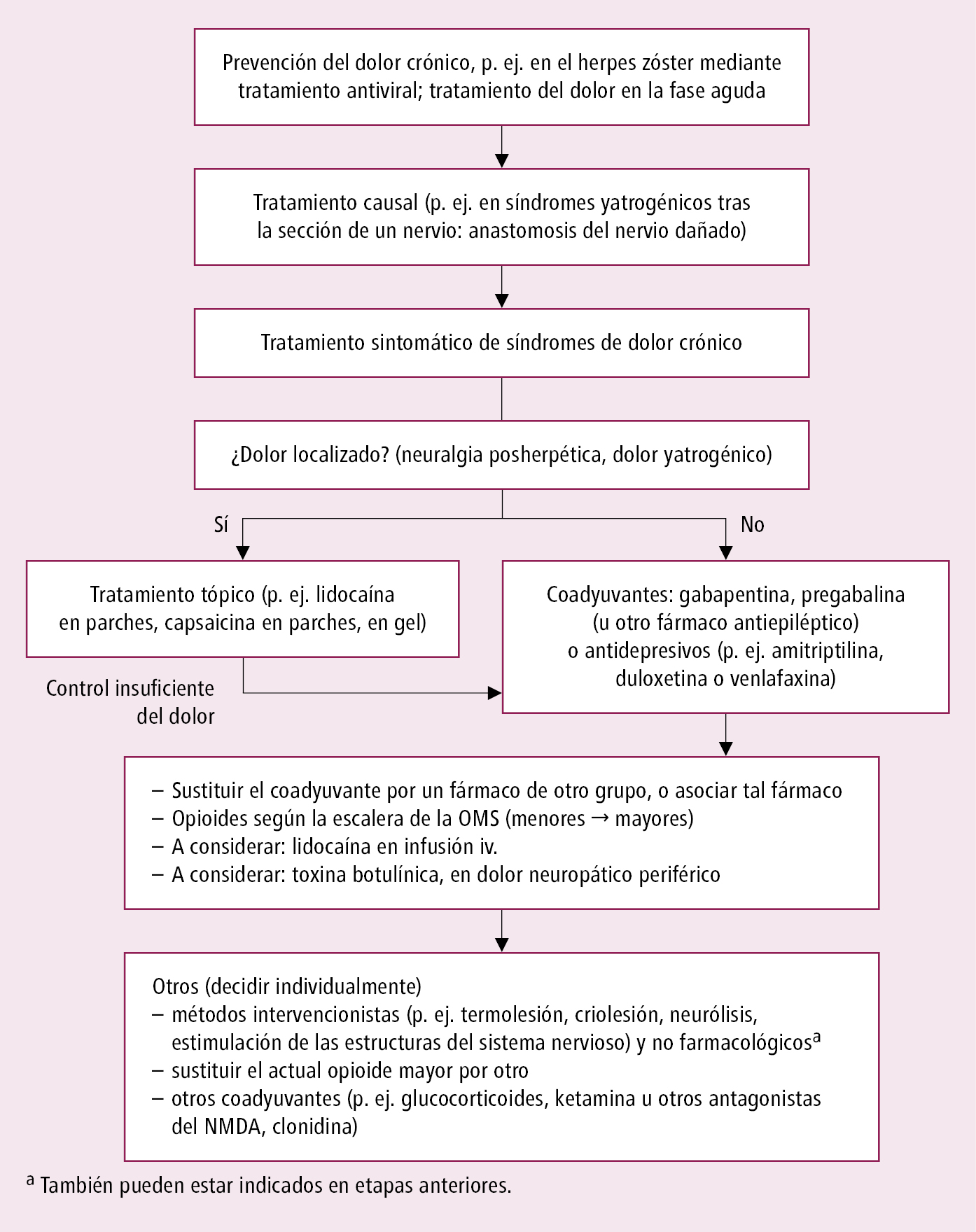
Fig. 24.1-2. Algoritmo de tratamiento del dolor neuropático puro
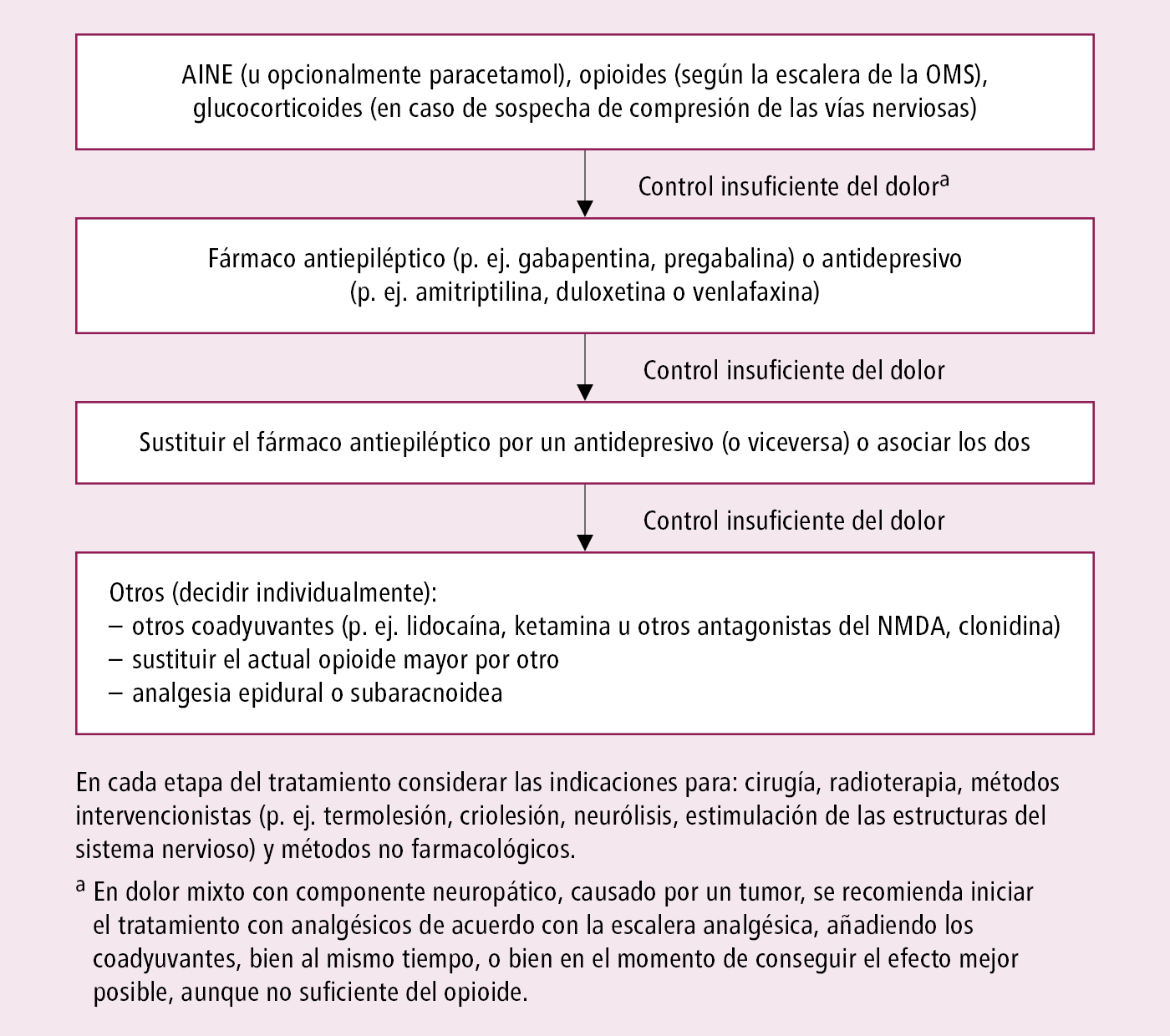
Fig. 24.1-3. Tratamiento del dolor mixto (con un componente neuropático) causado por neoplasias
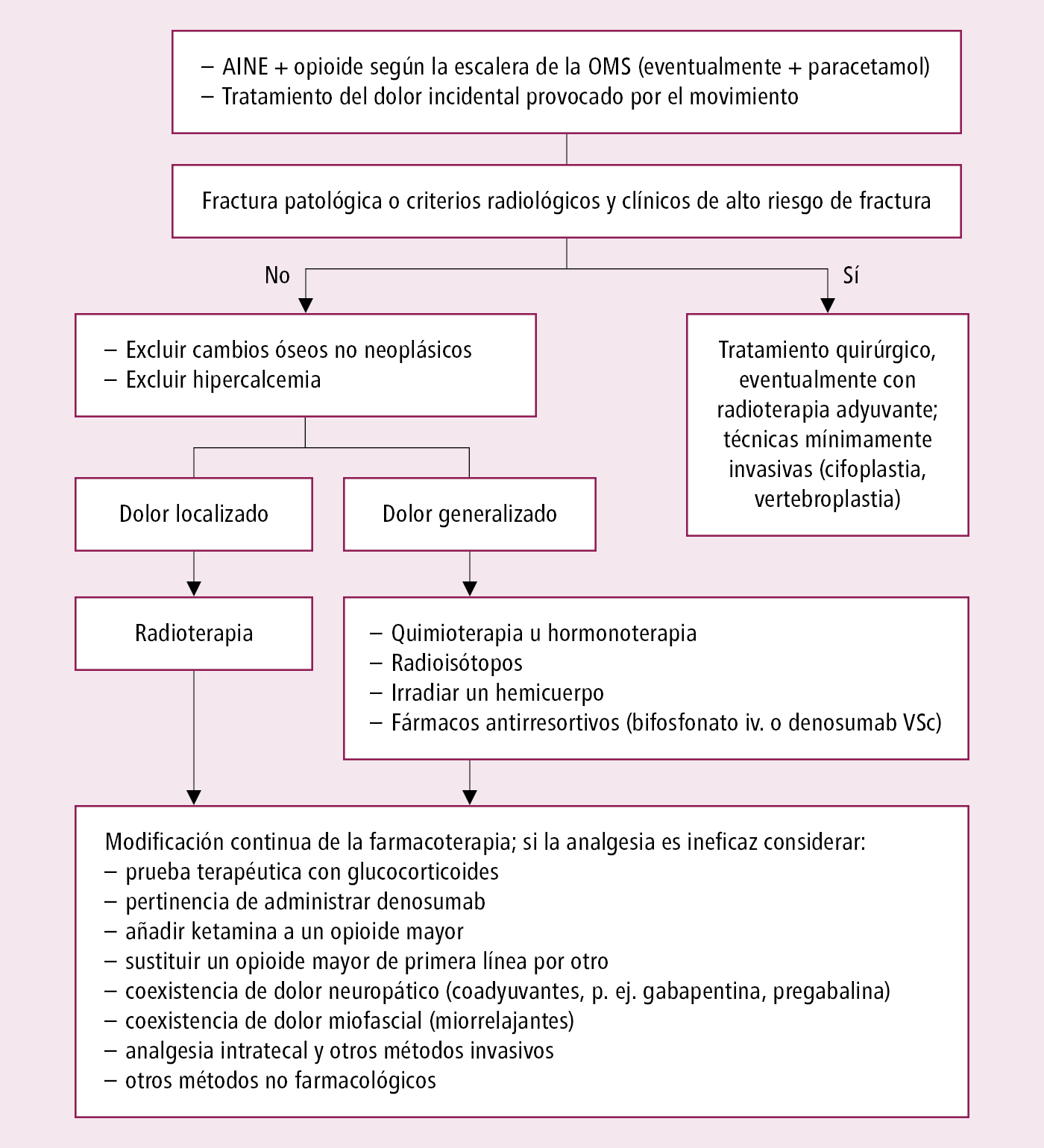
Fig. 24.1-4. Algoritmo de tratamiento del dolor óseo en la enfermedad neoplásica
Tabla 1.19-1. Laxantes utilizados en la terapia de estreñimiento
|
Fármacos y preparados |
Dosis |
Efectos adversos |
|
Hidrófilos y que aumentan el volumen de las hecesa |
|
|
Semillas de llantén de arena (Psyllium) o de llantén de la India (Plantago ovata)b |
10 g/d |
Meteorismo, flatulencia, alteración de la absorción de algunos fármacos
Ataques de asma, anafilaxia y otras reacciones alérgicas |
|
Fármacos osmóticosa |
Deshidratación |
|
|
Macrogoles (solución VO) |
8-25 g/d |
Náuseas, vómitos, dolor abdominal tipo cólico |
|
Lactulosa (jarabe) |
15-45 ml/d |
Meteorismo, flatulencia |
|
Glicerol |
3 g |
|
|
Fosfatos (enemas VR) |
120-150 ml |
Hiperfosfatemia e hipocalcemia |
|
Fármacos estimulantesa |
|
|
Antranoides (glucósidos antraquinónicos de origen vegetal) |
170-340 mg/d |
Dolor abdominal tipo cólico, pérdida excesiva de electrólitos |
|
|
Bisacodilo (comprimidos o supositorios) |
5-10 mg |
Dolor abdominal tipo cólico, dependencia a consecuencia de un uso prolongado |
|
Fármacos que ablandan las heces y lubricantes |
|
|
Docusato sódico |
50-200 mg/d o 1 supositorio 2 × d |
Diarrea, náuseas, vómitos, dolor abdominal, sabor amargo en la boca |
|
|
Parafina líquida |
15-45 g (por la noche o antes del desayuno) |
Escurrimiento anal de parafina |
|
a El enfermo debería ingerir una cantidad abundante de líquidos.
b Empezar el tratamiento con dosis de 10 g/d, luego se puede aumentar o disminuir gradualmente dependiendo del efecto clínico (no tomar con una frecuencia superior que la de 1 × semana, efecto solo después de un tiempo). Se debe tomar el fármaco justo antes de comer porque puede retrasar el vaciado gástrico y disminuir el apetito. |
 Español
Español
 English
English
 українська
українська








