DEFINICIÓN Y ETIOPATOGENIAArriba
Es el resultado de un daño hepático difuso, en el que se produce fibrosis y remodelación de la arquitectura normal del órgano en forma de nódulos regenerativos que tienen una estructura anormal → disminuye la cantidad de parénquima funcionante → se desarrollan alteraciones de la función hepática y de la estructura del sistema vascular, lo que lleva a hipertensión portal (aumento del gradiente de presión venosa hepática >5 mm Hg [normal ≤5 mm Hg]; en caso de aumento ≥10 mm Hg se trata de hipertensión portal clínicamente significativa). La hipertensión portal condiciona el desarrollo de una circulación colateral portosistémica (en el esófago, recto y pared abdominal), esplenomegalia/hiperesplenismo, ascitis, gastropatía portal y alteraciones similares en el intestino delgado y grueso (que pueden ser causa de hemorragia gastrointestinal oculta y translocación bacteriana). La translocación, al inducir una respuesta inflamatoria generalizada, puede causar descompensación de la cirrosis y desarrollo de la insuficiencia hepática. La cirrosis constituye el estadio terminal de diversas enfermedades hepáticas crónicas.
Causas: enfermedad hepática alcohólica, hepatitis B, D o C, hepatitis autoinmune, enfermedades metabólicas (hemocromatosis hereditaria y otros estados de sobrecarga de hierro, enfermedad de Wilson, déficit de α1-antitripsina, fibrosis quística, porfiria cutánea tardía, galactosemia, tirosinemia hereditaria, glucogenosis [tipo III y IV], telangiectasia hemorrágica hereditaria, hipervitaminosis A, abetalipoproteinemia, enfermedad hepática grasa no alcohólica), enfermedades de las vías biliares (obstrucción de las vías biliares extrahepáticas, obstrucción de las vías biliares intrahepáticas, colangitis biliar primaria, colangitis esclerosante primaria), obstrucción del retorno venoso (enfermedad venooclusiva hepática, síndrome de Budd-Chiari, insuficiencia hepática derecha), fármacos (metotrexato, metildopa, amiodarona), toxinas, anastomosis intestinal (en el tratamiento de la obesidad), cirrosis criptogénica (causa desconocida).
CUADRO CLÍNCO E HISTORIA NATURALArriba
Los síntomas clínicos dependen del tiempo de evolución de la enfermedad, de la cantidad de parénquima hepático funcionante, de las alteraciones de la circulación portal y del tratamiento administrado. Un 30-40 % de los enfermos con cirrosis cursa de forma completamente asintomática y se detecta de modo casual. La cirrosis sin síntomas de alteración de la función metabólica y sin complicaciones derivadas de la hipertensión portal se denomina compensada.
1. Síntomas generales: debilidad y fatigabilidad fácil (durante mucho tiempo es el principal y único síntoma), febrícula, pérdida de apetito, disminución de la masa corporal, postura característica (aspecto de "muñeco de castañas", es decir con las extremidades superiores e inferiores delgadas a consecuencia de la atrofia muscular, y el perímetro abdominal aumentado), calambres musculares dolorosos (molestos sobre todo por la noche), prurito (en caso de colestasis), contractura de Dupuytren, sangrados nasales y de encías (en caso de diátesis hemorrágica que puede derivar de trombocitopenia y coagulopatía), trastornos de la menstruación, trastornos del estado de ánimo, alteraciones de la concentración, calambres musculares, inversión del ritmo sueño-vigilia (expresión de encefalopatía).
2. Manifestaciones cutáneas: ictericia, arañas vasculares, telangiectasias, petequias y hemorragia subcutánea, eritema palmar y plantar, hiperpigmentación de la piel (en caso de hemocromatosis o colangitis biliar primaria [CBP]), leuconiquia, xantelasmas (en CBP), pérdida de vello en tórax y axilas en los hombres, hirsutismo, dilatación de las venas de la circulación colateral en la piel del abdomen ("cabeza de Medusa"). Cuando se desarrolla la diátesis hemorrágica (principalmente a consecuencia de una alteración en la síntesis de los factores de coagulación por los hepatocitos y de la trombocitopenia).
3. Trastornos en el sistema digestivo: distensión abdominal, náuseas y vómitos, lengua depapilada, edema de las glándulas salivales (en algunos enfermos), dolor en la región subcostal derecha, esplenomegalia (~60 % de los enfermos), hepatomegalia con superficie nodular palpable (solo se observa en algunos enfermos; típicamente el hígado está disminuido y escondido profundamente por debajo del arco costal), hernia de la pared abdominal (más frecuentemente hernia umbilical) causada por ascitis.
4. Trastornos funcionales del sistema reproductor: hipogonadismo (libido disminuida, trastornos menstruales, infertilidad y en hombres atrofia testicular) y feminización (ginecomastia, cambio en la distribución del vello).
5. Historia natural: la cirrosis hepática es una enfermedad progresiva. Con el tiempo aparecen las manifestaciones de laboratorio y clínicas de descompensación. Clasificación de Child-Pugh del grado de insuficiencia hepática en el curso de la cirrosis →tabla 7.12-1. El tiempo de evolución —desde la etapa temprana, posible de detectar solamente en el examen histopatológico (cirrosis compensada), hasta la insuficiencia hepática terminal (cirrosis descompensada)— es variable y depende de la etiología y del tratamiento utilizado (en general entre 10 y 20 años). La supervivencia desde el momento de la aparición de los primeros síntomas de descompensación es de un 45 % de los enfermos a los 5 años, y un 10-20 % a los 10 años.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Análisis de sangre
1) Hemograma: trombocitopenia (a veces es la primera y única manifestación analítica de la cirrosis hepática), anemia (muy frecuente; puede ser normocítica [a consecuencia de hiperesplenismo], macrocítica [con frecuencia en cirrosis alcohólica, a consecuencia de déficit de ácido fólico o toxicidad del alcohol], o microcítica [a consecuencia de una pérdida de sangre crónica o aguda]), leucopenia.
2) Pruebas bioquímicas: actividad de ALT y AST aumentada (generalmente AST >ALT; en cirrosis sin inflamación activa y en la fase terminal puede ser normal), ALP (2-3 veces; generalmente en enfermedades hepáticas colestásicas), GGT (un aumento aislado sugiere etiología alcohólica); actividad de colinesterasa disminuida; hipergammaglobulinemia (generalmente policlonal), hiperglucemia (frecuente), hipertrigliceridemia (sobre todo en la cirrosis alcohólica), hipercolesterolemia (en enfermedades hepáticas colestásicas), concentración de AFP aumentada (en cirrosis con gran actividad inflamatoria; un valor >10 ng/ml se considera anormal, y un valor >20 ng/ml indica hepatocarcinoma). En la cirrosis descompensada: hiperbilirrubinemia (generalmente con predominio de la bilirrubina conjugada; no cambia o se eleva de manera lenta y generalmente no llega a valores altos, excepto en las enfermedades hepáticas colestásicas), hipoalbuminemia, concentración aumentada de amonio en el suero, hipoglucemia (puede indicar insuficiencia hepática pronunciada, infección bacteriana o hepatocarcinoma), hiponatremia, hipo- o hiperpotasemia.
3) Pruebas de coagulación: déficit de la mayoría de los factores de coagulación; los déficits de inhibidores de la coagulación (proteína C, proteína S y antitrombina), junto con una formación excesiva del factor VIII y factor de Von Willebrand por las células endoteliales, causan estados de hipercoagulabilidad relativa (riesgo elevado de trombosis de la vena porta y de trombosis venosa profunda de las extremidades inferiores). La prolongación del TP es uno de los indicadores más sensibles de la disfunción de hepatocitos, precede a todas las demás manifestaciones de la descompensación metabólica y tiene un valor pronóstico.
2. Pruebas de imagen: se realizan para detectar lesiones focales (cáncer), determinar el tamaño y la forma del órgano, diagnosticar esteatosis asociada a cirrosis y evaluar manifestaciones de hipertensión portal y medir el flujo en los vasos hepáticos. Ecografía: se describe típicamente una hipertrofia del lóbulo izquierdo y del lóbulo caudado, con disminución del lóbulo derecho y un contorno hepático irregular y policíclico. Manifestaciones de la hipertensión portal: dilatación de la vena porta >15 mm con flujo monofásico o invertido, presencia de circulación colateral, sobre todo en la vena gástrica izquierda, esplénica y umbilical, y esplenomegalia (signo poco específico). Puede observarse un agrandamiento de la vesícula biliar, con edema de su pared y colelitiasis. El hepatocarcinoma generalmente es una pequeña lesión focal hipoecogénica (si el diámetro >2 cm, la probabilidad de cáncer es de ~95 %). La TC o RMN con contraste es complementario si se sospecha un hepatocarcinoma.
3. Prueba endoscópica: la esofagogastroduodenoscopia se realiza de rutina para detectar varices esofágicas y gástricas, además facilita el diagnóstico de gastropatía portal o úlceras.
4. Examen histológico de la biopsia hepática: base para el diagnóstico de la cirrosis hepática y sus causas, y para la valoración del estadio de la enfermedad hepática. Se realiza con muy poca frecuencia con esta indicación, gracias a la disponibilidad de las pruebas de imagen y métodos no invasivos de fibrosis hepática, así como debido al riesgo de complicaciones. Se observan nódulos regenerativos (pequeños, grandes o mixtos), fibrosis en estadio 4 y lesiones características de la enfermedad causante de la cirrosis, por lo que puede estar indicado realizar la prueba en caso de cirrosis de etiología incierta.
5. Elastografía: es una alternativa a la biopsia hepática; evalúa el grado de fibrosis.
Criterios diagnósticos
Un diagnóstico definitivo de cirrosis hepática se realiza sobre la base del estudio histológico de la biopsia hepática, sin embargo en la mayoría de los casos puede ser suficiente con los resultados fidedignos de las pruebas de imagen y pruebas no invasivas que evalúan la fibrosis en enfermos con manifestaciones clínicas y alteraciones típicas en las pruebas de laboratorio.
Diagnóstico diferencial
En la fase de compensación realizar el diagnóstico diferencial de la cirrosis hepática con otras enfermedades hepáticas crónicas. En la descompensada cada una de las manifestaciones de la enfermedad requiere el diagnóstico diferencial, en función del cuadro clínico predominante, entre otras la ictericia →Ictericia, la ascitis →Ascitis, la hipertensión portal (causas prehepáticas: trombosis de la vena porta o de la vena esplénica, compresión externa de la vena porta [neoplasias, fibrosis retroperitoneal], malformaciones congénitas de la vena porta; causas intrahepáticas [aparte de las causas de cirrosis]: enfermedad venooclusiva hepática, hiperplasia focal nodular, esquistosomiasis, sarcoidosis; causas extrahepáticas: síndrome de Budd-Chiari, trombosis de la vena cava inferior, pericarditis constrictiva, miocardiopatía restrictiva) y encefalopatía hepática →más adelante.
TratamientoArriba
1. En la cirrosis hepática compensada recomendar abstinencia absoluta de alcohol y tabaco y una dieta equilibrada (sin eliminar productos), que cubra las necesidades energéticas (35 kcal/kg/d) y proteicas diarias (1,2-1,5 g/kg/d). La ingesta de 3 comidas principales (desayuno, comida, cena) y 3 refrigerios en forma de segundo desayuno, merienda y —sobre todo— un refrigerio nocturno ligero a base de carbohidratos previene la gluconeogénesis nocturna a través del catabolismo de las proteínas y a la vez la desnutrición. En enfermos con desnutrición o sarcopenia puede ser útil la nutrición con suplementos líquidos (mezclas nutricionales instantáneas) o el uso de nutrición enteral, y a veces parenteral. No se recomienda suplementar la metionina ni usar los denominados fármacos hepatoprotectores (excepto la silimarina a dosis altas) o preparados de aminoácidos ramificados (salvo los casos en los que se necesita limitar el aporte diario de proteínas). Determinar la concentración sérica de vitamina D; en caso de <20 ng/ml → recomendar una suplementación oral (concentración objetivo >30 ng/ml). Hay que recomendar una actividad física (previene la pérdida de masa corporal).
2. Tratamiento causal, dependiendo de la etiología de la cirrosis.
3. Tratamiento sintomático
1) Hiponatremia con hipervolemia: es una manifestación de hiperhidratación. Si es asintomática no requiere tratamiento. Reducir el aporte de líquidos en natremia <125 mmol/l y suplementar con sodio en hiponatremia grave (<110 mmol/l) o sintomática.
2) Hiponatremia con hipovolemia: requiere la infusión del NaCl al 0,9 % y el tratamiento de la causa, lo más frecuente es la suspensión de diuréticos (contraindicados en natremia <120 mmol/l).
3) Alteraciones de la coagulación: no se recomienda corregir el sistema de coagulación al administrar p. ej. plasma fresco congelado (PFC) en enfermos sin sangrado o con sangrado no causado por los trastornos de coagulación (p. ej. sangrado de varices esofágicas) ni una transfusión profiláctica del concentrado de plaquetas en enfermos con cirrosis hepática y recuento de plaquetas <50 000/µl antes de intervenciones de bajo riesgo de sangrado, tales como extracción dental, colocación de ligaduras en las varices esofágicas o paracentesis. En enfermos con trombosis de la vena porta aplicar el tratamiento anticoagulante (previene el aumento del trombo, favorece la recanalización): en la trombosis aguda inicialmente heparina (HNF o HBPM), en el tratamiento de soporte HBPM o warfarina bajo el control de INR durante ≥6 meses (en enfermos con indicación para el trasplante hepático: hasta la intervención; no se recomiendan los ACOD).
4) Hiperglucemia y diabetes: generalmente dieta, con menor frecuencia insulinoterapia.
4. Tratamiento de las complicaciones →más adelante.
5. Otros métodos de tratamiento inespecífico: β-bloqueantes no selectivos en la profilaxis primaria y secundaria de sangrado de varices esofágicas (→más adelante); antibióticos en la prevención de complicaciones relacionadas con la traslocación de bacterias desde el tracto digestivo (→más adelante, Complicaciones); estatinas, p. ej. simvastatina 20-40 mg/d (disminuye la hipertensión portal). Se recomiendan vacunas contra la hepatitis A y B, la gripe y el neumococo.
6. El trasplante hepático es el tratamiento de elección de la cirrosis hepática descompensada.
OBSERVACIÓNArriba
1. Recomendar el control regular con el fin de vigilar la abstinencia de alcohol y detectar precozmente las complicaciones de la cirrosis.
2. En la fase compensada de la cirrosis controlar cada 3-6 meses la actividad de aminotransferasas, de ALP y GGT, TP, concentración de albúminas, bilirrubina y AFP. Cada 6 meses realizar una ecografía para detectar ascitis o lesiones focales en el hígado. Repetir el examen endoscópico, en función de la presencia de varices esofágicas y de su grado →fig. 7.12-1.
ComplicacionesArriba
Ascitis
La complicación más frecuente de la cirrosis y una de las más tempranas. La patogenia es compleja. Los principales factores relacionados son la retención renal de sodio y agua, la hipertensión portal y la hipoalbuminemia. Cuadro clínico, clasificación de gravedad, diagnóstico y diagnóstico diferencial →Ascitis.
Tratamiento
1) En enfermos con cirrosis sin ascitis no hay límite en el aporte de líquidos y sodio. No se deben utilizar diuréticos para prevenir su aparición.
2) Ascitis de grado 1 y 2 → iniciar desde la limitación de sodio en la dieta hasta 80-120 mmol/d (2-3 g de sodio, es decir 4,6-6,9 g/d de sal común). Si no hay efecto → iniciar la administración de diuréticos: espironolactona 100 mg 1 × d por la mañana, aumentar la dosis cada 72 h en 100 mg, hasta máx. 400 mg/d (si no hay respuesta a dosis menores). Si el tratamiento es ineficaz (es decir, reducción del peso corporal en <2 kg/semana) o hiperpotasemia → añadir furosemida 40 mg 1 × d por la mañana, aumentar la dosis en 40 mg/d hasta máx. 160 mg/d; si la furosemida es poco eficaz, puede cambiarse por torasemida. En caso de ascitis masiva, desde el principio puede aplicarse el tratamiento combinado con espironolactona y un diurético de asa (en proporción 100 g de espironolactona y 40 g de furosemida, aumentar gradualmente hasta máx. 400 mg y 160 mg). El objetivo del tratamiento diurético es la reducción del peso corporal en 0,3-0,5 kg/d en caso de ascitis aislada, o en 0,8-1,0 kg/d, en caso de coexistencia de edemas periféricos. Después de la resolución de la ascitis se debe continuar con la restricción del sodio en la dieta, la ingesta de líquidos será ~1,5 l/d y hay que mantener las dosis de diuréticos en un nivel que evite la recidiva de la retención de líquido (control de la masa corporal cada 1-2 días). Interrumpir el tratamiento diurético en caso de: hiponatremia grave (<125 mmol/l), lesión renal aguda (AKI), intensificación de la encefalopatía hepática o calambres musculares sin controlar. En caso de hipopotasemia (<3 mmol/l) interrumpir la administración de furosemida, y en caso de concentración sérica de potasio >6 mmol/l → interrumpir la espironolactona.
3) Ascitis de grado 3 → paracentesis terapéutica →Punción de la cavidad peritoneal (paracentesis). Eliminación del líquido ascítico en su totalidad durante una paracentesis. El procedimiento puede repetirse en caso de recidiva de ascitis; es relativamente seguro, bajo la condición de que se realice una adecuada reposición del volumen circulante (si se han extraído >5 l del líquido ascítico, se deben administrar 8 g iv. de solución de albúmina al 20 % por cada litro de líquido extraído). Puede realizarse en enfermos con peritonitis bacteriana espontánea y en enfermos con cirrosis acompañada de LRA. La paracentesis es el método de elección en enfermos con hiponatremia descompensada. Para prevenir la reaparición de la ascitis utilizar diuréticos y restringir el aporte de sal y de líquidos →más arriba.
4) Ascitis refractaria (ineficacia del tratamiento diurético, aparición de complicaciones que imposibilitan el uso de diuréticos a dosis eficaces o una recidiva temprana, es decir, en un mes después del tratamiento) → TIPS (pero aumenta el riesgo de encefalopatía), trasplante hepático o drenaje peritoneal. En un 20-25 % de los enfermos con ascitis refractaria se produce una hiponatremia <130 mmol/l (debido al incremento de la resorción de agua en los túbulos colectores a consecuencia de un exceso de hormona antidiurética) → limitar la ingesta de líquidos <1,5 l/d, y en caso de natremia <125 mmol/l → interrumpir la administración de diuréticos.
Un equivalente de ascitis es la presencia de derrame pleural, sobre todo del lado derecho (descartar la insuficiencia cardíaca, así como enfermedades pulmonares y pleurales). Es un signo de mal pronóstico; la ascitis resistente y el derrame pleural constituyen indicaciones para el trasplante hepático. En enfermos con disnea realizar una toracocentesis y drenar el líquido en sesiones aisladas (un drenaje crónico está contraindicado debido al riesgo de complicaciones, incluida la infección). La pleurodesis está indicada únicamente en enfermos no aptos para el trasplante hepático o el TIPS.
Peritonitis bacteriana espontánea (PBE)
Ocurre en un 10-20 % de los enfermos con ascitis. Está causada por la infección del líquido ascítico sin que exista una fuente de infección visible en la cavidad abdominal. Probablemente se produce a consecuencia de la traslocación de bacterias desde la luz del tracto digestivo y de la alteración de la actividad antibacteriana del líquido ascítico. Las bacterias que se aíslan con mayor frecuencia (70 %) son: Escherichia coli, Enterococcus faecalis, Enterobacter, Serratia, Klebsiella, Proteus, Pseudomonas.
Cuadro clínico: son relativamente raros los síntomas típicos de peritonitis (es decir fiebre, escalofríos, dolor abdominal difuso, signos de irritación peritoneal, disminución de los ruidos intestinales). La única manifestación de la PBE puede ser la fiebre o febrícula, la encefalopatía de origen desconocido o la insuficiencia renal; a veces ya en el momento de diagnóstico se presenta el shock séptico. En ~10 % de los casos el curso es asintomático.
Diagnóstico: en todos los enfermos con ascitis ingresados en el hospital se recomienda realizar paracentesis diagnóstica y analizar el líquido ascítico →Estudio del líquido peritoneal (ascítico), incluyendo la toma de cultivos (≥10 ml de líquido para cultivo aerobio y anaerobio en el frasco como para hemocultivo). La PBE se diagnostica cuando el número de neutrófilos en el líquido ascítico es >250/μl sin un claro origen de infección en la cavidad abdominal. Los cultivos del líquido ascítico son negativos en un 20-40 % de los enfermos a pesar de la existencia de rasgos inflamatorios en el líquido ascítico. Realizar el diagnóstico diferencial con la peritonitis secundaria en enfermos con ascitis →Estudio del líquido peritoneal (ascítico).
Tratamiento: se debe empezar de forma inmediata con antibioticoterapia empírica → cefotaxima iv. 2 g cada 8-12 h, en caso de hipersensibilidad a las cefalosporinas ciprofloxacina iv. o VO 0,4-0,5 g cada 12 h; continuar hasta el cese de manifestaciones clínicas o reducción del recuento de neutrófilos en el líquido ascítico <250/µl (en general 10-14 días). En los enfermos, y especialmente en los con una concentración de bilirrubina en sangre >68 μmol/l (4 mg/dl) y de creatinina >88,4 μmol/l (1 mg/dl) junto a la antibioticoterapia administrar, en infusión, una solución de albúmina (1,5 g/kg el 1.er día y luego 1 g/kg el 3.er día).
Prevención:
1) después de un episodio de PBE recomendar la norfloxacina VO 400 mg/d (o ciprofloxacino 500 mg/d)
2) VO norfloxacina 400 mg/d hasta una mejoría estable de estado clínico y desaparición de ascitis en enfermos con alto riesgo de PBE, es decir:
a) antecedente del sangrado del tracto digestivo independientemente de la causa, o
b) concentración de proteínas en el líquido ascítico <1 g/dl, o
c) ≥9 ptos. en escala de Child-Pugh y concentración sérica de bilirrubina ≥3 mg/dl (51 μmol/l), concentración de proteínas en el líquido ascítico <1,5 g/dl y alteraciones de la función renal o hiponatremia 3) inhibidores de la bomba de protones solamente cuando estén claramente indicados, ya que aumentan el riesgo de aparición de PBE y el riesgo de infección por C. difficile.
Hemorragia gastrointestinal
El más probable en enfermos con cirrosis hepática y el más significativo clínicamente es el sangrado de las varices esofágicas (~10 % de todas las causas de sangrado del tracto digestivo superior), que es consecuencia de la circulación colateral en la hipertensión portal. El riesgo de hemorragia de las varices esofágicas es de ~30 % a los 2 años desde su diagnóstico por endoscopia, por lo que es necesaria la profilaxis (→fig. 7.12-1). En ~10 % el lugar de sangrado no son las varices esofágicas, sino las varices gástricas (con mayor frecuencia subcardiales; difíciles de diagnosticar y de tratar). Mucho menos frecuente es el sangrado de varices del tracto digestivo inferior (p. ej. perianales).
Tratamiento
1) Actuación en la hemorragia por varices esofágicas →Hemorragia digestiva. En ~40 % de los casos el sangrado cede espontáneamente, pero la tasa de recidivas tempranas (hasta 5 días) después del sangrado es ~60 %. El tratamiento endoscópico con ligaduras al mismo tiempo previene las recidivas del sangrado.
2) Otros métodos usados para la prevención de las recaídas del sangrado:
a) β-bloqueante no selectivo (carvedilol 6,25-12,5 mg/d, nadolol 40-240 mg/d, propranolol 80-320 mg/d; se debe aumentar gradualmente la dosis hasta alcanzar la dosis máx. tolerada, o hasta la disminución del ritmo cardíaco hasta 50-55/min.); utilizar junto con métodos endoscópicos
b) realización de derivación portosistémica intrahepática transyugular (TIPS) mediante la colocación de un stent, en pacientes con fracaso del tratamiento endoscópico; puede causar aparición o exacerbación de la encefalopatía hepática.
Encefalopatía hepática
Conjunto de trastornos funcionales del SNC en el curso de las enfermedades hepáticas graves agudas o crónicas, probablemente como resultado de la acción de neurotoxinas endógenas (amoníaco, mercaptanos, ácidos grasos de cadena corta y media, fenoles), de la presencia de falsos neurotransmisores o de una activación excesiva del sistema gabaérgico.
Cuadro clínico: trastornos del comportamiento, del estado de ánimo, de la personalidad, de las funciones intelectuales, de la conciencia y de la actividad neuromuscular, de un grado de intensidad variable. Clasificación →tabla 7.12-2.
1) Mínima (anteriormente llamada oculta): alteraciones de las funciones intelectuales detectadas mediante tests psicométricos (en un 60-70 % de los enfermos con cirrosis hepática).
2) Establecida: en un 10-14 % de los enfermos (más a menudo después de la creación de una derivación portosistémica); puede presentarse de forma episódica (anteriormente llamada aguda; reversible) a consecuencia de la acción de un factor desencadenante (sangrado del tracto digestivo, sobredosis de diuréticos, infección, insuficiencia renal, estreñimiento) o en forma persistente (anteriormente crónica) con síntomas recurrentes o persistentes.
Diagnóstico: se basa en la presencia de manifestaciones neuropsíquicas →tabla 7.12-2, cambios en el EEG (ondas de alta amplitud y baja frecuencia, ondas trifásicas) y una concentración de amonio en sangre aumentada (la determinación del amonio no es necesaria para establecer el diagnóstico, no hay correlación con la estadificación de la encefalopatía). Realizar una valoración clínica simplificada del grado de encefalopatía (escala CHESS) →tabla 7.12-3. Establecer un diagnóstico diferencial con otras causas de alteraciones funcionales del SNC, entre otras la encefalopatía de Wernicke, meningitis, encefalitis, hemorragia subaracnoidea, alteraciones metabólicas (hipoglucemia, coma diabético, uremia), trastornos mentales, demencia, alteraciones de la circulación cerebral.
Tratamiento de la forma episódica
1) si es posible, identificar y eliminar el factor desencadenante
2) suspender la nutrición vía oral durante 24-48 h y administrar nutrición enteral (si posible) con una dieta que tenga un aumento gradual de la concentración de proteína desde 0,5 g/kg/d
3) administrar un laxante: lactulosa 45 ml VO o por sonda nasogástrica cada 1 h hasta la defecación, luego generalmente 15-45 ml cada 8-12 h para obtener 2-3 deposiciones blandas al día
4) en enfermos con alteraciones graves de la conciencia puede ser necesaria una limpieza mecánica del intestino (enemas)
5) rifaximina 400 mg 3 × d o 550 mg 2 × d VO durante 1-2 semanas (en lugar de o en combinación con lactulosa)
6) en caso de que se sospeche que el enfermo ha tomado benzodiazepinas → flumazenilo 1 mg iv.
7) aspartato de ornitina iv. hasta 30 g/d
8) en enfermos inconscientes mantener la permeabilidad de las vías respiratorias →Paro cardíaco súbito, en caso de necesidad considerar la ventilación mecánica.
Tratamiento de la forma persistente
1) dieta con un contenido de 1,2-1,5 g de proteína por kg de la masa corporal/día, sobre todo de origen vegetal y lácteo; en enfermos que no toleren ninguna proteína utilizar dietas comerciales que contienen aminoácidos ramificados
2) utilizar lactulosa en la forma aguda
3) si no hay mejoría → considerar tratamiento crónico con rifaximina 200 mg/d 2 × d VO
4) aspartato de ornitina VO hasta 6 g/d.
Prevención: realizar deposiciones de forma regular, prevenir los sangrados del tracto digestivo, evitar dosis altas de diuréticos y administrar fármacos, sobre todo los que deprimen el SNC, solamente en caso de necesidad.
Síndrome hepatorrenal (SHR)
Forma de LRA en un enfermo con enfermedad hepática grave aguda o crónica y ascitis, sin otras causas de alteración de la función renal. Se presenta en ~15 % de los enfermos ingresados en el hospital por ascitis a tensión. Es el resultado de la disminución de la filtración glomerular a consecuencia de cambios hemodinámicos que producen un empeoramiento de la perfusión renal. En un enfermo con cirrosis hepática, un aumento de la concentración de creatinina sérica puede indicar
1) lesión renal aguda (LRA): aumento de la concentración de creatinina en ≥0,3 mg/dl (26,5 µmol/l) en 48 h o en ≥50 % en 7 días
2) enfermedad renal aguda: TFG <60 ml/min/1,73 m2 durante <3 meses o reducción de la TFG en >35 % en <3 meses o aumento de la concentración de creatinina en ≥50 % en <3 meses; en enfermos con cirrosis hepática no se tiene en cuenta la cantidad de diuresis
3) enfermedad renal crónica: TFG <60 ml/min/1,73 m2 durante ≥3 meses.
En primer lugar hay que determinar cuál de las formas de alteraciones de la función renal se presenta en el enfermo. En enfermos con cirrosis hepática, la LRA puede estar causada por una infección, sangrado digestivo, uso de diuréticos o AINE.
Tipos de SHR
1) SHR-LRA (antes SHR tipo 1): rápidamente (en unos días) insuficiencia hepática progresiva
2) SHR-NLRA (non-AKI, antes SHR tipo 2): insuficiencia renal de progresión lenta (semanas o meses); con mayor frecuencia en enfermos con ascitis resistente; a lesión renal de progresión lenta puede superponerse el SHR-AKI causado por otra complicación de la cirrosis, p. ej. PBE.
Diagnóstico: el SHR-LRA en enfermos con cirrosis hepática se diagnostica únicamente sobre la base de las alteraciones de la concentración de creatinina sérica (el valor inicial se considera el resultado más reciente de los últimos 3 meses); no se debe tener en cuenta el criterio de diuresis.
Criterios de SHR-LRA
1) diagnóstico de cirrosis hepática con ascitis
2) diagnóstico de LRA:
a) aumento de la concentración de creatinina sérica en ≥0,3 mg/dl (≥26,5 µmol/l) en 48 h o
b) aumento de la creatinina sérica en ≥50 % en los últimos 7 días, en comparación con el valor inicial conocido o supuesto
3) falta de mejoría de la función renal (de la reducción de la concentración de la creatinina) después de ≥2 días sin tomar diuréticos y de la transfusión de albúmina a dosis 1 g/kg/d (máx. 100 g/d)
4) exclusión de shock, uso reciente de medicamentos nefrotóxicos y de contraste radiológico, enfermedad renal parenquimatosa (sugerida por la proteinuria >0,5 g/d, hematuria microscópica >50 eritrocitos por campo y/o imagen patológica en la ecografía renal).
Tratamiento
1) Tomar muestras de sangre, orina, líquido ascítico y esputo para cultivos, iniciar tratamiento con un antibiótico de amplio espectro hasta descartar la PBE.
2) Corregir la hipovolemia, suspender los fármacos nefrotóxicos y los que disminuyen la filtración glomerular, incluidos los AINE, aminoglucósidos, IECA, ARA-II.
3) Durante 2 días infundir iv. la solución de albúmina a dosis 1 g/kg/d (máx. 100 g/d; la falta de mejoría después de la infusión de albúmina es uno de los criterios de diagnóstico de SHR).
4) En enfermos con ascitis a tensión realizar paracentesis terapéutica controlando la presión arterial, la PVC y corrigiendo la volemia con infusión intravenosa de una solución de albúmina (también si se han extraído >5 l del líquido).
5) En SHR-LRA resultan eficaces los vasoconstrictores: terlipresina iv. 1 mg cada 4-6 h o infusión continua iv. 2 mg/d; si pasados 2 días de este tratamiento la concentración de creatinina no disminuye en ≥25 % → aumentar gradualmente la dosis de terlipresina hasta máx. 12 mg/d; los fármacos alternativos son octreotida VSc 100-200 μg cada 8 h en combinación con midodrina VO 7,5-12,5 mg cada 8 h o noradrenalina en infusión iv. 0,5-3 mg/h. El aumento de la presión arterial media en 5-10 mm Hg demuestra la eficacia de los vasoconstrictores. Continuar el tratamiento hasta reducir la creatininemia hasta máx. 0,3 mg/dl por encima de los valores iniciales o hasta un máximo de 14 días. Después de terminar el tratamiento de la SHR un 15-50 % de los enfermos recidiva. El tratamiento vasopresor utilizado nuevamente suele ser eficaz. En SHR-NLRA también se utilizan las infusiones de albúmina y terlipresina, pero casi siempre llega a la recidiva del SHR después del fin de tratamiento.
6) El trasplante de hígado es el mejor método del tratamiento. La terapia de reemplazo renal (hemodiálisis, hemofiltración) se utiliza como terapia puente hasta el momento de trasplante, y en enfermos no aptos para el trasplante se utiliza en caso de ineficacia del tratamiento vasopresor y como tratamiento sintomático para combatir la hiperpotasemia grave, la acidosis metabólica grave o la hiperhidratación grave.
Síndrome hepatopulmonar (SHP)
Es el resultado de un shunt arteriovenoso intrapulmonar. La patogenia no está clara. Se presenta como un aumento de disnea e hipoxemia en posición sentada o en bipedestación (con mejoría en decúbito). Pueden desarrollarse dedos en palillo de tambor. Sospechar el SHP en todo enfermo con hipoxemia (PaO2 <65 mm Hg). Realizar el diagnóstico diferencial con hipertensión portopulmonar. El único método eficaz de prevención y tratamiento del SHP es el trasplante hepático.
Hiperesplenismo
Generalmente no requiere ningún tratamiento. Si constituye la causa de transfusiones frecuentes de concentrado de hematíes o de plaquetas o si la esplenomegalia es dolorosa → se puede considerar la embolización de la arteria esplénica, TIPS o eventualmente esplenectomía (se realiza raramente, por el alto riesgo de complicaciones).
SITUACIONES ESPECIALESArriba
Embarazo
La mortalidad de embarazadas con cirrosis hepática se estima en ~2 %, y va aumentando con el grado de insuficiencia hepática (con MELD ≥10, el riesgo de descompensación de la función hepática en una embarazada supera el 80 %). Hay que informar a las enfermas con MELD ≥10 o con antecedentes de episodios de descompensación cirrótica sobre el importante riesgo de progresión de la enfermedad durante el embarazo. Las mujeres con cirrosis hepática deben estar bajo un estricto control de un hepatólogo, y el parto debe realizarse en un centro que asegure una vigilancia estrecha sobre el neonato. Una alta concentración de bilirrubina no conjugada (libre) en una mujer constituye un riesgo de presentación de kernícterus en el niño y es una indicación para realizar una exanguinotransfusión.
Un sangrado de varices esofágicas constituye un elevado riesgo para el embarazo (es mayor en el 2.º trimestre y durante el parto), ya que las varices aumentan durante el embarazo. La endoscopia digestiva alta en mujeres con cirrosis hepática debe realizarse el año previo al embarazo, y —si no se ha realizado— al inicio del 2.º trimestre. Si durante la endoscopia antes del embarazo no se detectan varices o se aplica una prevención primaria del sangrado (→fig. 7.12-1, excepto que durante el embarazo se puede considerar la administración de β-bloqueante no selectivo [preferentemente propranolol] en las varices de grado I, y en caso de signos de riesgo de sangrado donde se recomienda la ligaduras de las varices), no es necesario repetir la prueba durante el embarazo, salvo que se presenten signos de descompensación de la cirrosis o no se ha eliminado el factor que lesiona el hígado (p. ej. alcohol o infección por VHC). En caso de sangrado de varices esofágicas, la actuación debe ser estándar, salvo la administración de terlipresina (reduce la vascularización del útero y puede causar contracciones).
TABLAS Y FIGURASArriba
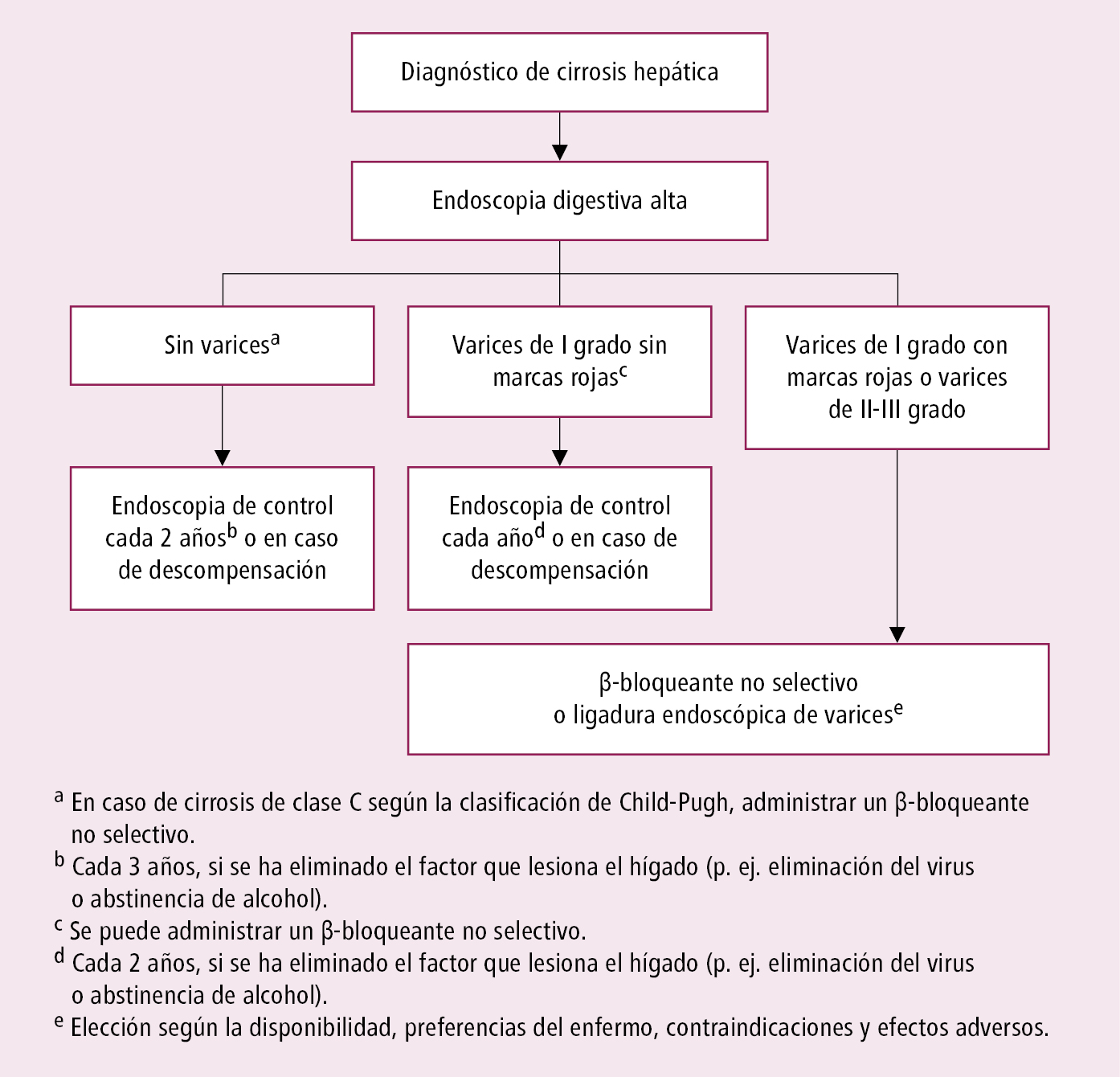
Fig. 7.12-1. Algoritmo de diagnóstico activo de varices esofágicas y de prevención de primer episodio de sangrado (a partir de las guías de la ESGE, 2020)
Tabla 7.12-1. Clasificación de Child (modificada por Pugh) de insuficiencia hepática
|
Parámetro |
Grado de alteración |
Puntos |
|
Encefalopatía |
Ausente |
1 |
|
Grado 1-2 |
2 |
|
Grado 3 |
3 |
|
Ascitis |
Ausente |
1 |
|
Moderada |
2 |
|
A tensión |
3 |
|
Bilirrubina (mg/dl [µmol/l]) |
<2 (<35) |
1 |
|
2-3 (35-50) |
2 |
|
>3 (>50) |
3 |
|
Albúmina (g/dl) |
>3,5 |
1 |
|
2,8-3,5 |
2 |
|
<2,8 |
3 |
|
Tiempo de protrombina
(en s por encima de la norma/INR) |
<4/<1,7 |
1 |
|
4-6/1,7-2,3 |
2 |
|
>6/>2,3 |
3 |
|
Resultado (clase) |
Puntuación |
|
A |
5-6 |
|
B |
7-9 |
|
C |
10-15 |
|
Interpretación:
clase A — cirrosis hepática compensada; no hay indicaciones para el trasplante hepático
clase B y C — cirrosis hepática descompensada; indicaciones para el trasplante hepático |
|
A partir de: Pugh R.N.H. y cols., Transection of the oesophagus for bleeding oesophageal varices, Brit. J. Surg., 1973, 60: 646-649, modificado |
Tabla 7.12-2. Grados clínicos de intensidad de encefalopatía hepática
|
Grado |
Estado de conciencia |
Funciones intelectuales |
Personalidad: comportamiento |
Alteraciones neuromusculares |
|
0 |
Normal |
Conservadas |
Normal |
Ausentes |
|
1 |
Somnolencia, insomnio o inversión del ritmo sueño-vigilia |
Alteraciones sutiles en la capacidad para realizar operaciones aritméticas, alteración en la capacidad de concentración, olvidos |
Euforia discretamente marcada, verborrea, irritabilidad, comportamiento exagerado pero adecuado |
Ataxia marcada, alteraciones de la escritura, temblores musculares ocasionales |
|
2 |
Apatía, letargo, desorientación incipiente |
Aumento de los síntomas de grado I, alteraciones evidentes de la memoria, pérdida de la orientación temporal |
Bajo umbral de control del comportamiento, alteraciones evidentes de la personalidad, comportamientos inadecuados |
Temblores musculares evidentes, disartria, reflejos tendinosos disminuidos, ataxia evidente, patología de la escritura |
|
3 |
Somnolencia, confusión, semiestupor |
Demencia avanzada |
Ansiedad, alucinaciones, ira incontrolable |
Reflejos tendinosos aumentados, reflejos patológicos (p. ej. de Babinski), mioclonías, nistagmo, síntomas extrapiramidales |
|
4 |
Coma |
Ausentes |
No valorable |
Rigidez de descerebración, pupilas dilatadas arreactivas |
Tabla 7.12-3. Escala CHESS de intensidad de encefalopatía hepática
|
Criterio |
0 ptos. |
1 pto. |
|
1. ¿El paciente sabe qué mes es? |
Sí |
No |
|
2. ¿El paciente sabe qué día de la semana es? |
Sí |
No |
|
3. ¿El paciente es capaz de contar hacia atrás desde 10 hasta 1 sin equivocarse ni pararse? |
Sí |
No |
|
4. ¿El paciente levanta los brazos si se lo pide? |
Sí |
No |
|
5. ¿El paciente entiende las preguntas que se le hacen? (basándose en las preguntas 1-4) |
Sí |
No |
|
6. ¿El paciente está despierto y alerta? |
Sí |
No |
|
7. ¿Es difícil despertar al paciente? ¿Se duerme inmediatamente? |
No |
Sí |
|
8. ¿El paciente consigue hablar? |
Sí |
No |
|
9. ¿El paciente habla bien (es posible entender todo) y sin tartamudeos? |
Sí |
No |
|
Se suman los puntos: 0 — sin signos de encefalopatía, 9 — intensidad máxima de encefalopatía hepática |
 Español
Español
 English
English
 українська
українська





