Definiciones y etiopatogeniaArriba
Hipertiroidismo subclínico (silente): estado asociado a un mínimo exceso de hormonas tiroideas (HT) a nivel tisular. En general es asintomático. El nivel sérico de TSH está disminuido y el de FT4 y T3 no supera el límite superior de la normalidad. Hipertiroidismo: secreción incrementada de hormonas tiroideas que supera la demanda actual de los tejidos, lo que conduce al desarrollo de un conjunto de síntomas característicos. El nivel de TSH disminuido orienta el diagnóstico hacia una causa del hipertiroidismo primaria (de origen tiroideo), mientras que un nivel elevado hacia causa secundaria (de origen hipofisario). Tirotoxicosis: exceso de HT que produce manifestaciones clínicas. Incluye hipertiroidismo clínico y casos en los que las HT son de origen exógeno (sobredosis de HT exógenas), o bien se generan en una localización extratiroidea, p. ej. en el ovario (estruma ovárico). Crisis tirotóxica (crisis hipertiroidea): estado de desequilibrio súbito y brusco de la homeostasis sistémica que supone un peligro para la vida, y que se desarrolla a consecuencia de un hipertiroidismo no diagnosticado o insuficientemente tratado. Cursa con alteraciones de la conciencia, incluido el coma, con insuficiencia multiorgánica y shock, así como con temperatura corporal elevada.
Causas y patogenia del hipertiroidismo →fig. 9.2-1.
Cuadro clínico e historia naturalArriba
El hipertiroidismo suele desarrollarse a lo largo de varios meses. Puede también presentarse de forma súbita (p. ej. inducido por amiodarona [→Tiroiditis crónicas inducidas por fármacos y tabla 9.2-2] o por exposición a yodo contenido en medios de contraste radiológicos) o desarrollarse a lo largo de años (nódulo tiroideo autónomo, bocio multinodular tóxico), tener carácter transitorio y remitir espontáneamente (tiroiditis subaguda o posparto) o alternar con períodos de remisión (enfermedad de Graves-Basedow, EGB). También puede presentarse como una complicación de la terapia de recuperación del sistema inmune, especialmente en enfermos con esclerosis múltiple tratados con alemtuzumab, enfermos con infección por VIH que reciben terapia antirretroviral altamente activa, o bien después del trasplante de la médula ósea o de las células madre hematopoyéticas. Las distintas causas de hipertiroidismo pueden coexistir, como en el caso de la presencia del nódulo tiroideo autónomo en un paciente con EGB, que puede cursar de forma atípica sin períodos de remisión. En personas mayores los síntomas pueden manifestarse de forma más discreta y limitada a fibrilación auricular paroxística o persistente y, en ocasiones, a un agravamiento de una cardiopatía isquémica o de una insuficiencia cardíaca preexistentes. Inicialmente puede presentarse como hipertiroidismo subclínico.
Hipertiroidismo subclínico
Es una fase asintomática o con escasos síntomas de cualquier enfermedad que se presenta con hipertiroidismo. En ~50 % de los casos el nivel de TSH se normaliza espontáneamente y el riesgo de que la enfermedad progrese hasta una forma sintomática es de ~5 %/año (puede inducirlo la exposición al yodo). Síntomas discretos del exceso de HT: taquicardia, arritmias supraventriculares (fibrilación auricular, extrasístoles supraventriculares) y, rara vez, ventriculares. La falta de tratamiento de forma prolongada puede ocasionar una disminución de la densidad mineral ósea. En enfermos mayores, con TSH <0,1 mUI/l, se asocia con un riesgo elevado de complicaciones cardiovasculares. El hipertiroidismo subclínico puede ser también causado intencionalmente por el uso de dosis de L-T4 ligeramente más elevadas en relación con el requerimiento fisiológico, p. ej. disminución de los niveles de TSH en el tratamiento del cáncer de tiroides de alto riesgo de recurrencia →Cáncer de tiroides.
Hipertiroidismo clínico
1. Síntomas generales: pérdida de peso (con frecuencia a pesar de conservar el apetito), debilidad, intolerancia al calor.
2. Cambios en el sistema nervioso: inquietud, irritabilidad, agitación psicomotora (comportamiento hipercinético), problemas de concentración, insomnio; raramente síntomas psicóticos (como en la esquizofrenia o el trastorno bipolar afectivo); temblor fino de las manos; hiperreflexia tendinosa; coma en caso de crisis tirotóxica.
3. Cambios oculares
1) resultantes de la hiperactividad simpática: retracción palpebral (sensación de mirada fija)
2) resultantes de la miopatía de los músculos oculomotores en el curso de la EGB:
a) signo de Graefe (con el movimiento del globo ocular hacia abajo se hace visible la esclerótica por encima del iris)
b) signo de Kocher (el mismo signo con el movimiento del globo ocular hacia arriba)
c) signo de Möbius (desviación de uno de los globos oculares con la mirada convergente)
d) signo de Stellwag (parpadeo infrecuente)
3) otros signos de la orbitopatía tiroidea en la EGB: dolor ocular, lagrimeo, diplopía, edema palpebral, enrojecimiento de las conjuntivas.
4. Cambios dérmicos: sudoración profusa e hiperemia de la piel (piel caliente, rubicunda, húmeda y excesivamente lisa); rara vez hiperpigmentación cutánea (sin afectar a las mucosas de las mejillas) o urticaria; cabello fino y quebradizo, que cae con facilidad; uñas finas y quebradizas, que pueden separarse prematuramente del lecho ungueal (onicólisis); en la EGB: dermopatía y acropaquia tiroidea →Enfermedad de Graves-Basedow.
5. Cambios en el aparato locomotor: pérdida de la masa y fuerza muscular (en el hipertiroidismo clínico). En sus formas graves: miopatía tirotóxica con afectación de los músculos distales de las extremidades y de los músculos faciales. La afectación de los músculos oculomotores puede imitar una miastenia grave real.
6. Cambios en el cuello: en ocasiones aumento del perímetro del cuello, sensación de compresión. En la exploración física: glándula tiroidea de tamaño normal o, más frecuentemente, aumentada (si el hipertiroidismo es clínico → diagnosticar un bocio tóxico). Si se detecta temblor y se ausculta un soplo vascular → diagnosticar un bocio vascular (característico de la EGB). Si se palpa ≥1 nódulo → realizar el diagnóstico diferencial con el bocio multinodular tóxico (la presencia de nódulos no excluye la EGB).
7. Cambios en el sistema respiratorio: disnea resultante de la compresión y la estenosis de la tráquea causadas por agrandamiento del tiroides.
8. Cambios en el sistema circulatorio: palpitaciones, síntomas de circulación hipercinética (taquicardia, hipertensión sistólica y amplitud de pulso aumentada, tonos cardíacos intensos); no son raras las extrasístoles o fibrilación auricular, soplo sistólico (prolapso de la válvula mitral o insuficiencia mitral), a veces también el soplo telediastólico; síntomas de la insuficiencia cardíaca, especialmente en caso de antecedentes de cardiopatía.
9. Cambios en el sistema digestivo: defecación frecuente o diarrea. En casos graves de hipertiroidismo pueden presentarse hepatomegalia e ictericia debida al daño en el hígado.
10. Cambios en el sistema reproductor y glándulas mamarias: en ocasiones disminución de la libido, oligomenorrea (en general, los ciclos son ovulatorios) o esporádicamente amenorrea, disfunción eréctil, ginecomastia.
Crisis tirotóxica (crisis hipertiroidea)
Puede desarrollarse en un enfermo hipertiroideo a causa de una infección, trauma u otra enfermedad grave o en caso de una intervención sin preparación apropiada previa con fármacos antitiroideos. En caso de empeoramiento repentino del estado clínico de un paciente con hipertiroidismo, siempre debe considerarse la posibilidad de una crisis tirotóxica inminente o establecida. Los síntomas de la enfermedad desencadenante de la crisis tirotóxica pueden ser más pronunciados.
1. Pródromos: agitación, insomnio (alucinaciones y otros trastornos psicóticos nocturnos), pérdida de peso significativa, intensificación del temblor muscular, fiebre, náuseas y vómitos.
2. Crisis tirotóxica establecida: fiebre, agitación grave e intensificación de los trastornos psicóticos, a veces con somnolencia potenciada y apatía e incluso coma; también puede presentarse estatus epiléptico. Intensificación repentina de los síntomas tirotóxicos en el sistema circulatorio (taquicardia notable, posible fibrilación auricular, insuficiencia cardíaca e incluso shock) y en el digestivo (náuseas, vómitos, diarrea, dolor abdominal); síntomas de deshidratación (a menudo precedidos de un período de sudoración excesiva).
DiagnósticoArriba
Siempre preguntar al paciente por antecedentes familiares de enfermedad tiroidea, exposición a dosis elevadas de yodo (algunos desinfectantes [p. ej. tintura de yodo] o expectorantes, amiodarona, medios de contraste radiológicos), antecedentes de tratamiento de enfermedades tiroideas y enfermedades autoinmunes de otros órganos. En el proceso diagnóstico de las enfermedades tiroideas se debe evaluar siempre tanto la función glandular como su morfología con el fin de diagnosticar la causa del trastorno. Siempre valorar si los resultados de la determinación de TSH y HT libres son congruentes y corresponden con las manifestaciones clínicas. Antes de realizar pruebas hormonales se debe indicar al enfermo que suspenda la toma de preparados con biotina, ya que esta puede alterar la reacción inmunoquímica. Si se utiliza la biotina a dosis bajas [<5 mg/d], basta con dejar de tomarla ≥24 h antes de la medición. Si esta dosis es más alta, el intervalo debe ser de ≥2 días, y si es mucho más alta, de 3-7 días.
Exploraciones complementarias
En caso de sospechar hipertiroidismo, evaluar los niveles séricos de TSH y, posteriormente, de FT4 (si los de TSH están disminuidos y los de FT4 son normales → determinar también la T3). También valorar si la glándula está aumentada de tamaño y presenta nódulos (palpables o detectados mediante ecografía, que pueden requerir clasificación para la PAAF →Bocio multinodular no tóxico). La determinación de anticuerpos antitiroideos permite diferenciar con gran certeza las causas de hipertiroidismo autoinmunes de las no autoinmunes.
1. Pruebas hormonales
1) Niveles séricos de TSH. Es el indicador más sensible de la acción de las HT. Sus niveles están bajos en el hipertiroidismo primario (tanto clínico como subclínico) y elevados en los raros casos de hipertiroidismo secundario. La fluctuación diaria de los niveles séricos de TSH no tiene importancia en un proceso diagnóstico rutinario.
2) Niveles séricos de FT4 y T3: elevados en el hipertiroidismo clínico, sobre todo la FT4 o T3 y FT4; rara vez T3 de forma aislada. Son normales en el hipertiroidismo subclínico, con frecuencia en valores cercanos al límite superior de normalidad.
2. Otras pruebas de laboratorio
1) anti-TSHR" class="index" name="141675">Anticuerpos TSH" class="underline-tooltip" >TRAb (antirreceptor de TSH, anti-TSHR) en el suero: niveles elevados confirman la EGB y la diferencian de otras causas de hipertiroidismo, en su mayoría de origen no autoinmune.
2) anti-TPO" class="index" name="141676">Anticuerpos anti-TPO (contra la tiroperoxidasa) y anti-Tg" class="index" name="141677">anti-Tg (contra la tiroglobulina, los menos específicos) en el suero: sus niveles pueden estar elevados en la EGB y tiroiditis crónica autoinmune acompañadas de hipertiroidismo, pero no determinan la etiología de la enfermedad (se presentan también en la población sana y en otras enfermedades tiroideas no autoinmunes, con mayor frecuencia en tiroiditis subaguda).
3) Niveles séricos de tiroglobulina (Tg): su determinación es útil únicamente para diferenciar el hipertiroidismo exógeno (niveles séricos bajos) vs. endógeno.
4) Hemograma de sangre periférica: es posible encontrar microcitosis, rara vez anemia normocítica; es frecuente la neutropenia con recuento de linfocitos normal o aumentado asociada a monocitosis y eosinofilia.
5) Perfil lipídico: niveles de colesterol total, LDL y triglicéridos disminuidos.
6) Aumento de actividad de ALT y fosfatasa alcalina en el suero.
7) Niveles séricos de calcio total y libre levemente elevados.
3. Pruebas de imagen. Ecografía tiroidea: determinación del volumen tiroideo, detección de lesiones focales tiroideas y valoración de su ecoestructura y características ecográficas de riesgo, selección de lugar para la biopsia (adicionalmente puede ser útil la elastografía →Bocio multinodular no tóxico) y verificación de la posición de la aguja durante la PAAF, evaluación de los ganglios linfáticos cervicales y diagnóstico diferencial con otras enfermedades tiroideas. Gammagrafía de tiroides: diagnóstico diferencial del nódulo tiroideo autónomo (un foco de captación intensa del radiofármaco) y la tiroiditis subaguda (captación de yodo muy baja) con otras causas del hipertiroidismo (gammagrafía con tecnecio). Diagnóstico del bocio retroesternal y evaluación de la captación de yodo para planificar el tratamiento del hipertiroidismo con radioyodo (gammagrafía con yodo). Preparación para la prueba: suspender los fármacos antitiroideos ≥5 días. Preguntar si el enfermo usa otros fármacos con yodo (disminuyen la captación de yodo). El paciente debe concurrir en ayunas. Radiografía de tórax o selectiva de la tráquea: evaluación de la desviación y compresión de la tráquea por bocios nodulares grandes. Diagnóstico del bocio retroesternal. RMN del cuello y el tórax: evaluación de la extensión del bocio retroesternal (en la TC puede estar exagerada). TC o RMN de las órbitas: en caso de orbitopatía tiroidea en el curso de la EGB. Permite evidenciar las características de la afectación de los músculos oculomotores.
PERSPECTIVA LATINOAMERICANA
En Chile, para la gammagrafía de tiroides se utiliza solo 99mTc, mientras que en otros países se emplea 123I o, como en Argentina y México, 131I.
4. Examen citológico: para la clasificación de los nódulos identificados como malignos (cáncer de tiroides), sospechosos o benignos, con el fin de definir las indicaciones para el tratamiento quirúrgico. Se puede obviar la PAAF en enfermos con hipertiroidismo clínico o subclínico y con un nódulo <3 cm en la ecografía, si cumple criterios de nódulo "caliente" en la gammagrafía (muy bajo riesgo de malignidad).
Criterios diagnósticos
1. Hipertiroidismo subclínico. Realizar el diagnóstico basándose en las pruebas hormonales: niveles séricos de TSH disminuidos (TSH <0,1 mUI/l o TSH 0,1-0,4 mUI/l: forma leve) y niveles séricos de HT dentro del rango normal (pueden aproximarse al LSN), una vez excluidas otras causas de descenso de los niveles de TSH (p. ej. uso de glucocorticoides o dopamina, 1.er trimestre del embarazo), sin síntomas clínicos o solo con síntomas discretos. Si los niveles bajos de la TSH persisten → realizar el diagnóstico diferencial con el fin de establecer la causa endógena del exceso de las HT (ecografía tiroidea, determinación de anticuerpos antitiroideos, gammagrafía tiroidea).
2. Hipertiroidismo clínico
1) Primario: disminución de los niveles séricos de TSH (<0,05 mUI/l) y aumento de los niveles de HT libres (FT4 o FT4 y T3, rara vez T3 sola) por encima del LSN, además de un conjunto de síntomas característico o un cuadro clínico atípico (enfermedad tirocardíaca: el hipertiroidismo se manifiesta principalmente en forma de fibrilación auricular, síntomas de enfermedad coronaria o insuficiencia cardíaca; en muy pocas ocasiones: hipertiroidismo apático en adultos mayores en los que predomina la sensación de cansancio, apatía, depresión e incluso confusión).
2) Secundario: niveles de FT4 y T3 elevados y niveles de TSH elevados o dentro del rango de la normalidad.
3. Crisis tirotóxica: puede presentarse en pacientes con hipertiroidismo no diagnosticado o insuficientemente tratado; sospecharla siempre que se produzca un empeoramiento repentino del estado clínico del paciente con hipertiroidismo (niveles de la TSH <0,05 mUI/l, niveles de FT4 y T3 no tienen que estar muy elevados); es alarmante la aparición de síntomas de insuficiencia multiorgánica. Evaluar el riesgo de la crisis tirotóxica según los criterios de Burch y Wartofsky
1) Temperatura corporal: 38-38,5 ºC — 5 ptos., 38,6-39 ºC — 10 ptos., 39,1-39,5 ºC — 15 ptos., 39,6-40 ºC — 20 ptos., 40,1-40,6 ºC — 25 ptos., >40,6 ºC — 30 ptos.
2) Síntomas en el sistema nervioso: ausentes — 0 ptos., leves (agitación) — 10 ptos., moderados (delirio, psicosis, somnolencia incrementada) — 20 ptos., graves (convulsiones o coma) — 30 ptos.
3) Síntomas en el sistema digestivo: ausentes — 0 ptos., moderados (diarrea, náuseas, vómitos o dolor abdominal) — 10 ptos., graves (ictericia de etiología desconocida) – 20 ptos.
4) Síntomas en el sistema cardiovascular:
a) frecuencia cardíaca: <90/min — 0 ptos., 90-109/min — 5 ptos., 110-119/min — 10 ptos., 120-129/min — 15 ptos., 130-139/min — 20 ptos., ≥140/min — 25 ptos.
b) insuficiencia cardíaca congestiva: ausente – 0 ptos., leve (edema de ambos pies) — 5 ptos., moderada (crepitantes bibasales) — 10 ptos., grave (edema pulmonar) — 15 ptos.
c) fibrilación auricular: ausente — 0 ptos., presente — 10 ptos.
5) Factor predisponente en los pacientes con hipertiroidismo no tratado o tratado de manera inadecuada: infección aguda, trauma, cirugía, parto, cetoacidosis, infarto de miocardio, ACV o accidente isquémico transitorio (AIT), tratamiento con radioyodo (rara vez) o administración de medios de contraste: ausente — 0 ptos., presente — 10 ptos.
Interpretación del resultado: <25 ptos. — poca probabilidad de crisis tirotóxica, 25-44 ptos. — riesgo de crisis tirotóxica (evaluar cuidadosamente el estado clínico del paciente antes de tomar la decisión sobre la instauración del tratamiento agresivo), ≥45 ptos. — alta probabilidad de crisis tirotóxica (está indicado el inicio inmediato de un tratamiento antitiroideo agresivo y del tratamiento de soporte).
Diagnóstico diferencial
Es imprescindible, debido a las diferencias en el curso clínico y en los criterios de selección del tratamiento. Diferenciar las alteraciones de la función tiroidea basándose en las concentraciones séricas de la TSH y la FT4 →fig. 9.2-2 y los resultados de otras pruebas →tabla 9.2-1.
Recordar causas menos frecuentes de hipertiroidismo: hashitoxicosis →Tiroiditis crónica autoinmune (enfermedad de Hashimoto), tiroiditis subaguda, tiroiditis silente y posparto, enfermedad trofoblástica, hipertiroidismo inducido por yodo o por amiodarona (→Tiroiditis crónicas inducidas por fármacos, →tabla 9.2-2), hipertiroidismo debido a inmunoterapia neoplásica con anticuerpos monoclonales (inhibidores de puntos de control inmunitario) o secundario a la destrucción del parénquima tiroideo provocada por la acción de otros fármacos (interferón α, interleucina 2, inhibidores de tirosina-cinasa, litio), metástasis activas del cáncer de tiroides, estruma ovárico. Descartar el uso de preparados de biotina (vitamina H) que pueden influir en las determinaciones de TSH y FT4 y provocar falsos positivos de hipertiroidismo.
En el diagnóstico diferencial del hipertiroidismo secundario se deben tomar en consideración el adenoma hipofisario productor de TSH y los estados clínicos acompañados de FT4 elevada sin inhibición de la secreción de TSH: síndrome de la T4 elevada y síndrome de resistencia a las hormonas tiroideas, en cuyo caso el tratamiento antitiroideo no está indicado.
Diferenciación entre el hipertiroidismo y la tirotoxicosis exógena provocada por la sobredosis, no intencional o intencional, de levotiroxina (L-T4): la tirotoxicosis exógena se caracteriza por niveles bajos de tiroglobulina, captación de yodo disminuida, habitualmente ausencia de bocio, FT4 mucho más elevada que la T3; los niveles de tiroxina pueden determinarse también en las heces.
En embarazadas el criterio diagnóstico de hipertiroidismo más importante es el aumento de niveles de FT4 y/o T3 con inhibición de la secreción de TSH (utilizar los valores de referencia para los diferentes trimestres del embarazo); diferenciar de la tirotoxicosis gestacional, que habitualmente no requiere tratamiento y cede espontáneamente antes de la semana 20 de embarazo.
TratamientoArriba
La selección del tratamiento depende de la causa del hipertiroidismo →tabla 9.2-3, →Enfermedad de Graves-Basedow, Bocio multinodular tóxico y Nódulo autónomo solitario, su curso clínico y la decisión del paciente.
En caso de hipertiroidismo subclínico con niveles de TSH <0,1 mUI/l, el tratamiento está expresamente indicado en enfermos ≥65 años, mientras que en enfermos <65 años se indica si coexisten factores de riesgo (enfermedad cardiovascular, osteoporosis, menopausia) y/o síntomas de hipertiroidismo. En los demás casos se admite observación sin tratamiento. Se puede también considerar el tratamiento en pacientes con hipertiroidismo subclínico leve con niveles de TSH 0,1-0,4 mUI/l, si bien solo en ≥65 años, especialmente con enfermedad cardiovascular concomitante. En enfermos más jóvenes el tratamiento está indicado solo en caso de una cardiopatía grave o la presencia de síntomas de hipertiroidismo. En embarazadas (especialmente hasta la semana 20 de embarazo) el hipertiroidismo subclínico no debe tratarse, no obstante, requiere una cuidadosa observación.
El manejo del hipertiroidismo subclínico ocasionado por el uso farmacológico de L-T4 dependerá de las indicaciones de dicho tratamiento. En enfermos con cáncer de tiroides con enfermedad neoplásica establecida → usar un β-bloqueante en caso de síntomas del hipertiroidismo (eficaz en muchos casos) y solo después valorar la posibilidad de reducir la dosis de L-T4. En el hipertiroidismo subclínico en enfermos tratados por hipotiroidismo o bocio no tóxico simple → disminuir inmediatamente la dosis de L-T4.
Tratamiento crónico y radical
Tratamiento farmacológico
Puede ser el método principal de tratamiento del hipertiroidismo o ser empleado como preparación para el tratamiento radical (con radioyodo o cirugía).
1. Fármacos antitiroideos: tionamidas. Su efecto se manifiesta entre la 1.ª y 3.ª semana (inhiben la síntesis de las HT, pero no inhiben la secreción de las hormonas generadas con anterioridad). Con el tiempo, se debe disminuir la dosis. Antes de iniciar el tratamiento es necesario evaluar el hemograma y, eventualmente, la actividad de las transaminasas y los niveles de bilirrubina en el suero. La granulocitopenia leve puede ser signo de hipertiroidismo y no constituye contraindicación para el tratamiento con tionamidas. Si durante el tratamiento el recuento de granulocitos es de 1000-1500/μl → planificar consultas de control frecuentes, tomar en consideración una disminución de la dosis del fármaco antitiroideo. Si es de 500-1000/μl → disminuir la dosis, considerar la retirada del fármaco. Si es de <500/μl → retirar el fármaco inmediatamente (puede ser eficaz el tratamiento con G-CSF). Durante el tratamiento antitiroideo no se realizan rutinariamente controles de recuento de leucocitos ni de la actividad hepática. No obstante, ante la mínima sospecha de granulocitopenia o daño hepático es necesario realizar estas pruebas. Informar al paciente sobre las posibles complicaciones relacionadas con el tratamiento. En caso de fiebre y dolor faríngeo (en general es la primera manifestación de la agranulocitosis), o de una infección urinaria, el enfermo debe suspender la tionamida y acudir urgentemente al médico. En este caso es indispensable evaluar el recuento de leucocitos en la sangre periférica junto con la fórmula leucocitaria. El uso de tionamidas está absolutamente contraindicado en pacientes con antecedentes de agranulocitosis. Informar al paciente sobre los posibles síntomas de daño hepático (ictericia, acolia, orinas oscuras), que constituyen una indicación para determinar la actividad de las enzimas hepáticas en el suero, y sobre la necesidad de acudir al médico en caso de aparición de exantema pruriginoso, artralgias, dolor abdominal, náuseas o debilidad significativa. Se debe informar a las mujeres sobre el riesgo de malformaciones del feto asociado al tratamiento antitiroideo. Este riesgo puede minimizarse al retirar dichos fármacos cuanto antes, o pautar PTU en el 1.er trimestre de embarazo.
1) Tiamazol: VO es el fármaco de elección, a una dosis inicial de 20-40 mg/d (repartida en 2 dosis). Disminuir la dosis, normalmente al cabo de 3-6 semanas (el tiempo para alcanzar el estado eutiroideo puede prolongarse hasta las 6 semanas), dosis de mantenimiento: 2,5-10 mg/d, por lo general 1 × d: en la enfermedad de Gaves-Basedow durante 12-24 meses (óptimamente 18 meses), mientras que en caso de nódulo autónomo no se consigue remisión (no se puede finalizar la farmacoterapia), por lo que el método de elección es el uso de radioyodo →más adelante. En caso de hipertiroidismo grave: hasta 60 mg/d VO repartidos en 2-3 dosis (tratamiento ambulatorio) y en caso del riesgo de la crisis tirotóxica (hospitalización) hasta 120 mg/d VO o iv. En embarazadas con hipotiroidismo que han sido tratadas con tiamazol, cambiar el tratamiento a PTU cuanto antes; conversión 1:20, p. ej. 5 mg/d de tiamazol → 100 mg/d de PTU. En las embarazadas tratadas por enfermedad de Graves-Basedow y en estado eutiroideo se debe considerar la suspensión del tratamiento antitiroideo →Enfermedad de Graves-Basedow. Si es necesario prescribir el tratamiento tras la semana 16 de embarazo puede administrarse tiamazol (utilizar la menor dosis eficaz; no usar de manera concomitante con L-T4).
2) Propiltiouracilo (PTU): fármaco de segunda elección (en la actualidad en general no está indicado, salvo en situaciones excepcionales, puesto que se han descrito casos de daño hepático grave y muerte). Según varios autores, es un fármaco de elección únicamente en mujeres hasta la semana 16 de embarazo, cuando sea imprescindible el uso de tionamida (en este período se considera más seguro para el feto). Después de la semana 16 de embarazo se prefiere cambiar PTU por tiamazol. Además, se indica excepcionalmente en caso de alergia al tiamazol (en un 50 % de los casos no se produce reacción cruzada). La dosis inicial es de 100-150 mg cada 8 h (en embarazadas 100 mg/d). Disminuirla a las 4-8 semanas (el tiempo para alcanzar el estado eutiroideo es más largo que en caso de tiamazol: hasta 10-17 semanas). La dosis de mantenimiento es de 50-150 mg/d. En embarazadas disminuir la dosis cuanto antes una vez alcanzados los niveles de FT4 cercanos al límite superior del rango normal (p. ej. el 10 % por encima de dicho rango).
Observación del tratamiento
1) Evaluar la remisión de las manifestaciones clínicas del hipertiroidismo. Una rápida mejoría puede requerir un descenso más rápido de la dosis del tratamiento antitiroideo.
2) Determinar los niveles de las TSH y FT4 a las 3-6 semanas desde el inicio del tratamiento. Si los síntomas de la tirotoxicosis han cedido y la FT4 se encuentra cerca del límite inferior del rango de normalidad o por debajo de dicho límite → disminuir la dosis del fármaco antitiroideo (los niveles de la TSH pueden permanecer bajos por más tiempo). La normalización de los niveles de la TSH es una señal para una rápida disminución de la dosis del fármaco.
3) Realizar la siguiente prueba a las 3-6 semanas siguientes. Si el hipertiroidismo no ha sido de larga duración, determinar únicamente la TSH. En caso de inhibición prolongada de la secreción de TSH, puede que dicha determinación no sea útil, entonces es preciso guiarse por la FT4.
Durante el tratamiento con fármacos antitiroideos no se recomienda una evaluación sistemática del recuento de leucocitos. Dicha prueba es necesaria en caso de sospechar granulocitopenia o agranulocitosis.
Reacciones adversas:
1) Infrecuentes, pero requieren que se interrumpa de forma inmediata el uso de tionamidas: agranulocitosis, anemia aplásica; hepatitis aguda (PTU), ictericia colestásica (tiamazol); vasculitis ANCA (+) y síndrome similar al lupus.
2) Que no requieren la interrupción inmediata de los derivados de tionamida: prurito, exantema o urticaria, a veces manifestaciones cutáneas muy pronunciadas (usar antihistamínicos, disminuir la dosis o cambiar el preparado de tionamida); mialgias y artralgias (en caso de artritis se debe considerar la suspensión del tratamiento antitiroideo); fiebre (no usar salicilatos, instruir al enfermo que siempre que aparezca la fiebre y faringitis es necesario realizar el hemograma y acudir al médico; si el recuento de leucocitos es normal, se puede seguir con el tratamiento antitiroideo); alteración del gusto, náuseas y vómitos (disminuir y dividir la dosis de tionamida); aumento leve de transaminasas séricas (emplear la menor dosis eficaz y planificar las pruebas de control; y en caso de elevación de la ALT × 3 de LSN se debe suspender la medicación); granulocitopenia o trombocitopenia transitoria (disminuir la dosis de tionamida y planificar las pruebas de control).
2. Otros fármacos que disminuyen la concentración de las hormonas tiroideas. No pueden usarse de forma rutinaria debido a sus reacciones adversas. Se deben emplear durante breves períodos y en casos justificados, como p. ej. cuando el uso de tionamidas está contraindicado (p. ej. debido a la agranulocitosis), en el tratamiento de la crisis tirotóxica →más adelante, o cuando es necesario controlar rápidamente el hipertiroidismo.
1) Yodo en yoduro de potasio (yodo inorgánico): como solución de Lugol (8 mg de yodo en 1 gota) o solución saturada de yoduro de potasio (SSKI; 50 mg de yodo en 1 gota). Disminuye la síntesis y liberación de las HT. Utilizado en el tratamiento de la crisis tirotóxica y, a veces, en la preparación para la cirugía tiroidea en enfermos con EGB con bocio vascular y sin nódulos tiroideos. No está indicado en el hipertiroidismo inducido por yodo y en caso de planear un tratamiento con yodo radioactivo (la captación de yodo estará disminuida durante ≥6 meses).
2) Medio de contraste yodado (yodo orgánico): iohexol iv.; ácido iopanoico y iopodato sódico VO. Inhibe la conversión de T4 a T3 y libera yodo inorgánico, que disminuye la síntesis y la secreción de HT. Se usa principalmente en el tratamiento de la crisis tirotóxica.
3) Carbonato de litio: disminuye la secreción de HT mediante la inhibición de la proteólisis de la tiroglobulina. Se administran 750-900 mg/d VO en el tratamiento de la crisis tirotóxica o, en ocasiones, en el hipertiroidismo grave (especialmente cuando el uso de tionamidas está contraindicado), aunque el uso de este fármaco está aprobado solo para indicaciones psiquiátricas. Requiere que se controlen los niveles séricos del fármaco.
4) Perclorato de sodio: inhibe el transporte de yodo al tiroides y puede ser útil en el tratamiento del hipertiroidismo inducido por yodo. Usar a corto plazo (<4 semanas) por los efectos adversos (el más grave: mielotoxicidad), en dosis de ≤1 g/d.
5) Glucocorticoides: inhiben la conversión de T4 a T3. P. ej. dexametasona VO: 8 mg/d dividida en 2-3 dosis, si se necesita normalizar de forma urgente las concentraciones de HT (su uso en combinación con tionamida y yodo inorgánico permite a lo largo de 24-48 h reducir sustancialmente o incluso normalizar T3).
3. β-bloqueantes. Indicaciones: taquicardia (>90/min en reposo) y arritmias supraventriculares, retracción palpebral, temblor de las manos, sudoración excesiva. Si los fármacos antitiroideos son efectivos por sí mismos, no es necesario administrar β-bloqueantes. En general se usa propranolol: 10-40 mg 3 × d VO, dosis mayores en el tratamiento de la crisis tirotóxica. Con menor frecuencia fármacos β1-selectivos: atenolol (25-100 mg/d, 1-2 × d), metoprolol (25-50 mg 2-3 × d, o 1 × d en caso de preparado de liberación prolongada, a dosis individualizada: inicialmente 47,5-95 mg/d, que puede aumentarse si fuese preciso) u otro utilizado anteriormente por el paciente por causas cardiológicas.
PERSPECTIVA LATINOAMERICANA
El propiltiouracilo ni el ácido iopanoico no están disponibles en Argentina.
En México, no está disponible el ácido iopanoico, mientras que el propiltiouracilo no es utilizado en instituciones públicas de salud.
Tratamiento con yodo radioactivo (radioyodo; 131I)
1. Mecanismo de acción y riesgo: 131I emite radiación β y γ. La radiación β causa daños irreversibles en las células tiroideas, tiene un alcance corto (~2 mm) y su acción se limita a la propia glándula tiroidea. El 131I administrado que no ha sido captado por la glándula tiroidea se elimina rápidamente por la orina. La exposición a la radiación de los órganos radiosensibles (médula ósea, gónadas) es baja.
2. Contraindicaciones: embarazo y lactancia, diagnóstico o sospecha de cáncer de tiroides concomitante con el hipertiroidismo (requiere cirugía), incapacidad de cumplir las medidas de precaución recomendadas (p. ej. planificación del embarazo en los 6 meses posteriores a la administración del isótopo), o coexistencia de orbitopatía activa de intensidad moderada a grave.
3. Precauciones: antes de la administración del 131I (hasta 48 h) debe excluirse el embarazo (lo que es responsabilidad del médico que realiza el tratamiento). Debido a la radiación γ emitida por el 131I captado por la glándula tiroidea, a lo largo de 1-2 semanas el paciente debe evitar contactos con niños pequeños y embarazadas para no exponerlos a la radiación ionizante. Una vez finalizado el tratamiento, la paciente no debería quedarse embarazada en los 6 meses posteriores (según ETA 2018; según ATA: 4-6 meses). También se recomienda anticoncepción de 6 meses (3-4 meses según ATA) para hombres tratados con 131I. No existe riesgo ni de alteraciones de la fertilidad permanentes, ni de anomalías congénitas en la progenie, por lo que el tratamiento con 131I no está contraindicado en personas jóvenes. En enfermos con orbitopatía tiroidea leve se debe usar simultáneamente corticoterapia profiláctica →más adelante.
4. Preparación para tratamiento con 131I
1) Suspender el tiamazol 5-7 días antes del tratamiento planificado y el PTU un mes antes.
2) Verificar la captación de yodo (con el fin de planificar la actividad requerida de 131I: la radiosensibilidad tiroidea es diferente en la EGB y en otras formas de hipertiroidismo).
3) Evaluar la compresión de la tráquea por la glándula tiroides agrandada: radiografía del tórax o radiografía dirigida a la tráquea.
4) Excluir el embarazo inmediatamente antes de la administración de 131I (prueba de embarazo negativa).
5) Informar al enfermo que debe presentarse en ayunas (administración de 131I VO) y sobre el manejo posterior (incluidas las medidas de precaución y los demás requisitos de la protección radiológica).
5. Manejo posterior a la terapia con 131I: se alcanza el estado eutiroideo a las 6 semanas hasta 6 meses desde la administración de 131I. Durante este período algunos enfermos requieren la continuación del tratamiento antitiroideo: considerar en enfermos mayores, con enfermedades cardiovasculares concomitantes, debido al riesgo de una exacerbación transitoria del hipertiroidismo que generalmente puede presentarse varias semanas después de la terapia con 131I.
6. Indicaciones para repetir el tratamiento con 131I: hipertiroidismo persistente a los 6 meses o recidiva del hipertiroidismo. Evaluación final de la eficacia del tratamiento: tras 1 año.
7. Observación de la función tiroidea: es imprescindible para la detección temprana y tratamiento del hipotiroidismo (es una posible consecuencia del tratamiento con 131I; el mayor riesgo en la EGB y el menor con un nódulo tiroideo autónomo). Controlar los niveles séricos de TSH y HT libres cada 4-6 semanas durante 6 meses o menos, hasta la aparición del hipotiroidismo y su compensación mediante el tratamiento con L-T4; después con menor frecuencia, cada 6-12 meses.
Tratamiento quirúrgico (tiroidectomía)
1. Indicaciones
1) absolutas: diagnóstico o sospecha de cáncer de tiroides concomitante con el hipertiroidismo
2) relativas: opción terapéutica alternativa al tratamiento con 131I (argumentos a favor de la cirugía: presencia de manifestaciones de compresión del bocio nodular grande, nódulos grandes inactivos o bocio retroesternal).
2. Preparación
1) Cirugía programada: en el hipertiroidismo sin tratamiento previo, administrar tiamazol a dosis completa durante ≥4-6 semanas para conseguir la remisión de los síntomas y normalizar los niveles séricos de HT libres. Si no se puede demorar la cirugía, con tan solo 2 semanas de tratamiento antitiroideo disminuirán significativamente los síntomas y se protegerá de las complicaciones. La TSH baja no constituye en este caso contraindicación para la cirugía (es consecuencia de una intensa inhibición previa de la hipófisis por el exceso de HT). En enfermos con bocio vascular el uso de solución de Lugol puede facilitar el tratamiento quirúrgico por reducir el tamaño del bocio y su vascularización: durante 7-10 días anteriores a la cirugía administrar 3-7 gotas de solución de Lugol 3 × d. Si el bocio es de gran tamaño → ir incrementando la dosis hasta 10-15 gotas 3 × d. En lugar de solución de Lugol se puede aplicar SSKI: 1-2 gotas 3 × d. En enfermos con bocio multinodular hiperfuncionante y con nódulo autónomo solitario no se recomienda administrar yodo antes de la cirugía. Recordar que, ante la presencia de nódulos tiroideos, si se diagnosticara un cáncer de tiroides en estudio histológico del nódulo tras la cirugía, en varios meses no sería posible emplear 131I para el diagnóstico y tratamiento de la neoplasia por encontrarse disminuida la captación de yodo.
2) Cirugía urgente: se pueden necesitar altas dosis de yodo, glucocorticoides, β-bloqueante y opcionalmente colestiramina, como en el caso de la crisis tirotóxica →más adelante.
3. Extensión de la cirugía: depende de la causa del hipertiroidismo y el riesgo de malignidad (EGB, bocio multinodular tóxico, cáncer de tiroides). Se puede realizar tiroidectomía subtotal (el volumen de los remanentes oscila entre 2 y 4 ml bilateralmente), lobectomía total con resección del istmo, tiroidectomía casi total (si el volumen de los remanentes es <1 ml bilateralmente) o tiroidectomía total. En la actualidad ya no se realizan operaciones con menor extensión (resección parcial, resección cuneiforme o extirpación de nódulos), debido al alto riesgo de recidiva del bocio.
4. Complicaciones del tratamiento quirúrgico: las permanentes (persisten >12 meses) ocurren rara vez (con mayor frecuencia después de la tiroidectomía total o reintervención de tiroidectomía). Son más frecuentes los trastornos transitorios, que suelen remitir al cabo de unas semanas o meses: hipoparatiroidismo →Hipoparatiroidismo primario, lesión del nervio laríngeo recurrente y parálisis de las cuerdas vocales (en la mayoría de los casos es unilateral y causa ronquera, muy pocas veces parálisis bilateral con disfunción respiratoria grave, que pueda requerir traqueotomía urgente).
5. Terapia de restitución tiroidea con L-T4 tras la cirugía: empezar el tratamiento con L-T4 a dosis de ~1,6 μg/kg 1 × d; en enfermos mayores o con enfermedades cardiovasculares concomitantes la dosis debe ser menor. Controlar los niveles séricos de TSH transcurridas 6-8 semanas y, si es necesario, ajustar la dosis. Determinar la concentración de TSH cada 1-2 meses hasta su estabilización, y posteriormente ≥1 × año. En caso de tiroidectomía parcial considerar el tratamiento con L-T4 en función de los resultados de la determinación de TSH y FT4 realizada pasadas 4-6 semanas de la cirugía. Descartar también el hipoparatiroidismo secundario como complicación de tiroidectomía.
Tratamiento de la crisis tirotóxica
Empezar inmediatamente, incluso antes de que el laboratorio lo confirme y continuar en la UCI.
1. Administrar fármacos
1) que disminuyen los niveles séricos de HT:
a) tiamazol 40-80 mg 3 × d iv. o 30 mg 4 × d VO (por sonda nasogástrica) o VR
b) administrar yodo lo más pronto posible (a no ser que la exposición a yodo haya desencadenado la crisis), pero ≥1 h después de administrar antitiroideos (para que no se utilice para la síntesis de nuevas HT): SSKI 800-1000 mg/d VO, dividido en 4 dosis (4-5 gotas 4 × d) o solución de Lugol (10-30 gotas 2-4 × d) o iohexol 0,6 g iv. 2 × d
2) β-bloqueante, p. ej. propranolol 2 mg iv. a lo largo de 2 min. Se puede repetir al cabo de unos minutos y posteriormente 2 mg cada 4 h o VO 40-80 mg 3-4 × d (inhibe también de forma leve la conversión de T4 a T3)
3) hidrocortisona 50-100 mg iv. 4 × d (además de tener acción anti-shock inhibe la conversión de T4 a T3)
4) antibióticos iv. ante la más mínima sospecha de infección (antibioticoterapia empírica hasta obtener los resultados del cultivo)
5) sedantes y antiepilépticos: en caso de necesidad.
2. Administrar oxígeno 2 l/min por catéter nasal. En caso de necesidad: oxigenoterapia más intensiva. Monitorizar la función respiratoria y, si es necesario, emplear ventilación asistida en la UCI.
3. Compensar los trastornos hidroelectrolíticos bajo control de presión venosa central y pruebas bioquímicas realizadas cada 12 h. Administrar también solución glucosada al 10 % (para compensar la deficiencia del glucógeno hepático).
4. Bajar la temperatura corporal en caso de fiebre: usar compresas frías y paracetamol o, con menor frecuencia, AINE (los salicilatos están contraindicados puesto que bloquean la unión de T4 a su proteína transportadora TBG).
5. Tratar intensivamente la enfermedad desencadenante de la crisis tirotóxica: p. ej. infección, cetoacidosis, embolismo pulmonar, etc.
6. Usar profilaxis antitrombótica →tabla 2.33-3 si existen indicaciones, p. ej. fibrilación auricular →Fibrilación auricular (FA), insuficiencia cardíaca grave, inmovilización.
7. Plasmaféresis: tomar en consideración en caso de ineficacia del tratamiento a las 24-48 h.
La mortalidad en la crisis tirotóxica es de un 30-50 %, por ello la estrategia de tratamiento temprano y eficaz del hipertiroidismo tiene como objetivo prevenir el desarrollo de dicha complicación.
8. Tratamiento nutricional: para prevenir el catabolismo significativo.
ComplicacionesArriba
Son consecuencias del exceso de HT, tanto de forma indirecta (p. ej. un ACV en casos de fibrilación auricular provocada por el hipertiroidismo), como de forma directa, bien aguda (crisis tirotóxica, que es una complicación potencialmente mortal), o crónica (fibrilación auricular y fracturas osteoporóticas). El riesgo de fibrilación auricular permanente es ~3 veces más grande y las terapias en general son ineficaces hasta que remita la tirotoxicosis. El incremento de morbimortalidad cardiovascular es consecuencia de un riesgo elevado de las arritmias cardíacas, complicaciones tromboembólicas en casos de fibrilación auricular, agravamiento de la enfermedad coronaria o de la insuficiencia cardíaca.
TABLAS Y FIGURASArriba
Tabla 9.2-1. Diagnóstico diferencial entre la enfermedad de Graves-Basedow y el hipertiroidismo de etiología no autoinmune
|
Criterios |
Enfermedad de Graves-Basedow |
Hipertiroidismo de etiología no autoinmune (bocio multinodular tóxico, nódulo autónomo solitario) |
|
Anamnesis |
Recaídas del hipertiroidismo. AITD u otras enfermedades autoinmunes en la familia y el paciente |
Antecedentes de bocio no tóxico |
|
Síntomas del hipertiroidismo |
No existen signos diferenciales |
|
Bocioa |
Rasgos de bocio vascularb |
Bocio multinodular o nódulo solitario |
|
Afectación ocular |
Signos de orbitopatía (inflamación autoinmune), orbitopatía clínica en un 20-30 %, exoftalmos maligno en un 2-3 % |
Los síntomas oculares resultantes de la hiperactividad simpática (retracción palpebral) no apuntan en contra de este diagnóstico |
|
Edema pretibial |
En el 1-3 % |
No se presenta |
|
Pruebas de laboratorio de la función tiroidea |
↓ TSH, ↑ FT4 (con menor frecuencia ↑ T3), sin rasgos que diferencien |
|
↑ TRAb |
En un 95 % |
Ausentes |
|
↑ anti-TPOc |
En un 70 % |
En un 15 % de los enfermos (de edad avanzada) |
|
Ecografía de tiroides |
Hipoecogenicidad difusa de parénquimab |
Lesiones focales |
|
Gammagrafía de tiroides |
Sin lesiones focales pronunciadas. A menudo se visualiza una imagen con ligera heterogeneidad en la captación del trazador |
Son visibles áreas de función autónoma y áreas inactivas |
|
a La ausencia de bocio no es un signo diferencial.
b En 1/4 de los enfermos pueden aparecer nódulos.
c Signo de sensibilidad y especificidad mucho menor que los TRAb.
↑ concentración aumentada, ↓ concentración disminuida, AITD – enfermedad tiroidea autoinmune |
Tabla 9.2-2. Diagnóstico diferencial y tratamientoa del hipertiroidismo inducido por amiodarona tipo I y II
|
|
Tipo I |
Tipo II |
|
Enfermedad subyacente de tiroides |
Bocio multinodular o EGB (a menudo no diagnosticado) |
No |
|
Mecanismo |
Exceso de yodo → síntesis de HT aumentada |
Toxicidad por amiodarona (inflamación) → destrucción de tirocitos y liberación de HT |
|
Captación de yodo |
>5 % |
<2 % |
|
Ecografía de tiroides + Doppler |
La glándula tiroides a menudo está aumentada de tamaño, posibles lesiones focales, flujo sanguíneo aumentado |
Glándula tiroides normal, flujo sanguíneo disminuido |
|
Anticuerpos TRAb |
Elevados en la EGB |
Ausentes |
|
Tratamiento farmacológicoa |
p. ej. tiamazol 40-60 mg/d y perclorato de sodio (<4-6 semanas) 200-250 mg 4 × d (inhibe el acúmulo de yodo en el tiroides). Considerar el tratamiento radical |
P. ej. prednisona 40-60 mg/d durante 1-3 meses, posteriormente seguir disminuyendo la dosis durante los 2 meses siguientes |
|
a Más información →Tiroiditis crónicas inducidas por fármacos. Si el diagnóstico diferencial no es posible y no se sabe nada de la función tiroidea antes de la administración de amiodarona, o se sospecha una forma mixta (coexistencia de los tipos I y II) se puede emplear el tratamiento mixto: comenzar por tiamazol y perclorato de sodio y en caso de falta de mejoría añadir glucocorticoides. |
Tabla 9.2-3. Métodos de tratamiento del hipertiroidismo
|
Causa del hipertiroidismo |
BB |
T |
131I |
Cir |
|
Enfermedad de Graves-Basedow |
Primer episodio |
|
|
|
|
|
Recaída |
|
|
|
|
|
Orbitopatía tiroidea leve |
|
|
a |
|
|
Orbitopatía tiroidea activa grave o moderada |
|
|
|
|
|
Con nódulo maligno diagnosticado o sospechoso |
|
|
b |
|
|
Recaída de la EGB tras la cirugía |
|
|
|
|
|
Bocio multinodular tóxico |
Bocio pequeño sin compresión de las vías respiratorias, benigno |
|
|
|
|
|
Bocio grande, tras biopsia de lesiones focales, benigno |
|
|
|
|
|
Bocio con diagnóstico o sospecha de malignidad |
|
|
b |
|
|
Nódulo autónomo solitario |
PAAF: lesión benigna o sospecha de neoplasia folicular sin factores de riesgo de malignidad |
|
|
c |
|
|
Diagnóstico de cáncer de tiroides (muy raras veces) |
|
|
b |
|
|
Hipertiroidismo inducido por exceso de yodo |
Hipertiroidismo inducido por amiodarona |
|
d |
|
|
|
Otros casos |
|
|
|
|
|
Tiroiditis |
Subaguda |
|
|
|
|
|
Silente o posparto |
|
|
|
|
|
Al inicio de la enfermedad de Hashimoto |
|
|
|
|
|
Hipertiroidismo en embarazadase |
|
f |
|
|
|
Hipertiroidismo subclínico |
|
|
|
g |
|
No hay indicaciones Método complementario Método empleado Método de preferencia Método contraindicado |
|
a Con el fin de prevenir la exacerbación de la orbitopatía se administran glucocorticoides VO, habitualmente prednisona a dosis de 0,3-0,5 mg/kg/d (p. ej. 30 mg/d) durante 1 mes, a continuación reducir gradualmente la dosis para suspender el fármaco a los 3 meses.
b Tras la cirugía del cáncer de tiroides en general es necesario administrar 131I.
c El tratamiento con 131I también se acepta en caso de sospecha de neoplasia folicular en la PAAF, en ausencia de rasgos clínicos de malignidad. El riesgo de cáncer en un nódulo solitario autónomo es de un 2 % (hay que distinguirlo de un área autónoma en el bocio multinodular tóxico).
d Según el tipo; en el tipo I a menudo está indicado añadir perclorato de sodio, en el tipo II se administran principalmente glucocorticoides.
e Diferenciarlo de la tirotoxicosis inducida por el embarazo que rara vez requiere tratamiento.
f Administrar solo si el tratamiento es necesario, a dosis considerablemente menores; en el 1.er trimestre se prefiere pautar propiltiouracilo.
g Solamente si las indicaciones para cirugía se deben a una compresión, o a un diagnóstico del bocio maligno.
BB — β-bloqueante, 131I — tratamiento con radioyodo, Cir — cirugía de la glándula tiroides, T — tionamidas (tiamazol como fármaco de elección) |
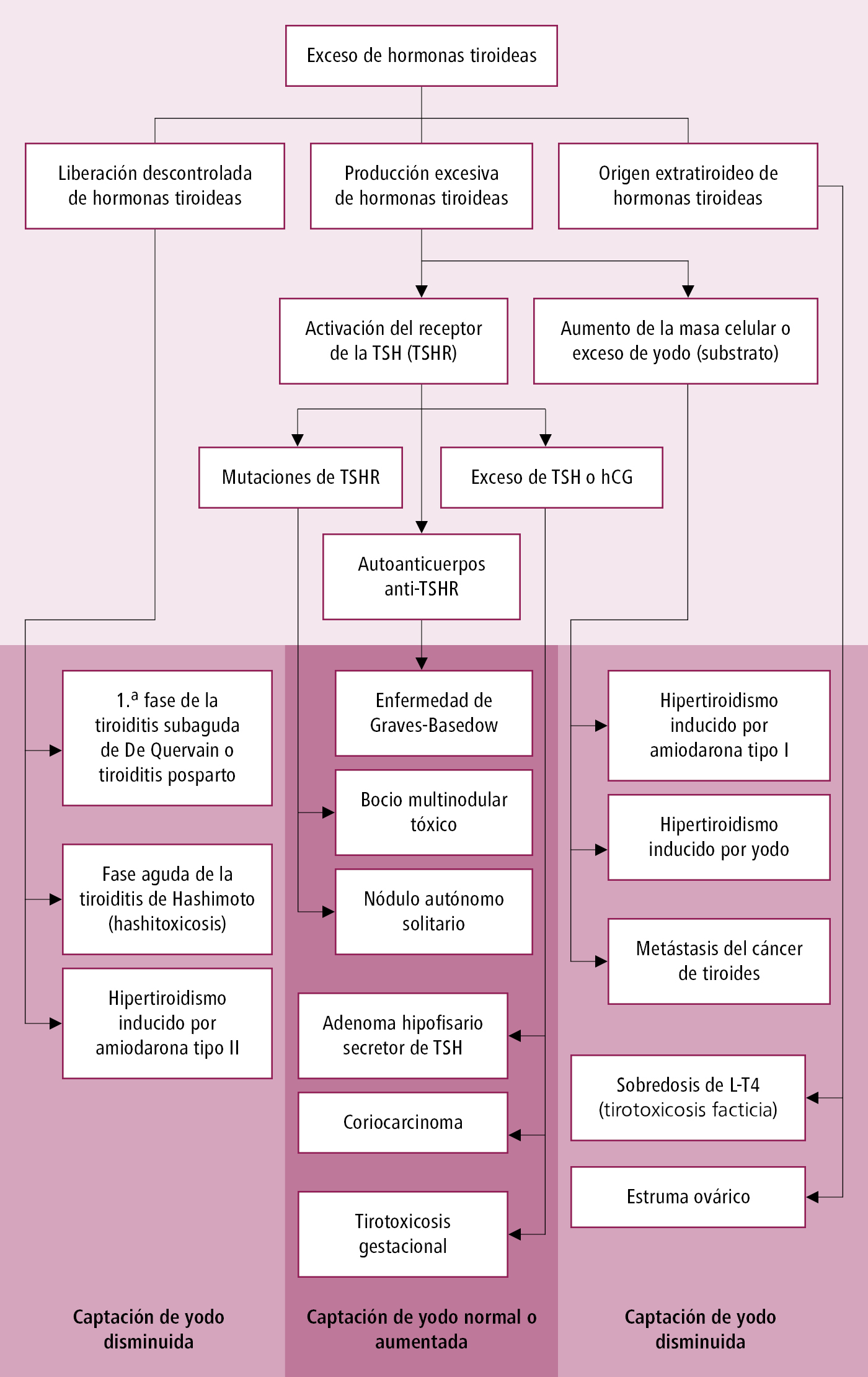
Fig. 9.2-1. Causas de hipertiroidismo
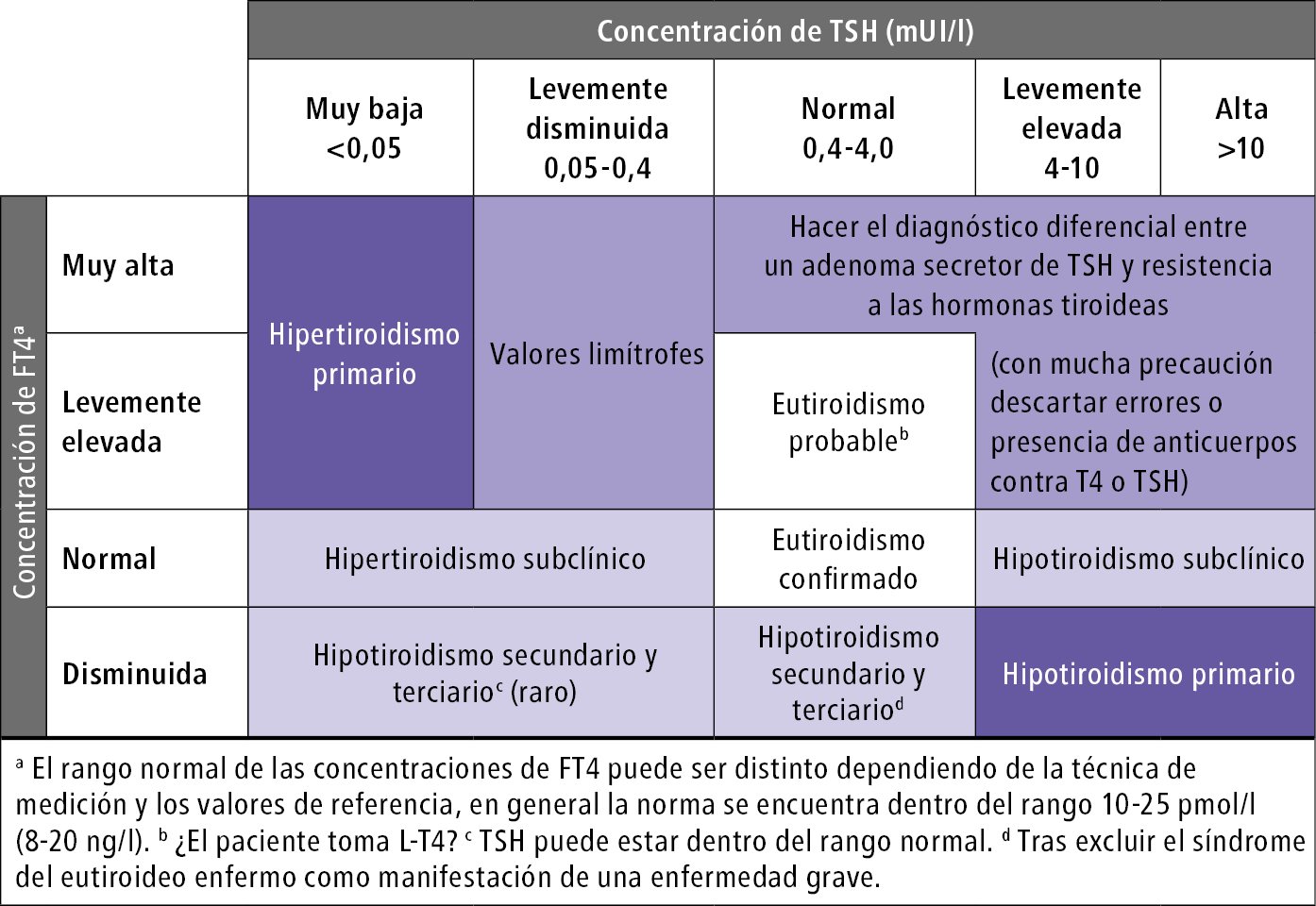
Fig. 9.2-2. Diagnóstico diferencial de los trastornos de la función tiroidea basado en los niveles séricos de TSH y FT4
Tabla 2.33-3. Profilaxis de ETV en enfermos en tratamiento conservador
|
Situación clínica |
Prevención indicada |
|
Hospitalizados por una enfermedad aguda tratada de manera conservadora, incluido el ACV isquémico con limitación de la movilidada |
Opciones:
– HBPM a dosis profiláctica adecuadab (preferible)
– fondaparinux 2,5 mgc Vsc cada 24 h
– eventualmente, HNF 5000 UI VSc cada 12 h
– eventualmente, CNI y/o medias elásticas de compresión graduada en caso de contraindicaciones para la anticoagulación, incluida la hemorragia o alto riesgo hemorrágico (por lo menos al inicio, hasta que el riesgo de sangrado disminuya)d
Nota: no utilizar heparina durante las primeras 24 h tras el tratamiento trombolítico del ACV. La heparina a dosis profiláctica puede usarse con seguridad junto con el AAS. |
|
ACV hemorrágicoa |
– en la fase temprana utilizar CNI
– en enfermos estables y con riesgo de ETV muy alto se puede utilizar HBMP a dosis profiláctica adecuadab (preferible) o HNF 5000 UI VSc cada 12 h, empezando 2-4 días del sangrado si se considera seguro (cese de la hemorragia documentado).
Nota: el momento de la introducción de la heparina depende del balance entre el riesgo de la trombosis y el riesgo de recidiva del sangrado. |
|
Enfermos graves tratados de manera conservadora en la unidad de cuidados intensivos debido al riesgo directo para la vida (enfermos críticos) |
Opciones:
– HBPM a dosis profiláctica adecuadab (preferible)
– eventualmente, HNF 5000 UI VSc cada 12 h
– en caso de sangrado o de riesgo alto de sangradoe utilizar CNI y/o medias elásticas de compresión graduada, por lo menos al principio, hasta que el riesgo hemorrágico disminuya. |
|
Enfermos inmovilizados crónicamente en casa o en una residencia |
No utilizar prevención de ETV de manera rutinaria. |
|
a Las indicaciones del manejo de los enfermos con ACV solamente se refieren a la prevención de la ETV y no al tratamiento anticoagulante ni trombolítico del ACV.
b Preparados →Trombosis venosa profunda (TVP), dosificación →tabla 2.33-4.
c 1,5 mg, si el aclaramiento de creatinina <50 ml/min.
d El riesgo de sangrado está aumentado sobre todo en relación con úlcera gástrica o duodenal activa, sangrado importante en los últimos 3 meses, recuento de las plaquetas <50 × 109/l, insuficiencia hepática (INR >1,5). Los demás factores del riesgo hemorrágico: edad ≥85 años (vs. <40 años), insuficiencia renal grave (TFG <30 ml/min/m2), ingreso en la unidad de cuidados intensivos médicos o cardiológicos, colocación de catéter venoso central, artritis crónica, enfermedad neoplásica, sexo masculino. La coexistencia de varios factores aumenta significativamente el riesgo de sangrado. A menudo, los mismos factores aumentan también el riesgo de ETV, de ahí que la decisión del uso de la anticoagulación se deba basar en la valoración del balance de estos riesgos.
Nota: no se recomienda el uso de ACOD (excepto en enfermos que reciben ACOD por otras indicaciones). Utilizar prevención farmacológica durante el período de inmovilización o de hospitalización.
AAS — ácido acetilsalicílico, ACOD — anticoagulante oral de acción directa, CNI — compresión neumática intermitente, ETV — enfermedad tromboembólica venosa, HBPM — heparina de bajo peso molecular, HNF — heparina no fraccionada |
 Español
Español
 English
English
 українська
українська






