Група метаболічних захворювань, які характеризуються гіперглікемією, що виникає внаслідок дефекту секреції або дії інсуліну. Хронічна гіперглікемія при цукровому діабеті (ЦД) призводить до пошкодження, дисфункції та недостатності різних органів, особливо очей, нирок, нервів, серця і кровоносних судин.
1. ЦД 1-го типу: зумовлений руйнуванням β-клітин підшлункової залози аутоімунним процесом, індукованим дією тригерних (пов’язаних із середовищем) факторів у осіб із генетичною схильністю. У розвитку захворювання беруть участь антитіла до острівців Лангерганса (до різних антигенів β-клітин), які можуть з'являтись за багато місяців і навіть років до появи симптомів ЦД; протягом цього періоду відбувається поступова втрата секреторної функції β-клітин, котра призводить до маніфестного ЦД, який характеризується абсолютним дефіцитом інсуліну. Проявляється у дітей і молоді, та в осіб віком <30-ти р. Можливим є повільний перебіг аутоімунної деструкції β-клітин, який призводить до маніфестації захворювання у 4-ій або 5-ій декаді життя (латентний аутоімунний діабет дорослих — LADA). Після маніфестації захворювання процес руйнування β-клітин триває ще впродовж певного часу; зникнення С-пептиду (маркера секреції інсуліну) в сироватці свідчить про їх остаточне знищення.
2. ЦД 2-го типу: найчастіша форма (≈80 %); зумовлена поступовим порушенням секреції інсуліну в умовах інсулінорезистентності. Може бути генетично обумовленим (полігенне успадкування), однак ключову роль відіграють фактори середовища (ожиріння [особливо абдомінальне] та низька фізична активність). Надмір вільних жирних кислот, які виділяє черевна жирова тканина, викликає «ліпотоксичність» — збільшене окиснення жирів призводить до гальмування гліколізу у м'язах, а у печінці призводить до посилення глюконеогенезу, що вимагає компенсаційної секреції інсуліну β-клітинами та може призвести до поступового виснаження їх резерву і порушення метаболізму глюкози.
3. ЦД відомої етіології: генетичні дефекти β-клітин підшлункової залози (напр., діабет дорослого типу у молодих людей [MODY], тривалий неонатальний ЦД), генетичні дефекти дії інсулінy, захворювання екзокринної частини підшлункової залози, ендокринопатії (напр., синдром Кушинга, акромегалія, феохромоцитома), ятрогенний діабет, що індукований ліками (напр. ГК) чи іншими хімічними речовинами, інфекції (напр. вроджена краснуха), рідкісні форми, що спричинені імунним процесом, інші генетичні синдроми, які іноді асоційовані з ЦД (напр., синдроми Дауна, Клайнфельтера, Шерешевського-Тернера).
4. Гестаційний діабет або ЦД у вагітної — діагностовані під час вагітності. Підвищення концентрації контрінсулярних гормонів, яке виникає під час вагітності, призводить до інсулінорезистентності, збільшення потреби в інсулінi та підвищення доступності глюкози для плоду, який розвивається — внаслідок цих адаптаційних змін зростає ризик порушень вуглеводного обміну у жінок, які досі були здоровими.
КЛІНІЧНА КАРТИНА ТА ТИПОВИЙ ПЕРЕБІГ
Перебіг захворювання залежить від швидкості втрати β-клітин. Спочатку виникає порушення ранньої фази секреції інсуліну, у подальшому розвивається предіабет (порушення глікемії натще [ПГН], і/або порушена толерантність до глюкози [ПТГ]), а далі — маніфестний ЦД. Суб'єктивні симптоми є неспецифічними і різноманітними, пов'язаними з типом ЦД та динамікою розвитку хвороби, проявляються при ЦД 1-го типу значно частіше, ніж при ЦД 2-го типу, аналогічно, як і кетоацидоз та кетоацидотична кома. У зв'язку з труднощами у досягненні повної корекції ЦД не вдається повністю запобігти розвитку хронічних ускладнень →розд. 13.4, які погіршують якість життя хворих і становлять причину підвищення смертності з приводу серцево-судинних захворювань.
Типові симптоми ЦД: поліурія (осмотичний діурез внаслідок глюкозурії), полідипсія (посилена спрага), ознаки дегідратації, які, переважно, є помірно вираженими (зниження еластичності шкіри, сухість шкіри та слизових оболонок), спричинені зневодненням слабкість та сонливість, схуднення (рідше), кетоацидоз та кетоацидотична кома (іноді перший помічений симптом), схильність до гнійних інфекцій шкіри чи інфекцій сечостатевої системи.
1. ЦД 1-го типу: раптове виснаження секреторних резервів β-клітин підшлункової залози у дітей і молоді є причиною гострого початку захворювання (кетоацидоз та кетоацидотична кома) та лабільного перебігу ЦД, що пришвидшує розвиток хронічних ускладнень (можуть з'являтись вже через 5 років від початку хвороби). Симптоми ЦД 1-го типу у дорослих осіб наростають повільно, деколи протягом кількох місяців, зазвичай, хвороба не починається кетоацидотичною комою (хоча з'являються симптоми кетоацидозу). Багаторічний перебіг, на перший погляд, лагідної гіперглікемії, напр. при ЦД LADA, сприяє підступному розвитку хронічних ускладнень.
2. ЦД 2-го типу: типові симптоми ЦД виникають значно рідше, ніж при ЦД 1-го типу. Більш, ніж половина випадків має безсимптомний перебіг і захворювання виявляють випадково, або під час скринінгових обстежень. Якщо ЦД не лікувати, це зумовлює розвиток хронічних ускладнень, особливо серцево-судинних, котрі є основною причиною смерті. ≈85 % хворих має ожиріння, переважно, абдомінальне; часто виникає артеріальна гіпертензія та ліпідні порушення. Гіперглікемія може вперше проявитись під час перебігу іншого захворювання (напр. інфекції), при якому збільшується потреба в інсуліні. Секреторні резерви β-клітин при ЦД з часом поступово виснажуються (це вимагає моніторингу перебігу захворювання та адаптації лікування до змінних потреб).
Алгоритм діагностики ЦД →рис. 13.1-1.
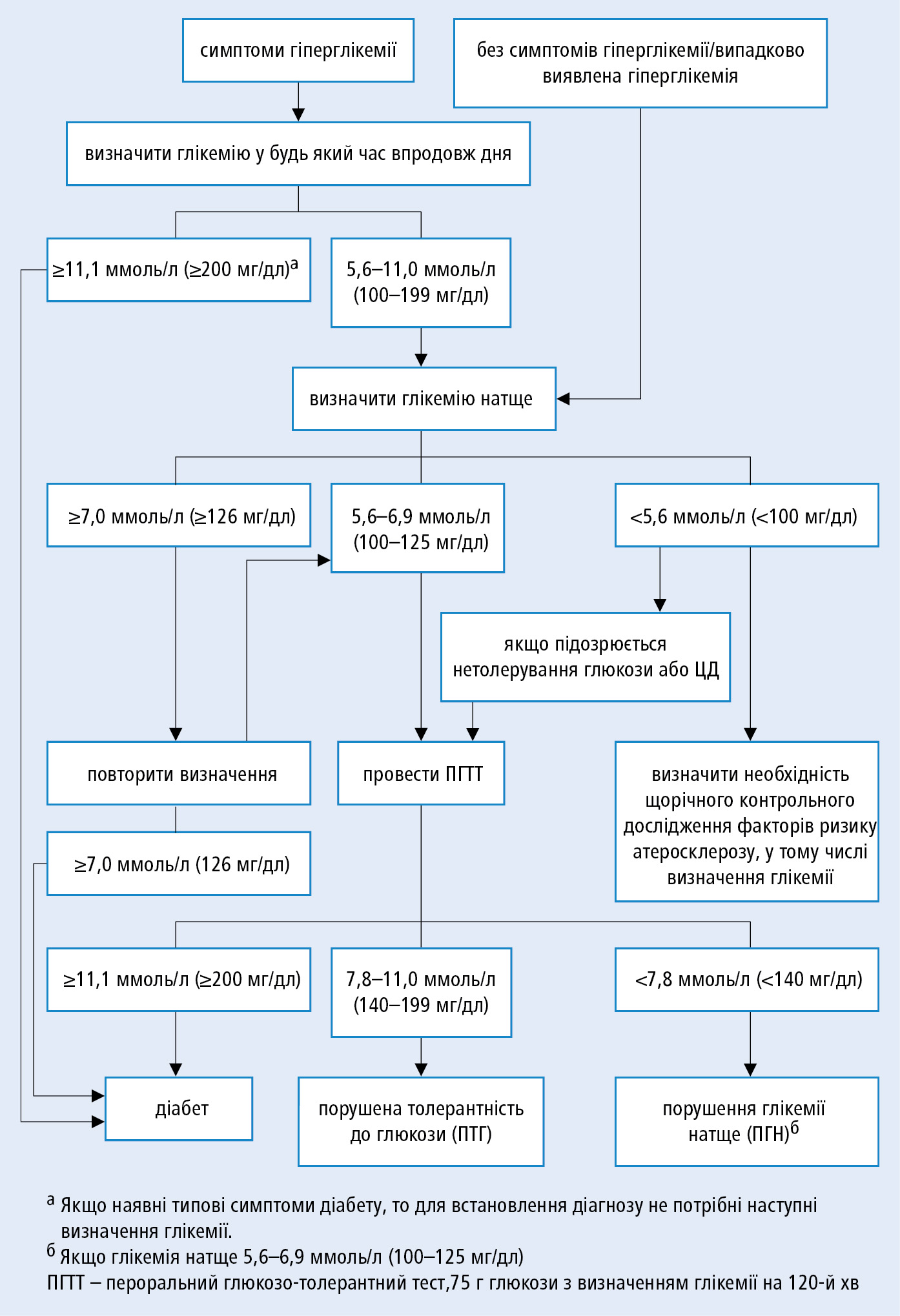
Рисунок 1. Алгоритм діагностики цукрового діабету
Багато випадків ЦД розвиваються безсимптомно, у зв'язку з чим рекомендується виконання скринінгових досліджень (глікемія натще або ПГТТ →нижче) щорічно у групах підвищеного ризику щодо розвитку ЦД 2 типу: надмірна вага або ожиріння (ІМТ ≥25 кг/м2 або окружність талії >80 см у жінок та >94 см у чоловіків); ЦД у батьків або сибсів; низька фізична активність; порушення вуглеводного обміну в анамнезі — ПГН або ПТГ; перенесений гестаційний діабет; народження дитини вагою >4 кг; артеріальна гіпертензія (≥140/90 мм рт. ст.); ХСЛПВЩ <1,0 ммоль/л (40 мг/дл) або концентрація тригліцеридів >1,7 ммоль/л (250 мг/дл); синдром полікістозних яєчників; захворювання серцево-судинної системи на фоні атеросклерозу; муковісцидоз (обстеження раз на рік з 10-річного віку); і кожні 3 роки у всіх осіб віком ≥45-ти р.
Принципи скринінгових досліджень вагітних жінок →розд. 13.2.2.
1. Лабораторні дослідження:
1) глікемія — концентрація глюкози у плазмі венозної крові (норма 4,0–5,5 ммоль/л [72–99 мг/дл]) використовується для діагностики ЦД або ПГН, а концентрація глюкози у цільній капілярній крові (аналіз за допомогою глюкометра, натще [тобто 8–14 год від останнього прийому їжі] i 90–120 хв після прийому їжі) — для моніторингу лікування ЦД;
2) відсоток глікозильованого гемоглобіну (HbA1с) — використовується з метою оцінки метаболічної корекції ЦД, віддзеркалює середню глікемію впродовж 3-х міс. перед визначенням; слід враховувати інші стани, що впливають на результат або роблять неможливим його інтерпретацію — гемоглобінопатії, анемії, стан після переливання еритроцитарної маси, гіпертригліцеридемію, гіпербілірубінемію, ниркову недостатність, прийом саліцилатів у великих дозах; лабораторії також можуть виражати результат дослідження HbA1c в одиницях SI (ммоль/моль);
3) концентрація фруктозаміну — віддзеркалює середню глікемію впродовж останніх 3-х тиж. (період напіврозпаду альбуміну), визначається рідко, напр., коли відсоток HbA1c є невірогідним (→вище), або коли є необхідною короткочасна оцінка компенсації глікемії (напр. у вагітних);
4) глюкоза в сечі — визначення за допомогою тест-смужки, є непридатним для моніторингу при лікуванні ЦД; підтвердження глюкозурії є показанням до визначення глікемії;
5) антитіла до острівців — аналіз використовують для підтвердження аутоімунної етіології ЦД:
а) антитіла до острівців (ICA; до різних цитоплазматичних антигенів β-клітин), значно рідше визначають з огляду на найнижчу специфічність;
б) до глутаматдекарбоксилази (анти-GAD65 антитіла);
в) до тирозинфосфатази (IA-2, IA-2β),
г) до ендогенного інсуліну (IAA);
д) до цинку (Zn8);
6) концентрація С-пептиду в сироватці — відповідає концентрації ендогенного інсуліну; знижена або не визначається при ЦД 1-го типу, збільшена у початковій фазі ЦД 2-го типу, коли домінує інсулінорезистентність та зростає секреція інсуліну, натомість, знижена після вичерпання секреторних резервів β-клітин;
7) кетонові тіла у сечі або їх підвищена концентрація у сироватці (при кетоацидозі →розд. 13.3.1) — тест-смужки визначають, головним чином, ацетооцтову кислоту, решта — це ацетон і β-оксимасляна кислота;
8) концентрація лактату в сироватці — підвищена при лактацидозі →розд. 13.3.3.
2. Функціональні дослідження
1) пероральний глюкозотолерантний тест (ПГТТ) — застосовують для діагностики ЦД або ПТГ; проводять через 8–14 год після останнього прийому їжі у хворого після відпочинку і нічного сну, після 3-х днів вживання звичайної дієти із нормальним вмістом вуглеводів; необхідно з'ясувати, чи пацієнт не приймає ліків, що можуть підвищувати глікемію (ГК, тіазидні діуретики, деякі β-блокатори); слід визначити глікемію натще та через 120 хв після перорального прийому розчину 75 г глюкози; у нормі концентрація глюкози у плазмі венозної крові через 120 хв <7,8 ммоль/л (140 мг/дл); ПГТТ виконується, якщо результат одноразового аналізу глікемії натще становить 5,6–6,9 ммоль/л (100–125 мг/дл) або коли при глікемії <5,6 ммоль/л (100 мг/дл) існує аргументована підозра на порушення толерантності до глюкози;
2) тест з глюкагоном — застосовують для оцінки секреторних резервів β-клітин підшлункової залози, придатний для диференціювання ЦД 1-го і 2-го типу; С-пептид визначається натще та через 6 хв після в/в введення 1 мг глюкагону; межі норми за звичайних умов — 0,4–1,2 нмоль/л (1,4–4,0 мкг/л); через 6 хв після ін'єкції глюкагону — 1–4 нмоль/л; концентрація <0,6 нмоль/л після стимуляції глюкагоном вказує на ЦД 1-го типу (відсутність С-пептиду може пояснювати лабільність його перебігу), або довготривалий ЦД 2-го типу (після виснаження секреторних резервів β-клітин). Дуже високі концентрації С-пептиду натще і після стимуляції глюкагоном можуть свідчити про гіперінсулінізм при ЦД 2-го типу або інсуліному.
3) оцінка чутливості до інсуліну за методом HOMA — індекс інсулінорезистентності HOMA‑IR розраховують за формулою: інсулінемія натще (в мМО/л) × глікемія натще (в ммоль/л)/22,5; у зв'язку з пульсаційною секрецією інсуліну, вимірювання слід провести 3–4 рази та визначити середній показник.
Діагностику гіперглікемічних станів не слід проводити під час гострої фази іншого захворювання (напр., інфекції чи гострого коронарного синдрому), безпосередньо після травми чи оперативного втручання, ані під час прийому ЛЗ, що можуть підвищувати глікемію (глюкокортикостероїди, тіазидні діуретики, деякі β-блокатори).
1. Предіабет або стан підвищеного ризику ЦД діагностують у 2-х ситуаціях:
1) порушення глікемії натще (ПГН) — глікемія натще у межах 5,6–6,9 ммоль/л (100–125 мг/дл); є показанням до виконання ПГТТ;
2) порушена толерантність до глюкози (ПТГ) — глікемія через 120 хв ПГТТ у межах 7,8–11,0 ммоль/л (140–199 мг/дл).
ADA дозволяє діагностувати предіабет на основі відсотка HbA1c 5,7–6,4 % (39–46 ммоль/моль), за умови визначення методом ВЕРХ.
2. ЦД діагностують у 4-х ситуаціях:
1) глікемія при випадковому визначенні ≥11,1 ммоль/л (200 мг/дл) i типові симптоми гіперглікемії (посилена спрага, поліурія, слабкість);
2) результати глікемії при випадковому визначенні ≥11,1 ммоль/л (200 мг/дл) без типових симптомів гіперглікемії та одноразово (в інший день) глікемія натще ≥7,0 ммоль/л (126 мг/дл);
3) глікемія натще двічі (визначена в різні дні) ≥7,0 ммоль/л (126 мг/дл);
4) глікемія через 120 хв ПГТТ ≥11,1 ммоль/л (200 мг/дл).
ADA дозволяє додатково діагностувати цукровий діабет при значенні HbA1c >6,5 % (48 ммоль/моль), за умови визначення методом ВЕРХ.
Критерії визначення цукрового діабету у вагітних жінок →розд. 13.2.2.
1. Інші причини клінічних симптомів, напр. поліурії (нецукровий діабет).
2. Диференціювання типу ЦД: формою, яка має основні риси ЦД 1-го типу та вимагає інсулінотерапії, але має «маску» ЦД 2-го типу (повільний розвиток, проявляється у більш пізньому віці), є ЦД LADA. До форм, що нагадують ЦД 2-го типу (піддаються, принаймні, до певної міри лікуванню пероральними ЛЗ), але їх перебіг має фенотипну «маску» ЦД 1-го типу (рано розвивається), належать: ЦД MODY (maturity onset diabetes of the young), довготривалий неонатальний ЦД і мітохондріальний діабет, який зараховують до т. зв. моногенного ЦД, що зумовлений мутацією окремого гену. При ЦД MODY виділяють кілька типів, котрі відрізняються клінічним перебігом; найчастіше мутація відбувається у гені HNF1A (MODY3) або у гені глюкокінази (MODY2). Остаточний діагноз встановлюють на основі генетичного дослідження. Під час диференційної діагностики у дорослих:
1) якщо підозрюється ЦД 1-го типу → необхідно врахувати ЦД MODY (табл. 13.1-1);
2) якщо підозрюється ЦД 2-го типу → необхідно враховувати ЦД LADA (latent autoimmune diabetes in adults →табл. 13.1-2).
|
Диференційні ознаки |
ЦД MODY |
ЦД 1-го типу |
|
вади розвитку (головним чином нирок та сечостатевої системи) |
так/ні |
ні |
|
ЦД в сімейному анамнезі у ≥3-х поколіннях |
так |
ні |
|
аутоімунні захворювання в сімейному або індивідуальному анамнезі |
ні |
так |
|
антитіла до острівців |
ні |
так |
|
С-пептид (тест з глюкагоном) |
на початку — в нормі |
низька концентрація |
|
основне лікування |
на початку — пероральні ЛЗ |
інсулін |
|
початок |
повільний |
скоріше гострий |
|
Диференційні ознаки |
ЦД LADA |
ЦД 2-го типу |
|
ІМТ |
як у загальній популяції |
ожиріння чи надлишкова вага |
|
артеріальна гіпертензія |
ні |
так |
|
ЦД в сімейному анамнезі |
ні |
так |
|
аутоімунні хвороби в сімейному або індивідуальному анамнезі |
так |
ні |
|
анти-GAD або інші антитіла до острівців |
так |
ні |
|
С-пептид (тест з глюкагоном) |
низька концентрація |
в нормі або на початку ↑ |
|
oсновне лікування |
інсулін |
на початку — пероральні ЛЗ |
Щораз частіше зустрічається поєднання різних типів ЦД — так званий подвійний, і навіть потрійний ЦД, а також ЦД 2-го типу в дітей та молоді.
1. Лікування ЦД включає:
1) навчання пацієнтів, що є необхідною умовою для успіху лікування;
2) нефармакологічне лікування — здоровий (т. зв. терапевтичний) спосіб життя, який включає різноманітну дієту, регулярну фізичну активність, уникнення вживання алкоголю, відмову від цигарок, а також забезпечення оптимальної тривалості сну та уникнення стресу;
3) гіпоглікемізуюче лікування — п/о гіпоглікемізуючі або антигіперглікемічні ЛЗ, інсулін, інкретиноміметики;
4) боротьба з факторами ризику серцево-судинних захворювань, особливо артеріальної гіпертензії →розд. 2.20 і порушень ліпідного обміну →розд. 2.4.1; у пацієнтів із супутнім захворюванням серцево-судинної системи та у хворих віком >40-ка р. із ≥1-м фактором серцево-судинного ризику слід розпочинати лікування статином, незалежно від ліпідного профілю плазми;
5) лікування ускладнень хвороби.
2. При ЦД 1-го типу необхідно застосовувати інсулін. ЦД 2-го типу є прогресуючим захворюванням, у зв'язку з чим через певний час виникає потреба модифікувати терапію: на початку застосовують ЛЗ, які підвищують чутливість тканин до інсуліну, а у подальшому приєднують ЛЗ, які стимулюють виділення інсуліну; при їх неефективності показана інсулінотерапія.
3. Якщо на момент встановлення діагнозу гіперглікемії виявляється дефіцит маси тіла, симптоми зневоднення, кетонурія чи ацидоз → слід розпочинати інсулінотерапію, навіть тоді, коли підозрюємо ЦД 2 типу; остаточний діагноз і відповідне тривале лікування узгоджується після ліквідації метаболічних порушень і виключення аутоімунного характеру захворювання.
4. Критерії компенсації ЦД
1) критерії компенсації вуглеводного обміну: інтенсивність гіпоглікемізуючого лікування, тобто цільові значення глікемії і HbA1с та швидкість їх реалізації, слід адаптувати до пацієнта, зокрема враховуючи його старання і співпрацю з лікарем, ризик гіпоглікемії, тривалість хвороби, передбачувану тривалість життя, супутні захворювання, судинні ускладнення, а також фінансування і можливість підтримки пацієнта (цільові значення глікемії залежно від прийнятих критеріїв компенсації ЦД →нижче — можуть бути вищими, якщо досягнуто цільового рівня HbA1с); критерії компенсації можна пом'якшити у пацієнтів похилого віку або із супутніми захворюваннями, чи у випадку частого виникнення гіпоглікемії. Якщо не вдається досягнути цільові показники, слід максимально до них наблизитись.
a) загальний критерій — HbA1с ≤7,0 % (53 ммоль/моль) — можна отримати при середній концентрації глюкози у плазмі крові ≈8,3–8,9 ммоль/л (150–160 мг/дл); слід досягти глікемії натще і перед прийомом їжі <7,2 ммоль/л (130 мг/дл) та постпрандіальної глікемії <10 ммоль/л (180 мг/дл); це критерій для усіх хворих, за винятком перерахованих нижче у детальних критеріях, включаючи хворих на ЦД 1-го типу, в яких досягнення цільового відсотка HbA1c ≤6,5 % було асоційовано з підвищеним ризиком гіпоглікемії, а також у хворих віком >65-ти р. (якщо очікувана тривалість життя >10-ти р.), у яких корекцію рівня глюкози слід проводити поступово;
б) детальні критерії: HbA1с ≤6,0 % (42 ммоль/моль) — у жінок під час II і III триместру вагітності, якщо це не корелює зі збільшенням частоти і тяжкості глікемії →розд. 13.2.2; HbA1с ≤6,5 % (48 ммоль/моль) у жінок, які планують вагітність, та під час I триместру вагітності, у хворих на ЦД 1 типу, в яких досягнення цієї мети не асоційовано з підвищеним ризиком гіпоглікемії чи погіршенням якості життя, при короткотривалому ЦД 2-го типу, та у дітей і молоді (незалежно від типу ЦД) → потрібно прагнути до рівня глікемії натще і перед прийомами їжі (також під час самостійного контролю) 4,4–6,1 ммоль/л (80–110 мг/дл) і глікемії через 2 год від початку прийому їжі <7,8 ммоль/л (140 мг/дл); HbA1с <8,0 % (64 ммоль/моль) — у пацієнтів похилого віку, із занедбаною формою ЦД, багаторічним перебігом ЦД і макроангіопатією (перенесеним інфарктом міокарда і/або інсультом і/або з тяжкими супутніми захворюваннями). Якщо попри збереження цільових показників глікемії натщесерце не вдається досягнути цільових рівнів HbA1с, слід прагнути до зниження постпрандіальної глікемії. Цільовий рівень HbA1с необхідно досягати поступово (тобто, протягом кількох місяців), оскільки (особливо при ЦД 1 типу) швидке зниження глікемії загрожує гіпоглікемією, у пацієнтів із запущеними мікроангіопатичними ускладненнями (головним чином, ретинопатією) може тимчасово призвести до прогресування ускладнень, а при ЦД 2-го типу — підвищити серцево-судинний ризик). При визначенні цілей необхідно враховувати співпрацю та старання пацієнтів, ризик гіпоглікемії, тривалість захворювання, прогнозовану тривалість життя, супутні захворювання, судинні ускладнення, а також фінансування i можливість підтримки для пацієнта.
2) критерії компенсації ліпідного обміну:
a) хворі з ЦД 1-го або 2-го типу з дуже високим серцево-судинним ризиком (із серцево-судинним захворюванням або хронічною хворобою нирок, а також хворі з ЦД 2-го типу віком >40-ка р. без серцево-судинного захворювання, але з факторами його ризику чи з органними ускладненнями) — цільова концентрація ХС ЛПНЩ <1,8 ммоль/л (70 мг/дл) або редукція на ≥50 %, якщо початково ХС ЛПНЩ 1,8–3,5 ммоль/л (70–135 мг/дл); цільова концентрація не-ХС ЛПВЩ (другорядна ціль) <2,6 ммоль/л (100 мг/дл);
б) хворі з ЦД 2-го типу та високим серцево-судинним ризиком (без ускладнень та інших факторів ризику серцево-судинних захворювань), а також хворі з ЦД 1-го типу та високим серцево-судинним ризиком — цільова концентрація ХС ЛПНЩ <2,6 ммоль/л (100 мг/дл) або редукція на ≥50 %, якщо початково концентрація ХС ЛПНЩ знаходилась у діапазоні 2,6–5,2 ммоль/л (100–200 мг/дл); цільова концентрація не-ХС ЛПВЩ <3,4 ммоль/л (130 мг/дл);
в) хворі з ЦД 1-го типу з низьким або середнім серцево-судинним ризиком (віком <40-ка р. без хронічних ускладнень ЦД та без інших факторів серцево-судинного ризику) — цільова концентрація ХС ЛПНЩ <3,0 ммоль/л (115 мг/дл), цільова концентрація не-ХС ЛПВЩ <3,7 ммоль/л (145 мг/дл);
г) хворі з ЦД 1-го типу з підвищеною екскрецією альбуміну з сечею та/або з порушеною функцією нирок — редукція концентрації ХС ЛПНЩ на ≥50 %, незалежно від початкової величини;
У всіх хворих цільовий рівень ХС ЛПВЩ: у чоловіків >1,0 ммоль/л (>40 мг/дл), у жінок на 0,275 ммоль/л(10 мг/дл) вище; цільовий рівень тригліцеридів в сироватці <1,7 ммоль/л (150 мг/дл).
3) критерії компенсації артеріального тиску: <140/90 мм рт. ст., незалежно від наявності протеїнурії. У вагітних жінок із діабетичною хворобою нирок — <130/80 мм рт. ст.
1. Навчання хворих відіграє таку ж важливу роль, як дієта, фізичне навантаження і фармакотерапія.
2. Мета: вироблення у пацієнтів таких навичок поведінки, які б забезпечили співпрацю при застосуванні командного підходу до лікування; навчання з користування приладами для введення інсуліну і моніторингу глікемії.
3. При ЦД проводять індивідуальні і групові навчання, найкраще паралельно. Навчання у групі є ефективнішим, ніж індивідуальне, також корисні є т. зв. групи підтримки. Індивідуальне навчання дозволяє сфокусуватись на індивідуальних цілях лікування та врахувати конкретні проблеми окремих пацієнтів; воно є необхідним в особливих ситуаціях, при методах лікування, які рідше використовуються (напр. індивідуальні інсулінові помпи), у хворих після баріатричних операцій та у пацієнтів на програмному діалізі. Пацієнтів з ЦД 2-го типу слід з самого початку захворювання підготувати до його прогресуючого перебігу, що вимагатиме поступових змін у лікуванні.
4. Необхідно повторювати навчальні заходи та постійно контролювати їх ефекти — не лише знання хворого, а передусім, його здатність контролювати хворобу.
Усі хворі на ЦД повинні пройти навчання на тему загальних принципів правильного харчування при ЦД, а детальні дієтичні рекомендації потрібно пристосовувати до потреб та побажань індивідуальних пацієнтів.
1. Регулярний прийом та відповідна кількість прийомів їжі:
1) при ЦД 2-го типу, що лікується дієтою та пероральними ЛЗ, достатніми є 3 прийоми їжі на добу;
2) лікування інсуліном двофазової дії (готовими сумішами) вимагає 5–6-ти прийомів їжі протягом доби;
3) лікування людським інсуліном короткої дії вимагатиме 6-ти прийомів їжі на добу (додаткове вживання другого сніданку, підвечірку та другої вечері запобігає гіпоглікемії);
4) лікування швидкодіючими аналогами інсуліну вимагає не більше, ніж 3 прийомів їжі протягом доби;
5) найбільшу свободу у прийомі їжі надає інсулінова помпа, за умов відповідного підбору дози інсуліну до потреби.
2. Відповідне споживання калорій повинно забезпечити збереження ідеальної маси тіла або поступове зниження маси тіла в осіб з ожирінням чи надлишком ваги:
1) зниження маси тіла не повинно перевищувати 2 кг/тиж., корисним є поступове зниження на 0,5–1 кг/тиж. Зниження маси тіла на ≥5 % відносно вихідної маси асоційоване з помітним покращенням контролю ЦД.
2) постачання енергії залежить від стилю життя і від належної маси тіла (формула: від зросту в см відняти 100 [при зрості ≤164 см], при зрості 165–175 см відняти 105, a при зрості >175 см відняти 110) і становить приблизно: робота у сидячому положенні — 20–25 ккал/кг належної маси тіла; робота, що пов'язана з помірним фізичним навантаженням — 25–30 ккал/кг належної маси тіла; важка фізична праця — 30–40 ккал/кг належної маси тіла.
3. Приблизна калорійність страв кожного дня: особливо важлива для хворих, які приймають інсулін, оскільки це полегшує його дозування.
4. Якісний склад дієти: пацієнти з ЦД 1-го типу повинні вміти розрахувати вміст вуглеводів в порції їжі, що має ключове значення для підбору дози інсуліну на прийом їжі, а також вміти оцінити глікемічний ефект білків і жирів, які надходять з цієї порцією їжі.
1) вуглеводи — все рідше визначають загальний відсотковий вміст вуглеводів у дієті, оскільки є замало доступних наукових даних, які б дозволили визначити їхню оптимальну кількість для усіх хворих; рекомендується індивідуальний план дієти, залежний зокрема від інтенсивності фізичної активності, а також від того, якій їжі пацієнт надає перевагу та від різновиду вуглеводних продуктів у дієті. У середньому вміст вуглеводів у забезпеченні енергетичних потреб повинен складати ≈45 %, та якщо вони походять із продуктів із низьким глікемічним індексом (ГІ) та високим вмістом клітковини, їх споживання може становити навіть 60 % калорійності дієти. Особи з дуже високою фізичною активністю мають збільшену енергетичну потребу, в той час як в осіб із низькою фізичною активністю прийом калорій вуглеводного походження може бути нижчим. ГІ це показник, котрий дозволяє класифікувати харчові продукти, які містять вуглеводи, залежно від їх впливу на постпрандіальну глікемію (чим вищий ГІ, тим більший вплив на глікемію), причому технологія приготування їжі також має значення (напр. коротший час термічної обробки). Слід рекомендувати продукти, що містять вуглеводи з низьким ГІ (<55), у т. ч. перш за все цільнозернові продукти, а практично цілком елімінувати з дієти прості вуглеводи, які дуже швидко всмоктуються і викликають значне постпрандіальне підвищення глікемії, яке складніше контролювати. ГІ відіграє меншу роль при виборі овочів і фруктів, які містять мало вуглеводів. Вміст клітковини у дієті повинен становити 25–50 г/д (або 15–25 г на 1000 ккал). Можна застосовувати підсолоджувачі в рекомендованих виробниками кількостях, але не слід замінювати харчовий цукор (сахарозу) фруктозою.
2) білок — 15–20 % від загальної енергетичної вартості дієти (1–1,5 г/кг м. т./добу); у хворих на ЦД 2-го типу з надмірною масою тіла може складати 20–30 % калорійності дієти (не застосовуйте у хворих із діабетичним захворюванням нирок). Максимальне значення у випадку хворих із хронічним захворюванням нирок складає 0,8–1 г/кг м. т., у вагітних — 1,3 г/кг м. т., a під час захворювання, яке протікає з лихоманкою, чи в період реконвалесценції — до 1 г/кг м. т. Слід надати перевагу білку рослинного походження, рибам та свійській птиці.
3) жири — 30–35 % від загальної енергетичної вартості дієти, з обмеженням насичених жирів; обмежте споживання холестерину до <300 мг/добу (<200 мг/добу, якщо ХС ЛПНЩ ≥2,6 ммоль/л [100 мг/дл]);
4) кухонна сіль — ≤5 г/добу;
5) вітаміни і мікроелементи — відсутні показання для застосування у разі відсутності їх дефіциту, за винятком поповнення вітаміну D (відповідно до рекомендацій для загальної популяції), а у вагітних жінок — фолієвої кислоти;
6) алкоголь — у хворих із ЦД споживання алкоголю не показане, може сприяти виникненню гіпоглікемії (гальмує вивільнення глюкози печінкою) і його необхідно враховувати до енергетичного балансу.
З огляду на численні позитивні сторони фізична активність є обов’язковою складовою лікування хворих на ЦД; повинна бути систематичною та пристосованою до можливостей пацієнта, виконуватись ≥2–3 ×/тиж., а найкраще — щодня.
1. Принципи безпечного виконання фізичного навантаження при ЦД 1-го типу: необхідно добре підготувати пацієнта, щоб він зміг самостійно оцінити ступінь і тривалість навантаження та потребу в інсуліні та додаткових вуглеводах, і уникати форсованого фізичного навантаження, якщо у хворого присутні занедбані ускладнення ЦД. Пацієнт повинен:
1) контролювати глікемію перед, під час та протягом декількох годин після навантаження;
2) приймати додаткові вуглеводи перед навантаженням та щогодини під час навантаження, а також після його завершення, особливо, якщо навантаження тривало довше (20–30 г на 30 хв навантаження);
3) уникати значного фізичного навантаження під час піку дії інсуліну;
4) не вводити інсулін в ділянку тіла, яка особливо інтенсивно бере участь у навантаженні (напр. у стегно);
5) зменшити дозу інсуліну перед навантаженням, навіть на 30–50 %, в залежності від інтенсивності навантаження та рівня глікемії (не у всіх хворих);
6) якщо глікемія становить >13,9 ммоль/л (250 мг/дл) — визначити кетонові тіла у сечі, а при їх наявності слід уникати навантаження (дуже інтенсивне навантаження може посилити гіперглікемію та кетоз).
2. Принципи безпечного виконання фізичного навантаження при ЦД 2-го типу:
1) систематичне фізичне навантаження є одним із основних методів лікування ЦД 2-го типу — його метою є зниження маси тіла та резистентності тканин до інсуліну;
2) ризик гіпоглікемії у пацієнтів, які застосовують дієту та пероральні ЛЗ, є низьким (пацієнтам з надлишком ваги та ожирінням слід уникати вживання додаткових вуглеводів під час навантаження);
3) у хворих на інсулінотерапії →вище;
4) пацієнт повинен систематично (найкраще щоденно, напр. впродовж 30–45 хв) виконувати помірно інтенсивне фізичне навантаження, що пристосоване до загального стану здоров'я та попереднього стилю життя; для пацієнтів у віці >65 років і/або з надмірною вагою відповідною формою фізичного навантаження є прогулянка швидким темпом (до появи задишки) 3–5 × на тиж. (≈150 хв/тиж.);
5) більше фізичне навантаження, якщо пацієнт його добре переносить, є показанимдекілька разів на тиждень, а не лише спорадично; повинно починатись та закінчуватись легшими вправами, які виконують протягом 5–10 хв;
6) при рівні глікемії >16,7 ммоль/л (300 мг/дл), пацієнт повинен визначити кетонові тіла у сечі за допомогою тест-смужки, при підтвердженні кетонурії — уникати навантаження (дуже інтенсивне навантаження може посилити гіперглікемію та кетоз).
1. Показання до інсулінотерапії
1) ЦД 1-го типу, а також ЦД LADA (від моменту встановлення діагнозу, оскільки стимуляція β-клітин похідними сульфонілсечовини пришвидшує виснаження секреторних резервів та погіршує перебіг захворювання);
2) ЦД 2-го типу:
a) неефективність лікування — HbA1c >7 %, незважаючи на інтенсифікацію фармакологічної і поведінкової терапії (після елімінації дієтичних помилок та інших причин неефективності пероральних ЛЗ, напр. вогнищ інфекції), можна розглянути навіть тоді, коли монотерапія метформіном є недостатньою; у разі існування сумнівів, вичерпання секреторних резервів підтверджують зниженою концентрацією С-пептиду у сироватці після стимуляції глюкагоном;
б) протипоказання до застосування пероральних ЛЗ;
в) тимчасове лікування — щойно діагностований ЦД зі значною гіперглікемією (глікемія натще >16,7 ммоль/л [300 мг/дл]) та її симптомами (після опанування глюкотоксичності, компенсації глікемії та метаболічного стану пацієнта можна застосувати пероральні ЛЗ або комбіновану терапію пероральними ЛЗ та агоністом рецептора ГПП-1 або (рідше) продовжувати інсулінотерапію у комбінації з метформіном); гострий коронарний синдром або процедура черезшкірної коронарної ангіопластики (оптимально — постійна в/в інфузія інсуліну), інсульт, гострі запальні стани, травми та інші невідкладні стани, кортикотерапія, оперативне втручання, вагітність.
Різновиди інсулінів
Вибір препарату та моделі інсулінотерапії проводиться індивідуально, зважаючи на стиль життя та притаманний для пацієнта час прийому їжі.
Класифікація на основі хімічної будови: людський інсулін та аналоги людського інсуліну.
Класифікація на основі тривалості дії →табл. 13.1-3.
|
Різновиди інсулінів і препарати |
Дія | |||
|
початкова |
максимальна |
діапазон | ||
|
швидкодіючі аналоги інсуліну |
аспарт |
10–20 хв |
1–3 год |
3–5 год |
|
глулізин |
10–20 хв |
1–2 год |
3–5 год | |
|
ліспро |
15 хв |
40–60 хв |
3–5 год | |
|
інсуліни короткої дії |
нейтральний |
30 хв |
1–3 год |
6–8 год |
|
інсуліни середньої тривалості дії |
ізофановий (НПХ) |
0,5–1,5 год |
4–12 год |
18–20 год |
|
aналоги інсуліну пролонгованої дії |
детемір |
1,5–2 год |
3(4)–14 год |
≤24 год |
|
гларгін |
1,5–2 год |
відсутній пік |
24 год | |
|
деглудек |
відсутній пік |
>48 год | ||
1) прандіальний інсулін:
a) аналоги інсуліну короткої дії — п/ш ін'єкція, переважно, безпосередньо перед початком прийому їжі, хоча можна також під час прийому їжі, і навіть після нього, зазвичай, 3 × на день; також п/ш з використанням індивідуальних інсулінових помп;
б) людський інсулін короткої дії (нейтральний інсулін) — п/ш ін'єкція до 30 хв перед основними прийомами їжі, 3 × на день; з огляду на довший період дії (→рис. 13.1-2) вимагається додатковий прийом їжі →вище, також використовується в персональних інсулінових помпах;
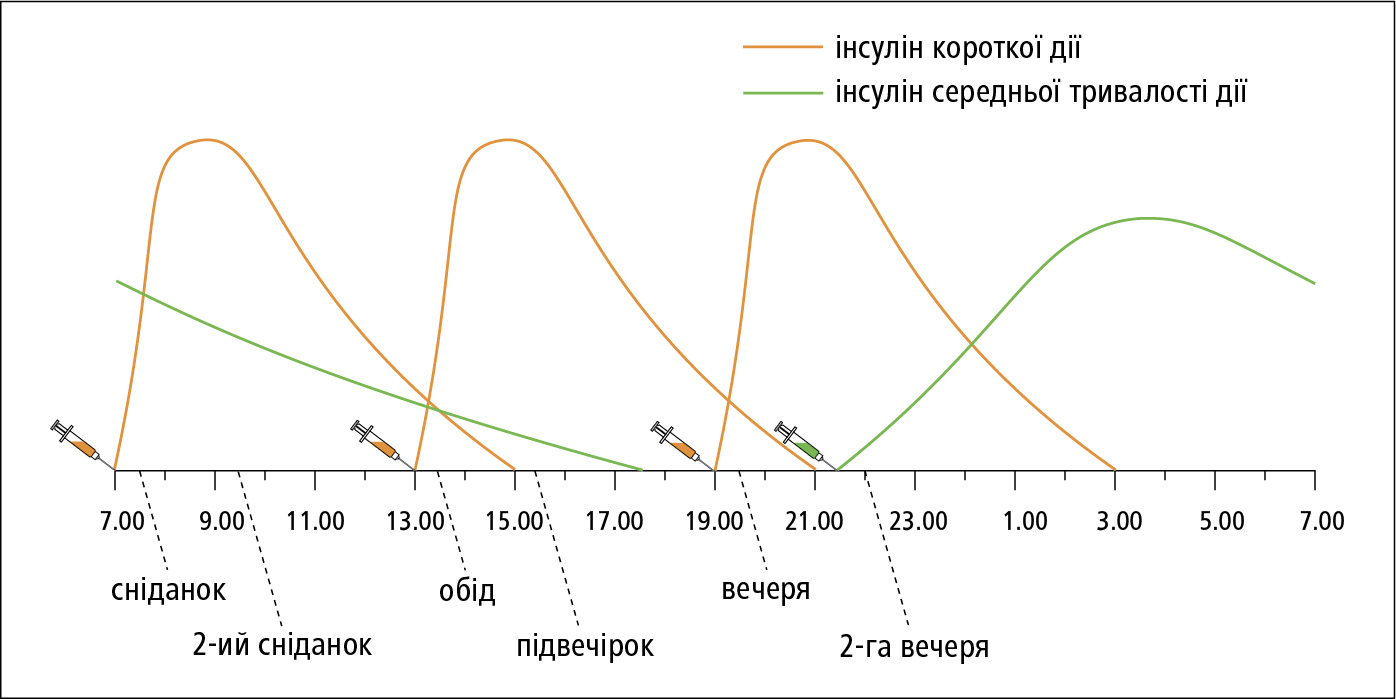
Рисунок 2. Інтенсивна інсулінотерапія у схемі 4-ох ін'єкцій на день: інсулін короткої дії у комбінації з інсуліном середньої або довготривалої дії (NPH)
2) базальний інсулін, який імітує базальну секрецію ендогенного інсуліну:
a) інсулін середньої тривалості дії (НПХ) — у поєднанні з інсуліном короткої дії вводиться п/ш ін'єкція 1 × на день (ввечері), а у поєднанні з швидкодіючими аналогами інсуліну — зазвичай 2 × на день (зранку та ввечері);
б) аналоги інсуліну довготривалої дії — застосовують переважно 1 × на день п/ш (зранку чи ввечері, в один і той же час); інсулін детемір у поєднанні зі швидкодіючими аналогами вводять п/ш 1 або 2 × на день (зранку та ввечері), залежно від потреби; перевагою є рівномірна концентрація у крові (→рис. 13.1-3), що полегшує проведення інтенсивної інсулінотерапії;
в) базальну секрецію інсуліну також імітують швидкодіючі аналоги інсуліну чи людські інсуліни короткої тривалості дії, за умови їх введення в/в за допомогою інфузомату або шляхом постійної п/ш інфузії за допомогою індивідуальної інсулінової помпи;
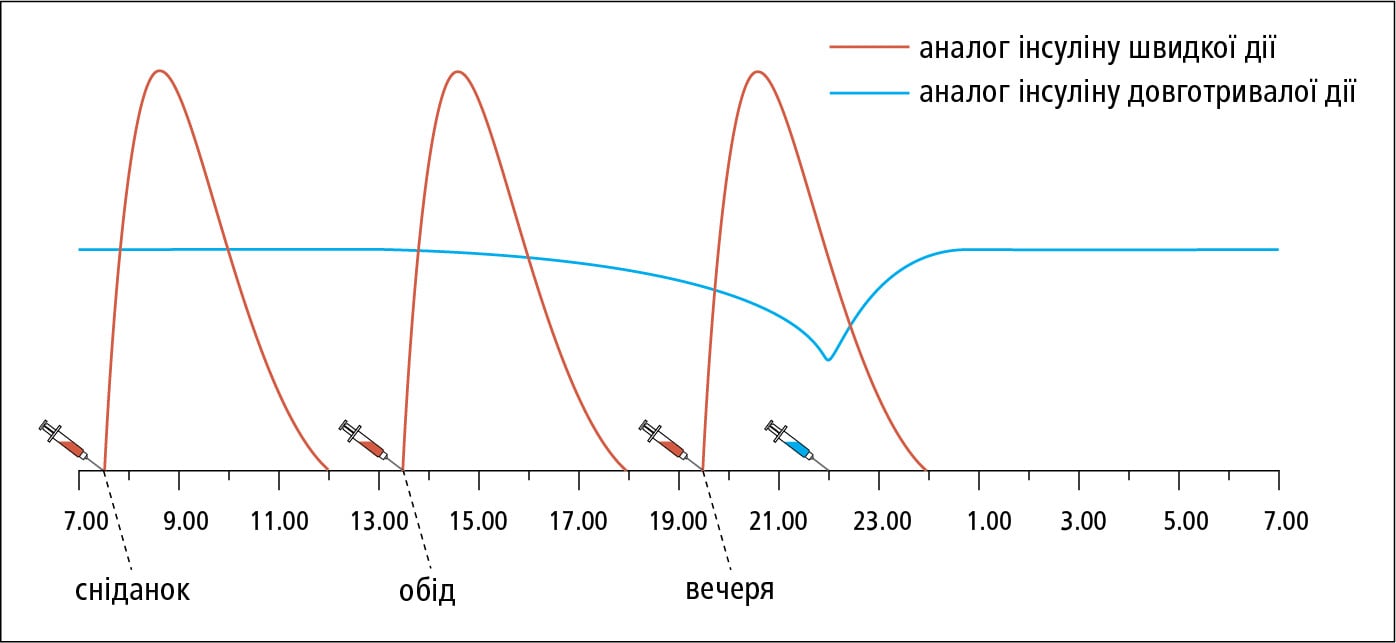
Рисунок 3. Інтенсивна інсулінотерапія у схемі 4-ох ін'єкцій на день: аналог інсуліну швидкої дії у комбінації з аналогoм інсуліну довготривалої дії
3) інсулінові суміші (комбіновані, двофазові інсуліни →табл. 13.1-4):
a) суміш аналогів інсуліну — швидкодіючий аналог інсуліну з протаміновою суспензією цього аналогу з подовженою тривалістю дії;
б) суміш людських інсулінів — інсулін короткої дії з інсуліном середньої тривалості дії.
|
Різновиди інсулінів, які входять до складу суміші |
Вміст інсуліну швидкої або короткої дії |
|
інсулін аспарт з протаміновою суспензією інсуліну аспарт (аналог інсуліну) |
30 % |
|
50 % | |
|
інсулін ліспро з протаміновою суспензією інсуліну ліспро (аналог інсуліну) |
25 % |
|
50 % | |
|
двофазний інсулін, людський |
20 % |
|
25 % | |
| 30 % | |
|
40 % | |
|
50 % |
Кожен з інсулінів у суміші досягає піку своєї дії у різний час, тобто, одна ін'єкція викликає 2 піки концентрації інсуліну у крові →рис. 13.1-4.
Висота цих піків залежить від пропорції складників вибраного препарату та від дози, пік дії швидкодіючого інсуліну чи інсуліну короткої тривалості дії є вищим, а тривалість його дії — коротша. Ін'єкцію інсулінових сумішей слід вводити 2 × на день, перед кожним піком дії інсуліну пацієнт повинен вживати їжу. Суміші часто застосовують для лікування ЦД 2-го типу, особливо у хворих старшого віку та зі зниженою працездатністю, у котрих досягнення критеріїв компенсації ЦД не є абсолютно необхідним.
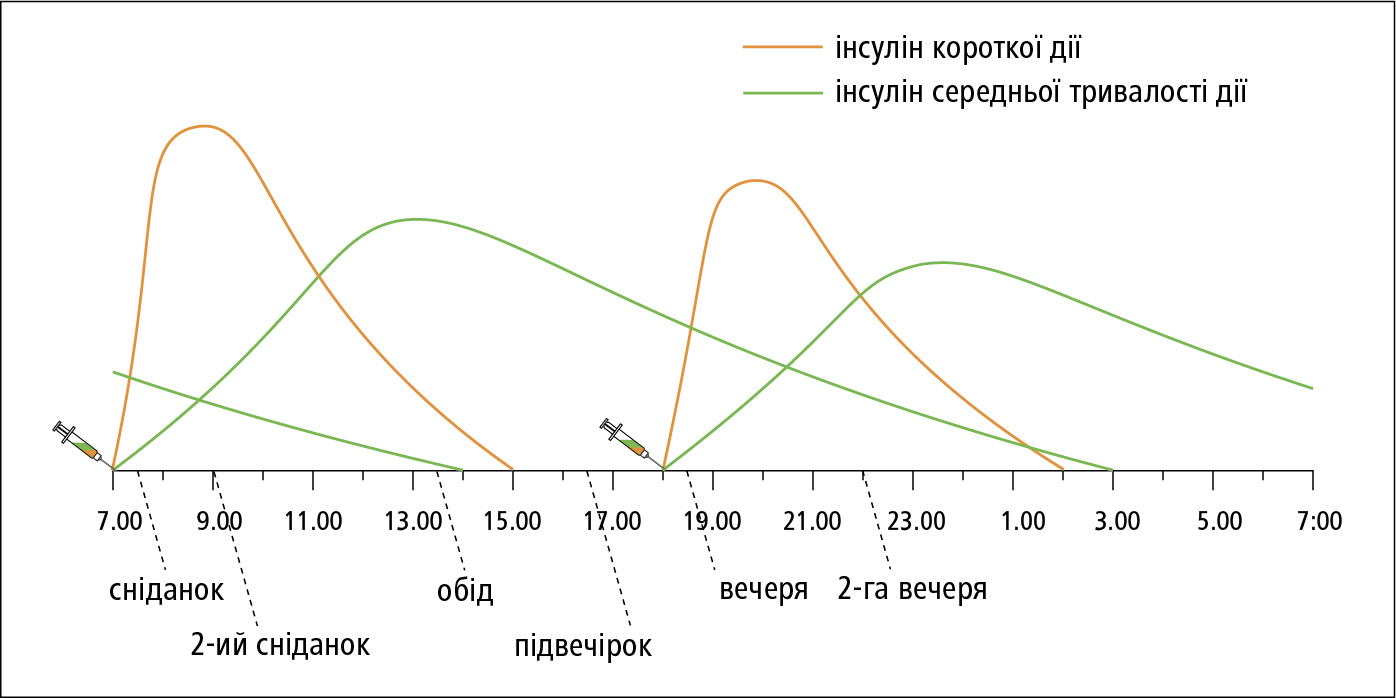
Рисунок 4. Схема лікування сумішшю людських інсулінів, що вводиться 2 × на день (інсулін короткої дії з інсуліном середньої тривалості дії)
Режими та способи інсулінотерапії
Не можна зволікати з інсулінотерапією — при збереженні гіперглікемії та підвищеної концентрації проінсуліну пришвидшується розвиток ускладнень ЦД. В усіх режимах інсулінотерапії при ЦД 2 типу одночасно необхідно застосовувати метформін (→рис. 13.1-5) (за відсутності протипоказань).
1. Проста схема інсулінотерапії: комбіноване лікування ЦД пероральними ЛЗ (найчастіше метформіном) та однією ін'єкцією базального інсуліну, який імітує його базальну секрецію (інсулін середньої тривалості дії [НПХ] або аналог пролонгованої дії, застосування якого пов'язане з нижчим ризиком нічної та тяжкої гіпоглікемії). Це перехідний режим ведення ЦД 2-го типу, який застосовують протягом декількох місяців, а навіть років, перед введенням повної терапії інсуліном. Розпочніть при неефективності комбінованого лікування 2–3-ма пероральними ЛЗ або пероральними ЛЗ і агоністом рецептора ГПП-1. Вже на етапі неефективності монотерапії метформіном, можна розглядати комбінацію терапії метформіном з 1-ю ін'єкцією інсуліну. У пацієнтів, які отримують інсулін 1 × на добу, одночасно можна застосовувати пероральні ЛЗ та інкретинові ЛЗ відповідно до інструкції для медичного застосування; у випадку супутньої надмірної ваги/ожиріння перевага надається комбінованій терапії метформіном з інгібітором SGLT‑2 або інкретиновим препаратом (інгібітором ДПП‑4 або агоністом ГПП‑1); при нормальній масі тіла можна розглянути комбіновану терапію метформіном і похідним сульфонілсечовини.
1) Початкова дозу інсуліну, що вводиться 1 × на день може становити 10 ОД або 0,2 ОД/кг маси тіла; якщо наявна гіперглікемія натще, рекомендується ін'єкція ввечері, а якщо глікемія натще у межах норми і виникає гіперглікемія впродовж дня — зранку.
2) Контроль глікемії натще та поступове збільшення дози інсуліну, напр. на 2–4 ОД кожні 4–5 днів, доки не буде досягнута глікемія у запланованому діапазоні (напр. 3,9–7,2 ммоль/л [70–130 мг/дл], але може бути й ширшим).
3) Якщо глікемія натще >10 ммоль/л (180 мг/дл) → збільшуйте дозу базального інсуліну, який вводять у вечірню пору, напр. на 4 ОД кожні 3 дні (амбулаторне лікування).
4) Якщо вночі чи зранку виникла гіпоглікемія (a пацієнт адекватно приймав їжу) або якщо глікемія натще <3,9 ммоль/л (70 мг/дл) → зменшіть дозу базального інсуліну, введеного перед сном, напр. на 4 ОД чи на 10 % (зазвичай, на вищий з цих показників).
5) Якщо HbA1c зберігається >7 %, незважаючи на інтенсифікацію фармакологічної та поведінкової терапії, чи потреба в ізофановому інсуліні (НПХ) введеному 1 × на день, складає >30 ОД/добу → продумайте інтенсифікацію терапії — комбіновану інсулінотерапію (у вигляді 2-х ін'єкцій суміші інсулінів або додаткове призначення до інсуліну пролонгованої дії ін’єкцій інсуліну короткої дії або швидкодіючого аналогу 1–3 × день перед прийомами їжі, причому дане лікування можете впроваджувати поступово) та відмініть ЛЗ, які стимулюють секрецію інсуліну. Якщо основним порушенням є постпрандіальна гіперглікемія (незважаючи на нормоглікемію натще), то на початку комбінованої інсулінотерапії розгляньте передусім можливість багаторазових ін'єкцій інсуліну короткої дії або аналогу інсуліну швидкої дії перед прийомами їжі.
2. Комбінована інсулінотерапія: використання ≥2 × на день ін'єкцій інсуліну, які забезпечують покриття потреби в інсуліні у базових умовах та після прийомів їжі.
1) Застосування інсулінових сумішей: базовий режим інсулінотерапії при ЦД 2-го типу. Переваги — мала кількість ін'єкцій (переважно 2), що полегшує лікування пацієнтів похилого віку та інвалідів; недоліки — часто відсутня можливість досягнення рекомендованих критеріїв компенсації ЦД та необхідність приймати їжу у визначений час, особливо у полудень.
a) Потрібно підібрати відповідну суміш інсулінів →табл. 13.1-4 та в індивідуальному порядку встановити дозування.
б) Змінюючи введення ізофанового інсуліну у схемі 1 × на день на 2 ін'єкції двофазового інсуліну, який, напр. містить 30 % інсуліну короткої дії, не забувайте, що його загальна доза повинна бути на ≈30 % вищою, ніж доза ізофанового інсуліну, який попередньо застосовувався.
в) Початковий поділ добової дози: зранку 60 %, ввечері 40 % →рис. 13.1-4.
г) У період встановлення дози слід запланувати частіші візити; кожного разу необхідно переконатись, чи пацієнт належним чином вводить інсулін та чи правильно визначає глікемію за допомогою глюкометра.
2) Схема базал-плюс: проміжна схема інсулінотерапії, як полегшує перехід між простою та інтенсивною схемами інсулінотерапії — у хворих на ЦД 2-го типу, які приймають базальний інсулін 1 × на день, можете поступово впроваджувати ін’єкції інсуліну короткої дії або швидкодіючого аналогу перед прийомами їжі, призначаючи початково 1 додаткову ін’єкцію (найкраще перед прийомом їжі, після якого виникає найбільше зростання глікемії), щоб поступово перейти до 3-х ін’єкцій даного інсуліну перед усіма основними прийомами їжі впродовж дня.
3) Інтенсивна інсулінотерапія (модель база-болюс): режим багаторазових ін'єкцій інсуліну протягом доби є основним методом лікування ЦД 1-го типу, його також рекомендують хворим на ЦД 2-го типу, які вимагають постійної інсулінотерапії і для котрих не є проблематичним введення ін'єкцій інсуліну 4 × на день.
a) Забезпечте базальну концентрацію інсуліну введенням (зазвичай 1 × на день ввечері) інсуліну середньої тривалості дії (НПХ) або аналогу інсуліну пролонгованої дії. Поступово підвищуйте дозу базального інсуліну до етапу досягнення нормальної (цільової) глікемії натще.
б) Під час прийомів їжі вводьте інсулін короткої дії або швидкодіючий аналог. Якщо, незважаючи на цільові показники глікемії натще, не досягнуто бажаного показника HbA1c → потрібно прагнути до зниження постпрандіальної глікемії шляхом поступового збільшення доз інсуліну, який вводять між прийомами їжі. Якщо пацієнт не в змозі самостійно передбачити потребу у прадіальному інсуліні, тоді він повинен подбати про те, щоб вміст вуглеводів в окремих стравах був наближеним протягом наступних днів — це полегшить підбір відповідної дози інсуліну та досягнення цільових показників глікемії. Приймаючи рішення про зміну дози прандіального інсуліну, слід керуватись показниками постпрандіальної глікемії після введення попередньої дози впродовж останніх 2–3-х днів.
в) Приклади схем із використанням 4-х ін'єкцій: інсулін короткої дії перед сніданком (20–25 % добової дози), перед обідом (15 %) i перед вечерею (20 %) та інсулін середньої тривалості дії перед сном близько 22.00 год (40 % добової дози) →рис. 13.1-2; швидкодіючий аналог інсуліну перед сніданком (20 % добової дози), перед обідом (15–20 %) і перед вечерею (20 %) та аналог інсуліну довготривалої дії перед сном близько 22.00 год (40 % добової дози) →рис. 13.1-3;
г) Приклади схем із використанням 5-х ін'єкцій — швидкодіючий аналог перед сніданком (20 % добової дози), перед обідом (20 %), перед першою вечерею близько 17.00–18.00 год (10 %) та інсулін НПХ перед сніданком (25 %) і перед другою вечерею (25 %);
4) Інтенсивна гнучка інсулінотерапія: рекомендована схема лікування ЦД 1-го типу; являє собою продовження вищевказаного методу або може проводитися з використанням персональної інсулінової помпи. Її «гнучкість» полягає в тому, що залежно від передбачуваної пори прийому і складу їжі (із врахуванням її глікемічного індексу), а також запланованого фізичного навантаження і початкової глікемії, належним чином навчений пацієнт самостійно модифікує час введення та дозу інсуліну. При застосуванні персональної інсулінової помпи схожі модифікації можуть стосуватись як базальної інфузії (базису), так і прандіальних ін’єкцій (болюсів). У хворих на ЦД 1-го типу віддають перевагу застосуванню аналогів інсуліну з огляду на нижчий ризик гіпоглікемії та вищий життєвий комфорт.
5) Індивідуальні інсулінові помпи: вводять швидкодіючий аналог інсуліну у п/ш інфузії — постійна базальна інфузія та прандіальні ін’єкції (болюси). Використання інсуліну короткої дії не є протипоказаним, але не дозволяє повністю використовувати переваги цього методу лікування. Показання: лабільний ЦД, поява ефекту «рикошету» (гіперглікемія у дуже ранніх годинах та перед сніданком); ситуації, коли на певний час абсолютно необхідно прагнути до нормоглікемії (напр., при вагітності або під час лікування синдрому діабетичної стопи); необхідність у застосуванні низьких доз інсуліну (напр., у дітей та вагітних жінок); відсутня можливість досягнення доброї метаболічної компенсації за допомогою багаторазових ін’єкцій інсуліну; рецидивуючі непередбачувані епізоди гіпоглікемії або безсимптомні гіпоглікемії; нерегулярні стиль життя та прийоми їжі. Необхідно пристосувати дозування інсуліну до виду та кількості прийнятих вуглеводів та врахувати фізичну активність пацієнта. В цьому допомагає програмне забезпечення помпи, котре посеред іншого містить «калькулятор болюса». Слід пам’ятати про ризик, що пов’язаний з перериванням інфузії (гіперглікемія, ацидоз), інфекцією у місці підшкірного введення катетеру та гіпоглікемією (якщо доза, яку вводять з базальною інфузією, є надто високою в порівнянні до споживання калорій). Дедалі ширше застосовуються помпи з системою «закритої петлі» (першу зареєструвала FDA у США у 2016 р.).
1. Класифікація пероральних цукрознижуючих ЛЗ →табл. 13.1-5, табл. 13.1-6 (окрему групу складають інкретиноміметики, які вводять п/ш або п/о →нижче):
1) гіпоглікемізуючі ЛЗ — похідні сульфонілсечовини: стимулюють підвищену секрецію інсуліну β-клітинами острівців підшлункової залози шляхом зв'язування з рецептором SUR1; відрізняються за силою та тривалістю дії;
2) антигіперглікемічні ЛЗ:
a) похідний бігуаніду (метформін) — пригнічує глюконеогенез у печінці, посилює анаеробний гліколіз, підвищує чутливість до інсуліну, призводить до зниження маси тіла, покращення ліпідного профілю та зниження артеріального тиску;
б) інгібітор α-глюкозидази — має у ≈100 000 разів вищу афінність до α-глюкозидази (ферменту зони посмугованої кайми кишкових ворсинок), ніж олігосахариди, внаслідок чого тимчасово майже повністю блокують її дію, що сповільнює кінцевий ензиматичний етап травлення полісахаридів, олігосахаридів та деяких дисахаридів (мальтози, сахарози);
в) інгібітори дипептидилпептидази-4 (ДПП-4), т. зв. гліптини, які належать до групи інкретиноміметиків (обговорені далі, разом з іншими ліками цієї групи, які вводять п/ш);
г) інгібітори натрій-глюкозного котранспортера 2-го типу (SGLT-2), відповідального за реабсорбцію ≈90 % глюкози з сечі, так звані флозини (гліфлозини) — обмежують реабсорбцію глюкози в проксимальному канальці нефрону і таким чином підвищують екскрецію її надлишку з сечею (глюкозурія без супутньої гіперглікемії), можуть сприяти зниженню маси тіла і знижують артеріальний тиск;
д) агоніст ядерних рецепторів PPAR‑γ, належить до похідних тіазолидиндіонів, т. зв. глітазонів (піоглітазон) — знижує інсулінорезистентність у жирових клітинах, скелетних м'язах та печінці, і, як наслідок, знижує концентрацію вільних жирових кислот і глюкози в крові.
2. Окрім метформіну, який є ЛЗ першого вибору у лікуванні ЦД 2 типу, не надається перевага жодній іншій групі ЛЗ та підкреслюється значення індивідуального підходу до лікування та врахування побажань пацієнта. Вибираючи пероральний ЛЗ, необхідно брати до уваги ефективність зменшення гіперглікемії та домінуючий на даний момент патогенетичний механізм: інсулінорезистентність або порушення секреції інсуліну. У пацієнтів із кардіоваскулярним захворюванням, передусім після інфаркту міокарда, розгляньте призначення ЛЗ із доведеним позитивним впливом на кардіоваскулярний ризик, які знижують ризик смерті внаслідок серцевих причин; цей ефект виявлено при застосуванні окремих ЛЗ з групи агоністів рецептора ГПП-1 (ліраглутид) та з групи інгібіторів SGLT‑2 (емпагліфлозин), або зменшують ризик виникнення кардіоваскулярних подій (канагліфлозин). На початку слід використовувати метформін у монотерапії (у випадку непереносимості — індивідуально підібраний один із наступних ЛЗ: похідне сульфонілсечовини, інгібітор ДПП-4, флозин або піоглітазон [нижче]). Слід враховувати профіль безпеки, переносимість, простоту застосування і кошт лікування →табл. 13.1-6. Далі, по мірі прогресування хвороби, використовуйте комбіноване лікування з метформіном — як 2-ий ЛЗ застосуйте похідне сульфонілсечовини, інкретиновий ЛЗ, інгібітор SGLT‑2 або піоглітазон; у випадку необхідності доєднайте 3-ій ЛЗ іншого механізму дії (протипоказано поєднання агоністів рецептора ГПП-1 із інгібіторами ДПП-4) в т. ч. і акарбозу. Не слід зволікати з інсулінотерапією, якщо є показання. Алгоритм лікування ЦД 2 типу →рис. 13.1-5.
3. Дозування завжди встановлюється у індивідуальному порядку на основі профілю глікемії →Моніторинг.
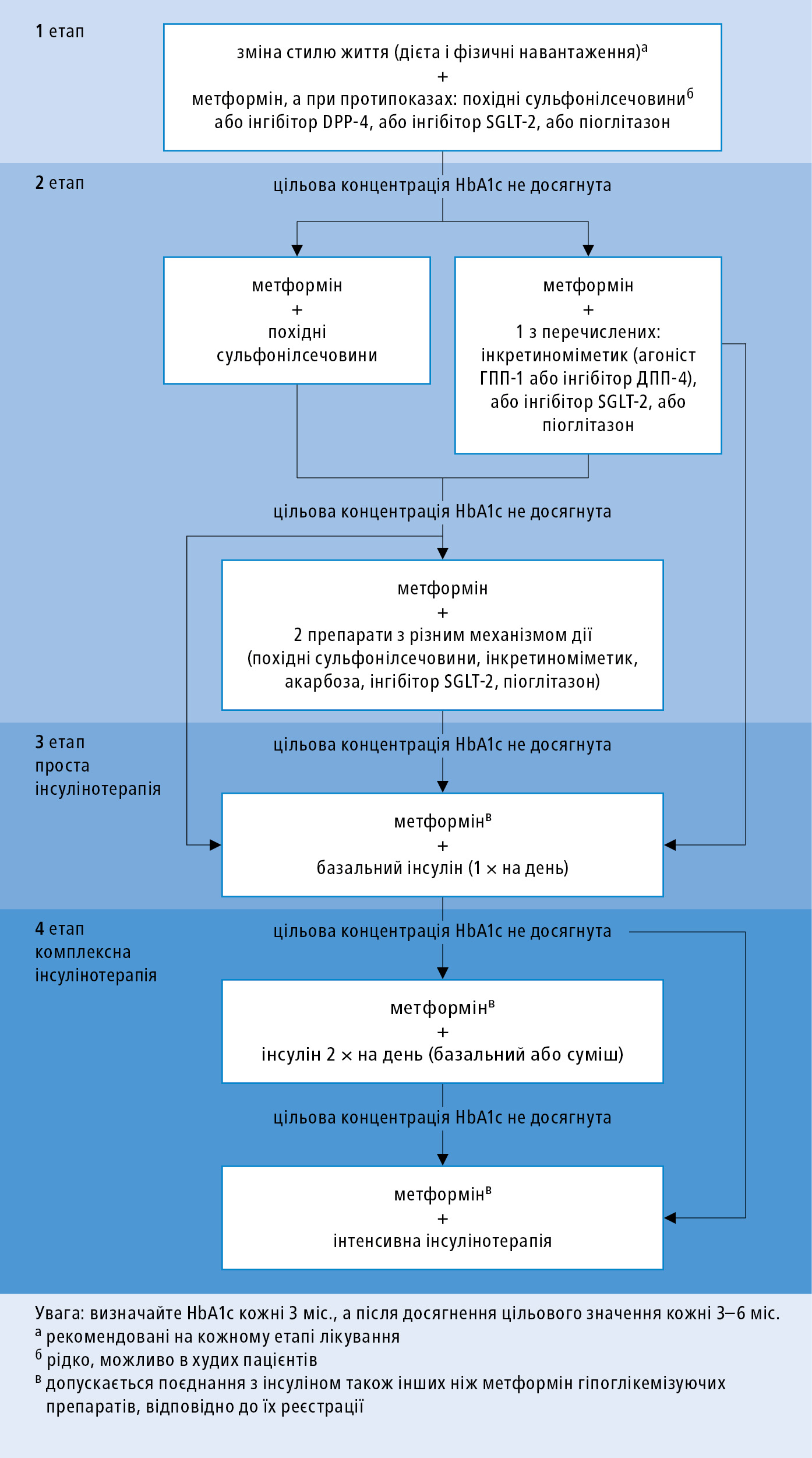
Рисунок 5. Алгоритм лікування пацієнтів з діабетом 2 типу
1. ЛЗ, що впливають на інкретинову систему (інкретиноміметики) →табл. 13.1-7:
1) агоністи рецептора глюкагоноподібного пептиду-1 (ГПП-1) — дулаглутид, ексенатид пролонгованого вивільнення (тривалої дії), ліраглутид, ліксисенатид і альбіглутид; активують рецептор для ГПП-1, що підсилює глюкозозалежну секрецію інсуліну; гальмують секрецію глюкагону, подовжують шлунковий пасаж, знижують апетит та сприяють зменшенню маси тіла; характеризуються резистентністю до травлення специфічною ДПП-4 та діють значно довше, ніж ГПП-1, але вимагають п/ш введення;
2) інгібітори ДПП-4 (гліптини) — алогліптин, лінагліптин, саксагліптин, сітагліптин i вілдагліптин; сильні селективні інгібітори ДПП-4, гальмуючи інактивацію ендогенних інкретинів (ГПП‑1 i ГІП) спричиняють зростання їх концентрації, підвищують чутливість β-клітин до глюкози та глюкозозалежну секрецію інсуліну; застосовують п/о.
2. Показання до застосування у хворих на ЦД 2-го типу (із застереженням, що не всі препарати є зареєстровані для застосування у такому поєднанні, тому призначаючи конкретний препарат, слід переконатись у його актуальних зареєстрованих показаннях):
1) при монотерапії, якщо не можна використовувати метформін;
2) як другий препарат у комбінації з метформіном, з похідним сульфонілсечовини або похідним тіазолідинодіону;
3) при лікуванні трьома ЛЗ з похідним сульфонілсечовини і метформіном, або з похідним тіазолідинодіону і метформіну;
4) у комбінації з інсуліном як 2-ий ЛЗ або як наступний препарат у комбінації з інсуліном і метформіном і/або з піоглітазоном.
|
ЛЗ |
Дозування |
Коментарі |
|
агоністи рецептора глюкагоноподібного пептиду-1 (ГПП-1) | ||
|
ексенатид із подовженим вивільненням |
вводиться в постійній дозі 2 мг 1 × на тиж. п/ш у стегно, живіт або верхню частину плеча; незалежно від прийому їжі у будь-який час дня |
переваги: сприяє зниженню маси тіла, застосовується 1 × на тиж. недоліки: асто симптоми з боку ШКТ; мало даних щодо безпеки застосування; зареєстровано декілька випадків гострого геморагічного або некротичного панкреатиту — у разі підозри на панкреатит слід негайно відмінити ЛЗ; можливе погіршення функції нирок у пацієнтів з нирковою недостатністю, вимагає моніторингу (ЛЗ протипоказані при тяжкій нирковій недостатності) |
|
альбіглутид |
на початку 30 мг 1 × на тиж. п/ш, при необхідності дозу можна збільшити до 50 мг/тиж. |
переваги: сприяє зниженню маси тіла; альбіглутид застосовується лише 1 × на тиж. недоліки: симптоми з боку ШКТ; мало даних щодо безпеки застосування |
|
дулаглутид |
у дозі 0,75 мг 1 х/тиж. п/ш в стегно або живіт (монотерапія) або 1,5 мг х 1 тиж. (комбінована терапія з іншими антидіабетичними ЛЗ | |
|
ліксисенатид |
на початку 10 мкг п/ш 1 × на день впродовж 14 днів, пізніше 20 мкг/добу | |
|
на початку 0,6 мг п/ш 1 × на день, впродовж ≥1 тиж., потім — 1,2 мг/добу; через ≥1 тиж. можна збільшити дозу до 1,8 мг/добу | ||
|
інгібітори дипептидилпептидази-4 (ДПП-4) | ||
|
лінагліптин |
при монотерапії або комбінованому лікуванні з метформіном, з метформіном та похідними сульфонілсечовини або інсуліном — 5 мг 1 × на день у тій самій годині під час їжі або незалежно від прийомів їжі; при комбінованій терапії продовжуйте попереднє дозування метформіну, розгляньте доцільність зниження дози похідних сульфонілсечовини або інсуліну з метою зниження ризику гіпоглікемії |
переваги: п/о прийом; препарати цієї групи не викликають збільшення маси тіла; вілдагліптин — багато задокументованих відгуків про використання у пацієнтів похилого віку; лінагліптин — єдиний гліптин, котрий не видаляється з сечею, не потребує відміни або зміни дозування у пацієнтів з нирковою недостатністю недоліки: мало даних щодо безпеки застосування
небажані ефекти: найчастіше — нудота; біль голови та головокружіння (частіше — після вілдагліптину); рідше — надмірна сонливість, біль в епігастрії, закрепи (при комбінованій терапії з похідними сульфонілсечовини) або діарея (при комбінованій терапії сітагліптином та метформіном); можливий підвищений ризик серцевої недостатності (саксагліптин); підвищений ризик гіпоглікемії (при комбінованому лікуванні з похідними сульфонілсечовини або інсуліном → початково знижте дози цих ЛЗ); рідко — анафілактичні реакції (напр., кропив'янка, ангіоневротичний набряк); FDA оголосило попередження про те, що ці ЛЗ можуть викликати сильну артралгію, яка вимагає відміни цих ЛЗ
|
|
у монотерапії або комбінованій терапії з метформіном і/або з похідними сульфонілсечовини, з похідними тіазолідиндіону або з інсуліном: 5 мг 1 × на день | ||
|
ситагліптин |
у монотерапії або комбінованому лікуванні з метформіном і/або з похідними сульфонілсечовини, з похідними тіазолідиндіону (також з метформіном) або з інсуліном (з метформіном або без нього) — 100 мг 1 × на день п/о (під час їжі або незалежно від прийомів їжі); при комбінованому лікуванні не змінюйте попереднього дозування метформіну, розгляньте доцільність зниження дози похідних сульфонілсечовини або інсуліну з метою зниження ризику гіпоглікемії | |
|
вілдагліптин |
у монотерапії, якщо не можна призначити метформін; комбінована терапія з метформіном, з похідними сульфонілсечовини і метформіном, з похідними тіазолідиндіону або з інсуліном (з метформіном або без нього): 50 мг 2 × на день п/о (під час їжі або незалежно від прийомів їжі); комбінована терапія з похідними сульфонілсечовини: 50 мг 1 × на день (зранку); макс. 100 мг/добу 1 табл. 2 × на день | |
1. Трансплантація підшлункової залози: найчастіше — у пацієнтів із нирковою недостатністю, яким пересаджують одночасно нирку та підшлункову залозу.
2. Трансплантація острівців Лангерганса: пов'язана з меншим ризиком, ніж пересадка підшлункової залози, дає можливість досягти тотальної нормоглікемії, однак, з часом виникає погіршення функції трансплантованих клітин.
3. Імплантований інсуліновий насос (помпа), який контролюється глікемією: пристрій, який функціонує за принципом замкнутого кола, тобто дозує інсулін або інсулін і глюкагон залежно від актуальної глікемії — під час клінічних проб.
4. Баріатричні операції: при ЦД 2-го типу, асоційованому з ожирінням, дозволяють отримати добрий і тривалий метаболічний ефект; розгляньте скерування хворих із ІМТ >40 кг/м2 або >35 кг/м2 і з супутніми захворюваннями (напр. артеріальною гіпертензією, розладами ліпідного обміну), у віці 18–65 р., у спеціалізовані центри з метою відбору до баріатричної операції і подальшої довготривалої опіки (з огляду на особливі вимоги щодо харчування у післяопераційному періоді).
1. Оцінка компенсації вуглеводного обміну:
1) типи вимірювання глікемії протягом доби: визначення у цільній капілярній крові за допомогою глюкометра:
a) випадкове визначення — найчастіше, натще;
б) скорочений глікемічний профіль (напівпрофіль) — зранку натще i через 60–120 хв після кожного основного прийому їжі (4 визначення протягом доби);
в) повний добовий глікемічний профіль — зранку натще, перед кожним основним прийомом їжі, через 60–120 хв після кожного основного прийому їжі, перед сном i, напр., о 24.00 год та поміж 2.00 і 4.00.
2) рекомендована частота самоконтролю залежить від призначеного лікування та індивідуальних потреб;
a) виключно дієта і метформін → 1 × на міс. скорочений глікемічний профіль, додатково раз на тиждень визначення глікемії у різний час доби;
б) пероральні антидіабетичні ЛЗ і/або агоністи рецептора ГПП-1 → 1 × на тиж. скорочений глікемічний профіль, щодня одне визначення глікемії у різний час доби;
в) інсулін у постійних дозах або комбіноване лікування похідними сульфонілсечовини при ЦД 2-го типу → щоденно 1–2 визначення глікемії, 1 × на тиж. скорочений глікемічний профіль, 1 × на міс. повний глікемічний профіль;
г) багаторазові ін'єкції інсуліну, інтенсивна функціональна інсулінотерапія (незалежно від типу ЦД) → багаторазове визначення протягом доби (повний добовий глікемічний профіль або багаторазове визначення протягом доби у конкретний час та відповідно до потреб пацієнта, в т. ч. як перед вживанням їжі, так і після, під час сну, перед запланованим фізичним навантаженням, при підозрі на гіпоглікемію та перед діяльністю, під час якої глікемія є особливо небезпечною (напр. водіння автомобіля). Усі пацієнти, незалежно від методу терапії, при поганому самопочутті та погіршенні стану, повинні контролювати глікемію частіше. Найточнішу оцінку добової глікемії дозволяють здійснити системи постійного моніторингу (CGMS), особливо корисні для пацієнтів з ЦД 1-го типу з нестабільним перебігом та частими епізодами гіпоглікемії (особливо, якщо пацієнт їх не відчуває), у пацієнтів, які використовують індивідуальну інсулінову помпу та у вагітних жінок із супутнім ЦД. CGMS рекомендується при ЦД 1-го типу, натомість подібні рекомендації щодо контролю ЦД 2-го типу неоднозначні. Значення CGMS у разі тривалішого застосування полягає у можливості оцінки трендів глікемії (зниження або наростання) і швидкості прогресування змін, а також можливості програмування сигналів тривоги, які попереджають про те, що глікемія наближається до встановленої граничної межі. Це дозволяє відносно рано провести заходи щодо профілактики небажаної гіпо- або гіперглікемії. Під час інтерпретації результатів визначення концентрації глюкози у тканинній рідині необхідно врахувати її 15–20 хв запізнення у порівнянні з концентрацією глюкози в крові. Важливою є можливість комплексного застосування CGMS з інсуліновими помпами, особливо такими, що мають функцію переривання інфузії інсуліну у разі тенденції до гіпоглікемії, яка допомагає зокрема запобігти розвитку нічної гіпоглікемії. При проведенні самоконтролю глікемії також можна застосувати метод сканування (flash glucose monitoring — FGM), особливо у хворих на ЦД 1-го типу з лабільним перебігом. Вимірювання концентрації глюкози також проводяться у тканинній рідині, однак дані не передаються до датчика в режимі реального часу, а для отримання даних необхідно на короткий час приблизити датчик до імплантованого сенсора — таким чином відсутня можливість програмування сигналів тривоги.
3) HbA1c — контролюйте принаймні 1 × на рік, частіше (оптимально 2–4 × на рік) — якщо хворий не досягнув цільового рівня HbA1c.
2. Діагностика та контроль терапії артеріальної гіпертензії і дисліпідемії: вимірювання артеріального тиску під час кожного прийому; ліпідограма — 1 × на рік, або частіше у випадку моніторингу ліпідних порушень.
3. Дослідження з метою оцінки і лікування віддалених ускладнень ЦД:
1) нефропатії → 1 × на рік екскреція альбуміну з сечею (у пацієнтів, котрі не вживають ІАПФ або БРАзагальний аналіз сечі з мікроскопією осаду — 1 × на рік; концентрація креатиніну у сироватці та розрахунок швидкості клубочкової фільтрації — 1 × на рік; у пацієнтів з ЦД 1-го типу через 5 років після початку хвороби, у хворих на ЦД 2-го типу від моменту встановлення діагнозу — у випадку підтвердження підвищеної концентрації креатиніну, потрібно проводити визначення концентрації креатиніну, натрію, калію, кальцію та неорганічних фосфатів у сироватці кожні 6 міс.;
2) ретинопатії → офтальмологічний контроль (оцінка очного дна при розширених зіницях) 1 × на рік: у хворих на ЦД 1-го типу — через 5 років від початку захворювання, у хворих на ЦД 2-го типу — від моменту встановлення діагнозу; у випадку діагностування ретинопатії частоту контрольних обстежень визначає офтальмолог;
3) синдром діабетичної стопи — огляд ніг під час кожного прийому.
4. Інші: наявність діагнозу ЦД є показанням для виконання скринінгового дослідження щодо наявності захворювань щитовидної залози: визначення рівня ТТГ та антитіл проти тиреопероксидази (анти-ТПО) при ЦД 1-го типу, а ТТГ при ЦД 2-го типу.
ОСОБЛИВІ СИТУАЦІЇ
1. Тяжкі інфекції чи травми: підвищують потребу в інсуліні. При захворюваннях ШКТ виникає обмеження або абсолютна нездатність приймати їжу — частою помилкою є зниження дози інсуліну, що може призвести до ацидозу та коми.
1) при ЦД 1-го типу — необхідно навчити хворих, щоб у наведених ситуаціях підвищення чи (рідше) збереження дози інсуліну супроводжувалось адекватним постачанням калорій. При хворобах ШКТ з нудотою та блюванням необхідно застосувати в/в інфузію глюкози, яка забезпечить постачання 1000–1200 ккал/добу, найкраще у поєднанні з постійною в/в інфузією інсуліну.
2) при ЦД 2-го типу, який досі був лікований пероральними ЛЗ або виключно дієтою — тяжка інфекція становить показання до тимчасового призначення інсуліну, найкраще — методом інтенсивної інсулінотерапії, або, якщо відсутні перешкоди у прийомі їжі, з використанням інсулінових сумішей.
2. Гострий коронарний синдром: у кожного пацієнта необхідно визначати глікемію — якщо у пацієнта без ЦД у анамнезі глікемія становить >10,0 ммоль/л (180 мг/дл) → використовується інсулін в/в. У пацієнта з ЦД слід відмінити пероральні цукрознижуючі ЛЗ та починати в/в інсулінотерапію при глікемії >7,8 ммоль/л (140 мг/дл). Необхідно здійснювати моніторинг глікемії та концентрації калію у сироватці:
1) у 1-шу добу призначте в окремих в/в інфузіях
а) інсулін 0,5–6 ОД/год, залежно від глікемії (орієнтаційний перерахунок; →табл. 13.1-8);
б) 10% розчин глюкози зі швидкістю ≈50 мл/год і
в) 10 ммоль хлориду калію (контролюйте концентрацію калію і при потребі повторіть інфузію);
|
Глікемія |
Інсулін (ОД/год) |
|
<100 мг/дл (<5,5 ммоль/л) |
зупинити інфузію на 15–30 хв |
|
100–140 мг/дл (5,5–7,8 ммоль/л) |
0,5–1,0 |
|
140–180 мг/дл (6,7–10 ммоль/л) |
1,0–2,0 |
|
180–250 мг/дл (10–13,9 ммоль/л) |
2,0–4,0 |
|
250–300 мг/дл (13,9–17,4 ммоль/л) |
4,0–6,0 |
Інфузію 10 % розчину глюкози слід розпочинати лише після зниження глікемії до 11,1–13,9 ммоль/л (200–250 мг/дл). Намагайтесь зберігати глікемію в межах 5,6–10 ммоль/л (100–180 мг/дл), а у випадку її підвищення >10 ммоль/л (180 мг/дл) тимчасово припиніть інфузію. Контролюйте рівень глікемії щогодини, а після її стабілізації — кожні 2 год; введення глюкози повинно забезпечувати 800–1000 ккал/добу.
2) з 2-ї доби до кінця госпіталізації — індивідуалізуйте лікування, щоб забезпечити оптимальний контроль глікемії: повинна знаходитись в межах 5,6–10,0 ммоль/л (100–180 мг/дл) впродовж усієї доби; у пацієнтів з ЦД 2-го типу і надмірною вагою/ожирінням можна, за відсутності протипоказань, починаючи з 3-ї доби додатково застосувати метформін, однак у випадку запланованої коронарографії не призначайте метформін за ≥48 год до і 24 год після процедури.
Після завершення госпіталізації, якщо потреба в інсуліні ≤30 ОД/добу, можете повернутись до попереднього перорального лікування. У хворих без ЦД в анамнезі потрібно виконати ПГТТ →розд. 13.1.
3. Інсульт: у кожного пацієнта з інсультом потрібно визначати глікемію: якщо рівень становить >10,0 ммоль/л (180 мг/дл) → необхідно розпочати в/в інсулінотерапію за допомогою інсулінової помпи та зберігати глікемію в діапазоні 7,8–10 ммоль/л (140–180 мг/дл); уникайте глікемії <6,1 ммоль/л (110 мг/дл) з метою зниження ризику гіпоглікемії. На гострій стадії захворювання уникайте в/в введення глюкози; застосовуйте інсулін у вигляді в/в інфузії в 0,9 % розчині NaCl (але не в розчині, котрий містить глюкозу і калій). Коли пацієнт починає споживати їжу → розпочніть (≈1 год перед від'єднанням помпи) інсулінотерапію з п/ш введення інсуліну короткої дії або швидкодіючого аналогу інсуліну. У пацієнтів без встановленого раніше діагнозу ЦД, після завершення гострої фази хвороби та після стабілізації клінічного стану, проведіть дослідження в напрямку порушень вуглеводного обміну.
1. Планова хірургічна операція
Підготовка до хірургічної операції:
1) п/о цукрознижуючі ЛЗ потрібно відмінити 2 дні перед операцією та розпочати інтенсивну інсулінотерапію — добова доза інсуліну ≈0,3–0,7 ОД/кг м. т., у т. ч. 50–60 % інсулін короткої дії (який вводиться перед основними прийомами їжі у пропорціях ≈50–20–30 %), решта — 40–50 % складає НПХ-інсулін (у 2-х ін'єкціях: о 7.00–8.00 год — 40 % i o 22.00–23.00 год — 60 % дози), або аналог інсуліну тривалої дії (1 × на день у один і той сам час, переважно ввечері);
2) забезпечте компенсацію ЦД — глікемія в периопераційному періоді в безпечних межах 5,6–10,0 ммоль/л (100–180 мг/дл); коли глікемія >13,9 ммоль/л (300 мг/дл), a HbA1c >9,0 %, або глюкозурія разом із ацетонурією → потрібно перенести термін операції (якщо це можливо);
3) контроль (в міру можливостей) хронічних ускладнень ЦД.
Підготовку найкраще проводити у терапевтичному відділенні, за винятком пацієнтів, яких ефективно лікують іметодом інтенсивної інсулінотерапії (з постпрандіальною глікемією <10 ммоль/л [180 мг/дл]), якщо заплановану операцію можна виконати врежимі хірургії одного дня. Дрібні оперативні втручання без зміни способу харчування (неускладнена екстракція зуба, розтин абсцесу), не вимагають тимчасової інсулінотерапії.
У день операції:
1) застосовуйте інсулін у постійній в/в інфузії;
2) введіть глюкозу шляхом в/в інфузії (4–5 × 500 мл 10 % розчину глюкози забезпечує 800–1000 ккал/добу; інший розчин, залежно від потреби у гідратації), разом із KCl (10–20 ммоль);
3) перевірте каліємію і, у разі потреби, проведіть поповнення дефіциту калію;
4) перевіряйте глікемію під час та після операції;
5) під час операції зберігайте глікемію у межах 5,6–10,0 ммоль/л (100–180 мг/дл), а після операції намагайтесь досягти нормоглікемію (уникайте гіпоглікемії).
Після операції:
1) з моменту відновлення перорального харчування знову потрібно починати інтенсивну інсулінотерапію, a у разі дефіциту калорій компенсувати його інфузією глюкози;
2) після загоєння операційної рани можна повернутись до лікування ЦД, яке застосовували до операції, або його модифікувати, якщо це показане для досягнення задовільної компенсації глікемії.
2. Термінова або екстрена операція:
1) максимально можливо компенсуйте глікемію → введіть інсулін у постійній в/в інфузії та забезпечте постачання ≈1000 ккал/добу в/в інфузією глюкози;
2) у разі кетоацидозу (pH <7,3) →розд. 13.3.1 чи лактацидозу →розд. 13.3.3, чи гіперосмолярного синдрому →розд. 13.3.2 → необхідно ліквідувати їх перед операцією; якщо операцію необхідно провести негайно (напр. при кровотечі) → проводьте корекцію ацидозу під час операції;
3) якщо пацієнт вживав метформін у день, в якому проводиться термінова операція → введіть в/в 300 мг (1 амп.) ацетилцистеїну та адекватно наводнюйте хворого з метою попередження розвитку гострої ниркової недостатності.
1. ЦД 1-го типу: ефективні методи відсутні.
2. ЦД 2-го типу: ефективними є збалансована дієта та збільшення фізичної активності (≥150 хв/тиж.), які призводять до зниження надмірної ваги чи зберігають належну масу тіла. Виявлено ефективність використання деяких ЛЗ, головним чином при предіабеті або ожирінні (метформін, акарбоза, орлістат, вілдагліптин).
3. Активний скринінг ЦД з метою його раннього виявлення та досягнення критеріїв компенсації належить до методів профілактики ускладнень (вторинна профілактика), у разі появи хронічних ускладнень — гальмування їх розвитку та попередження інвалідності є методами третинної профілактики. Пацієнти з діагностованим предіабетом належать до групи підвищеного ризику ЦД — 1 × на рік проводьте ПГТТ. Пацієнти, котрі приймають метформін, повинні припинити його прийом ≥1 тиж. перед ПГТТ та, в залежності від результату дослідження:
1) при встановленні діагнозу ЦД → продовжуйте лікування метформіном у попередній чи збільшеній дозі та продовжуйте діяти у відповідності до правил лікування і моніторингу вперше діагностованого ЦД;
2) у випадку збереження предіабету можете продовжувати лікування метформіном, повторюйте контрольний ПГТТ раз на рік;
3) у випадку виключення порушень вуглеводного обміну (правильний результат ПГТТ) → відмініть метформін (відсутність показань для застосування), призначте контрольний ПГТТ через 6–12 міс.