Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертвуСкорочення: AAPM — American Association Physicist in Medicine, ATP (antytachycardia pacing) — антитахіаритмічна терапія, CIED (cardiac implantable electronic device) — серцевий імплантований електронний пристрій, СРТ (англ. CRT — cardiac resynchronization therapy) — серцева ресинхронізуюча терапія, ESC — European Society of Cardiology, ІКД (англ. ICD — implantable cardioverter defibrillator) — імплантований кардіовертер-дефібрилятор, LET (linear energy transfer) — лінійний коефіцієнт передачі енергії, ЕКС (англ. PM — pacemaker) — електрокардіостимулятор
Одночасно зі старінням населення зростає кількість операцій імплантації пристроїв для електротерапії серця (CIED). Серед них можна виділити пристрої для кардіостимуляції (ЕКС), кардіоверсії-дефібриляції (ІКД) та серцевої ресинхронізаційної терапії (СРТ). Водночас спостерігається збільшення кількості пацієнтів, які потребують онкологічного лікування, в тому числі променевої терапії.
Сучасні серцеві імплантовані електронні пристрої (CIED) побудовані зі схем, інтегрованих із металооксидними напівпровідниками, що зменшує споживання енергії, але ціною більшої чутливості системи до потенційного пошкодження під впливом різних фізичних факторів.
Випромінювання, як пряме, так і дифузне, може бути помилково виявлено CIED як внутрішньосерцева активність і спричинити пригнічення стимуляції та антитахіаритмічної терапії (ATP), неадекватні розряди кардіовертера-дефібрилятора (ІКД), зміну енергії імпульсу стимуляції або зміну енергії терапії високою напругою.
У результаті радіотерапії дані, що зберігаються в пам'яті пристрою, можуть бути втрачені або пошкоджені.
Стійке пошкодження CIED зустрічається дуже рідко, найчастіше в результаті перевищення рекомендованої загальної дози. Може відбутися зменшення терміну служби батареї, збільшення імпедансу електродів, повна втрата функції генератора імпульсів, або перехід в аварійний режим, що може призвести до погіршення клінічного стану, ослаблення або втрати свідомості, пов’язаних із уповільненням серцевого ритму, артеріальною гіпотензією та погіршенням симптомів серцевої недостатності.
Ризик дисфункції CIED залежить від типу випромінювання, яке використовується під час променевої терапії. Корпускулярне (протонне) випромінювання та високоенергетичне фотонне випромінювання призводять до вторинного утворення нейтронів, що підвищує цей ризик.
Узагальнено дані щодо вторинного утворення нейтронів при різних видах променевої терапії — табл. 1.
|
Вид енергії |
Відсутність утворення нейтронів |
Граничне утворення нейтронів |
Клінічно значуще утворення нейтронів |
|
фотони |
<10 MV |
10 MV |
>10 MV |
|
електрони |
<20 MeV |
≥20 MeV |
|
|
протони |
|
|
при будь-якій величині енергії |
|
радіоактивні ізотопи (60Co, брахітерапія) |
всі види |
|
|
|
на основі позиції Heart Rhythm Society (2017) 12 | |||
Пацієнти, залежні від кардіостимуляції, включають осіб:
1) після абляції атріовентрикулярного з'єднання;
2) з відсутністю ендогенної активності шлуночків після сповільнення шлуночкової стимуляції до максимально можливої повільної — 30/хв;
3) із симптомами, залежними від брадикардії, незважаючи на частоту ритму шлуночків >30/хв.
Пацієнти з імплантованими пристроями для кардіоверсії або дефібриляції складають групу високого ризику, пов’язаного з променевою терапією.
Рекомендації основних виробників ЕКС/ІКД, що визначають принципи безпечного застосування променевої терапії у хворих із CIED — табл. 2.
|
Рекомендації |
Medtronic |
St. Jude Medical/Abbott |
Boston Scientific |
Biotronik |
|
контроль CIED перед променевою терапією |
не вказано |
не вказано |
індивідуально для кожного пацієнта |
так |
|
контроль CIED під час променевої терапії |
так |
так (детальна оцінка 1 або 2 × протягом циклу променевої терапії у пацієнтів, залежних від стимуляції) |
індивідуально для кожного пацієнта |
не вказано |
|
контроль CIED після променевої терапії |
так |
так |
так, включаючи ретельний моніторинг роботи пристрою згодом |
так, включаючи доповнююче спостереження невдовзі після променевої терапії |
|
максимальна доза для ЕКС |
5 Гр |
немає безпечної дози |
немає безпечної дози (2 Гр як еталон) |
2 Гр |
|
максимальна доза для ІКД |
1–5 Гр (залежно від моделі) |
немає безпечної дози |
немає безпечної дози (2 Гр як еталон) |
2 Гр |
|
максимальна енергія пучка |
≤10 MV |
не вказано |
не вказано |
≤10 MV |
|
інактивація антитахіаритмічної терапії |
так |
так |
так |
так |
|
екранування пристрою |
ні (неефективний проти нейтронів) |
не вказано (рекомендоване зниження дози на пристрій) |
всі доступні варіанти екранування |
так |
|
моніторинг серцевого ритму під час променевої терапії |
не вказано |
так |
медичною командою визначено як найбільш прийнятне |
так |
Перед застосуванням променевої терапії у пацієнта з CIED слід розглянути інші можливі терапевтичні варіанти.
При прийнятті рішення про параметри променевої терапії доцільно визначити пріоритетність лікування — вилікувати онкологічне захворювання (радикальна променева терапія) і ризик (часто невеликий) пошкодження CIED або лише полегшити симптоми онкологічного захворювання (паліативна променева терапія) і максимальний захист CIED.
Найголовніше, щоб пучок випромінювання не був спрямований безпосередньо на CIED. Якщо неможливо оминути пристрій під час променевої терапії, слід подумати про зміну його положення. Таке втручання, однак, наражає пацієнта не лише на ускладнення, пов’язані з хірургічним видаленням наявного пристрою та імплантацією іншого на новому місці, але й на відтермінування променевої терапії в результаті такої складної процедури. Існує також ризик інфікування переміщуваної системи CIED. Згідно із позицією HRS від 2017 року, положення пристрою не повинно змінюватися, якщо планова поглинена доза складатиме <5 Гр.
На основі розрахункової сумарної дози, залежності від стимуляції та вторинного утворення нейтронів під час променевої терапії оцінюється індивідуальний ризик радіаційних ускладнень (низький, проміжний або високий). Категорії ризику згідно з рекомендаціями AAPM TG-203 — табл. 3.
|
Залежність від стимуляції |
Категорія ризику в залежності від дози | |||
|
<2 Гр |
2–5 Гр |
>5 Гр |
наявність нейтронів | |
|
ні |
низький ризик |
середній ризик |
високий ризик |
високий ризик |
|
так |
середній ризик |
середній ризик |
високий ризик |
високий ризик |
Європейське товариство кардіологів перелічує в клінічних настановах 3 ситуації, у яких підвищується ризик пошкодження CIED під час променевої терапії:
1) променева терапія використанням фотонів з енергією >6–10 MV — ризик виникає внаслідок вторинної продукції нейтронів, не залежить від зони опромінення, і пучок випромінювання не може бути екранований (звужений);
2) сумарна прийнята доза CIED >2 Гр (проміжний ризик) або 10 Гр (високий ризик), дозу можна оцінити до початку променевої терапії та виміряти під час променевої терапії — ризик залежить від зони опромінення, а пучок може бути екранованим;
3) пацієнти, залежні від стимуляції (див. вище).
На рис. 1 показано менеджмент під час променевої терапії у пацієнтів з CIED.
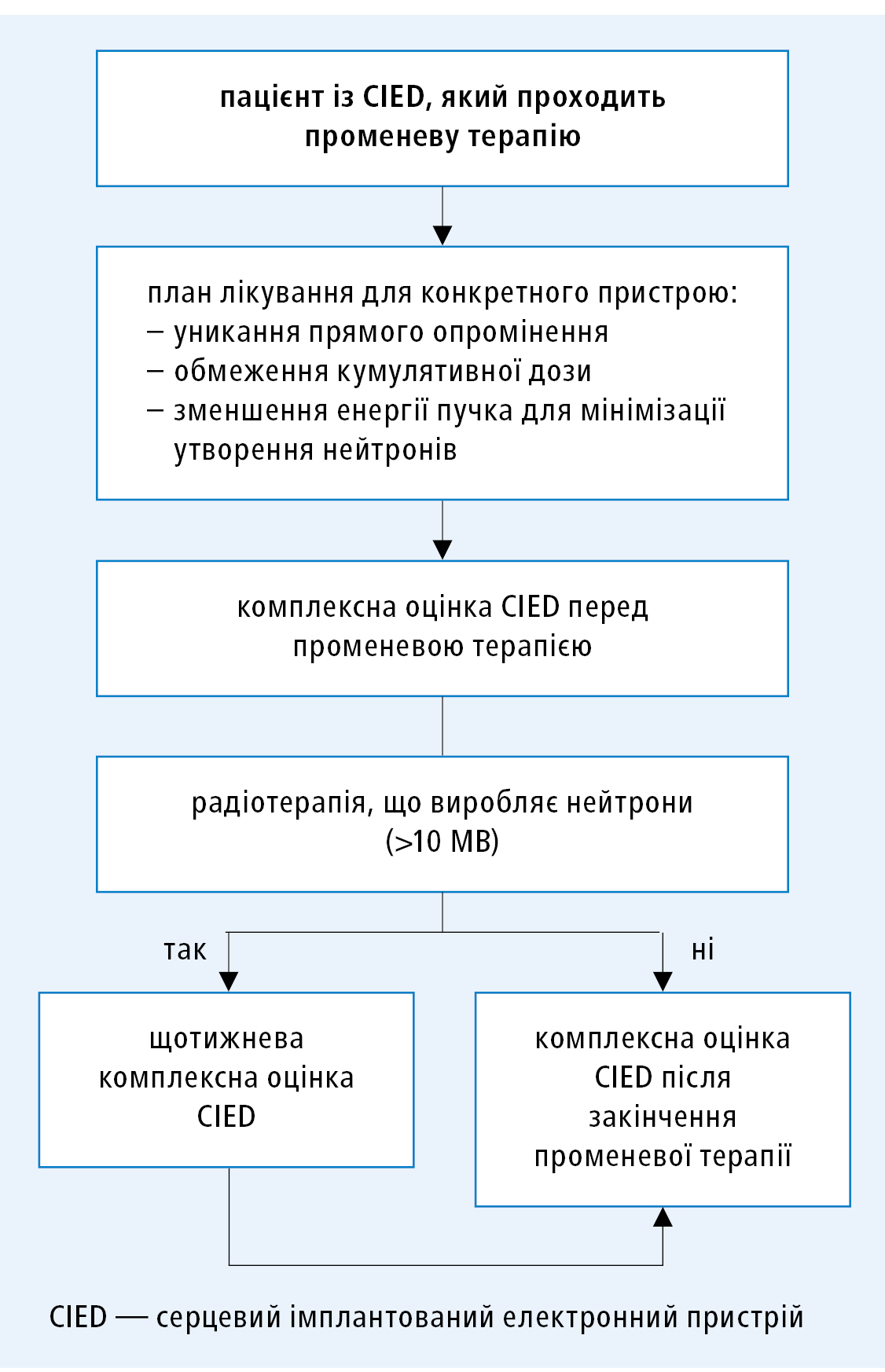
Рисунок 1. Тактика дій під час променевої терапії у пацієнтів з серцевим імплантованим електронним пристроєм
4.4. Електрокардіостимуляція
|
1871 — перші спроби електростимуляції серця (Duchenne) 1952 — створення першого зовнішнього кардіостимулятора (Zoll) 1958 — імплантація першого кардіостимулятора в людини (Senning Elmqvist) 1960 — впровадження кардіостимулятора "на вимогу" |
Електрокардіостимуляція полягає в ініціації електричної функції серця за допомогою електричного струму. Система для стимуляції складається з генератора ритму та 1 електроду або більшої кількості електродів. Розрізняють тимчасову або постійну стимуляцію.
Тимчасова стимуляція (черезшкірна, черезстравохідна або внутрішньосерцева) застосовується у пацієнтів з транзиторною симптомною брадиаритмією, а також у пацієнтів із ризиком її виникнення. Найбільш поширені причини тимчасових порушень автоматизму або провідності включають гострий період інфаркту міокарда та вплив таких ЛЗ, як глікозиди наперстянки, β-блокатори, верапаміл та антиаритмічні ЛЗ I та III класів.
Імплантований електрокардіостимулятор (ЕКС) — це складний електронний пристрій, що дозволяє програмувати багато параметрів (частоту ритму, напругу та тривалість імпульсу, чутливість тощо), оснащений функцією Холтера та багатьма іншими.
ЕКС мають позначки у відповідності до міжнародного літерного коду; ці літери означають (по черзі):
1) місце стимуляції (А — передсердя, V — шлуночок, D — обидві камери серця)
2) детектор (А, V, D — як вище);
3) режим відповіді ЕКС (I — пригнічення, Т — тригер, В — обидва типи відповіді)
4) можливість адаптації частоти стимуляції, напр. до фізичного навантаження (0 — адаптація відсутня, R — модуляція ритму).
Для стимуляції в режимі VVI електрод розміщують у правому шлуночку, а стимуляція та контроль — шлуночкові (рис. I.G.4-1A). Ця нефізіологічна система призводить до втрати синхронного скорочення передсердь і шлуночків. Стимулюючі системи AAI, VDD та DDD (рис. I.G.4-1Б-Г) здатні забезпечити більш фізіологічну стимуляцію. Найбільш фізіологічна стимуляція серця системою Гіса-Пуркіньє може бути забезпечена стимуляцією пучка Гіса. Перевагами цього методу є: фізіологічний шлях деполяризації шлуночків, одноелектродна стимуляція, відсутність негативного впливу на трикуспідальний клапан. Потенційні проблеми включають вищий поріг стимуляції та швидше розрядження акумулятора, а електрод може пошкодити провідну систему. Стимуляція пучка Гіса дедалі ширше застосовується, особливо у великих центрах електрокардіотерапії.
У пацієнтів із хронотропною недостатністю, тобто неможливістю адекватно збільшити частоту серцевих скорочень у ситуаціях підвищеного метаболічного попиту, є показання для застосування стимуляції з адаптованою частотою імпульсів.
У клінічній практиці найпоширенішими типами тривалої електрокардіостимуляції є AAI(R), VVI(R), VDD, DDD(R) та бівентрикулярна стимуляція (СРТ, синхронна стимуляція правого та лівого шлуночків).
Новинка - безелектродні системи. Такого типу ЕКС - це мініатюризований пристрій, імплантований всередину правого шлуночка. З його допомогою можлива лише однокамерна - шлуночкова стимуляція. Ця система дозволяє уникнути проблем, пов'язаних із ложем імплантованого ЕКС, та пошкодженням електродів.
ОПИС ПРОЦЕДУРИвгору
Процедура проводиться з використанням місцевої анестезії та седації. Електрод (або електроди) вводять через головну або підключичну вену, а потім, під рентгенологічним контролем, в серце, залежно від типу стимуляції — лише в правий шлуночок або також у праве передсердя (рис. I.G.4-2). У разі двокамерної стимуляції через коронарний синус вводиться додатковий електрод в одну з вен серця, розташовану на бічній стінці лівого шлуночка. Під час процедури вимірюється сигнал, отриманий від електрода, опір та поріг стимуляції.
ЕКС імплантують підшкірно, зазвичай нижче лівої ключиці. Сучасні ЕКС важать 20–30 г, а час автономної роботи акумуляторної батареї становить ≈10 років.
Безелектродний ЕКС вводять у правий шлуночок через стегнову вену та імплантують в ділянці шлуночкової перегородки або верхівки серця, використовуючи нітинолові «зубчики». ЕКС важить ≈2,0 г, а час автономної роботи акумуляторної батареї становить ≈10 років (подібно до стандартного ЕКС).
Підготовка пацієнта
Важливо підготувати шкіру в зоні операційного поля та розпочати профілактичну антибіотикотерапію. У зв'язку з постійною імплантацією штучного пристрою важливо забезпечити оптимальний гемостаз; тому, якщо це не протипоказано, антикоагулянти та антитромбоцитарні ЛЗ слід відмінити.
УСКЛАДНЕННЯвгору
До ускладнень, пов’язаних із процедурою, належать: гематома, венозний тромбоз, пневмоторакс або гемоторакс, перфорація серця з рідиною в перикардіальній сумці або, рідше, з тампонадою серця, повітряна емболія, підшкірна емфізема, інфекція. На більш пізньому етапі може статися наступне:
1) зміщення або пошкодження електрода з порушеннями стимуляції або керування (рис. I.G.4-3)
2) пошкодження стимулятора
3) індукована стимулятором тахікардія
4) підвищення порогу стимуляції,
5) синдром електрокардіостимулятора — несинхронна робота передсердь і шлуночків у пацієнтів із ЕКС типу VVI, що призводить до зниження серцевого викиду і скорочення передсердя при закритих передсердно-шлуночкових клапанах, що призводить до синкопе, запаморочення, швидкої втомлюваності і відчуття стискання в горлі
6) місцеве інфікування, інфекційний ендокардит, асоційований з імплантованими пристроями (CDRIE), сепсис. Інфікування системи стимуляції є серйозним ускладненням, що трапляється у 0,5–1 % пацієнтів, частіше у тих, хто проходить процедуру заміни пристрою, ніж при першій імплантації.
ПоказАННЯвгору
Показання до імплантації ЕКС при порушеннях автоматизму та провідності — табл. I.G.3-1, табл. I.G.3-2, табл. I.G.3-3, табл. I.G.3-4 i табл. I.G.4-5.
ПротипокАзаннявгору
1) місцева або генералізована інфекція
2) тимчасові або оборотні порушення автоматизму чи провідності є протипоказанням до імплантації постійного ЕКС.
ДОГЛЯД ЗА ХВОРИМ З імплантованим стиМУЛЯТОРОМвгору
Для забезпечення тривалої допомоги пацієнтам із імплантованою системою стимуляції необхідна добре організована спеціалізована поліклініка, інфраструктура та досвідчений персонал якої гарантують надійну періодичну оцінку стану пацієнта, зокрема функції ЕКС. Перший контрольний огляд після виписки з лікарні планується через 2–12 тиж., а наступний, залежно від клінічних проблем пацієнта та ступеня складності імплантованого пристрою, кожні 3–12 міс. (найчастіше кожні 12 міс., частіше у пацієнтів із імплантованою СРТ). Коли з’являються перші симптоми розрядження акумуляторної батареї, контрольні огляди повинні бути частішими, напр., кожні 3 міс.
Також все частіше використовується дистанційний контроль імплантованих ЕКС. ЕКС автоматично та бездротово підключається до ретрансляційної станції, розташованої в будинку пацієнта, звідки дані передаються до центру моніторингу. Завдяки такому методу контролю кількість звернень пацієнтів у поліклініку можна обмежити, а отримана інформація дозволяє раніше розпочати відповідне лікування.
Сучасні стимулюючі пристрої дозволяють пацієнтам вести нормальний активний спосіб життя і навіть займатися різними видами спорту, за винятком тих, що становлять високий ризик травм та механічних пошкоджень імплантованої системи (контактні види спорту). Також дозволяється керувати автомобілем, як правило, вже через тиждень після імплантації ЕКС.
Електромагнітне поле може бути джерелом порушень у роботі стимулюючої системи. Порушення можна розділити на:
1) такі, що виникають в лікарняних умовах (діагностичні та терапевтичні процедури)
2) негоспітальні.
Незважаючи на ефективне екранування систем стимуляції, їх функція може бути порушена під час таких медичних процедур, як літотрипсія, електрокоагуляція або РЧ-абляція, що може призвести до перепрограмування пристрою або припинення кардіостимуляції. Тому під час процедури необхідно спостерігати за пацієнтом, а після неї — контролювати пристрій і , в разі потреби, його перепрограмувати.
Особливу увагу слід приділити електрокоагуляції, використання якої також може бути пов'язане з місцевим нагріванням електрода, яке навіть призводить до пошкодження серцевого м'яза та збільшення порогу детекції та/або стимуляції. Отже, у пацієнтів з імплантованою системою стимуляції застосування електрокоагуляції повинно бути зведене до мінімуму, а при необхідності її потужність та тривалість аплікації слід обмежити. Також рекомендується уникати місця імплантованого ЕКС та використовувати біполярну систему електрокоагуляції. Пацієнтам, які повністю залежать від стимуляції, рекомендується розглянути можливість перепрограмування ЕКС на асинхронний або тригерний режим на час процедури.
У пацієнтів із імплантованими традиційними ЕКС може розглядатися проведення магнітно-резонансної томографії (МРТ) з магнітною індукцією до 1,5 Тесла (Т), а ризик ускладнень такого дослідження низький, якщо вжити відповідні запобіжні заходи (рис. I.G.4-4). Все частіше використовуються ЕКС, які не обмежують можливість проведення МРТ. Однак слід дотримуватися рекомендацій виробника.
Хоча позалікарняні джерела рідше порушують роботу ЕКС, пацієнту слід уникати сильних магнітних полів. Сучасні мікрохвильові печі не становлять загрози для нормальної роботи ЕКС. У випадку деяких приладів (тих, що випромінюють сильні електромагнітні поля) слід дотримуватись безпечної відстані: для індукційних плит — 60 см, рацій і Cі-Бі-радіо 3–15 Вт — 30 см, а для інструментів для майстрування — 15 см. Також безпечно користуватися мобільним телефоном, якщо він знаходиться на відстані ≥15 см від ЕКС; пацієнтам слід порадити під час розмови тримати телефон біля вуха на протилежній стороні від імплантованого ЕКС. Електронні протиугінні системи можуть впливати на роботу ЕКС. Проходження через електронні контрольні рамки ймовірно не матиме великого клінічнеого значення, але пацієнта слід поінформувати про необхідність швидко проходити через такі рамки, а особливо не спиратися на них.

Рисунок 5.
1. Azraai M., D`Souza D., Lin Y., Nadurata V.: Current clinical practice in patients with cardiac implantable electronic devices undergoing radiotherapy: a literature review. Europace, 2021; 24: 362-374
2. Krajowy Rejestr Nowotworów. http://onkologia.org.pl (доступ: 20.02.2022)
3. Miften M., Mihailidis D., Kry S.F. i співавт.: Management of radiotherapy patients with implanted cardiac pacemakers and defibrillators: a report of AAPM TG-203. Med. Phys., 2019; 46: e757–e788
4. Hudson F., Coulshed D., D`Souza E., Baker C.: Effect of radiation therapy on the latest generation of pacemakers and implantable cardioverter defibrillators: a systematic review. J. Med. Imaging Radiat. Oncol., 2010; 54: 53-61
5. Radiotherapy. CRHF Technical Services Standard Letter, Medtronic. 17.04.2017. https://wwwp.medtronic.com/crs-upload/letters/51/51_CQES-Standard_Letter_Radiotherapy-Rev3-2017Apr.pdf (доступ: 21.03.2022)
6. St Jude Medical: Effects of therapeutic radiation on St. Jude Medical implantable cardiac rhythm devices. Sylmar, CA: Technical Services; 2013
7. Boston Scientific: Therapeutic radiation and implantable device systems revision 002–1675. Marlborough, MA, Technical Services, 2013
8. Biotronik. Radiation Therapy and BIOTRONIK CRM Devices – Pacemakers (IPG), Defibrillators (ICD) and CRT-Devices. Berlin: Global Technical Services CRM; 2011.
9. Tajstra M., Blamek S., Niedziela J.T. i співавт.: Patients with cardiac implantable electronic devices undergoing radiotherapy in Poland. Expert opinion of the Heart Rhythm Section of the Polish Cardiac Society and the Polish Society of Radiation Oncology. Kardiol. Pol., 2019; 77: 1106-1116
10. Bujko K.: Podstawy radioterapii. Gastroenterol. Klin., 2010; 4: 121-126
11. Chmielewska-Michalak L., Konstanty E., Mitkowski P.: Konsensus dotyczący radioterapii u chorych ze stymulatorami serca i kardiowerterami – defibrylatorami. WDR, 2018; 47: 27-31
12. Indik J.H., Gimble J.R., Abe H. i співавт.:. 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm, 2017; 14: e97–e153
13. Lelakowski J., Majewski J., Bednarek J. i співавт.: Pacemaker dependency after pacemaker implantation. Cardiol. J., 2007; 14: 83-86
14. Levine P.A.: Pacemaker dependency after pacemaker implantation. Cardiol. J., 2007; 14: 318-320
15. Sharifzadehgan A., Laurans M., Thuillot M. i співавт.: Radiotherapy in patients with a cardiac implantable electronic device. Am. J. Cardiol., 2020; 128: 196-201
16. Stühlinger M., Burri H., Vernooy K. i співавт.: EHRA consensus on prevention and management of interference due to medical procedures in patients with cardiac implantable electronic devices. EP Europace, 2022; euac040; doi: 10.1093/europace/euac040
17. Glikson M., Nielsen J., Kronborgc M. i співавт.: 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). Eur. Heart J., 2021; 42: 3427-3520