Рідинні утворення, що, зазвичай, містять секрет підшлункової залози і можуть бути розташовані як всередині, так і назовні підшлункової залози. Розрізняють справжні та післязапальні кісти.
1. Справжні кісти — мають стінку, вистелену епітелієм:
1) застійні кісти (ретенційні) — утворені внаслідок розширення протоки підшлункової залози, спричиненого непрохідністю (часто при ХП);
2) неопластичні кісти (>50 % кіст підшлункової залози) — муцинозні кістозні пухлини (MCN ; високий ризик злоякісності); серозні цистаденоми (SCA; майже завжди — доброякісні); інтрадуктальні папілярні муцинозні пухлини (IPMN; ризик трансформації в інвазивний рак залежить від підтипу: вищий у випадку IPMN котрі походять з головного панкреатичного протоку, нижчий при IPMN з бічних гілок та при мішаних формах);
3) паразитарні кісти — утворюються внаслідок інфікування ехінококом, аскаридою людською та при шистосоміазі;
4) дермоїдні кісти (вроджені) і тератоми.
2. Постзапальні кісти (псевдокісти) — наслідок ГП (→розд. 5.1).
Клінічна картина та типовий перебіг
Кісти підшлункової залози зазвичай протікають безсимптомно і виявляються випадково під час візуалізаційної діагностики черевної порожнини. У випадку постзапальних кіст в анамнезі ГП або ХП (або фактори ризику даних захворювань), травма. Типові симптоми: можуть виникати відчуття дискомфорту у черевній порожнині, біль низької інтенсивності, інколи — гострий біль, нудота, блювання, загальна слабкість, відсутність апетиту, прогресуюча втрата маси тіла, лихоманка. В епігастрії або мезогастрії може відчуватись ригідність м’язів при пальпації. Перші симптоми зазвичай є наслідком ускладнення →нижче. Впродовж 6–12 тиж. від ГП до 80 % постзапальних рідинних утворень підлягають самостійному розсмоктуванню. Ймовірність розсмоктування зменшується у випадку множинних, великих (≥4 см) утворень, розміщених у ділянці хвоста підшлункової залози, з грубою стінкою, що з’єднані з протокою підшлункової залози, таких, що збільшуються під час спостереження, із супутнім звуженням протоки підшлункової залози в проксимальній ділянці, або таких, що виникли внаслідок біліарного або післяопераційного ГП і алкогольного ХП.
Діагностичний алгоритм →рис. 5.3-1.
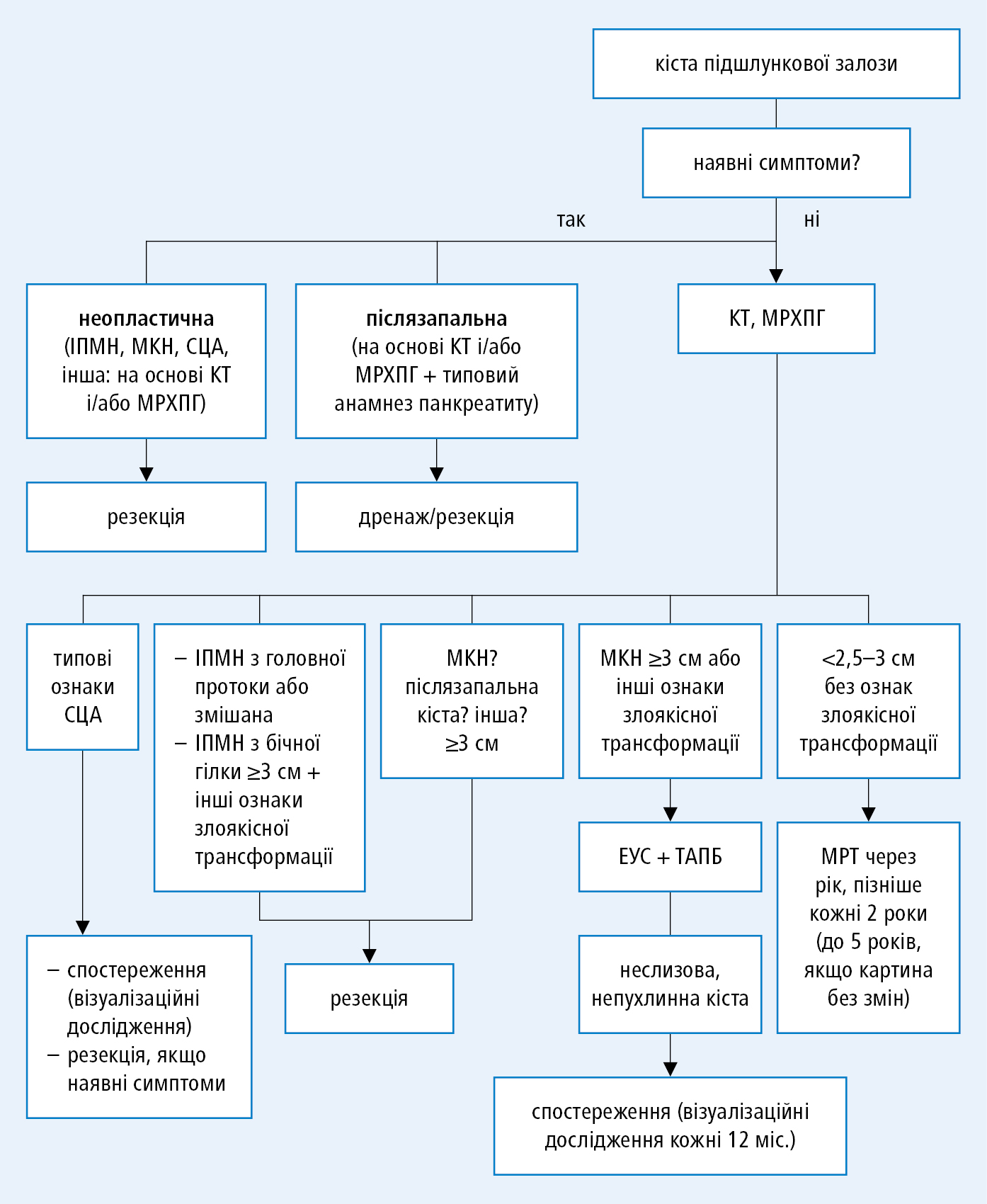
Рисунок 1. Алгоритм дій у разі діагностування кісти підшлункової залози
1. Лабораторні дослідження: при постзапальних кістах (часто тільки періодично) збільшення активності α амілази у сироватці та сечі та активності ліпази у сироватці; періодично – лейкоцитоз і підвищення концентрації СРБ у крові; збільшення активності ЛФ і гіпербілірубінемія, у випадку компресії на позапечінкові жовчні шляхи.
2. Візуалізаційні методи досліджень: УЗД і ЕУС — інкапсульована порожнина з рідиною, як правило, з наявністю гіперехогенних структур у просвіті; наявність у просвіті кісти солідних структур вказує на злоякісну пухлину. ЕУС являється найточнішим методом для оцінки невеликих змін в головці підшлункової залози; дозволяє точно оцінити структуру кісти, а також здійснити її пункцію з метою отримання рідини для дослідження. МРТ/МРХПГ – це дослідження першої лінії для оцінки кіст підшлункової залози, оскільки воно неінвазивне, без іонізуючого випромінювання, і найкраще показує зв’язок між кістою та протокою підшлункової залози (що є характерною ознакою IPMN з бічної гілки протоки підшлункової залози). Мультиспіральна КТ, виконана згідно з протоколом підшлункової залози (виконується, коли МРТ протипоказана або недоступна) — візуалізує гладкостінне, округле гіподенсне вогнище низької однорідної рідинної густини; окреслює детальне місце розташування кісти, але не дає змоги відрізнити ретенційну кісту від псевдокісти. ЕРХПГ — виконують, якщо планується ендоскопічне лікування (напр., імплантація стенту до протоки підшлункової залози). Селективна вісцеральна ангіографія у разі підозри на псевдоаневризму, дозволяє виконати емболізацію.
3. Дослідження рідини з кісти: рідина може бути прозорою, світлою, жовтою або коричневою, у ній часто визначається висока активність α амілази і ліпази, що значно перевищує показники у сироватці; мікробіологічне дослідження; у випадку підозри на кісту пухлинного походження → (РЕА [CEA]), фарбування на наявність слизу, цитологічне дослідження.
Перш за все, неопластичні кісти →табл. 5.3-1. Визначення ймовірного типу кісти (найчастіше за допомогою візуалізаційних досліджень, перевагу надають МРТ і МРХПГ; можливо ЕУС, за необхідності з ТАПБ) і, відповідно, ризику малігнізації, має основне значення для вибору алгоритму дій. Про злоякісний перебіг MCN і IPMN свідчать: товсті стінки кісти з наявними вузликами, діаметр кісти ≥3 см та постійні структури (включення) в їх просвіті. У випадку IPMN на високий ризик малігнізації вказує розширення головного панкреатичного протоку >5 мм. У випадку ≥2-х ознак високого ризику малігнізації проведіть ЕУС з ТАПБ. Допоміжним під час диференційної діагностики є дослідження вмісту кісти. Зазвичай постановка остаточного діагнозу є можливою лише на підставі гістологічного дослідження видаленої кісти.
|
Тип кісти |
Середній вік (роки) |
Стать (Ж:Ч) |
Візуалізаційні дослідження |
Характеристика кістозної рідини |
Цитологічне дослідження рідини |
|
муцинозні кістозні неоплазми (МКН) |
40–70 |
>10:1 |
великі поодинокі або багатокамерні кісти, розташовані у тілі або хвості підшлункової залози, відсутність сполучення з панкреатичними протоками, товсті стінки, периферичні кальцинози |
– висока в'язкість – (РЕА [CEA]) ↑ (у 75 % випадків >200 нг/мл) – амілаза ↓ – концентрація глюкози ≤40 мг/дл |
клітини циліндричного епітелію ± атипія |
|
інтрадуктальні папілярні муцинозні неоплазми (ІПМН) |
50–70 |
1:1 |
– багатокамерні кісти – ІПМН з головної панкреатичної протоки: розширення головної панкреатичної протоки — дифузне або сегментарне – ІПМН з бічної гілки: кіста, яка сполучається з протокою – змішана ІПМН: комбінація вищевказаних |
– висока в'язкість – (РЕА [CEA]) ↑ (у 75 % випадків >200 нг/мл) – амілаза ↑ – концентрація глюкози ≤40 мг/дл |
клітини циліндричного епітелію ± атипія |
|
серозні цистаденоми (СЦА) |
50–80 |
7:3 |
різної величини; множинні дрібні кісти нагадують медові соти, центрально розташований зірчастий рубець |
– низька в'язкість – (РЕА [CEA]) ↓ (зазвичай <5–20 нг/мл) – амілаза ↓ |
клітини одношарового кубічного епітелію, високий вміст глікогену в цитоплазмі |
|
постзапальні кісти (псевдо кісти) |
різний |
1:1 |
однокамерна кіста, товста, фіброзна капсула; панкреатит в анамнезі |
– низька в'язкість – (РЕА [CEA]) ↓ (<5 нг/мл) – амілаза ↑ |
запальні клітини, відсутність епітеліальних клітин з муцином |
|
↓ — низька концентрація/активність, ↑ — висока концентрація/активність, (РЕА [CEA]) — раковоембріональний антиген на основі: Semin. Oncol., 2015; 42: 70–85, і клінічних настанов ACG (2018), модифіковано | |||||
Алгоритм лікування післязапальних кіст →рис. 5.3-2.
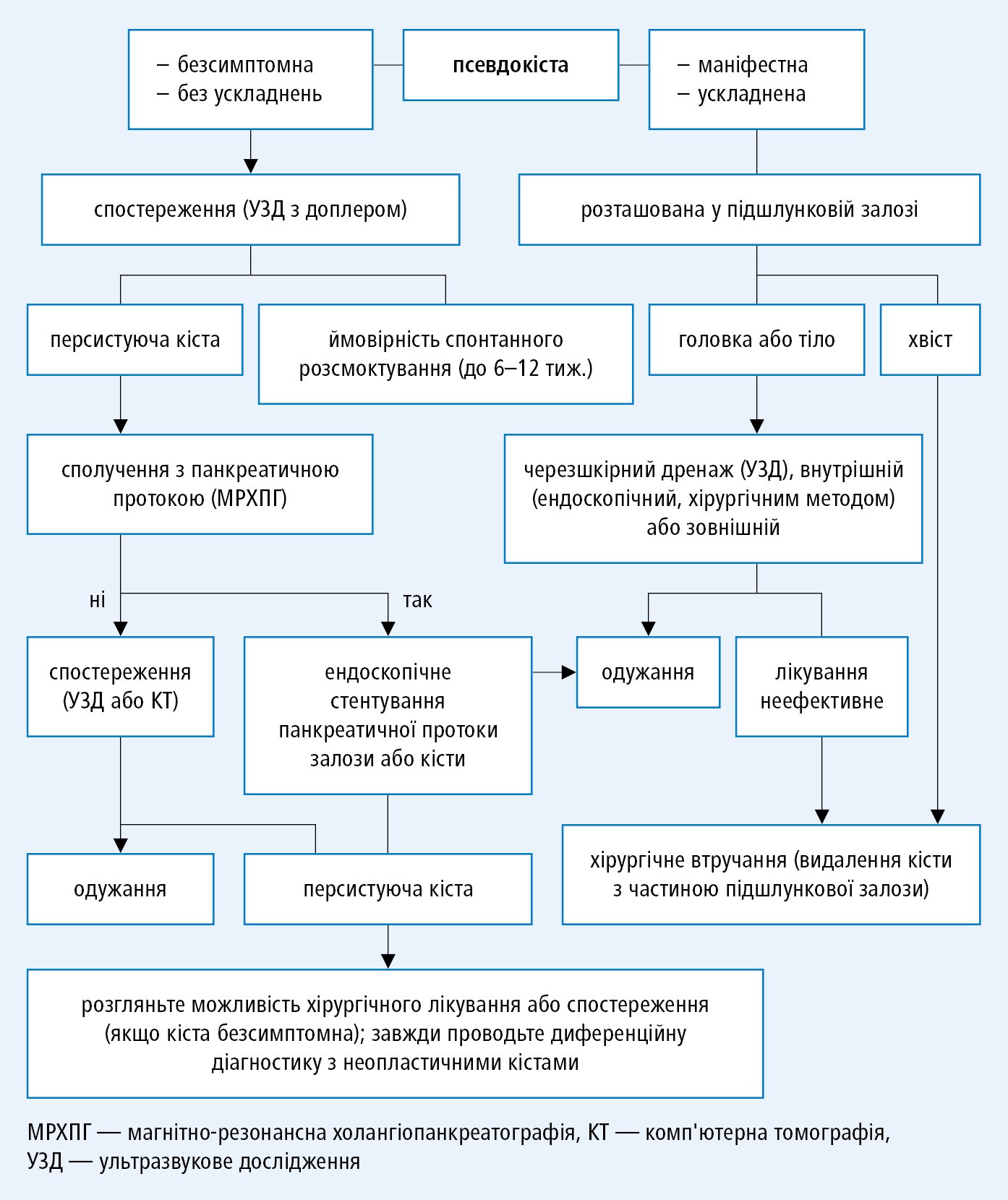
Рисунок 2. Алгоритм лікування псевдокіст підшлункової залози
1. Дренування: застосовуйте тільки при постзапальних кістах, у випадку виникнення симптомів компресії (протипоказане при ракових кістах). Методи:
1) пункція під контролем УЗД;
2) постійне черезшкірне дренування (2–3 тиж.);
3) ендоскопічне внутрішнє дренування (найкращі результати; ендоскопічне введення стенту до протоки підшлункової залози, якщо її цілісність була порушена на довгому відрізку, або безпосередньо до кісти крізь шлунок чи дванадцятипалу кишку). При лікуванні персистуючих кіст, що сполучаються з протокою підшлункової залози, перед ендоскопічним дренуванням або під час процедури з метою зменшення виділення панкреатичного соку можете розглянути застосування окреотиду 100–250 мг п/ш кожні 8–12 год (ефективність такої тактики низька).
2. Хірургічне лікування неопластичних кіст: повне видалення кісти; показане при MCN та при IPMN головного протоку підшлункової залози. У випадку IPMN бокових гілок та мішаних IPMN, показання до оперативного втручання неоднозначні; зазвичай приймаються наступні: діаметр кісти ≥3 см, постійні включення в просвіті кісти, вузлики в стінці кісти або клінічні симптоми. Беручи до уваги низький потенціал малігнізації SCN (серозна кістозна неоплазія) оперують тільки тоді, коли вони викликають клінічні симптоми.
3. Хірургічне лікування постзапальних кіст: розгляньте покази у випадку симптоматичної, персистуючої псевдокісти (>12 тиж.), що не підлягає ендоскопічному лікуванню. Методи:
1) повне видалення кісти (часто можливе у випадку кіст, розташованих у хвості підшлункової залози – видалення кісти з тканиною хвоста підшлункової залози, із збереженням селезінки);
2) внутрішнє хірургічне дренування (тобто анастомоз кісти з просвітом ШКТ — панкреатоцистогастростомія, панкреатоцистодуоденостомія або панкреатоцистоєюностомія; повне вилікування досягається у 70–80 % випадків);
3) зовнішнє хірургічне дренування (найменш корисне, часто спричиняє виникнення зовнішніх нориць підшлункової залози).
У пацієнтів з випадково виявленими безсимптомними кістами діаметром <2,5–3 см, без ознак малігнізації проведіть МРТ дослідження через рік, а потім кожні 2 роки (до 5 років, якщо картина не змінюється). У випадку виникнення ознак малігнізації або клінічних симптомів — оперативне лікування. При постзапальних кістах періодична оцінка лабораторних параметрів (активність α-амілази у сироватці і сечі, активність ліпази і ЛФ у сироватці, концентрація білірубіну у сироватці) і кількості лейкоцитів, та УЗД органів черевної порожнини. Завжди необхідно проводити диференціальну діагностику з кістами пухлинного походження.
1. Прорив кісти у черевну порожнину: симптоми подразнення очеревини і асцит.
2. Позапечінковий холестаз або непрохідність дванадцятипалої кишки, спричинена компресією кістою ззовні; якщо наявний холестаз → виконайте МРХПГ та інколи ЕРХПГ із протезуванням жовчних шляхів (якщо показане ендоскопічне лікування).
3. Кровотеча з варикозно розширених вен дна шлунку чи стравоходу, що сформувались, внаслідок компресії кісти на селезінкову або ворітну вену: доплер УЗД може виявити компресію судин стінкою кісти.
4. Кровотеча до кісти з парапанкреатичних судин: при УЗД виявляється гіперехогенний вміст у кісті.
5. Псевдоаневризма: виникає внаслідок пошкодження парапанкреатичних артерій (селезінкової, шлунково-дуоденальної, підшлунково-дуоденальної, печінкових) із збереженням прохідності між артерією та просвітом кісти.
Доплерівське дослідження може візуалізувати кровоплин всередині кісти. Розрив псевдоаневризми може викликати кровотечу (в залежності від локалізації) до черевної порожнини або заочеревинного простору; рідкісним ускладненням аневризми є кровотеча до дванадцятипалої кишки через протоку підшлункової залози.