Remdesivir, un medicamento antiviral originalmente desarrollado para tratar a pacientes con fiebre hemorrágica por Ébola, actualmente despierta grandes esperanzas de una terapia causal efectiva y segura contra la COVID-19. Se mostró activo contra los coronavirus SARS y MERS in vitro (en cultivo celular) y en estudios con animales. Los estudios in vitro también han confirmado su actividad inhibidora del SARS-CoV-2, y el mecanismo de acción consiste en el bloqueo de la ARN polimerasa viral (véase más abajo).
Como informa en su página web Gilead Sciences, la entidad responsable de los trabajos e investigaciones sobre este fármaco, actualmente se están llevando a cabo en todo el mundo 6 ensayos clínicos aleatorizados sobre el uso de remdesivir en pacientes con COVID-19 con un curso moderadamente grave o grave. Como no todos los pacientes pueden participar en estos estudios, tanto el fabricante del medicamento como las autoridades administrativas competentes de cada país adoptan medidas para permitir el uso de remdesivir en el marco de un programa de "uso compasivo" (compassionate use). En respuesta a la solicitud de cuatro países de la Unión Europea (UE) realizada a finales de marzo del presente año, el Comité de Medicamentos de Uso Humano (CHMP), que se encarga de la evaluación científica de los medicamentos por la EMA (Agencia Europea de Medicamentos), emitió el 2 de abril de este año recomendaciones sobre las condiciones de uso del remdesivir en el tratamiento de pacientes con COVID-19 en el marco de los programas de "uso compasivo" en los estados miembros de la UE.
¿Qué es el programa de "uso compasivo"?
Este programa permite administrar al paciente un medicamento que aún no ha sido autorizado bajo estrictas condiciones. El art. 83 del Reglamento (CE) no 726/2004 del Parlamento Europeo y del Consejo proporciona el marco legal y generalizado para este procedimiento. De acuerdo con este, el medicamento que se utilice en el programa debe estar en trámites para conseguir su autorización de comercialización o en la fase de ensayos clínicos. En esta etapa, aunque en general se hayan completado los ensayos preclínicos y los ensayos clínicos en su fase temprana, es posible que todavía no se conozca el perfil completo de seguridad y eficacia del medicamento ni el régimen de dosificación óptimo. Tal medicamento, en el programa de "uso compasivo", solo está disponible para el grupo de pacientes con enfermedades potencialmente mortales, de larga duración o severamente debilitantes en las que el uso de otros medicamentos ya registrados no es posible o resulta ineficaz. Según las guías de la EMA para los programas de "uso compasivo", estos no pueden reemplazar a los ensayos clínicos requeridos para evaluar de manera confiable la eficacia y seguridad de un medicamento. Por tanto, primero debe intentarse integrar al paciente en un ensayo clínico apropiado y considerar el programa de "uso compasivo" solo si no se le puede calificar para dicho ensayo.
La decisión de permitir el uso de un medicamento determinado bajo este programa es tomada individualmente por cada uno de los estados miembros de la UE, pero es necesario informar a la EMA. La Agencia, a solicitud del fabricante o del país en cuestión, a través del CHMP, emite recomendaciones sobre el uso, distribución e indicaciones para la administración del medicamento en dicho programa. Cada estado miembro de la UE debería preparar su propia base legal para el funcionamiento del programa de "uso compasivo" y, a continuación, tener en cuenta los dictámenes disponibles sobre el tratamiento específico que se autorizará en virtud del mismo (los dictámenes emitidos por los propios órganos de la EMA no tienen el carácter de disposiciones legales).
Principales recomendaciones del CHMP sobre el remdesivir
¿A quién se le puede administrar? En el marco del programa de "uso compasivo", se puede considerar el uso de remdesivir en pacientes (niños ≥12 años de edad que pesen ≥40 kg o adultos) que requieren ventilación mecánica invasiva debido a COVID-19 (confirmado por los resultados de laboratorio de PCR y también en espera de su resultado, pero con contacto confirmado con una persona diagnosticada con COVID-19). Los criterios de calificación adicionales son eTFG ≥30 ml/min y actividad ALT ≤5 veces el límite superior del valor normal. No se ha establecido la seguridad y eficacia del tratamiento en niños de hasta 12 años. Debido a la falta de datos sobre el uso en embarazadas, no se recomienda administrar remdesivir en esta población.
Contraindicaciones: hipersensibilidad a cualquiera de los componentes del preparado, fallo multiorgánico, uso de >1 fármaco vasopresor en el tratamiento del shock séptico (se permite administrar remdesivir a los enfermos que reciben 1 fármaco vasopresor en una dosis pequeña o mediana debido a la sedación o a los relajantes administrados durante la ventilación mecánica), insuficiencia renal (eTFG <30 ml/min), diálisis o hemodiafiltración venovenosa continua, actividad ALT >5 veces el límite superior del valor normal, y participación del enfermo en cualquier ensayo clínico o tratamiento experimental de COVID-19. Remdesivir no debe usarse junto con otros medicamentos con hepatotoxicidad conocida.
Dosificación, duración del tratamiento, método de administración . El medicamento solo debe usarse en condiciones hospitalarias. El remdesivir está disponible en forma de polvo para concentrado o de concentrado listo para la preparación de una solución para una infusión iv. que dura de 30 a 120 minutos. Se recomienda una dosis de 200 mg el 1.er día de terapia, seguida de 100 mg/d durante 9 días. En caso de reacción anafiláctica, la infusión debe interrumpirse inmediatamente, se debe aplicar el tratamiento adecuado y terminar la terapia con remdesivir.
No es necesario modificar la dosis en caso de trastornos funcionales renales o hepáticos leves o moderados, ni en las personas de edad avanzada.
Seguimiento de la terapia . Durante el tratamiento con remdesivir, deben realizarse con regularidad las pruebas de laboratorio apropiadas, incluidos los parámetros bioquímicos de la función hepática. También debe controlarse regularmente la eTFG, especialmente en enfermos que presentaban trastornos funcionales renales ya antes del tratamiento con remdesivir. En caso de eTFG <30 ml/min, se debe considerar la posibilidad de interrumpir el medicamento y vigilar cuidadosamente a los pacientes hasta que la eTFG vuelva al valor inicial o se establezca la causa de dicho cambio.
Efectos secundarios, interacciones con otros fármacos y advertencias sobre su uso . Todavía no se conoce el perfil de seguridad completo del remdesivir, pero se conoce el riesgo de hepatotoxicidad asociada con su uso. En los ensayos clínicos realizados hasta ahora, se han observado aumentos transitorios de la actividad de la ALT y AST (tanto después de una dosis única de 225 mg de remdesivir como después de la administración de 150 mg/d durante 14 días), acompanados de una prolongación leve y transitoria del TP en algunos pacientes, pero sin efectos clínicamente significativos sobre el INR u otros síntomas hepáticos.
En los ensayos clínicos realizados hasta ahora, no se han observado signos clínicos de nefrotoxicidad del remdesivir administrado como dosis única de hasta 225 mg o en dosis de 150 mg 1 x/d durante 14 días. No existen datos sobre el paso de remdesivir a la leche materna o sobre su efecto en la fertilidad humana.
Aunque los estudios in vitro indican que el remdesivir es un sustrato de CYP2C8, CYP2D6 y CP3A4, no se han realizado estudios de interacción clínica con otros medicamentos, incluidos los utilizados para tratar la COVID-19.
Características farmacológicas del remdesivir
Remdesivir (también denominado con el código GS-5734) es un análogo de adenosina con actividad antiviral. Es un profármaco que se transforma dentro de las células en el compuesto designado como GS-441524, y este se metaboliza rápidamente al metabolito activo: trifosfato farmacológicamente activo (GS-443902; fig.). El GS-443902, al ser un análogo estructural del ATP, es utilizado en su lugar por la ARN polimerasa vírica, bloqueando así su actividad, lo que conduce a la terminación prematura de la síntesis de la cadena de ARN y, por consiguiente, a la inhibición de la replicación del virus.
En estudios in vitro (cultivo celular) o en animales realizados hasta ahora, el remdesivir ha demostrado su acción contra muchos virus de ARN, incluidos los de las familias Coronaviridae (como el SARS-CoV, el MERS-CoV o cepas provenientes de murciélago capaces de infectar las células epiteliales respiratorias humanas), Paramyxoviridae (como los virus de Nipah, VSR y Hendra) y Filoviridae (p. ej. los virus de las fiebres hemorrágicas del Ébola y de Marburg). Los datos sobre la actividad del remdesivir contra el SARS-CoV-2 se limitan actualmente a unas pocas observaciones in vitro y a la extrapolación de los resultados de investigaciones sobre los coronavirus similares del SARS y el MERS.
El remdesivir sigue siendo un medicamento experimental, en fase de investigación. Desarrollado originalmente para tratar la fiebre hemorrágica del Ébola, no tuvo éxito durante la epidemia de esta enfermedad en la República Democrática del Congo en 2019. Su perfil de seguridad no ha sido definido, ni su eficacia ha sido confirmada en ninguna indicación. Tampoco está autorizado para su comercialización en ningún país.
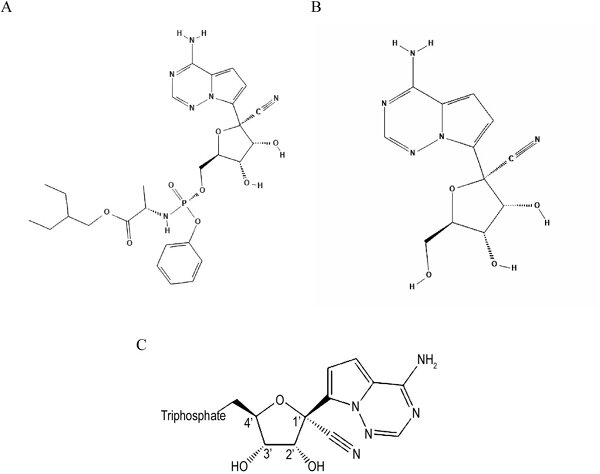
Fig. Estructuras químicas: A: remdesivir (profármaco); B: GS-441524 (metabolito intermedio); C: metabolito activo GS-443092 (Amirian S.E., Levy J.K ., Current knowledge about the antivirals remdesivir [GS-5734] and GS-441524 as therapeutic options for coronaviruses”, One Health, 2020; 9 1001282)
Bibliografía:
1. Comunicación del 03.04.2020 „EMA provides recommendations on compassionate use of remdesivir for COVID-19” https://www.ema.europa.eu/en/news/ema-provides-recommendations-compassionate-use-remdesivir-covid-19 [consulta: 08.04.2020]2.Información relativa al programa „compassionate use” https://www.ema.europa.eu/en/human-regulatory/research-development/compassionate-use [consulta: 08.04.2020]
3. Documento del 03.04.2020 „Summary on compassionate use Remdesivir Gilead” https://www.ema.europa.eu/en/documents/other/summary-compassionate-use-remdesivir-gilead_en.pdf [consulta: 08.04.2020]
4. Documento del 03.04.2020 „Conditions of use, conditions for distribution and patients targeted and conditions for safety monitoring adressed to member states for remdesivir available for compassionate use” https://www.ema.europa.eu/en/documents/other/conditions-use-conditions-distribution-patients-targeted-conditions-safety-monitoring-adressed_en-2.pdf [consulta: 08.04.2020]
5. Amirian S.E., Levy J.K., Current knowledge about the antivirals remdesivir (GS-5734) and GS-441524 as therapeutic options for coronaviruses”, One Health, 9 (2020) 1001282 https://doi.org/10.1016/j.onehlt.2020.100128 [consulta: 8.04.2020]
6. Información publicada en el sitio web de Gilead Science: https://www.gilead.com/purpose/advancing-global-health/covid-19 [última actualización: 4.04.2020; consulta: 8.04.2020]
7. Reglamento (CE) no 726/2004 del Parlamento Europeo y del Consejo de 31 de marzo de 2004 por el que se establecen procedimientos comunitarios para la autorización y el control de los medicamentos de uso humano y veterinario y por el que se crea la Agencia Europea de Medicamentos https://eur-lex.europa.eu/legal-content/ES/TXT/PDF/?uri=CELEX:32004R0726&from=ES [consulta 8.04.2020]
8. Ley polaca del 6.09.2001, Ley farmacéutica, con cambios posteriores, texto consolidado.
El número de casos confirmados de infecciones por coronavirus, junto con la localización, así como el número de casos mortales puede consultarse en el mapa del Centro de Ciencia e Ingeniería de Sistemas de la Universidad Johns Hopkins
 Español
Español
 English
English
 українська
українська




