Autoras de las fotografías: Maria Niebielecka, Jolanta Lukaszczyk
Cómo citar: Sawiec P., Rymer W., Ozorowski T., Praktyka kliniczna – choroby zakaźne. Pobieranie wymazu z części nosowej gardła, Med. Prakt., 2020, 5: 105-109
Siglas y abreviaturas: CDC (Centers for Disease Control and Prevention) — Centros para el Control y la Prevención de Enfermedades estadounidenses, PCR (polymerase chain reaction) — reacción en cadena de la polimerasa, SARS-CoV-2 — coronavirus 2 del síndrome respiratorio agudo grave
Introducción
El frotis de la nasofaringe es un procedimiento de extracción de material que sirve para detectar distintos microorganismos presentes en las vías respiratorias superiores, como virus (p. ej. VSR, gripales o paragripales, SARS-CoV-2) y bacterias (p. ej. Bordetella pertussis, Streptococcus pneumoniae). En función del microorganismo sospechado, el material extraído se puede utilizar para realizar pruebas tanto en casete/de antígenos como moleculares (PCR).
En la actualidad, la indicación principal para extraer exudado nasofaríngeo es la sospecha de infección por SARS-CoV-2 (método preferido por los CDC estadounidenses). Según los CDC, no es obligatorio obtener un exudado orofaríngeo. Sin embargo, se puede tomar un exudado de varias localizaciones (p. ej. de la orofaringe y la nasofaringe por medio de 2 hisopos o 1 hisopo en el orden anterior) y, según las instrucciones del hisopo, incluirlos en el mismo tubo de ensayo, lo cual incrementa la sensibilidad de la prueba.
Contraindicaciones y complicaciones
No existen contraindicaciones absolutas para la toma de exudado nasofaríngeo. Un traumatismo reciente o defectos anatómicos craneofaciales y la diátesis hemorrágica grave se consideran contraindicaciones relativas, ya que pueden dificultar la introducción del hisopo o incrementar el riesgo de traumatismo local y hemorragia. Las complicaciones se deben a una lesión tisular local (hemorragia, dolor o malestar). El procedimiento puede inducir tos y estornudos, y en ocasiones vómitos (a causa de la irritación de la pared posterior de la faringe).
Material necesario
Equipos de protección individual
El material extraído es infeccioso y el procedimiento puede generar aerosol (en caso de toser o estornudar). Por lo tanto, la persona encargada de obtener el exudado debe utilizar equipos de protección individual: un delantal impermeable de manga larga, guantes, mascarilla y gafas protectoras o pantalla facial. En caso de tomar un exudado de una persona con sospecha de infección por SARS-CoV-2, lo más aconsejable es utilizar una mascarilla con filtro FFP2/FFP3 (si no hubiera ninguna disponible, se permite usar una mascarilla quirúrgica, sobre todo cuando el trabajo no implica una exposición continua), pantalla facial, una bata adicional (p. ej. de polipropileno) y guantes dobles, con los interiores bajo el puño de la bata y los exteriores por encima.
El proceso se debe llevar a cabo en una habitación aislada y bien ventilada. El paciente debe llevar mascarilla puesta y solo se la puede quitar justo antes del procedimiento.
Equipo para la toma del exudado
Antes de llevar a cabo el procedimiento, se debe preparar el equipo necesario para obtener el exudado. El tipo de hisopo y de medio de cultivo dependen del tipo de microorganismo y de medio.
Si los exudados se han de tomar para pruebas de PCR, solo se deben usar hisopos de fibras sintéticas enrolladas alrededor de un mango de plástico (los otros tipos pueden inhibir la PCR). No se permite usar hisopos de materiales orgánicos (p. ej. de algodón o madera) ni con alginato de calcio, ya que pueden inhibir la PCR. Del mismo modo, al tomar un exudado para la prueba de tosferina, no se deben utilizar puntas de algodón ni seda artificial (rayón). Se consideran universales los hisopos de poliéster, dacrón o nailon con mango de plástico. En el mango del hisopo hay un marcador creado por el fabricante que determina la profundidad a la que se debe introducir, así como un estrechamiento que marca el sitio donde hay que romperlo tras introducirlo en el tubo de ensayo.
Si el diagnóstico se centra en la infección por SARS-CoV-2, se pueden utilizar:
1) kits comerciales: contienen un hisopo flocado flexible de plástico y un tubo de ensayo con medio de cultivo para virus
2) kits caseros (para exudados faríngeos y nasales), que contienen:
a) hisopos flocados estériles o hisopos estándar de plástico, con punta de dacrón, viscosa o seda artificial
b) un tubo de ensayo con solución tampón estéril de NaCl al 0,9 % de un volumen que permita sumergir el extremo del hisopo (fig. 1).
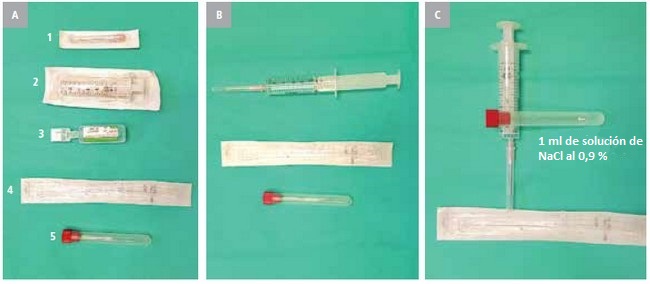
Fig. 1. A — equipo necesario para preparar un kit casero. 1: aguja para la extracción de una solución de NaCl al 0,9 %, 2: jeringuilla, 3: envase pequeño de solución de NaCl al 0,9 % (se deben usar envases pequeños para evitar que la solución se contamine debido a la reutilización), 4: hisopo, 5: tubo de ensayo. B — extraer a la jeringuilla la solución de NaCl al 0,9 % de forma estéril. C: echar aprox. 1 ml de solución al tubo de ensayo en el que se introducirá el hisopo después de tomar el exudado
Antes de tomar el frotis, se debe marcar el tubo de ensayo en el que se vaya a colocar el hisopo y pegar un código en él (cuando sea necesario; fig. 2).
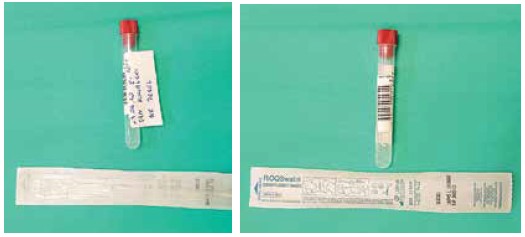
Fig. 2. Descripción y codificación del tubo de ensayo para el hisopo. El tubo por lo general debe incluir los siguientes datos (depende del país y del centro): nombre y apellidos del paciente, número del documento de identidad, fecha y hora de la toma del frotis
Instrucciones para la toma de frotis nasofaríngeo
1. El paciente debe sentarse en posición erguida, de ser posible con la nuca apoyada; la cabeza puede estar colocada en vertical o ligeramente inclinada hacia atrás.
2. Informar al paciente de que el procedimiento puede ser molesto, puesto que hay que introducir el hisopo profundamente.
3. Pedirle al paciente que se quite la mascarilla (que se descubra la nariz) y se suene la nariz con un pañuelo desechable.
4. Medir la distancia entre las fosas nasales anteriores y la salida del conducto auditivo externo para determinar la distancia a la que se debe introducir el hisopo (la profundidad real a la que se debe introducir el hisopo es algo menor: en los pacientes adultos normalmente es de 1-2 cm; fig. 3). Antes de desempaquetar el hisopo, verificar que la distancia marcada se corresponde con la distancia entre la punta del hisopo y marcador del fabricante (fig. 4).
5. Desempaquetar el hisopo de forma estéril (fig. 5).
6. Introducir con cuidado el hisopo en la cavidad nasal: en paralelo al paladar hasta notar una resistencia a la altura del marcador (fig. 6).
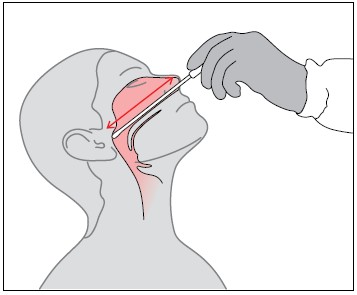
Fig. 3
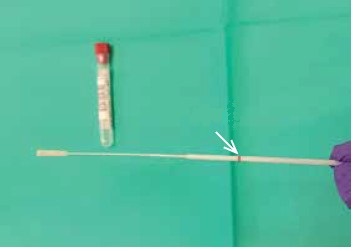
Fig. 4 La flecha muestra el marcador

Fig. 5. Manera de abrir el envase del hisopo
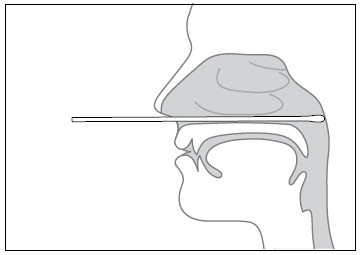
Fig. 6. Manera de introducir el hisopo
En caso de notar resistencia mucho antes y no consiguir alcanzar la profundidad marcada, retirar el hisopo e intentar volver a introducirlo con otro ángulo, pero también en paralelo al paladar. En caso de no conseguir introducir el hisopo a la profundidad adecuada en la fosa nasal elegida (el paciente puede tener un tabique nasal torcido u otro obstáculo anatómico), volver a intentar tomar el exudado en el lado contrario de la cavidad nasal.
7. Después de introducir el hisopo a la profundidad adecuada (cuando contacte con la pared posterior de la faringe; fig. 7A) hay que dejarlo en la misma posición durante unos segundos para que las secreciones se absorban, y después hay que rotarlo durante 5-10 s para tomar el frotis (fig. 7B).
8. Retirar lentamente el hisopo girándolo alrededor de su eje.
9. Tras extraer el material, se debe introducir el hisopo en un tubo de ensayo con una solución de NaCl al 0,9 % (o con medio de cultivo para virus si se usa un kit comercial), romper el extremo saliente y cerrar herméticamente el tubo de ensayo (fig. 8).
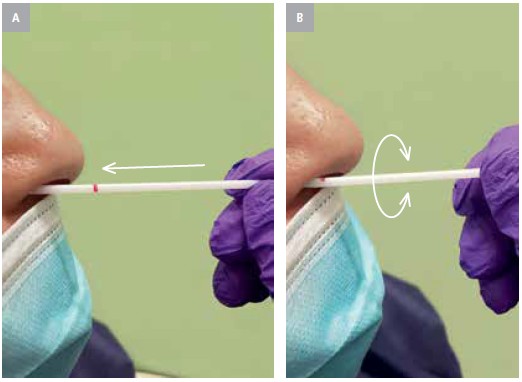
Fig. 7
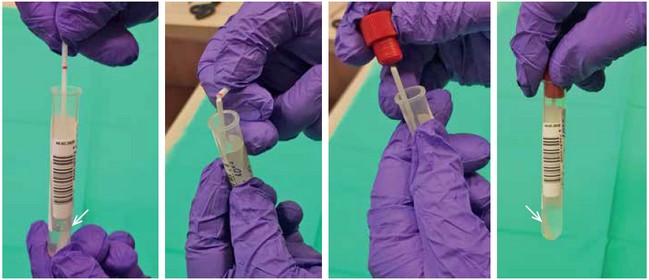
Fig. 8. Manera de colocar el hisopo en el tubo de ensayo: la punta entera del hisopo debe sumergirse en una solución de NaCl al 0,9 % o en un medio de cultivo para virus
Almacenamiento y transporte de materiales
El tubo de ensayo se debe empaquetar adecuadamente. Las normas de empaquetado de muestras deben cumplir con el nivel de bioseguridad 2 (BSL-2) y los recipientes deben embalarse y marcarse según las reglas establecidas para los agentes patógenos para los humanos. Se debe emplear el sistema de embalaje triple (1: recipiente primario, 2: envase secundario, 3: embalaje exterior).
La superficie externa del recipiente primario se debe considerar como contaminada, por eso se debe introducir en el envase secundario de un modo que minimice su riesgo de contaminación. Los pasos a seguir pueden variar en función de los procesos empleados en el centro en cuestión y del número de personas que hayan participado en la toma del exudado y el embalaje de las muestras. Por ejemplo, si la muestra se extrae en el domicilio del paciente y solo una persona se encarga de todo el proceso, antes de colocar el recipiente primario en el envase secundario, esta persona debe salir del domicilio del paciente, descontaminarse las manos, quitarse los guantes externos y el delantal externo, volver a desinfectarse las manos, ponerse un nuevo par de guantes y desinfectarlos. Entonces, debe introducir el recipiente primario en el envase secundario, cerrarlo herméticamente, desinfectarse las manos y desinfectar la superficie externa del envase secundario. El envase secundario debe contener una capa absorbente que contenga el líquido en caso de que el tubo de ensayo presente fugas.
La derivación adjunta a las muestras no se puede incluir en el envase secundario, sino que debe introducirse en un sobre cerrado y fijado al embalaje exterior.
La temperatura de almacenamiento/transporte recomendada depende del tipo de material:
1) medio de transporte preparado: ≤5 días a 2-8 °C, >5 días a –70 °C (hielo seco)
2) kit casero: ≤2 días a 2-8 °C, >2 días a –70 °C (hielo seco).
Bibliografía:
1. Li L., Chen Q., Li Y. ycols., Comparison among nasopharyngeal swab, nasal wash, and oropharyngeal swab for respiratory virus detection in adults with acute pharyngitis, BMC Infect. Dis., 2013; 13: 281; doi.org/10.1186/1471-2334-13-2812. Satzke C., Turner P., Virolainen-Julkunen A. y cols., Standard method for detecting upper respiratory carriage of Streptococcus pneumoniae: updated recommendations from the World Health Organization Pneumococcal Carriage Working Group, Vaccine, 2013; 32: 165–179
3. https://www.cdc.gov/pertussis/clinical/diagnostic-testing/specimen-collection.html (consulta: 30.04.2020)
4. WHO guidelines for the collection of human specimens for laboratory diagnosis of avian influenza infection. 12.01.2005. https://www.who.int/influenza/human_animal_interface/ virology_laboratories_and_vaccines/guidelines_collection_h5n1_humans/en/ (consulta: 30.04.2020)
5. Cornia P., Lipsky B.A., Pertussis infection in adolescents and adults: Clinical manifestations and diagnosis, https://www.uptodate.com/contents/pertussis-infection-in-adolescents-and-adults-clinical-manifestations-and-diagnosis (consulta: 30.04.2020)
6. Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 (COVID-19), 29.04.2020 https://www.cdc.gov/coronavirus/ 2019-nCoV/lab/guidelines-clinical-specimens.html (consulta: 30.04.2020)
7. Marty F.M., Chen K., Verrill K.A., How to obtain a nasopharyngeal swab specimen, N. Engl. J. Med., 2020; doi: 10.1056/NEJMvcm2 010 260
8. Dzierzanowska-Fangrat K., Ozorowski T., Burdynowski K. y cols., Zasady pobierania i transportu materialu do badan metodami molekularnymi RT PCR w kierunku SARS-CoV-2. Zalecenia konsultanta krajowego w dziedzinie mikrobiologii lekarskiej, 14.04.2020. https://www.gov.pl/web/zdrowie/zasady-pobierania-i-transportu-materialu-do-badan-metodami-molekularnymi (consulta: 30.04.2020)
 Español
Español
 English
English
 українська
українська




