Siglas y abreviaturas: AAS — ácido acetilsalicílico, angio-RMN — angiografía por resonancia magnética, angio-TC — angiografía por tomografía computarizada, DFM — displasia fibromuscular, SCAD (spontaneous coronary artery dissection) — disección espontánea de arterias coronarias, SCeAD (spontaneous cervical artery dissection) — disección espontánea de la arteria carótida, TC — tomografía computarizada
Introducción
La displasia fibromuscular (DFM) es una enfermedad no ateroesclerótica ni inflamatoria de las arterias de pequeño y mediano tamaño que se caracteriza por una arquitectura anormal de la pared arterial. En la última década, y con el objeto de conocer mejor la epidemiología y el cuadro clínico de la DFM, se crearon registros multicéntricos —nacionales e internacionales— que incluyeron grupos extensos de pacientes. Su análisis aportó nuevos datos sobre varios aspectos de la DFM y contribuyó a un desarrollo importante de su diagnóstico y tratamiento. Se demostró, entre otras cosas, que la DFM es una enfermedad de vasta sintomatología que puede cursar de forma asintomática, aunque también puede conllevar complicaciones potencialmente mortales. Tiene carácter de arteriopatía generalizada: los típicos cambios que estrechan los vasos sanguíneos se suelen observar en más de un lecho vascular, asociándose con una mayor frecuencia de complicaciones como el aneurisma, la disección o la excesiva tortuosidad arterial.
La primera opinión del ámbito internacional relativa al diagnóstico y el tratamiento de la DFM fue elaborada en 2019 por un grupo de expertos del Grupo de Trabajo Hypertension and the Kidney de la European Society of Hypertension (ESH) y de la Society for Vascular Medicine (SVM) estadounidense. En un extenso documento se presentó el estado de conocimiento actual sobre la DFM, así como consejos prácticos asociados, acerca de la atención al paciente con DFM, incluido un protocolo estandarizado para la realización de una angiografía clásica y angioplastia percutánea en la estenosis de la arteria renal causada por la DFM. El presente escrito incluye la información más relevante del citado documento.
Los expertos recapitularon los primeros análisis del registro europeo/internacional de pacientes con DFM (European/International FMD Registry) y presentaron los resultados actualizados del registro americano de DFM, realizado en Estados Unidos. También hicieron referencia a otros registros, como el registro polaco ARCADIA-POL, llevado a cabo desde 2015 en la Clínica de Hipertensión Arterial del Instituto Cardiológico de Varsovia.
Definición y clasificación de la displasia fibromuscular
La DFM se define como una enfermedad idiopática, segmentaria, no ateroesclerótica y no inflamatoria de la lámina muscular de las arterias de pequeno y mediano tamano que provoca la estenosis de las mismas. Para confirmar el diagnóstico de DFM hay que descartar otras anomalías de la pared arterial, tales como el espasmo arterial, cambios de ateroesclerosis y enfermedades monogénicas o inflamatorias de las arterias.
La clasificación actual de los cambios en la DFM se basa en la imagen angiográfica y distingue 2 tipos de DFM, según la imagen radiológica y la longitud de la estenosis:
1) DFM multifocal – alternancia de estenosis y dilataciones (imagen de collar de cuentas), que afecta generalmente al tercio medio o distal de las arterias (fig. 1)
2) DFM focal – estenosis única y corta (imagen de anudación con hilo) o estenosis tubular más larga que puede presentarse en cualquier tercio de la arteria (fig. 2).
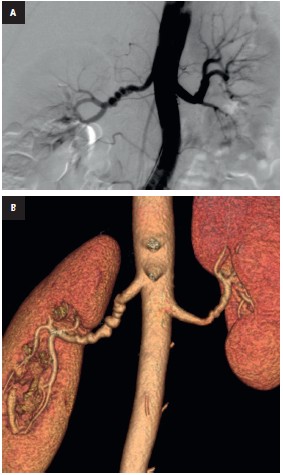
Fig. 1. Displasia fibromuscular multifocal A — angiografía: imagen de collar de cuentas en la arteria renal derecha B — angio-TC de las arterias renales, reconstrucción VR 3D: a la derecha, una imagen típica de collar de cuentas; a la izquierda, cambios atenuados
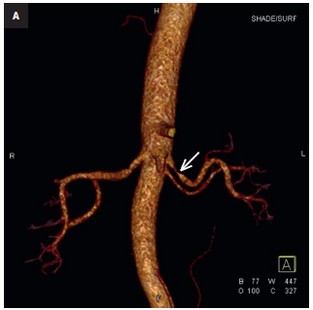
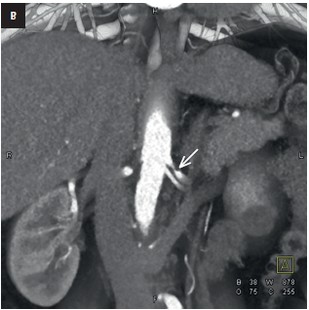
Fig. 2. Displasia fibromuscular focal: estenosis de la arteria renal superior derecha (flecha) Angio-TC: A — renderización de volumen 3D tras el aislamiento vascular B — reconstrucción MIP
Los cambios multifocales son los más habituales y característicos de la DFM. La imagen angiográfica de los cambios focales, al ser menos específica, puede presentar problemas diagnósticos y requiere sobre todo la eliminación de la etiología ateroesclerótica e inflamatoria.
La clasificación anterior de cambios displásicos está basada en la imagen histológica. Actualmente, para el tratamiento de las estenosis arteriales originadas por la DFM se suelen emplear los métodos intravasculares, por lo que la evaluación histológica de los cambios es muy raramente posible. Esto lleva a los expertos a considerar que la clasificación histológica no tiene aplicación práctica.
Morfología de los cambios: estenosis, aneurisma, disección y tortuosidad vascular
En pacientes con DFM, los cambios arteriales típicos coexisten con frecuencia con aneurismas, disecciones y tortuosidades excesivas de las arterias, tanto las afectadas por DFM, como las restantes. Los pacientes con DFM están sometidos a un gran riesgo de disección de la pared arterial (9-20 %) y aneurismas (17-32,5 %). También es posible la relación de la DFM con la disección espontánea de arterias coronarias (SCAD), ), especialmente en mujeres jóvenes sin los típicos factores de riesgo.
También en los pacientes con DFM se observó una mayor frecuencia de tortuosidades arteriales. La tortuosidad de las arterias carótidas internas presenta la imagen típica de una curva en S. La tortuosidad arterial en los enfermos con DFM también fue descrita en otros lechos vasculares, tales como las arterias coronarias. Los científicos de la Clínica Mayo definieron la tortuosidad de las arterias coronarias como la presencia de tres curvaturas consecutivas de 90 a 180° en las arterias epicárdicas grandes, con un diámetro mínimo de 2 mm (también existen otras definiciones de tortuosidad). También se observó mayor reincidencia de SCAD en pacientes con tortuosidad excesiva de las arterias coronarias.
La única presencia de aneurismas, disecciones o tortuosidades arteriales, sin cambios focales o multifocales, no autoriza el diagnóstico de DFM. Sin embargo, si en un paciente se confirma la DFM (focal o multifocal), la presencia de aneurisma, disección o tortuosidad en otra arteria permite clasificar dicho cambio como la afectación de la arteria por parte de la DFM en forma de aneurisma, disección o tortuosidad, y diagnosticarle en este caso una DFM de niveles múltiples.
Etiopatogenia
La patogenia de desarrollo de los cambios fibromusculares de las arterias no ha sido completamente explicada. En el desarrollo de los cambios de la DFM pueden influir factores genéticos, hormonales y/o ambientales.
Se otorga una gran importancia a una posible predisposición genética en el desarrollo de la DFM, lo cual viene avalado por la mayor frecuencia de casos con dichos cambios entre parientes muy cercanos.
Entre los factores que favorecen el desarrollo de los cambios de la DFM está el hábito tabáquico.
La clara mayor frecuencia de DFM en las mujeres permitió formular la hipótesis de la relación entre las hormonas femeninas endógenas y exógenas y el desarrollo de DFM.
También cabe mencionar una hipótesis no confirmada aún, según la cual una movilidad excesiva del rinón conducente a microlesiones de la pared arterial favorece el desarrollo de los cambios de la DFM.
Tanaka y cols. examinaron, mediante técnicas biomoleculares, la composición de las paredes de los aneurismas en las arterías celíacas causados por ateroesclerosis y la de los aneurismas relacionados con la DFM. Concluyeron que la distribución lipídica varía en ambos grupos de aneurismas, por lo que la presencia de lisofosfatidilcolina en la pared arterial puede relacionarse con la predisposición de los pacientes con DFM a sufrir aneurismas de las arterias celíacas.
Registros de pacientes con DFM
Registro americano
El primer registro de pacientes con DFM se creó en 2008 en Estados Unidos (United States Registry for Fibromuscular Dysplasia) y se mantuvo hasta febrero de 2018, logrando recopilar datos de 2000 enfermos.
Registro europeo/internacional
El registro europeo de pacientes con DFM se inició en diciembre de 2015, y se basó en un registro francés, ARCADIA. En la actualidad, el registro es de carácter internacional: agrupa 30 centros de selección de 17 países (no solo de Europa, sino también de Argentina, Japón, China y Túnez). Desde el inicio del registro se han incluido 675 enfermos con DFM.
Comentario
Uno de los grandes registros de pacientes con DFM es un estudio polaco ARCADIA-POL, cuya selección de pacientes se inició en enero de 2015 en el Instituto Cardiológico de Varsovia. Desde el inicio del proyecto hasta finales de 2018, en el estudio ARCADIA-POL se incluyeron 434 enfermos.
Comparación de los registros americano y europeo
Los resultados de ambos registros son compatibles e indican muchas similitudes en las característica clínicas de los pacientes con DFM en Europa y Estados Unidos. Sin embargo, es necesario subrayar las diferencias en la metodología de los distintos registros.
Tanto en el estudio francés ARCADIA, que forma parte integral del registro europeo, como en el estudio polaco ARCADIA-POL, se realizó en todos los pacientes una imagen diagnóstica completa: angio-TC de todos los lechos vasculares, independientemente de los síntomas. En el registro estadounidense, sin embargo, la ATC de los lechos vasculares particulares se realizaba en función de indicaciones clínicas. Uno de los objetivos principales del consenso de expertos fue la unificación de la estrategia para el procedimiento y la realización de los estudios de imagen en pacientes con DFM.
Diagnóstico de la displasia fibromuscular
El diagnóstico de la DFM se basa en los resultados de las pruebas de imagen, donde se reconocen cambios focales y multifocales típicos de la DFM, además de complicaciones vasculares relacionadas con la DFM, tales como disecciones, aneurismas y tortuosidad arterial.
Diagnóstico diferencial
El conocimiento del cuadro clínico y del carácter de los cambios displásicos, además de una correcta interpretación de resultados de los estudios de imagen y clínicos de los enfermos con DFM son fundamentales para diferenciar la DFM de otras enfermedades arteriales.
El diagnóstico diferencial de la DFM es amplio y comprende muchas otras enfermedades arteriales, como arteritis (enfermedad de Taykasu, arteritis de células gigantes), síndrome de Dunbar, síndrome de Williams, síndrome de Alagille, neurofibromatosis tipo 1, además de artefactos de imagen o vasoespasmo durante el examen.
Localizaciones de la DFM: características individuales
DFM de las arterias renales
No se ha determinado con exactitud la prevalencia de los cambios de la DFM en las arterias renales de la población general, y los datos de los grandes registros de pacientes comprenden un grupo seleccionado: sobre todo, pacientes sintomáticos con DFM de arterias renales. Sobre la base de los exámenes realizados en donantes de riñón, la prevalencia de DFM de arterias renales es de un 3-4 %. La prevalencia de los cambios displásicos en los enfermos con hipertensión renovascular que participaron en el ensayo CORAL fue de un 5,8 %.
Cabe destacar que se han observado diferencias fenotípicas entre pacientes con DFM focal y multifocal de las arterias renales. Los pacientes con DFM multifocal son en su mayoría mujeres de mediana edad con hipertensión arterial. En el caso de la DFM focal: se diagnostica generalmente antes de los 30 años de edad; los pacientes suelen tener una presión arterial elevada; y el porcentaje de los hombres es superior en comparación con la DFM multifocal.
La DFM prevalece en las arterias renales (86,4 % y 91 % en los registros europeo y estadounidense, respectivamente). La hipertensión arterial es el síntoma más común de DFM de las arterias renales. Se deben considerar los estudios de imagen de las arterias renales si aparecen síntomas específicos de DFM de las arterias renales (hipertensión arterial a edad temprana, hipertensión arterial grave de carácter fulminante, hipertensión arterial difícil de tratar, soplo en mesogastrio, un riñón pequeno, aneurisma/disección de la arteria renal, DFM en otro lecho vascular). El examen de elección para pacientes con sospecha de DFM de las arterias renales es la angio-TC. Solo en caso de contraindicaciones se debe realizar una angio-RMN. Por su parte, la ecografía Doppler de arterias renales debe considerarse como examen de elección únicamente en los centros especializados que cuentan con gran experiencia en su realización.
Cabe recordar que la sola aparición de aneurisma, disección o tortuosidad arterial sin otros cambios no legitima el diagnóstico de la DFM.
DFM de arterias carótidas, vertebrales e intracraneales
La prevalencia de cambios displásicos en las arterias carótidas, vertebrales e intracraneales ha sido, hasta el momento, subestimada. Los datos del registro americano demuestran que la prevalencia de DFM de arterias carótidas e intracraneales puede alcanzar al 89 % de pacientes en los que se realizó la ATC de estos lechos vasculares. Sin embargo, cabe destacar que la prevalencia de cambios en arterias carótidas e intracraneales fue menor tanto en el ensayo francés ARCADIA como en el polaco ARCADIA-POL, donde se realizaron en todos los enfermos exámenes sistemáticos de todos los lechos vasculares, independientemente de los síntomas.
La manifestación clínica de los cambios de DFM de las arterias extracraneales es variada y no específica. No existen datos concluyentes acerca del predominio de una prueba de imagen en enfermos con sospecha de DFM de arterias extracraneales e intracraneales. En la mayoría de los centros se realiza una angio-TC o angio-RMN de arterias extracraneales e intracraneales.
En los centros especializados con una gran experiencia en la realización de la ecografía Doppler de arterias carótidas, dicho examen puede realizarse para la evaluación preliminar de los pacientes con respecto a la presencia de cambios en esta localización. Es necesario resaltar que este método no sirve para evaluar la presencia de cambios de DFM en los segmentos distales de las arterias carótidas, vertebrales e intracraneales.
Se aconseja la realización de angio-TC (o angio-RMN) de arterias cerebrales en todos los enfermos con DFM, independientemente de la localización de los cambios displásicos, para descartar la presencia de aneurismas cerebrales no diagnosticados. No existen datos que permitan determinar si en un enfermo con DFM sin aneurisma intracraneal diagnosticado es necesario repetir un estudio de imagen durante la observación posterior.
DFM en otras localizaciones
Los cambios displásicos se presentan con más frecuencia en las arterias renales, carótidas y extracraneales, pero pueden presentarse en cualquier otra arteria. Los datos de los registros en cuestión demuestran que la DFM en el lecho visceral se localiza con más frecuencia en el tronco celíaco y las arterias: mesentérica superior, mesentérica inferior, hepática común y esplénica. En cuanto a las arterias de las extremidades, se suele diagnosticar DFM en arterias ilíacas externas, y con poca frecuencia en arterias femorales, poplíteas y peroneas (arterias de las extremidades inferiores) y en arteria braquial, radial y cubital (arterias de las extremidades superiores). El diagnóstico de DFM en los demás lechos vasculares, de modo similar que en las arterias renales, carótidas e intracraneales, se basa en estudios de imagen, siendo angio-TC el estudio de primera elección.
La DFM tiene carácter de arteriopatía generalizada. En todos los enfermos, independientemente de la localización inicial de los cambios displásicos, se debe realizar al menos una vez en la vida un estudio de imagen de todo el lecho vascular mediante la angio-TC o angio-RMN a fin de buscar cambios de DFM en otras localizaciones, aneurismas y disecciones no diagnosticados.
Tratamiento de la displasia fibromuscular
Tratamiento farmacológico: terapia antiagregante
Aunque no se han realizado ensayos clínicos prospectivos del tratamiento farmacológico en la DFM, los integrantes del grupo de opinión subrayan los beneficios de uso de los medicamentos antiagregantes, sobre todo el ácido acetilsalicílico (AAS) a dosis de 75-100 mg/d, para la prevención de complicaciones tromboembólicas en pacientes con DFM, y aconsejan el uso de dichos medicamentos en ausencia de contraindicaciones.
Tratamiento invasivo
La angiografía clásica de arterias renales sigue siendo el estándar de oro en el estudio de la localización y morfología de los cambios de la DFM. Sin embargo, se aconseja realizar esta prueba únicamente cuando sus resultados puedan influir en la actuación con el enfermo. Este es el caso, principalmente, de pacientes con sospecha de una importante estenosis de la arteria renal, basada en los resultados de exámenes no invasivos.
Para examinar la importancia de la estenosis, sobre todo en enfermos con DFM multifocal de arterias renales, se aconseja la medida de gradiente translesional (diferencia de presión a ambos lados de la estenosis) durante la angiografía para confirmar que el enfermo presenta una estenosis importante y hacer una verificación final de que es apto para la angioplastia. También se aconseja realizar la medida de este gradiente inmediatamente después de la angioplastia, tanto de los cambios focales como multifocales en arterias renales, para confirmar la eficacia del examen realizado.
Observación posterior al tratamiento
Un enfermo con DFM después de una angioplastia de la arteria renal debería permanecer bajo estricta vigilancia. Se aconseja la administración de AAS en la dosis de 75-100 mg/d por tiempo ilimitado. Algunos expertos aconsejan continuar con la terapia antiagregante (AAS con clopidogrel con la dosis de 75 mg/d) durante 4-6 semanas después del procedimiento. También hay que tener en cuenta que inmediatamente después del procedimiento de angioplastia de la arteria renal, por una importante estenosis debida a la DFM, puede tener lugar una fuerte disminución de la presión arterial. Por esta razón, se debe modificar adecuadamente el tratamiento hipotensor.
Además, se aconseja la realización de una ecografía Doppler de las arterias renales al mes del procedimiento, luego de forma semestral durante 2 años y posteriormente de forma anual. En caso de síntomas que puedan sugerir la recurrencia de la estenosis de la arteria renal (rápida pérdida de control de la presión arterial, deterioro de la función renal), se aconseja la realización de dicho examen sin importar el tiempo transcurrido desde el último procedimiento.
Situaciones especiales
Disección espontánea de la arteria carótida
La actuación en enfermos con disección espontánea de la arteria carótida (SCeAD) y DFM no es distinta de la actuación con enfermos con SCeAD sin cambios displásicos. En las recientes guías americanas se aconseja proceder con el tratamiento anticoagulante o antiagregante durante un mínimo de tres meses en todos los enfermos con SCeAD que hayan sufrido un episodio isquémico de sistema nervioso central en forma de accidente isquémico transitorio (AIT) o ACV. El tratamiento durante la fase aguda del ACV causado por SCeAD no es diferente al tratamiento de ACV causado por otros factores. Parece que se puede realizar tanto la fibrinólisis como la tromboectomía, pero no hay datos que apoyen los beneficios de la aplicación de esta terapia en los enfermos con SCeAD. En algunas situaciones clínicas, como el cierre completo de la arteria carótida en SCeAD, es posible proceder con el tratamiento endovascular.
Pacientes con DFM y aneurisma intracraneal
En la población general, el riesgo de ruptura de aneurisma intracraneal es inferior al 1 %. Por el momento no se ha determinado si este riesgo aumenta en pacientes con DFM y aneurisma de las arterias cerebrales. El procedimiento de actuación en enfermos con aneurisma intracraneal y DFM debe ser igual al de los pacientes con aneurisma intracraneal sin DFM. Se debe tomar la decisión sobre el tratamiento intervencionista de aneurisma (intravascular o quirúrgico) teniendo en cuenta la expectativa de vida, el riesgo de ruptura del aneurisma, el riesgo de complicaciones derivadas de la intervención y las preferencias del paciente. El riesgo de ruptura del aneurisma depende de factores relacionados con el mismo aneurisma (cantidad de aneurismas, tamano, tipo, localización) y las características clínicas del enfermo (hipertensión arterial, tabaquismo, abuso de alcohol, episodio previo de ruptura de aneurisma).
La decisión sobre el método de tratamiento —intravascular o quirúrgico— depende de factores anatómicos, de la evaluación del neurorradiólogo y el neurocirujano, y de las preferencias del enfermo. Los enfermos con DFM con aneurisma intracraneal no aptos para el tratamiento intervencionista deberían permanecer bajo observación en un centro especializado a fin de controlar el posible crecimiento del aneurisma. Sin embargo, no se ha especificado la frecuencia de las visitas de control en estos enfermos.
Disección espontánea de la arteria coronaria
SCAD es una causa muy poco frecuente de síndromes coronarios agudos en mujeres jóvenes sin factores de riesgo cardiovascular. En el registro americano, SCAD fue la causa del 24 % de los casos de infarto agudo de miocardio en mujeres con DFM menores de 50 años de edad, con una prevalencia de SCAD en la población general de un 3 %.
El síndrome coronario agudo en el desarrollo de SCAD en enfermos con DFM se refiere a la arteria descendente anterior izquierda de la arteria coronaria. En los exámenes histológicos de pacientes fallecidos por muerte cardíaca súbita se detectaron cambios no solo en las principales ramas de la arteria coronaria izquierda y derecha, sino también en las arterias marginales que abastecen a los atrios y ventrículos. En el registro americano, casi 1/5 de enfermos con DFM tenía antecedentes de muerte cardíaca súbita entre los parientes de primer o segundo grado. En 2011, Saw y cols., (autores del registro más grande de enfermos con SCAD a escala mundial) documentaron una estrecha relación entre los cambios de DFM y SCAD. Los cambios de DFM se observaron en un 72-86 % de los incluidos en el registro de pacientes con SCAD.
El diagnóstico de SCAD puede determinarse mediante una coronariografía clásica. Si la imagen angiográfica es ambigua, serán de utilidad las técnicas de imagen intravascular (p. ej. tomografía de coherencia óptica [TCO]). Los resultados del tratamiento intervencionista en pacientes con SCAD son peores que en enfermos con cambios en las arterias coronarias de origen ateroesclerótico. Se observa una mayor frecuencia de complicaciones relacionadas con intervenciones coronarias percutáneas: expansión yatrogénica de la disección e introducción de catéter en un falso canal. Asimismo, la intervención quirúrgica de derivación vascular en enfermos con SCAD conduce a peores resultados que el tratamiento quirúrgico de una enfermedad coronaria de origen ateroesclerótico: a menudo conlleva el cierre de derivaciones a causa de la recanalización de las arterias afectadas por SCAD.
Los autores del citado grupo de opinión afirman que el tratamiento farmacológico es preferible para enfermos con SCAD. Al igual que en SCeAD, la mayoría de los casos de SCAD termina con la recanalización y recuperación en el plazo de 3-6 meses desde el incidente. Sin embargo, el pronóstico para los enfermos con SCAD es grave debido a un alto porcentaje de reincidecias.
Los datos relacionados con una farmacoterapia óptima para enfermos con SCAD son limitados. Se indica el papel de los ß-bloqueantes y el control óptimo de la presión arterial de los enfermos para prevenir las reincidencias de los incidentes coronarios.
Asistencia de larga duración a enfermos con DFM
La DFM es una enfermedad arterial crónica y generalizada, por lo cual la asistencia a enfermos debe ser de larga duración, con especial énfasis en la vigilancia de la progresión de la enfermedad mediante estudios de imagen. Tras una compleja evaluación preliminar del enfermo, relativa a la coexistencia de los cambios de DFM en distintos lechos vasculares y a las complicaciones vasculares, es recomendable repetir la evaluación en un centro especializado al menos una vez al año. Los enfermos con agudización de síntomas o cambios vasculares avanzados deben examinarse con más frecuencia.
Durante una visita de control, se debe someter a un enfermo con DFM a una evaluación clínica detallada, basada en la anamnesis y exploración física, incluido el nivel de control de la presión arterial. También es necesaria una evaluación de la función renal y concentración de los electrólitos séricos. Se debe adaptar el tipo de estudio de imagen al cuadro clínico del enfermo con DFM, teniendo en cuenta la intensidad y localización de los cambios displásicos, presencia de aneurismas y/o disecciones y previos tratamientos intervencionistas.
Las mujeres en edad reproductiva que padecen DFM y planean un embarazo deben permanecer bajo una estricta asistencia médica, tanto de un especialista en materia de DFM, como de un ginecólogo obstetra. El control del embarazo en una mujer con DFM, sobre todo con un SCeAD o antecedentes de SCAD, debe llevarse a cabo en un centro altamente especializado. El parto —incluyendo la cesárea o la segunda fase del trabajo del parto vaginal facilitada— se debe planificar de manera individual, teniendo en cuenta las disecciones previas o los aneurismas coexistentes. A pesar de los datos limitados, se postula que las embarazadas con DFM de las arterias renales pueden estar sometidas a un elevado riesgo de preeclampsia.
A recordar
Definición
• La DFM es una enfermedad idiopática, segmentaria, no ateroesclerótica y no inflamatoria de la musculatura de la pared de las arterias de pequeño y mediano tamaño, que provoca la estenosis de las mismas.
• Los cambios de DFM deben clasificarse, según la imagen angiográfica, en focales y multifocales.
• La sola aparición de un aneurisma, disección o tortuosidad arterial sin otros cambios no legitima el diagnóstico de DFM. La presencia de aneurisma, disección o tortuosidad arterial sin otros cambios no apoya el diagnóstico de DFM. Sin embargo, si en un enfermo con DFM focal o multifocal se detecta la presencia de aneurisma, disección o tortuosidad en por lo menos un lecho arterial distinto, se debe diagnosticar una DFM de niveles múltiples.
Diagnóstico
• No se aconsejan exámenes genéticos en parientes asintomáticos de los enfermos con DFM. En parientes sintomáticos de los enfermos con DFM se aconseja realizar estudios de imagen para buscar cambios displásicos.
• Se deben considerar los estudios de imagen de las arterias renales si aparecen síntomas específicos de DFM de las arterias renales (hipertensión arterial a edad temprana, hipertensión arterial grave de carácter fulminante, hipertensión arterial resistente a tratamiento, soplo en mesogastrio, un riñón pequeño, aneurisma/disección de arteria renal, DFM en otro lecho vascular).
• La prueba de elección para enfermos con sospecha de DFM de arterias renales es la angio-TC y, en caso de contraindicaciones, la angio-RMN. La ecografía Doppler de arterias renales debe considerarse como prueba de elección únicamente en los centros especializados.
• En todos los enfermos, independientemente de la localización inicial de los cambios displásicos, se debe realizar, al menos una vez en la vida, un estudio de imagen de todo el lecho vascular mediante una angio-TC o angio-RMN.
• Se debe realizar una angio-TC o angio-RMN de todo el cuerpo en los enfermos con SCAD en su historial médico.
Tratamiento
• Se debe administrar un medicamento antiagregante (p. ej. AAS 75-100 mg/d) en enfermos con DFM.
• La angiografía de las arterias renales se realiza generalmente en los enfermos con sospecha de una importante estenosis de la arteria renal, fundada en los resultados de exámenes no invasivos Para analizar la importancia de la estenosis, sobre todo en los enfermos con DFM multifocal de arterias renales, se aconseja la medida de gradiente translesional durante la angiografía.
• Un enfermo con DFM después de una angioplastia de la arteria renal debería permanecer bajo estricta vigilancia: se aconseja realizar una ecografía Doppler de las arterias renales un mes después del procedimiento, luego cada 6 meses durante 2 años y, posteriormente, una vez al año. En caso de síntomas que puedan sugerir recurrencia de la estenosis de la arteria renal (rápida pérdida de control de la presión arterial, deterioro de la función renal), se aconseja la realización de dicho examen sin importar el tiempo transcurrido desde el último procedimiento.
• El procedimiento de actuación en enfermos con SCeAD y DFM no es distinto del de enfermos con SCeAD sin DFM. Se aconseja proceder con el tratamiento con antiagregante durante un mínimo de 3-6 meses en todos los enfermos que sufrieron un SCeAD, aunque se recomienda su continuidad a largo plazo.
Observación a largo plazo
• Los enfermos con DFM deben permanecer bajo observación a largo plazo (visitas de control ≥1 vez al año). En el marco de las visitas de control, se debe realizar una evaluación clínica, una evaluación de la función renal (sobre todo en enfermos con DFM de las arterias renales) y estudios de imagen. El tiempo exacto de realización y el tipo de estudio de imagen debe adaptarse a cada enfermo de manera individual, sobre la base del cuadro clínico, incluida la necesidad de observación de aneurismas y disecciones, así como de los resultados del tratamiento intervencionista y la experiencia y posibilidades del centro.
Bibliografía:
1. Bofinger A., Hawley C., Fisher P. i wsp.: Polymorphisms of the renin-angiotensin system in patients with multifocal renal arterial fibromuscular dysplasia. J. Hum. Hypertens., 2001; 15: 185–1902. Dobrowolski P., Januszewicz M., Witowicz H. i wsp.: Prevalence of smoking and clinical characteristics in fibromuscular dysplasia. The ARCADIA-POL study. Blood Press, 2019; 28: 49–56
3. Ganesh S.K., Morissette R., Xu Z. i wsp.: Clinical and biochemical profiles suggest fibromuscular dysplasia is a systemic disease with altered TGF-ß expression and connective tissue features. FASEB J., 2014; 28: 3313–3324
4. Giavarini A., Savard S., Sapoval M. i wsp.: Clinical management of renal artery fibromuscular dysplasia: temporal trends and outcomes. J. Hypertens., 2014; 32: 2433–2438; discussion 2438
5. Goncharenko V., Gerlock A.J. Jr, Shaff M.I. i wsp.: Progression of renal artery fibromuscular dysplasia in 42 patients as seen on angiography. Radiology, 1981; 139: 45–51
6. Gornik H.L., Persu A., Adlam D. i wsp.: First International Consensus on the diagnosis and management of fibromuscular dysplasia. Vasc. Med., 2019; 24: 164–189
7. Gornik H.L., Persu A., Adlam D. i wsp.: First international consensus on the diagnosis and management of fibromuscular dysplasia. J. Hypertens., 2019; 37: 229–252
8. Green R., Gu X., Kline-Rogers E. i wsp.: Differences between the pediatric and adult presentation of fibromuscular dysplasia: results from the US Registry. Pediatr. Nephrol., 2016; 31: 641–650
9. Kadian-Dodov D., Gornik H.L., Gu X. i wsp.: Dissection and aneurysm in patients with fibromuscular dysplasia: findings from the U.S. Registry for FMD. J. Am. Coll. Cardiol., 2016; 68: 176–185
10. Kiando S.R., Barlassina C., Cusi D. i wsp.: Exome sequencing in seven families and gene-based association studies indicate genetic heterogeneity and suggest possible candidates for fibromuscular dysplasia. J. Hypertens., 2015; 33: 1802–1810; discussion 1810
11. Kim E.S., Olin J.W., Froehlich J.B. i wsp.: Clinical manifestations of fibromuscular dysplasia vary by patient sex: a report of the United States Registry for Fibromuscular Dysplasia. J. Am. Coll. Cardiol., 2013; 62: 2026–2028
12. Lather H.D., Gornik H.L., Olin J.W. i wsp.: Prevalence of intracranial aneurysm in women with fibromuscular dysplasia: a report from the US Registry for Fibromuscular Dysplasia. JAMA Neurol., 2017; 74: 1081–1089
13. O’Connor S., Gornik H.L., Froehlich J.B. i wsp.: Smoking and adverse outcomes in fibromuscular dysplasia: U.S. Registry Report. J. Am. Coll. Cardiol., 2016; 67: 1750–1751
14. Olin J.W.: Expanding clinical phenotype of fibromuscular dysplasia. Hypertension, 2017; 17: 488–489
15. Olin J.W.: Is fibromuscular dysplasia a single disease? Circulation, 2012; 126: 2925–2927
16. Olin J.W., Froehlich J., Gu X. i wsp.: The United States Registry for Fibromuscular Dysplasia: results in the first 447 patients. Circulation, 2012; 125: 3182–3190
17. Olin J.W., Gornik H.L., Bacharach J.M. i wsp.: Fibromuscular dysplasia: state of the science and critical unanswered questions: a scientific statement from the American Heart Association. Circulation, 2014; 129: 1048–1078
18. Olin J.W., Kadian-Dodov D.: Fibromuscular dysplasia: looking beyond the “string of beads”. JACC Cardiovasc. Imaging, 2017; 10: 562–564
19. Pannier-Moreau I., Grimbert P., Fiquet-Kempf B. i wsp.: Possible familial origin of multifocal renal artery fibromuscular dysplasia. J. Hypertens., 1997; 15: 1797–1801
20. Pasquini M., Trystram D., Nokam G. i wsp.: Fibromuscular dysplasia of cervicocephalic arteries: prevalence of multisite involvement and prognosis. Rev. Neurol. (Paris), 2015; 171: 616–623
21. Persu A., Giavarini A., Touzé E. i wsp.: European consensus on the diagnosis and management of fibromuscular dysplasia. J. Hypertens., 2014; 32: 1367–1378
22. Persu A., Van der Niepen P., Touzé E. i wsp.: Revisiting fibromuscular dysplasia: rationale of the European Fibromuscular Dysplasia Initiative. Hypertension, 2016; 68: 832–839
23. Plouin P.F., Baguet J.P., Thony F. i wsp.: High prevalence of multiple arterial bed lesions in patients with fibromuscular dysplasia: The ARCADIA Registry (Assessment of Renal and Cervical Artery Dysplasia). Hypertension, 2017; 70: 652–658
24. Plouin P.F., Perdu J., La Batide-Alanore A. i wsp.: Fibromuscular dysplasia. Orphanet J. Rare Dis., 2007; 2: 28
25. Sang C.N., Whelton P.K., Hamper U.M. i wsp.: Etiologic factors in renovascular fibromuscular dysplasia. A case-control study. Hypertension, 1989; 14: 472–479
26. Savard S., Azarine A., Jeunemaitre X. i wsp.: Association of smoking with phenotype at diagnosis and vascular interventions in patients with renal artery fibromuscular dysplasia. Hypertension, 2013; 61: 1227–1232
27. Savard S., Steichen O., Azarine A. i wsp.: Association between 2 angiographic subtypes of renal artery fibromuscular dysplasia and clinical characteristics. Circulation, 2012; 126: 3062–3069
28. Saw J., Aymong E., Sedlak T. i wsp.: Spontaneous coronary artery dissection: association with predisposing arteriopathies and precipitating stressors and cardiovascular outcomes. Circ. Cardiovasc. Interv., 2014; 7: 645–655
29. Saw J., Mancini G.B., Humphries K. i wsp.: Angiographic appearance of spontaneous coronary artery dissection with intramural hematoma proven on intracoronary imaging. Catheter. Cardiovasc. Interv., 2016; 87: E54–E61
30. Saw J., Starovoytov A., Humphries K. i wsp.: Canadian spontaneous coronary artery dissection cohort study: in-hospital and 30-day outcomes. Eur. Heart J., 2019; 40: 1188–1197
31. Sethi S.S., Lau J.F., Godbold J. i wsp.: The S curve: a novel morphological finding in the internal carotid artery in patients with fibromuscular dysplasia. Vasc. Med., 2014; 19: 356–362
32. Shivapour D.M., Erwin P., Kim E.Sh.: Epidemiology of fibromuscular dysplasia: a review of the literature. Vasc. Med., 2016; 21: 376–381
33. Silhol F., Sarlon-Bartoli G., Daniel L. i wsp.: Intranuclear expression of progesterone receptors in smooth muscle cells of renovascular fibromuscular dysplasia: a pilot study. Ann. Vasc. Surg., 2015; 29: 830–835
34. Stanley J.C., Fry W.J.: Renovascular hypertension secondary to arterial fibrodysplasia in adults: criteria for operation and results of surgical therapy. Arch. Surg., 1975; 110: 922–928
35. Stanley J.C., Gewertz B.L., Bove E.L. i wsp.: Arterial fibrodysplasia. Histopathologic character and current etiologic concepts. Arch. Surg., 1975; 110: 561–566
36. Talarowska P., Dobrowolski P., Klisiewicz A. i wsp.: High incidence and clinical characteristics of fibromuscular dysplasia in patients with spontaneous cervical artery dissection: The ARCADIA-POL study. Vasc. Med., 2019; 24: 112–119
37. Tanaka H., Zaima N., Sasaki T. i wsp.: Characteristic Distribution Pattern of Lysophosphatidylcholine in Fibromuscular Dysplasia-Associated Visceral Artery Aneurysms Compared with Atherosclerotic Visceral Artery Aneurysms. J. Atheroscler. Thromb., 2016; 23: 673–680 38. Touzé E., Oppenheim C., Trystram D. i wsp.: Fibromuscular dysplasia of cervical and intracranial arteries. Int. J. Stroke, 2010; 5: 296–305 39. Van der Niepen P., van Tussenbroek F., Devos H. i wsp.: Visceral Fibromuscular Dysplasia: From asymptomatic disorder to emergency. Eur. J. Clin. Invest., 2018; 48: e13 023 40. Vance C.J., Taylor R.N., Craven T.E. i wsp.: Increased prevalence of preeclampsia among women undergoing procedural intervention for renal artery fibromuscular dysplasia. Ann. Vasc. Surg., 2015; 29: 1105–1110\\knot\teksty_mp\03_MP miesiecznik\1-MP-2019\!!19–09\korekty\do skladu\Dysplazja_stanowisko_do skladu.docx
 Español
Español
 English
English
 українська
українська




