Siglas y abreviaturas: ACV — accidente cerebrovascular, HBPM — heparina de bajo peso molecular, TC — tomografía computarizada
Descripción del caso clínico
Una mujer de 35 años con insuficiencia cardíaca crónica con fracción de eyección del ventrículo izquierdo preservada, debida a la miocardiopatía restrictiva, fue hospitalizada por la descompensación ventricular derecha y derivada a otro hospital por accidente cerebrovascular (ACV) isquémico reciente.
Durante el examen neurológico realizado al ingreso la enferma estaba consciente, pero no respondía a las preguntas; se observó la afasia global, hemianopsia (derecha), parálisis de la extremidad superior derecha y paresia de la extremidad inferior derecha de alto grado.
La enferma no refirió disnea en reposo. Al inicio no se levantaba ni realizaba por su cuenta ninguna actividad. En la exploración física llamaron la atención edemas de las extremidades inferiores que llegaban hasta el 2/3 de las piernas, ingurgitación excesiva de las venas yugulares, signo de Kussmaul y hepatomegalia.
En las pruebas de laboratorio realizadas al ingreso se observaron las siguientes anomalías: trombocitopenia (recuento de plaquetas 78 mil/μl [se descartó la pseudotrombocitopenia]), INR espontáneo (es decir, sin tratamiento anticoagulante) 1,8, actividad de la alanina‑aminotransferasa (ALT) 1370 uds./l y de la aspartato‑aminotransferasa (AST) 728 uds./l, niveles de la fracción N‑terminal del propéptido natriurético tipo B 2321 pg/ml.
En el ECG realizado al ingreso se observó el ritmo sinusal regular de 58/min, eje cardíaco normal, intervalo PR de 240 ms, QRS de 100 ms, intervalo QT de 440 ms, depresiones difusas del segmento ST en varias derivaciones: II, III, aVF y V3‑V6 (hasta –2 mm), y adicionalmente la elevación del segmento ST de 1 mm en la derivación aVR y de 0,5 mm en V1 (fig. 1). Además, llamaron la atención las ondas P gigantes (3,5 mm en la derivación II, 2 mm en la derivación III, y 2,5 mm en la derivación aVF, y además onda P bifásica muy alta en las derivaciones: V1 (4 mm en fase positiva, 1,5 mm en fase negativa) y V2 (3 mm en fase positiva, 1 mm en fase negativa).
Durante el registro de ECG con el método de Holter de 24 h no se observaron importantes arritmias supraventriculares ni ventriculares. La frecuencia cardíaca media fue de 65/min, con el valor mínimo de 56/min y máximo de 75/min. Se registraron 11 extrasístoles ventriculares y 256 supraventriculares aisladas.
Debido a los trastornos de la coagulación, la paciente no fue apta para recibir el tratamiento trombolítico. Se realizó la trombectomía mecánica urgente. Se eliminó el trombo del segmento distal de la arteria carótida interna izquierda, logrando la reperfusión del hemisferio cerebral izquierdo. El mismo día se presentaron manifestaciones de isquemia de la extremidad inferior derecha, por lo que tuvo que realizarse la embolectomía arterial de la misma.
En los siguientes días tras la trombectomía el estado de la paciente mejoró, las manifestaciones neurológicas se resolvieron y la mujer recuperó la capacidad funcional.
En la ecocardiografía transtorácica se observó un aumento importante de tamaño de las aurículas, con marcado ecocontraste espontáneo (fig. 2), ventrículo izquierdo de tamaño normal con paredes no engrosadas y función sistólica preservada, y flujo mitral restrictivo. Para determinar las causas de ACV, se realizó la ecocardiografía transesofágica, que permitió descartar la presencia de comunicación interauricular, pero que reveló un eco adicional y móvil en la aurícula izquierda. Debido a la presencia de ecocontraste espontáneo importante, se planteó la hipótesis de la presencia de trombo. Por esta razón, a pesar de que la tomografía computarizada (TC) objetivó un pequeño foco hemorrágico en las estructuras profundas del hemisferio izquierdo, se asoció la heparina de bajo peso molecular (HBPM) a dosis terapéuticas. A pesar de haber escalado las dosis, la actividad de anti‑Xa siguió siendo no determinable. También llamó la atención la disminución importante de la antitrombina III (48 %, con el límite inferior de la normalidad del 75 %). Por esta razón se sospechó el déficit congénito de la antitrombina III, y después de una consulta multidisciplinaria se cambió HBPM por dabigatrán a dosis de 150 mg 2 × d, considerando que el riesgo de hemorragia intracerebral secundaria es menor que el riesgo trombótico. En la TC de la cabeza de control, realizada el 7.º día desde el inicio de la anticoagulación oral se constató una evolución normal (hemólisis) del hematoma intracraneal previamente observado. Además, se amplió el diagnóstico cardiológico realizando la resonancia magnética de corazón, en la cual no se observaron estructuras patológicas adicionales. En la ecocardiografía transesofágica de control en la aurícula izquierda no se observó el eco adicional anteriormente descrito, lo que confirmó el diagnóstico preliminar de trombo, el cual se disolvió con el tratamiento aplicado. La enferma fue dada de alta, con la recomendación de tomar dabigatrán 150 mg 2 × d y un diurético (torasemida 20 mg 1 × d). También se programó una hospitalización para clasificarla al trasplante cardíaco.
Comentario
Las ondas P altas y puntiagudas (>5 mm, en la derivación II, III, aVF o V1), en inglés reciben la denominación de Himalayan P waves, y se deben a la conducción prolongada del impulso eléctrico por la dilatación de la aurícula derecha. Típicamente, se presentan en cardiopatías congénitas, tales como: anomalía de Ebstein, atresia tricúspide o coexistencia de las estenosis tricúspide y pulmonar, en las cuales la presión elevada en la aurícula derecha conduce a su dilatación.1 Las ondas P gigantes pueden presentarse de manera temporal en los pacientes con exacerbación de la enfermedad pulmonar obstructiva crónica, como consecuencia de la hipoxia grave de la aurícula derecha (directamente asociada al broncoespasmo) y de la posición baja del diafragma por enfisema prolongado.2 Las ondas P gigantes también pueden observarse en los enfermos con miocardiopatía hipertrófica, isquémica y restrictiva.3,4 En el caso presentado, la dilatación de las aurículas en el ECG, que cumplía con los criterios de ondas P gigantes en la derivación V1 (fase positiva y negativa de la onda P de >5 mm), guardó una estricta relación con los resultados de las pruebas de imagen. Sin embargo, en este caso los factores que con más probabilidad condujeron a las complicaciones embólicas graves fueron los trastornos de la coagulación y no las arritmias auriculares.
Las depresiones importantes del segmento ST que imitan la isquemia, al igual que en el ECG presentado, se describieron en unos pocos casos de miocardiopatía restrictiva idiopática.5,6 Estos cambios se deben probablemente a la presión telediastólica alta en las cavidades cardíacas, que altera el flujo coronario en la zona subendocárdica y conduce a las alteraciones en el período refractario, secundarias a la isquemia.
Las anomalías en la exploración física y en las pruebas de laboratorio se debían a la congestión venosa y hepatomegalia, es decir, a las manifestaciones típicas de exacerbaciones de la descompensación ventricular derecha en pacientes con miocardiopatía restrictiva.
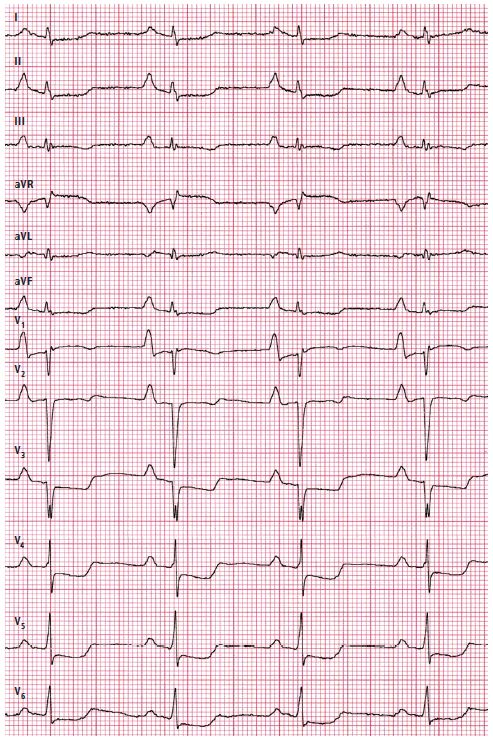
Fig. 1. ECG en reposo realizado al ingreso. Descripción en el texto
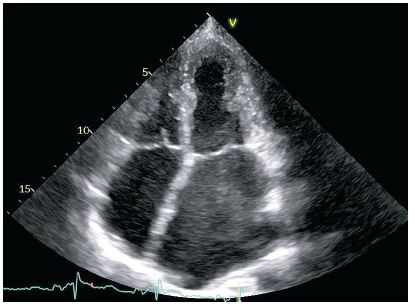
Fig. 2. Ecocardiograma transtorácico, proyección apical de cuatro cámaras. Descripción en el texto
Bibliografía
- Vlismas P.P., Jorde U.P., Sims D.B., Himalayan P waves, Alpine A waves, Circ. Heart Fail., 2019; 12: e006 235
- Vijayakrishnan R., Spodick D.H., Himalayan P waves in the setting of severe hypoxemia and emphysema, Can. J. Cardiol., 2010; 26: 136
- Stöllberger C., Avanzini M., Siostrzonek P. y cols., Familial Himalayan p wave and left ventricular hypertrabeculation/noncompaction, Ann. Noninvasive Electrocardiol., 2015; 20: 181‑186
- Sinha S.K., Verma C.M., Gupta G., Mittal P., Case images: Himalayan P waves in a patient with ischemic cardiomyopathy – a new entity, Turk. Kardiyol. Dern. Ars, 2014; 42: 315
- Selvaganesh M., Arul A.S., Balasubramanian S. y cols., An unusual ECG pattern in restrictive cardiomyopathy, Indian Heart J., 2015; 67: 362‑367
- Rivenes S.M., Kearney D.L., Smith E.O. y cols., Sudden death and cardiovascular collapse in children with restrictive cardiomyopathy, Circulation, 2000; 102: 876‑882
 Español
Español
 English
English
 українська
українська




