Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертву
На сьогодні великі сподівання покладаються на те, що ремдесивір, противірусний лікарський засіб (ЛЗ), який первинно розроблявся для лікування хворих на геморагічну лихоманку Ебола, виявиться ефективною та безпечною етіотропною терапією COVID-19. Він був активним проти коронавірусів SARS та MERS in vitro (в культурі клітин) та в дослідженнях на тваринних моделях. Дослідження in vitro також підтвердили його інгібіторну активність щодо SARS-CoV-2, а механізм цієї дії — блокування вірусної РНК-полімерази (див. нижче).
Як повідомляє на своєму веб-сайті Gilead Sciences, суб’єкт, відповідальний за розробку та дослідження цього ЛЗ, в даний час в усьому світі проводиться 6 рандомізованих клінічних досліджень щодо застосування ремдесивіру у хворих із середньо-тяжким або тяжким перебігом COVID-19. Оскільки не всі хворі можуть брати участь у цих дослідженнях, як виробник ЛЗ, так і компетентні адміністративні органи окремих країн вживають заходів, щоб дозволити застосування ремдесивіру в рамах процедури „застосування з міркувань гуманності” (compassionate use).
У відповідь на запит чотирьох країн Європейського Союзу (ЄС), що датований наприкінці березня цього року, Комітет з лікарських засобів для застосування людиною (CHMP — Committee for Medicinal Products for Human Use), який займається науковою оцінкою ЛЗ від імені EMA (European Medicines Agency — Європейське агентство з лікарських засобів), видав 2 квітня цього року рекомендації щодо умов застосування ремдесивіру при лікуванні пацієнтів із COVID-19 у рамах процедури „застосування з міркувань гуманності” (compassionate use) в країнах-членах ЄС.
Ця процедура дозволяє застосувати у пацієнта ЛЗ — з дотриманням відповідних умов — що ще не був введений в обіг. Правові та загальні рамки цієї процедури становить ст. 83 Положення № 726/2004 Європарламенту та Ради Європи. Відповідно до неї, ЛЗ, який повинен застосовуватися у рамах цієї процедури, повинен бути на етапі клінічних досліджень або очікування на дозвіл введення в обіг. На цьому етапі, хоча доклінічні дослідження та ранні фази клінічних досліджень по суті є завершеними, проте повний профіль безпеки та ефективності ЛЗ та оптимальний режим дозування ще можуть бути невідомі.
Такий ЛЗ в рамах процедури "застосування з міркувань гуманності" доступний лише для групи пацієнтів із загрозливою для життя, тривалою або вкрай виснажливою хворобою, у яких інші, вже зареєстровані ЛЗ, не можна застосувати або вони неефективні.
Відповідно до настанов EMA щодо процедури "застосування з міркувань гуманності", вона не може замінити обов'язкові для надійної оцінки ефективності та безпеки ЛЗ клінічні дослідження. Отже, в першу чергу слід спробувати залучити пацієнта у відповідне клінічне дослідження, а процедуру "застосування з міркувань гуманності" слід розглядати лише в тому випадку, якщо пройти відбір до такого дослідження було неможливо.
Рішення дозволити використання даного ЛЗ за цією процедурою приймається індивідуально кожною з держав-членів ЄС, яка, однак, повинна повідомити про це EMA. Агентство у відповідь на запит виробника чи відповідної країни видає через свій орган — CHMP — рекомендації щодо застосування, розповсюдження та показань до застосування ЛЗ за такою процедурою. Кожна країна-член ЄС повинна підготувати власну правову базу для функціонування процедури "застосування з міркувань гуманності", а потім врахувати всі доступні відгуки щодо конкретної терапії, яка має бути затверджена для використання в її рамах (оцінки, надані органами ЕМА, не є правовими положеннями) .
У кого можна застосовувати? Застосування ремдесивіру в рамах процедури "застосування з міркувань гуманності" може розглядатись у пацієнтів (діти віком ≥12 років з масою тіла ≥40 кг або дорослі), які потребують інвазивної ШВЛ через COVID-19 (лабораторно підтверджену результатом дослідження ПЛР, а також в разі очікування на його результат, але при підтвердженому контакті з особою, якій поставили діагноз COVID-19). Додатковими критеріями відбору є рШКФ ≥30 мл/хв та активність АЛТ, яка у ≤5 разів перевищує верхню межу норми. Безпека та ефективність лікування у дітей віком до 12 років не були встановлені. У зв'язку з відсутністю даних про застосування у вагітних жінок, застосування ремдесивіру в цій популяції не рекомендується.
Протипоказання: підвищена чутливість до будь-якого компонента препарату, поліорганна недостатність, використання >1-го вазопресорного ЛЗ при лікуванні септичного шоку (дозволяється давати ремдесивір пацієнтам, які отримують 1 вазопресорний ЛЗ у низькій або середній дозі у зв'язку з застосуванням седації чи міорелаксантів під час ШВЛ), ниркова недостатність (рШКФ <30 мл/хв), діалізна терапія або безперервна вено-венозна гемодіафільтрація, активність АЛТ, яка у >5 разів перевищує верхню межу норми, а також участь хворого у будь-якому клінічному дослідженні або експериментальному лікуванні COVID-19. Ремдесивір не слід застосовувати разом з іншими ЛЗ з доведеною гепатотоксичною дією.
Дозування, тривалість лікування, спосіб введення. ЛЗ слід застосовувати лише в умовах стаціонару. Ремдесивір доступний у формі порошку для приготування концентрату або у формі готового концентрату для приготування розчину для внутрішньовенної інфузії тривалістю від 30 до 120 хв. Рекомендована доза 200 мг у перший день терапії, а потім 100 мг/добу протягом 9 днів. Якщо виникає анафілактична реакція, інфузію слід негайно припинити, призначити відповідну терапію, а лікування ремдесивіром припинити.
Не потрібно коригувати дозу при легкій або помірній дисфункції нирок чи печінки, ані в осіб похилого віку.
Моніторинг лікування. Під час лікування ремдесивіром слід регулярно проводити відповідні лабораторні дослідження, включаючи біохімічні показники функції печінки. Також слід систематично контролювати рШКФ, особливо у пацієнтів, у яких порушення функції нирок виявлено ще до лікування ремдесивіром. При рШКФ <30 мл/хв слід розглянути питання про припинення застосування ЛЗ, а за пацієнтами слід ретельно спостерігати, поки рШКФ не повернеться до вихідного рівня або не буде встановлена причина такого погіршення цього показника.
Небажані ефекти, взаємодія ЛЗ та застереження щодо його застосування. Повний профіль безпеки ремдесивіру ще не вивчений, проте відомо про ризик гепатотоксичності, пов'язаний з його використанням. У дотепер проведених клінічних дослідженнях спостерігалось транзиторне підвищення АЛТ та АСТ (як після введення одноразової дози 225 мг ремдесивіру, так і після застосування 150 мг/добу протягом 14 днів) з супровідним слабко-вираженим, минущим подовженням ПЧ у деяких пацієнтів, але без клінічно значущого впливу на МНВ чи інших симптомів з боку печінки.
У досі проведених клінічних дослідженнях не виявлено симптомів нефротоксичності ремдесивіру, який було введено в одноразовій дозі 225 мг або який застосовувався в дозі 150 мг 1 ×/добу протягом 14 днів. Немає даних про проникнення ремдесивіру в грудне молоко та його вплив на фертильність у людей.
Хоча дослідження in vitro вказують на те, що ремдесивір є субстратом CYP2C8, CYP2D6 i CP3A4, досі не було проведено клінічних досліджень щодо взаємодії з іншими ЛЗ, зокрема з тими, що застосовуються при лікуванні COVID-19.
Ремдесивір (також відомий під назвою GS-5734) — це аналог аденозину з противірусною активністю. Є пролікарським засобом, який внутрішньоклітинно трансформується в сполуку під назвою GS-441524, яка швидко метаболізується з утворенням активного метаболіту — фармакологічно активного трифосфату (GS-443902; рис.). GS-443902 — структурний аналог АТФ, використовується вірусною РНК-полімеразою замість АТФ, що призводить до блокування її активності та передчасного закінчення синтезу ланцюга РНК, і, як наслідок, до загальмуваня вірусної реплікації.
У досі проведених дослідженнях in vitro (під час культивування клітин) або на тваринних моделях ремдесивір був активним щодо багатьох РНК-вмісних вірусів, зокрема з родин Coronaviridae (таких як SARS-CoV, MERS-CoV чи штами вірусів, що походять від кажанів, здатних заражати епітеліоцити дихальних шляхів людини), Paramyxoviridae (таких як віруси Ніпах, РСВ і Хендра) та Filoviridae (напр. віруси геморагічних лихоманок Ебола та Марбург). На сьогодні дані про активність ремдесивіру щодо SARS-CoV-2 обмежені до кількох спостережень in vitro та становлять результат екстраполяції результатів досліджень щодо схожих коронавірусів SARS i MERS.
Ремдесивір все ще є експериментальним лікарським засобом у фазі досліджень. Первинно розроблений для лікування геморагічної лихоманки Ебола, виявився неефективним під час епідемії цієї хвороби в Демократичній Республіці Конго у 2019 році. Його профіль безпеки не визначений, а також його ефективність не була досі підтверджена за будь-якими показаннями. Він також не введений в обіг у жодній країні.
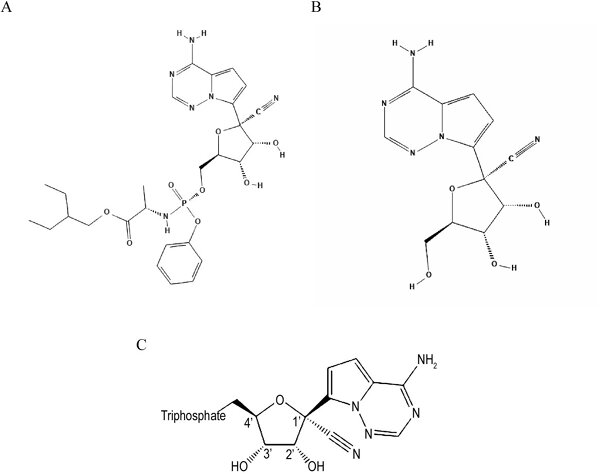
Рисунок 1. Хімічні структури: A — ремдесівір (пролікарський засіб); B — GS-441524 (проміжний метаболіт); C — активний метаболіт GS-443092 (Amirian S.E., Levy J.K.: Current knowledge about the antivirals remdesivir [GS-5734] and GS-441524 as therapeutic options for coronaviruses”, One Health, 2020; 9 1001282)
1. „EMA provides recommendations on compassionate use of remdesivir for COVID-19” https://www.ema.europa.eu/en/news/ema-provides-recommendations-compassionate-use-remdesivir-covid-19 [доступ 08.04.2020]
2. https://www.ema.europa.eu/en/human-regulatory/research-development/compassionate-use [доступ 08.04.2020]
3. „Summary on compassionate use Remdesivir Gilead” https://www.ema.europa.eu/en/documents/other/summary-compassionate-use-remdesivir-gilead_en.pdf [доступ 08.04.2020]
4. „Conditions of use, conditions for distribution and patients targeted and conditions for safety monitoring adressed to member states for remdesivir available for compassionate use” https://www.ema.europa.eu/en/documents/other/conditions-use-conditions-distribution-patients-targeted-conditions-safety-monitoring-adressed_en-2.pdf [доступ 08.04.2020]
5. Amirian S.E., Levy J.K.: Current knowledge about the antivirals remdesivir (GS-5734) and GS-441524 as therapeutic options for coronaviruses”, One Health 9 (2020) 1001282 https://doi.org/10.1016/j.onehlt.2020.100128 [доступ 8.04.2020]
6. https://www.gilead.com/purpose/advancing-global-health/covid-19 [останнє оновлення: 4.04.2020; доступ: 8.04.2020]
7. https://eur-lex.europa.eu/legal-content/PL/TXT/PDF/?uri=CELEX:32004R0726&from=PL [доступ 8.04.2020]