EtiopatogeniaArriba
1. Agente etiológico: está causada por el protozoo hemoflagelado intracelular Trypanosoma cruzi, que tiene un gran tropismo por los cardiomiocitos, por células nerviosas, etc. En el ser humano el parásito se desarrolla en dos formas, una flagelada con forma de C, llamada tripomastigote, que circula en la sangre periférica, y una segunda forma intracelular que carece de flagelo, denominada amastigote (→fig. 19.4-1).
2. Patogenia: después de la picadura puede aparecer una inflamación local (chagoma de inoculación), que puede pasar desapercibida y/o simular cualquier picadura de insecto. Desde ese lugar se produce la diseminación por vía hematógena a todo el cuerpo. Las células del sistema reticuloendotelial, el miocardio, los músculos y el sistema nervioso son las estructuras comprometidas con mayor frecuencia. La respuesta inflamatoria e inmunitaria (incluida autoinmunidad) genera anomalías microvasculares y daño nervioso progresivo en las células de los plexos mientéricos del sistema parasimpático (de Meissner y Auerbach), originando el daño en los órganos diana, de los cuales el principal es el corazón.
3. Reservorio y vías de transmisión: en un ambiente natural el reservorio son los mamíferos domésticos (perros, gatos, ganado caprino, etc.) y salvajes, especialmente roedores y marsupiales, así como el humano. El parásito es transmitido al humano por vía vectorial (la más frecuente en áreas endémicas), congénita (representa el 20 % de los nuevos casos), transfusional (20 % de los casos totales) y, menos frecuentemente, por vía oral, trasplante de órganos o por accidente con riesgo biológico. Los vectores más importantes son Triatoma infestans en Argentina, Bolivia, Brasil, Chile, Paraguay Uruguay y Perú; Rhodinius prolixus en Colombia, Venezuela y Centroamérica, T. dimidiata en Ecuador y América Central; y R. pallescens en Panamá.
El triatomino al picar emite sus deyecciones con tripomastigotes y el humano al rascarse en la zona de la picadura, arrastra los tripomastigotes, lo que permite que el parásito penetre por ella. En las zonas endémicas el porcentaje de infección alcanza el 50 % de los triatominos. La tasa de transmisión congénita es del 2-8 %, y puede ocurrir en embarazos sucesivos. El tamizaje sistemático para Chagas en embarazadas es muy variable entre países y regiones de América Latina (oscilando entre 7 y 55%), al igual que el diagnóstico y tratamiento oportuno en el recién nacido, los cuales son fundamentales para el control de la transmisión por esta vía.
En zonas con alta carga de triatomíneos infectados, como en Brasil y Colombia, se han descrito brotes de la enfermedad de Chagas causadas por la ingesta de zumo de frutas o de caña de azúcar contaminados con heces de triatominos infectados. La transmisión por hemoderivados persiste fundamentalmente asociada a la falta de control adecuado de estos productos biológicos.
Las vías de transmisión no vectoriales, junto con las migraciones, explican la tendencia a la urbanización de la enfermedad, así como a la creciente importancia epidemiológica de esta infección en regiones no endémicas.
4. Factores de riesgo:
1) Países endémicos: vivir en zona endémica, principalmente en áreas rurales, en viviendas con paredes de barro y con grietas, con techos de paja o totora (Schoenoplectus californicus), que son condiciones que favorecen la infestación y reproducción intradomiciliaria del vector.
2) Áreas urbanas de países endémicos y países no endémicos: transfusiones de sangre no controlada, trasplantes de médula y de órganos de donantes infectados, y falta de tamizaje en el embarazo en poblaciones provenientes de área endémica.
5. Período de incubación y transmisibilidad: transmisión vectorial de 7-14 días.
EpidemiologíaArriba
La enfermedad es endémica en 21 países de América. Se estiman 6 000 000 de personas infectadas, con 30 000 casos nuevos anuales por todas las formas de transmisión y 12 000 muertes anuales atribuibles a esta enfermedad. Es una enfermedad relacionada históricamente con déficits socioeconómico-sanitarios por lo que se la considera una enfermedad desatendida.
Las infecciones son cada vez más frecuentes en países no endémicos de América del Norte y Europa entre los inmigrantes de los países endémicos, así como debido a la transmisión vertical y las infecciones asociadas a la transfusión de sangre, siendo mucho más raras en viajeros. Se estima que en Europa hay ~80 000 infectados, >50 % de ellos en España, y la mayoría de ellos sin diagnóstico. La persistencia de la infección entre los descendientes de los inmigrantes de América Latina que viven en España y Portugal debida a la transmisión por vía no vectorial hace que esta enfermedad sea un problema epidemiológico importante.
Cuadro clínico e historia naturalArriba
1. Fase aguda de la infección: en la vía vectorial la fase aguda es sintomática en solo un 1-10 % de los casos, mientras que por transmisión oral puede llegar a serlo hasta en un 75 % de los casos. Esta fase puede ser de duración diversa, hasta de varios meses, y puede ser asintomática, oligosintomática o, mucho más raramente, cursar con un cuadro clínico agudo que oscila desde formas leves hasta una afectación multisistémica.
En el sitio de entrada del parásito puede presentarse edema con consistencia dura (chagomas de inoculación) que puede persistir hasta 15 días, mientras que en caso de invasión a través de la conjuntiva se produce el complejo oftalmoganglionar (signo de Romaña) con edema palpebral unilateral, sin dolor, frecuentemente acompañado de conjuntivitis y agrandamiento de un nódulo linfático local, que persiste por 30-60 días.
La fase aguda puede estar acompañada de síntomas generales como fiebre, linfadenopatía generalizada, debilidad, mialgias, exantema, edemas generalizados, hepato- y/o esplenomegalia, así como miocarditis y meningoencefalitis. Un 5-10 % de los pacientes sintomáticos presentan durante la fase aguda una miocarditis de evolución rápida hacia una forma grave de cardiopatía de Chagas. La parasitemia en sangre periférica puede persistir durante muchos años en forma de oligoparasitemias intermitentes.
2. Fase crónica de la enfermedad: aparece tras un período de 10-20 años desde la infección primaria, los síntomas se desarrollan en 3-4 de cada 10 infectados: un 20-30 % presentará alteraciones cardiacas, un 10 % alteraciones digestivas o ambas (forma mixta) y menos del 5 % una forma neurológica. El resto permanecerá en la fase crónica sin patología evidenciable durante toda su vida. Se produce daño progresivo del músculo cardíaco, con proliferación del tejido fibrótico para reemplazar el miocardio dañado, y esto genera trastornos del ritmo cardíaco (bloqueos y bradicardia), y miocardiopatía dilatada. En el tracto digestivo falla la propagación del peristaltismo, con dilatación de las vísceras huecas, que se manifiesta como acalasia del esófago y consecuente megaesófago, y alteraciones en el intestino grueso que llevan a constipación progresiva grave y desarrollo de megacolon.
3. Infección congénita por T. cruzi: en la mayoría de los casos (>90 %) los niños con infección congénita son asintomáticos al nacer. Los que presenten síntomas pueden manifestar: prematurez, bajo peso al nacer, hepato- y/o esplenomegalia, ictericia, anemia, arritmias, hepatitis, miocarditis, meningoencefalitis, fiebre, edemas, exantema, entre otros.
4. Enfermedad de Chagas en pacientes inmunocomprometidos (VIH/sida), trasplantados, oncológicos: puede deberse a infección aguda adquirida por diversas vías o reactivación de una infección en fase crónica. Las formas clínicas más frecuentes en inmunocomprometidos son el síndrome febril prolongado y los cuadros neurológicos (meningoencefalitis y lesión ocupante de espacio única o múltiple), y eventualmente miocarditis. Siempre constituyen cuadros graves que requieren diagnóstico y tratamiento rápidos. En pacientes trasplantados son frecuentes los episodios de paniculitis aguda.
DiagnósticOArriba
Exploraciones complementarias
1. Identificación del agente etiológico:
1) Las pruebas parasitológicas directas son útiles en la fase aguda de la enfermedad, en casos de reactivación y ante la sospecha de una infección vertical de los recién nacidos de madres con enfermedad de Chagas. Se recomienda realizar pruebas parasitológicas directas (microhematocrito y observación directa), y eventual seguimiento serológico posterior. No son útiles, en general, en fase crónica de infección debido a la baja parasitemia de los enfermos.
2) Los métodos moleculares (PCR) se utilizan en situaciones similares a aquellas en las que se emplean las pruebas microscópicas.
3) Pruebas serológicas: son de utilidad en la fase crónica. En los recién nacidos de madres con enfermedad de Chagas las pruebas serológicas no son útiles para diagnóstico precoz, ya que las IgG anti-T.cruzi halladas en el recién nacido pueden ser de origen materno, por lo que se recomienda realizar pruebas serológicas a partir de los 8 meses de vida.
2. Otras:
1) VHS elevada, concentraciones altas de proteína C-reactiva y procalcitonina en suero (en fase aguda).
2) Pruebas de imagen. En la fase aguda: ecografía abdominal (hepatomegalia, esplenomegalia); en fase crónica: radiografía de tórax (cardiomegalia), ecocardiografía (engrosamiento de las paredes y dilatación de los ventrículos y/o aurículas) y estudios con contraste del tracto digestivo (acalasia del esófago, megacolon), que se justifican solo cuando hay sintomatología digestiva.
3) ECG tanto en fase aguda como en crónica: bloqueos de la conducción, arritmias, ondas Q anormales y cambios de las ondas T.
Criterios diagnósticos
La confirmación diagnóstica de la fase aguda debe realizarse mediante la identificación del protozoo T. cruzi circulante en la sangre periférica. El diagnóstico en fase crónica se confirma con la combinación de dos pruebas serológicas con diferentes antígenos que detecten anticuerpos contra T. cruzi (ELISA, HAI o IFI), y una tercera si los resultados de dichas pruebas son discordantes.
Diagnóstico diferencial
1) Enfermedades infecciosas agudas que cursan con fiebre y síntomas generalizados, de presentación en América del Sur: malaria, bartonelosis (enfermedad de Carrión, fiebre de Oroya), fiebre tifoidea y fiebres paratifoideas, brucelosis, infección por VIH.
2) Otras causas de dilatación del tracto digestivo (incluso la enfermedad de Hirschsprung congénita, megacolon andino), de miocarditis y de miocardiopatía (incluyendo las enfermedades de almacenamiento).
3) Infección por un protozoo Trypanosoma rangeli, que tiene una forma morfológica semejante, pero que no es patogénico para el ser humano.
TratamientoArriba
Tratamiento causal
El tratamiento causal de la enfermedad de Chagas tiene por objeto eliminar la infección por T.cruzi. En etapa aguda es altamente efectivo, por lo que se recomienda tratar siempre, y su eficacia disminuye con el tiempo de infección. Los beneficios potenciales de la medicación en los casos crónicos para prevenir o retrasar el desarrollo de la enfermedad de Chagas deben sopesarse frente a las posibles reacciones adversas que se presentan en hasta el 40 % de los pacientes tratados.
1. Indicaciones para el tratamiento causal:
1) Se recomienda fuertemente indicar tratamiento tripanocida en caso de:
a) pacientes con infección aguda/congénita por T. cruzi (el tratamiento en esta etapa es altamente efectivo, se recomienda tratar siempre)
b) reactivación en inmunocomprometidos
c) fase crónica en niños
d) niñas y mujeres en edad fértil no embarazadas con infección crónica
e) donante vivo seroreactivo para T. cruzi en trasplante de órganos, cuando el mismo no es de urgencia
f) accidente de laboratorio o quirúrgico de alto riesgo con material contaminado con T. cruzi.
2) Se sugiere indicar tratamiento tripanocida (recomendación condicional) a pacientes adultos con infección crónica por T. cruzi sin daño orgánico específico.
3) Se sugiere no indicar tratamiento tripanocida en pacientes adultos con infección crónica por T. cruzi y daño orgánico específico.
2. Fármacos recomendados en el tratamiento causal y su dosificación:
1) Tratamiento recomendado en adultos y niños (excepto en la infección congénita):
a) Primera opción: benznidazol, en pacientes ≤40 kg 7,5-10 mg/kg/d VO y en pacientes >40 kg 5-7 mg/kg/d VO. En ambos casos, administrar en 2-3 dosis divididas durante 60 días.
b) Otras opciones: nifurtimox, en pacientes ≤40 kg 10-15 mg/kg/d VO y en pacientes >40 kg, 8-10 mg/kg/d VO. En ambos casos, administrar en 2-3 dosis divididas durante 60 días.
Estos fármacos no deben administrarse a embarazadas, personas con insuficiencia hepática o renal graves, ni a personas con trastornos neurológicos graves preexistentes.
2) Tratamiento de la infección congénita:
a) Primera opción: benznidazol 10 mg/kg/d VO, dividido en 2-3 dosis diarias durante 60 días.
b) Otras opciones: nifurtimox 10-15 mg/kg/d VO; pacientes de >4 kg 8-10 mg/kg/d VO. En ambos casos, administrar en 2-3 dosis divididas durante 60 días.
Tratamiento sintomático
Es el tratamiento de las complicaciones orgánicas evidenciables.
1) Cardiológicas: alteraciones del ritmo cardíaco (tratamiento farmacológico y/o colocación de marcapasos), insuficiencia cardíaca, embolismo, etc.
2) Digestivas: acalasia del esófago (tratamiento endoscópico con dilatación mecánica o cardiomiotomía), alteraciones del intestino grueso. La torsión del intestino grueso debe tratarse de manera inmediata. Tratamiento preventivo de la constipación con educación del hábito evacuatorio, régimen rico en fibras, coadyuvantes de la defecación (lactulosa, polietilenglicol 3350).
VIGILANCIAArriba
Recomendar el control regular cardiológico (ECG, ecocardiografía) y la realización de pruebas de imagen del tracto digestivo cada 6-12 meses en todos los casos asintomáticos para una detección temprana de los trastornos del tracto digestivo. En los enfermos sintomáticos se debe realizar un control sistemático cada 2-3 meses.
ComplicacionesArriba
1. Complicaciones cardíacas: miocarditis aguda, insuficiencia cardíaca, arritmias, aneurisma apical cardíaco, embolismo.
2. Complicaciones en el tracto digestivo: trastornos de la motilidad del tracto digestivo, estreñimiento crónico, íleo paralítico, peritonitis fecal. El megaesófago produce trastornos de la deglución y, en consecuencia, una neumonía por aspiración. La deglución dificultada lleva a desnutrición.
3. Complicaciones en el SNC: puede presentarse meningoencefalitis.
PronósticoArriba
Es una enfermedad silenciosa y potencialmente mortal si no recibe tratamiento adecuado, pudiendo ser causa de muerte súbita o de discapacidad. En la mayoría de los casos la infección es asintomática y el pronóstico es bueno. Solo un 10-30 % de los infectados desarrolla patología evidenciable. En la infección aguda el pronóstico es bueno, el riesgo de muerte es mayor en niños e inmunodeprimidos. Una instauración rápida del tratamiento en los casos con la forma aguda e infección vertical permite la curación completa, clínica y parasitológica. La mortalidad se asocia fundamentalmente a las complicaciones cardiológicas.
PrevenciónArriba
Métodos específicos
No hay.
Métodos no específicos
1. Eliminar el vector y evitar la exposición: mejorar las viviendas de las zonas rurales endémicas, estucando paredes y tapando grietas, evitando techos de totora o paja, fumigando las viviendas en el interior y exterior, alejando los establos de las proximidades de las casas y manteniéndolos a una distancia prudente de la vivienda, colocar trampas adhesivas en árboles. No se deben usar materiales que favorezcan la anidación de los triatominos a la hora de construir casas (p. ej. hojas de las palmeras, paja o totora para cubrir techos). Se recomienda el uso de iluminación artificial en los dispositivos de producción de miel de la caña de azúcar y zumo de caña (los triatominos son activos por la noche). Las personas que viajan a regiones endémicas de la enfermedad deben evitar dormir en viviendas en las que puedan vivir los triatominos.
2. Aislamiento de enfermos: no es necesario.
Tamizaje
1. En países endémicos: evaluación de donantes de sangre, médula y órganos, así como examen de embarazadas (en Chile era la manera más frecuente de propagación de la infección, pero ahora se hace tamizaje en todas las embarazadas). Examen de hijos nacidos de madres con marcadores de infección por T. cruzi (un inicio temprano de tratamiento en la etapa inicial de la vida facilita la curación completa, clínica y parasitológica, lo que es imposible en caso de enfermedad crónica). Estudio serológico a afectados por megaesófago, megacolon, portadores de marcapasos con antecedentes epidemiológicos, parientes de chagásicos (madre, padre, hermanos, hijos), si compartieron el ambiente de riesgo.
2. En países no endémicos: evaluación de los donantes de tejidos y sangre procedentes de América Latina y de sus hijos.
Notificación obligatoria
Variable entre países. Se recomienda incluir en los sistemas nacionales de vigilancia de morbimortalidad de los países la notificación obligatoria de los casos agudos y crónicos de enfermedad de Chagas que incorpore, por lo menos, las variables de edad y sexo.
FIGURAS
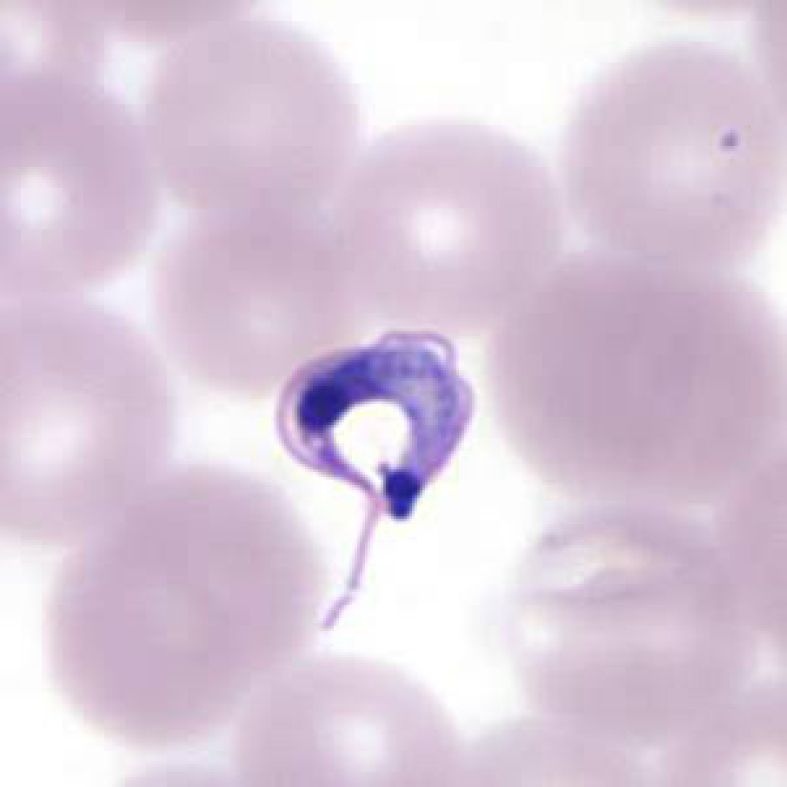
Fig. 19.4-1. Forma flagelada de T. cruzi en frotis fino de sangre periférica preparado con tinción de Giemsa
 Español
Español
 English
English
 українська
українська





