ETIOPATOGENIAArriba
1. Agente etiológico: 2 especies de micobacterias del género Mycobacterium: Mycobacterium leprae y Mycobacterium lepromatosis, denominadas conjuntamente complejo Mycobacterium leprae, causan las mismas manifestaciones clínicas con una respuesta similar al tratamiento y un pronóstico parecido. Estas bacterias son aerobias, ácido-alcohol resistentes, no tienen movilidad, no producen esporas y crecen muy lentamente (el tiempo de generación [en otras palabras, el tiempo de duplicación, es decir, el tiempo necesario para duplicar la población dividiendo una célula en dos] es de 12-14 días, el más largo entre las bacterias que causan infecciones en los seres humanos). Viven obligatoriamente de forma intracelular. La temperatura óptima de crecimiento es de 27-33 °C, lo que da lugar a una colonización preferente de las partes periféricas del cuerpo (dedos de manos y pies, piel de la cara, pabellones auriculares). Producen el glicolípido fenólico PGL-1, específico de la especie, que se utiliza en el serodiagnóstico. Pueden sobrevivir durante mucho tiempo en el medio externo (en tejidos secos sin acceso a la luz solar mantienen su infectividad durante ≥5 meses).
2. Patogenia: las micobacterias de la lepra muestran tropismo hacia las células de Schwann y los macrófagos, donde se multiplican. El mecanismo que conlleva la neuropatía, principal síntoma de la lepra, es complejo y no del todo conocido. El complejo M. leprae entra en las células de Schwann mediante la unión del glicolípido fenólico PGL-1 de la pared bacteriana a una proteína específica (laminina α-2) de las células huésped. Después de la infección celular, la replicación bacteriana progresa lentamente hasta que las células T reconocen los antígenos micobacterianos y comienza una respuesta inflamatoria crónica. Tanto las propias micobacterias, que tienen la capacidad de "reprogramar" las células de Schwann infectadas mediante la modificación epigenética de los genes, como la respuesta del sistema inmunitario que provoca la inflamación, desempeñan un papel en el proceso patológico. La infección de las células de Schwann y la colonización de los nervios conducen gradualmente a la desmielinización, la degeneración axonal, la fibrosis y, luego, al daño permanente de los nervios, la pérdida de sensibilidad y cambios patológicos en los tejidos. El cuadro clínico de la lepra depende de la respuesta inmune del huésped. Se estima que solo ~5 % de los infectados desarrollan la enfermedad. Con una respuesta celular eficaz a las micobacterias, las primeras fases de la lepra pueden remitir espontáneamente, y las lesiones aisladas se resuelven en su mayoría sin tratamiento. La capacidad de desarrollar una inmunidad celular específica frente al complejo M. leprae determina si se producirá la autocuración, o si se desarrollará la enfermedad sintomática y evolucionará hacia una de las formas de lepra. La respuesta celular específica desempeña un papel importante en la respuesta a las micobacterias. Los anticuerpos contra varios antígenos micobacterianos están presentes en la lepra lepromatosa en altas concentraciones, pero no conducen a la eliminación del patógeno.
Además, la respuesta inmunitaria al complejo M. leprae es variable y provoca síntomas clínicos que cambian espontáneamente, así como reacciones leprosas.
3. Reservorio y vía de transmisión: el principal reservorio de micobacterias de la lepra es la persona enferma. Además, las micobacterias se encuentran en los armadillos de nueve bandas (Dasypus novemcinctus), que han sido reconocidos como huésped natural y reservorio de la lepra (la micobacteria que se encuentra en estos animales es idéntica a la que se encuentra en los humanos). También se han detectado micobacterias en amebas de vida libre, artrópodos y ardillas comunes (Sciurus vulgaris). Se está considerando la posibilidad de un reservorio ambiental, en el que probablemente sean importantes las amebas de vida libre.
La transmisión de la lepra no ha sido plenamente explicada. Las micobacterias son excretadas por el enfermo principalmente a través de la mucosa nasal, especialmente en el caso de la lepra multibacilar.
Lo más probable es que la infección sea adquirida tras la inhalación de gotitas que contienen micobacterias. No se pueden descartar otras vías de infección: a través de la piel por contacto con un nódulo no tratado, ulcerado y multibacilar en la lepra lepromatosa. El transporte de micobacterias de la lepra en la mucosa nasal por parte de una persona infectada asintomática también puede desempeñar un cierto papel en la transmisión de la lepra. Actualmente se propone un modelo de transmisión antroponótica y zoonótica (contacto con armadillos enfermos). También se considera la posible participación de vectores (p. ej. chinches Triatoma).
4. Factores de riesgo de infección:
1) Tipo de contacto con el enfermo: la duración del contacto y la distancia al enfermo son importantes. Los factores que contribuyen a la transmisión incluyen el contacto cercano y prolongado con una persona infectada con una alta carga bacteriana. Se supone que la lepra lepromatosa supone un mayor riesgo de infección para las personas de contacto.
2) Edad: el riesgo de infección aumenta con la edad. Los niños rara vez enferman, la mayoría de las veces con la forma tuberculoide. La incidencia es más alta en los grupos de edad de 10-14 y de 35-44 años.
3) Contacto con animales infectados.
4) Predisposición genética: algunos genes y regiones del genoma humano se asocian a una mayor susceptibilidad a la enfermedad y el desarrollo de formas clínicas específicas de lepra; por ejemplo, las personas con HLA-DR2 y HLA-DR3 tienen más probabilidades de desarrollar lepra tuberculoide, y las personas con HLA-DQ1 lepra lepromatosa.
Los hombres enferman dos veces más que las mujeres. En las mujeres, los síntomas aparecen más tarde y las deformidades corporales son más comunes.
5. Periodo de incubación e infectividad: el periodo de incubación varía de 2 a >20 años (una media de 4 años para la lepra tuberculoide y 10 años para la lepromatosa). La infectividad es baja. El paciente deja de ser infeccioso a los pocos días de iniciar el tratamiento.
CUADRO CLÍNICO E HISTORIA NATURALArriba
En el 95 % de las personas en contacto con M. leprae la enfermedad no se desarrolla. En regiones endémicas también se han descrito infecciones asintomáticas que duran años o incluso décadas y que pueden curarse por sí solas.
El cuadro clínico de la lepra es rico y depende de la respuesta inmune del huésped a la infección. En el curso de la lepra, los cambios ocurren principalmente en los nervios periféricos ubicados superficialmente y en la piel, a veces también en las membranas mucosas, los ojos y algunos órganos internos (p. ej. en los testículos).
La lepra puede adoptar una forma local o de infección sistémica. Los principales síntomas de la enfermedad son lesiones cutáneas acompañadas de síntomas de afectación del sistema nervioso periférico, principalmente alteraciones sensoriales.
1. Manifestaciones clínicas:
1) Sistema nervioso: en todas las formas de lepra el sistema nervioso periférico se ve afectado, con mayor frecuencia los nervios cubital, mediano, las ramas cutáneas del nervio radial, peroneo común, tibial, facial y auricular mayor. La pérdida de sensibilidad es más pronunciada que la pérdida de la función motora. Inicialmente, el paciente refiere hiperestesia o disestesia (que puede indicar el comienzo del daño nervioso), luego evoluciona hacia una hipoestesia y finalmente a la pérdida total de la sensibilidad. Raramente se produce la pérdida de la sensación de la posición del cuerpo, sensibilidad vibratoria y la atrofia de los reflejos tendinosos. La lesión de los nervios es asimétrica. En algunos casos se produce parálisis de los nervios que inervan la cara. El deterioro de la función motora a menudo coexiste con una debilidad muscular, seguida de deformidades como mano en garra, pie caído y asimetría facial. Los daños en los nervios del sistema vegetativo pueden manifestarse primero como una leve hinchazón de manos y pies que luego se vuelven secos y cianóticos.
Es muy característico y palpable el engrosamiento de los nervios: mediano en la fosa cubital y peroneo común a nivel de la cabeza del peroné. El engrosamiento de los nervios cutáneos suele afectar a pequeñas ramas que conectan con la lesión cutánea leprosa. En ~5 % de los casos, no se encuentran lesiones cutáneas y el paciente tiene la llamada forma neurológica pura de la lepra. Las lesiones de los nervios periféricos a menudo provocan discapacidad y deformidades corporales.
2) Piel: las lesiones de lepra pueden ocurrir en cualquier parte del cuerpo, pero con menos frecuencia en el cuero cabelludo, las axilas y la ingle. Como resultado de una polineuropatía progresiva, se desarrollan en las extremidades úlceras tróficas con hiperqueratosis de las manos y las plantas de los pies. El paciente no se protege de las quemaduras y otras lesiones debido a la falta de sensibilidad. Las úlceras son más frecuentes en las plantas de los pies en el punto de mayor presión (→fig. 19.2-1), así como en los dedos y la superficie palmar de las manos.
3) Membranas mucosas: en la lepra lepromatosa la mucosa de las vías respiratorias altas a menudo se ve afectada. Aparecen: secreción nasal (a veces de color sangre) y sensación de congestión nasal. La mucosa nasal presenta hiperemia e hinchazón. La ulceración en el área del tabique nasal puede conducir a su perforación, destrucción del cartílago y colapso del puente nasal, seguido de deformación (nariz en silla de montar →fig. 19.2-2). En raras ocasiones se producen lesiones en la laringe; entonces aparece ronquera, tos y sibilancias laríngeas.
4) Sistema musculoesquelético: los cambios ocurren en el 95 % de los pacientes. La osteítis y las infecciones secundarias son comunes. La reabsorción ósea afecta a las falanges y conduce a la flexión indolora de los dedos, seguida de deformación, incluida la autoamputación (→fig. 19.2-2, →fig. 19.2-3, →fig. 19.2-4), a lo que contribuyen las heridas repetidas y otras lesiones. Algunos pacientes desarrollan articulaciones de Charcot. La osteoporosis se desarrolla en ~50 % de los pacientes.
5) Testículos: en la lepra lepromatosa las micobacterias pueden penetrar en los testículos, que sufren atrofia, lo que origina infertilidad y ginecomastia. La orquitis es una causa importante de disfunción testicular en la leprorreacción de tipo 2.
6) Otros: linfadenopatía, edema linfático de las extremidades inferiores. En ocasiones las micobacterias de la lepra colonizan el bazo y el hígado. También se han descrito glomerulonefritis, nefritis intersticial y pielonefritis, así como amiloidosis, que se asocia a un curso grave de la leprorreacción de tipo 2 (→más adelante).
2. Formas de lepra: desde 1966 se utiliza la clasificación de Ridley-Jopling, que combina los síntomas clínicos y el grado de deterioro de la inmunidad celular. La lepra tuberculoide (LT) ocurre en personas con una respuesta celular normal a la infección. Luego, a medida que se deteriora la respuesta inmune a las micobacterias, se distinguen las siguientes formas: lepra tuberculoide borderline (BT), lepra borderline (BB), lepra lepromatosa borderline (BL). En personas con deterioro de la respuesta inmunitaria suele ocurrir la lepra lepromatosa (LL; no son personas inmunodeprimidas, sino con una incapacidad selectiva para desarrollar inmunidad celular contra M. leprae). También existe una forma indeterminada (I). La clasificación para el tratamiento se basa en la división de la lepra a partir de la OMS en formas paucibacilar (paucibacillary, LP) y multibacilar (multibacillary, LM), →tabla 19.2-1.
Lepra indeterminada (indeterminate, I): es la fase más temprana del curso natural de la infección, que adopta la forma de una lesión cutánea. Es más frecuente en los niños infectados, cuya respuesta inmune aún no está completamente desarrollada. Esta denominación no se utiliza cuando el diagnóstico es incierto, sino cuando el examen histológico revela la afectación de los nervios o la presencia de micobacterias ácido-alcohol resistentes, pero las lesiones son tan tempranas que no se pueden atribuir a ninguna forma de lepra. En el enfermo se puede observar una o varias lesiones maculares, poco pigmentadas, a veces mal delimitadas, sin eritema ni infiltrado. Las lesiones pueden aparecer en cualquier parte del cuerpo y pueden confundirse fácilmente con una micosis o un eccema. Esta forma de lepra puede persistir hasta 5 años, sanar espontáneamente o progresar a una de las otras formas de la enfermedad. Al final de este período pueden presentarse síntomas neurológicos leves, como disminución de la sudoración o pérdida de la sensación térmica. La percepción del dolor permanece invariable. El diagnóstico de esta forma de lepra es difícil, por lo general no se puede detectar M. leprae. En esta fase, la lepra no es contagiosa y, con el tratamiento adecuado, no deben producirse lesiones permanentes en los nervios. Si el paciente no recibe tratamiento, la enfermedad puede evolucionar a una forma determinada, dependiendo del estado inmunológico del paciente. La siguiente etapa de la enfermedad es una de las formas de la lepra pauci- o multibacilar (→tabla 19.2-1).
Lepra tuberculoide (tuberkuloid, LT): las lesiones cutáneas adoptan la forma de pápulas y placas aisladas que pueden fusionarse en una forma eritematosa con bordes elevados y aspecto anular, con un centro atrófico y poco pigmentado. El borde de la lesión está bien delimitado. En las pieles oscuras, las lesiones son más a menudo decoloradas, y en las pieles claras suelen ser eritematosas o de color cobrizo. La lesión es única o son poco numerosas, ocurren de forma asimétrica, principalmente en las extremidades, y a menudo se asemejan a una dermatofitosis. Es posible la curación espontánea antes de alcanzar un diámetro de 10 cm. La sensibilidad (tacto, dolor, temperatura) suele estar alterada debido a las lesiones nerviosas, aunque puede estar preservada en lesiones localizadas en la cara. La afectación de los nervios autónomos provoca una alteración de la secreción de sudor y sequedad en las zonas afectadas por la enfermedad. Se pueden palpar los nervios circundantes engrosados. Los defectos neurológicos se producen de forma asimétrica. En la lepra tuberculoide, una manifestación cutánea clínicamente moderada puede acompañar a una lesión de los nervios muy grave tanto en la sensibilidad como en el movimiento. La lepra tuberculoide es paucibacilar y, por tanto, poco infecciosa.
Lepra lepromatosa (lepromatous, LL): las lesiones tempranas son múltiples máculas simétricas, mal delimitadas, con ligera hipopigmentación y eritema. Pueden aparecer pápulas y nódulos de color carne o eritematosos. La piel facial afectada por la enfermedad se infiltra y se desarrolla la llamada leontiasis. Aparecen numerosas protuberancias simétricas de color marrón rojizo que penetran en la piel y las mucosas (lepromas), principalmente en la cara y las aurículas, que a menudo se engrosan y luego se vuelven nodulares. Es característica la pérdida de pestañas y cejas. La afectación de la mucosa nasal conduce a la sensación de congestión nasal seguida de deformación (nariz en silla de montar). A veces las lesiones afectan a todo el segmento nasal de la faringe, con ulceraciones características de la mucosa palatina y laríngea. Una complicación grave es la afectación ocular, que conduce a la pérdida completa de la visión en ~10 % de los casos. Es posible la diseminación de M. leprae a través de la linfa y la sangre, lo que provoca daño renal y hepático, así como orquitis. En caso de afectación del sistema esquelético se observan lesiones en la médula ósea y en las articulaciones.
Lepra dimorfa (lepra borderline): ocurre en la mayoría de las infecciones por M. leprae. Las lesiones son características tanto de la lepra tuberculoide como de la lepromatosa. Dependiendo del estado inmunológico del paciente se distinguen:
1) lepra tuberculoide borderline (borderline tuberculoid, BT): las lesiones son más numerosas que en la forma típica de LL, pero están menos infiltradas, tienen formas y tamaños diferentes y están peor delimitadas. Las lesiones eritematosas son asimétricas, a veces ocurren lesiones satélites. Se pueden observar defectos neurológicos sensoriales y motores. La afectación nerviosa es menos pronunciada que en la lepra tuberculoide.
2) lepra borderline-borderline (borderline borderline, BB): aumenta el número de lesiones cutáneas que ocurren de forma casi simétrica. Las lesiones pueden ser tanto papulares como maculares o en forma de placa. Algunas tienen un borde exterior mal delimitado y un claro borde interior de insensibilidad (lesiones anulares características). El crecimiento capilar y la sudoración se ven alterados. El número de bacterias puede ser pequeño o grande, y el número de granulomas aumenta. Ocurren defectos neurológicos sensoriales y motores.
3) lepra lepromatosa borderline (borderline lepromatous, BL): se desarrollan numerosas pápulas, nódulos y placas mal delimitadas, dispuestas simétricamente. A medida que la enfermedad progresa se produce una infiltración de las lesiones. Los límites de las lesiones son más claros que en la LL, pero siguen siendo borrosos. Resulta evidente la alteración del crecimiento capilar y de la sudoración, así como los defectos neurológicos periféricos, aunque la sensibilidad puede estar preservada en las lesiones.
3. Leprorreacciones: ocurren en el 30-50 % de los enfermos, tanto antes como durante la terapia, así como después del tratamiento, incluso eficaz, como una expresión de la alteración del equilibrio inmunitario entre el patógeno y el huésped. A veces su curso es grave, incluso con riesgo vital.
La reacción de tipo 1 (reacción reversa) es probablemente el efecto de una respuesta celular exacerbada a los antígenos micobacterianos y la aparición de hipersensibilidad de tipo retardado. Por lo general, se desarrolla gradualmente y, sin tratamiento, persiste durante semanas. Dentro de las lesiones cutáneas existentes y/o en la piel cercana al nervio afectado, aparecen eritema e hinchazón, acompañados de signos de neuritis. En casos graves se pueden formar úlceras. Se observa un aumento de la temperatura y, a veces, sensibilidad en la piel afectada. A veces también aparecen nuevas lesiones y edemas en pies y manos. Los nervios afectados son dolorosos y edematosos, a veces con una pérdida súbita de la función nerviosa (sensorial y motora). Es la leprorreacción más común, en ~30 % de los enfermos con lepra dimorfa (BT, BB, BL), generalmente dentro de los 12 meses de iniciado el tratamiento, y los factores desencadenantes pueden ser el embarazo, las comorbilidades y el tratamiento administrado. La reacción de tipo 1 que se produce en los pacientes tratados refleja una respuesta celular creciente y una transición a una enfermedad de tipo tuberculoide. Si se produce en pacientes no tratados o tratados inadecuadamente, puede ser un síntoma de que la enfermedad progresa a una forma lepromatosa.
La reacción de tipo 2 (eritema nodoso leproso, ENL) está asociada a una vasculitis con inmunocomplejos y a la infiltración por macrófagos, linfocitos y neutrófilos. Es característico el aumento en la concentración de citoquinas IL-6, IL-8 e IL-10, así como IL-4 e IL-5. Las lesiones afectan a la piel y también pueden ser generalizadas y manifestarse como glomerulonefritis, linfadenitis, iritis e iridociclitis y orquitis. El ENL se manifiesta repentinamente, las lesiones persisten varios días (hasta ~2 semanas) y pueden reaparecer. Se observan nódulos eritematosos dolorosos en la piel o el tejido subcutáneo, independientemente de las lesiones previas. A diferencia del eritema nodoso, las lesiones se localizan no solo en las extremidades inferiores, sino en todo el cuerpo; pueden ulcerarse o necrosarse. Aparecen principalmente en los extensores de las extremidades y en la cara, pudiendo afectar también al torso. Los cambios se acompañan de mialgias y artralgias, fiebre, malestar general y anorexia. La reacción de tipo 2 generalmente ocurre en la lepra lepromatosa borderline y en las variantes lepromatosas después del inicio del tratamiento. El ENL recurre con frecuencia y en algunos enfermos puede presentarse durante años. Entre los factores desencadenantes se encuentran: maduración sexual, embarazo, parto, lactancia e infecciones que cursan con fiebre.
La reacción de tipo 3 (fenómeno de Lucio) ocurre en pacientes con lepra lepromatosa no tratados, con mayor frecuencia en México. Se manifiesta como manchas extensas de color rojo oscuro con infiltrados vesiculares que pueden ulcerarse o necrosarse. Las lesiones cutáneas se acompañan de fiebre, linfadenopatía, hepatoesplenomegalia y anemia. La afectación durante la enfermedad de las vías respiratorias superiores provoca daños en los cartílagos y huesos nasales, así como epistaxis. En caso de tratamiento efectivo, las lesiones suelen curarse y cicatrizar. El examen histológico puede revelar vasculitis con proliferación endotelial. En el estadio avanzado pueden observarse hemorragias subcutáneas y trombos, y la presencia de M. leprae en el endotelio. La reacción de tipo 3 a menudo resulta mortal.
DIAGNÓSTICOArriba
En áreas endémicas, la lepra se diagnostica con mayor frecuencia sobre la base del cuadro clínico, mientras que en áreas donde la enfermedad es rara o puede ser importada, el diagnóstico se facilita mediante la realización de exploraciones complementarias.
Exploraciones complementarias
1. Identificación del agente etiológico:
1) Examen microscópico: en el caso de lepra multibacilar, las micobacterias pueden visualizarse al microscopio óptico en preparaciones de material obtenido de lesiones cutáneas o de la mucosa nasal. El frotis suele realizarse a partir de un líquido tomado a través de una incisión en la piel (slit-skin smears, SSS). Se realiza una incisión en la piel con un bisturí en un lugar desprovisto de fuerte perfusión y, a continuación, con la punta del bisturí, se extrae el contenido de la incisión y se extiende en un portaobjetos; el preparado se tiñe mediante el método Ziehl-Neelsen. En la lepra paucibacilar por lo general no se pueden ver las micobacterias. Durante muchos años se prefirió obtener material para el examen de los pabellones auriculares, aun cuando macroscópicamente no parecían estar afectados. Normalmente se recomienda recoger material de 2-4 sitios, incluyendo 1 de una lesión cutánea y 1 del lóbulo de la oreja. Los preparados se valoran mediante un índice bacteriano (de 1+ a 6+; sirve para estimar la masividad de la infección y la respuesta terapéutica) y un índice morfológico (porcentaje de bacterias viables en relación al total de bacterias, incluidas las muertas y dañadas; se utiliza para evaluar la eficacia del tratamiento; en enfermos con lepra lepromatosa no tratados es del 4-5 %). La prueba cuantitativa se realiza con aceite de inmersión con un aumento de ×100. La mayoría de los pacientes tienen un resultado SSS negativo. Un resultado positivo tiene importancia diagnóstica y es de gran ayuda, especialmente en personas con la enfermedad en estadio temprano, en quienes no siempre se pueden observar los principales síntomas de la lepra. Un resultado SSS positivo indica una forma de lepra multibacilar, independientemente de las características de las lesiones cutáneas y de la afectación nerviosa.
2) Pruebas moleculares: la PCR es un método de diagnóstico sensible, aunque en la lepra paucibacilar su sensibilidad es del 34-80 %. Permite detectar resistencia a la rifampicina (en ~5 % depende de la mutación del gen rpoB, que codifica la subunidad β de la ARN-polimerasa de la micobacteria) y a la dapsona (resistencia relacionada con el gen folP1). La PCR no es una prueba rutinaria en el diagnóstico de la lepra, y su resultado debe interpretarse junto con los datos clínicos. No está estandarizada y no existen pruebas comerciales ampliamente disponibles. El examen del material de la SSS o de una biopsia es más preciso que el de la sangre y la orina.
3) Cultivo: M. leprae no se puede cultivar en medios artificiales, para su cultivo se utilizan ratones o armadillos de nueve bandas. Es posible determinar su sensibilidad a los antibióticos. Debido al largo tiempo de generación de la micobacteria esta evaluación lleva varios meses.
4) Pruebas serológicas: detección de anticuerpos anti-PGL-1. La sensibilidad en la lepra lepromatosa es de ~70 %, pero ya el examen microscópico suele ser concluyente. En la forma tuberculoide, la baja sensibilidad de las pruebas serológicas (estos enfermos rara vez producen anticuerpos anti-PGL-1) impide su uso. Un resultado positivo de anticuerpos anti-PGL-1 se considera predictivo de daño nervioso.
2. Otras:
1) Examen histológico: la imagen varía mucho según la forma de lepra. El resultado de la prueba siempre debe evaluarse junto con el cuadro clínico, a menudo es concluyente cuando no hay síntomas importantes de lepra y, a veces, confirma un diagnóstico diferencial. Se deben tomar biopsias cutáneas de las partes más activas de la lesión (áreas enrojecidas, infiltradas), generalmente de los bordes de la lesión; también deben contener tejido subcutáneo. Las micobacterias se pueden visualizar en la preparación. El método de tinción de Fite-Faraco es más sensible que el de Ziehl-Neelsen. Si se está considerando una biopsia de nervio, se recomienda seleccionar un nervio cutáneo engrosado para minimizar el riesgo de posibles complicaciones. Lesiones observadas en las diferentes formas de lepra:
a) Lepra indeterminada: infiltrados perivasculares y perineurales, sin granulomas; linfocitos a menudo visibles dentro de los nervios, se pueden detectar micobacterias.
b) Lepra tuberculoide: granulomas directamente debajo de la epidermis, que pueden ulcerarse, y más profundos alrededor de los vasos y nervios. Los histiocitos se agrupan en células epitelioides, a veces fusionándose en células gigantes, rodeadas de linfocitos. Son visibles células gigantes de Langerhans. Los nervios periféricos pueden estar significativamente engrosados e infiltrados por linfocitos. A veces se observa necrosis central en los granulomas. Raramente se detectan micobacterias.
c) Lepra lepromatosa: macrófagos espumosos de color gris azulado que forman infiltrados difusos o nodulares, una cantidad significativa de material lipídico micobacteriano insuficientemente procesado, linfocitos escasos. Es visible un signo en la zona (la llamada zona de Grenz) entre la epidermis y la dermis. En la dermis se observan signos de inflamación crónica y células llenas de bacterias que no se encuentran en la hipodermis. Como resultado de la laminación, el perineuro presenta el aspecto de una piel de cebolla. Las micobacterias de la lepra son numerosas y agrupadas. El examen inmunohistoquímico puede mostrar infiltrados compuestos principalmente por linfocitos T CD8+.
2) Prueba de lepromina: actualmente rara vez se usa. Tras la administración de 0,1 ml de una suspensión estandarizada de micobacterias inactivadas de la lepra, se observa una reacción de hipersensibilidad retardada en forma de pápulas de color rojo oscuro después de 3-4 semanas (reacción de Mitsuda). Actualmente esta reacción cutánea se considera la expresión de una respuesta inmunitaria celular a los antígenos de las micobacterias de la lepra, y no una confirmación de la infección. En la lepra tuberculoide, la reacción es muy pronunciada, pero puede no ocurrir en la lepra dimorfa y lepromatosa.
3) Pruebas de imagen: ecografía y RMN para la evaluación de los nervios, radiografía y TC para la evaluación de los cambios óseos.
4) EMG: la prueba de conducción nerviosa es la prueba de elección, pero en países endémicos generalmente no es posible realizarla.
5) Pruebas de laboratorio: en el ENL aparece leucocitosis, anemia, niveles elevados de proteína C reactiva y actividad de las aminotransferasas séricas.
6) Esquemas de localización de lesiones cutáneas y neurológicas (body-map o body-charting): se marcan la ubicación, el tamaño y el tipo de las lesiones cutáneas, la ubicación del agrandamiento de los nervios y los signos de su daño. Esto permite evaluar la eficacia del tratamiento. Al evaluar los nervios periféricos se debe determinar su engrosamiento y pérdida de función. En todos los pacientes con sospecha de lepra, y luego durante las visitas de seguimiento, se debe palpar cuidadosamente el recorrido de los nervios. El sistema muscular se puede evaluar utilizando p. ej. la escala MRC para la valoración de la fuerza muscular.
Criterios diagnósticos
1. Criterios de la OMS. La lepra se puede diagnosticar cuando se observa ≥1 de las siguientes manifestaciones:
1) pérdida de sensibilidad en la zona de las lesiones decoloradas o enrojecidas
2) engrosamiento de los nervios periféricos con pérdida de sensibilidad y/o debilitamiento de los músculos inervados por estos nervios
3) presencia de micobacterias ácido-alcohol resistentes en el SSS.
2. Criterios NIPH-NIH (Instituto Nacional de Salud Pública - Instituto Nacional de Higiene de Polonia) de 2007: un caso confirmado de lepra incluye un criterio clínico (cuadro clínico de acuerdo con el descrito a continuación) y confirmación de laboratorio.
1) Criterios clínicos. En una persona no tratada ≥1 de las siguientes manifestaciones:
a) lesiones cutáneas características (lepromas): placas decoloradas o enrojecidas, con mayor frecuencia ubicadas asimétricamente en la cara y el torso, con pérdida permanente de la sensibilidad
b) afectación de los nervios periféricos superficiales: engrosamiento de los nervios, dolor, pérdida de sensibilidad.
2) Criterios de laboratorio: aislamiento de micobacterias ácido-alcohol resistentes a partir de frotis cutáneos o biopsias de la piel afectada.
Diagnóstico diferencial
1. Lesiones cutáneas:
1) de etiología infecciosa: tuberculosis cutánea, sífilis, pian, dermatofitosis, blastomicosis, pitiriasis versicolor, filariasis, leishmaniasis
2) de etiología no infecciosa: vitiligo, psoriasis, sarcoidosis, esclerodermia, granuloma anular, granuloma multiforme.
2. Lesiones neurológicas: síndrome de Déjérine-Sottas, neuropatía sensorial hereditaria, siringomielia, neuropatía alcohólica, neuropatía diabética, amiloidosis primaria, lesión del nervio cubital, lesión del plexo braquial, lesión de la costilla cervical, atrapamiento del nervio, tabes dorsal.
TRATAMIENTOArriba
Tratamiento etiológico
La monoterapia no está permitida. Los medicamentos de primera línea son la dapsona, la rifampicina y la clofazimina (que tiene principalmente efecto antinflamatorio y, en menor medida, bactericida). La rifampicina es el fármaco bactericida básico y, tras unos días de tratamiento, las micobacterias suelen ser indetectables, incluso en la lepra lepromatosa.
Antes de iniciar el tratamiento, se debe descartar la tuberculosis y, si se diagnostica, asegurarse de que el paciente sea tratado con un esquema efectivo para ambas enfermedades con el fin de evitar el riesgo de desarrollar una tuberculosis multirresistente.
La elección del tratamiento de la lepra se basa en la clasificación del tipo de enfermedad a partir de la OMS (→tabla 19.2-1) y la farmacorresistencia.
1. Esquema preferido a partir de las guías de la OMS: rifampicina 600 mg VO 1 × mes junto con dapsona 100 mg VO cada 24 h y clofazimina 50 mg VO cada 24 h y adicionalmente 300 mg VO 1 × mes. Duración del tratamiento: lepra paucibacilar, 6 meses; lepra multibacilar, 12 meses.
2. Tratamiento en caso de resistencia, a partir de las guías de la OMS →tabla 19.2-2.
Durante el tratamiento con un esquema alternativo está indicado el seguimiento por ECG para la prolongación del intervalo QT. Después de las primeras semanas de tratamiento con clofazimina, en >75 % de los enfermos aparece una decoloración marrón rojiza dentro de las lesiones. El color de la piel suele volver a la normalidad transcurridos 6-12 meses después de finalizar el tratamiento, pero a veces se prolonga durante más tiempo (incluso años). La decoloración es una de las causas más comunes para suspender el tratamiento, especialmente en mujeres jóvenes. La clofazimina también provoca trastornos en el tracto digestivo asociados a la deposición de cristales del fármaco en sus paredes y una queratosis excesiva de la piel.
3. La recidiva se define como el desarrollo de nuevas lesiones cutáneas junto con el aumento del índice bacteriano tras finalizar el tratamiento tuberculostático. Las recidivas no son frecuentes, ocurren en ~0,5 % de los enfermos en los 2-5 años posteriores a la finalización del tratamiento. No se realiza ningún examen microscópico de seguimiento del material de SSS al final del tratamiento. Para tratar la recidiva se utiliza el mismo esquema de tratamiento que en la lepra multibacilar. Es importante distinguir la recidiva de una leprorreacción de tipo 1; en caso de duda, se recomienda la SSS, también se puede intentar el tratamiento con glucocorticoides.
4. Tratamiento de las leprorreacciones:
1) Reacción de tipo 1: prednisolona 40-60 mg/d, después de 2 semanas reducir la dosis en 5 mg cada 14 días, dependiendo de la rapidez con que desaparezcan los síntomas. La duración de la terapia suele ser de 6 meses. Alternativamente, se puede usar metotrexato o ciclosporina (si no hay respuesta a los glucocorticoides). Si es necesario prolongar el tratamiento se utiliza p. ej. azatioprina.
2) Reacción de tipo 2: se recomienda talidomida 100-400 mg/d, a veces en combinación con glucocorticoides como prednisolona 40 mg/d durante 14 días con reducción gradual de la dosis (los síntomas pueden reaparecer cuando se reduce la dosis). En casos graves es necesario usar talidomida durante muchos meses, con una reducción de dosis de 100 mg cada 20-30 días. Debido al efecto teratogénico del fármaco, se requiere una anticoncepción eficaz en mujeres en edad reproductiva. En el ENL recurrente, en el momento de la reducción de la dosis de glucocorticoides, se recomienda incluir clofazimina 200-300 mg/d, como máximo durante 12 meses.
3) Reacción de tipo 3: los glucocorticoides son el tratamiento de elección.
En cualquier reacción se debe continuar el tratamiento tuberculostático.
Tratamiento sintomático
1. Recomendaciones generales. Los pacientes con afectación nerviosa requieren fisioterapia para las extremidades paralizadas o las contracturas musculares existentes y un cuidado intensivo de la piel, especialmente en las partes distales del cuerpo. Hay que tener cuidado para evitar heridas y otras lesiones. Las úlceras tróficas requieren tratamiento como en otras enfermedades. El cuidado personal adecuado, la modificación de las actividades diarias, el cuidado de la higiene y la hidratación de la piel son fundamentales. En caso de deformidades de los dedos del pie (→fig. 19.2-3), es necesario el uso de calzado ortopédico. Los pacientes con cierre insuficiente de las fisuras palpebrales requieren protección ocular (lágrimas artificiales durante el día y pomada ocular por la noche para prevenir la queratitis).
2. Tratamiento farmacológico:
1) el diagnóstico temprano del deterioro de la función nerviosa requiere el uso de glucocorticoides para prevenir el daño y la discapacidad posterior (el daño nervioso que dura >6 meses no responde a la corticoterapia)
2) la iridociclitis se trata inmediatamente con preparaciones que dilatan la pupila y glucocorticoides tópicos
3) úlceras cutáneas: limpieza de la herida y antibióticos cuando sea necesario
4) dolor neuropático (en ~20 % de los enfermos): tratamiento analgésico.
3. Tratamiento quirúrgico: reconstrucción de las partes cartilaginosas y óseas de la nariz, restablecimiento de la apertura de las fisuras palpebrales mediante sutura parcial de los párpados, corrección de la mano en garra o del pie caído mediante injerto de tendón.
COMPLICACIONESArriba
Cierre insuficiente de las fisuras palpebrales, cataratas y ceguera, mano en garra, pie caído, autoamputación de los dedos (→fig. 19.2-2, →fig. 19.2-3, →fig. 19.2-4), esterilidad masculina, deformación facial, pérdida de cabello, daño renal, debilidad muscular.
PRONÓSTICOArriba
En la lepra, el pronóstico de curación de la infección es bueno. Las recidivas son raras, al igual que la muerte en las etapas tempranas de la enfermedad. La muerte suele ser el resultado de sepsis en úlceras no tratadas, y también se han reportado muertes por reacciones graves a medicamentos, principalmente a la dapsona.
A pesar de la elevada tasa de curación, la discapacidad física sigue siendo frecuente.
PREVENCIÓNArriba
Métodos específicos
1. Vacunación preventiva: no existe. La vacuna BCG contra la tuberculosis ofrece diversos grados de protección, posiblemente sobre todo contra la infección durante un contacto estrecho.
2. Profilaxis farmacológica: una dosis única de rifampicina (single dose rifampicin, SDR) reduce el riesgo de infección en las personas de contacto, aunque no es un efecto permanente. Es probable que el efecto protector de la vacuna BCG y de la rifampicina se sume. Actualmente se recomienda una dosis única de rifampicina (600 mg VO) como tratamiento profiláctico para adultos y niños >2 años en caso de contacto con un paciente de lepra. Es obligatorio excluir la infección por M. tuberculosis y M. leprae antes de administrar el medicamento. En el estudio COLEP, el uso de SDR redujo el riesgo de lepra en un 57 % a los 2 años de seguimiento y en un 30 % a los 5-6 años de seguimiento. La protección aumenta al 80 % si se recibe la vacuna BCG al nacer.
Métodos no específicos
1. Aislamiento de enfermos: generalmente no se requiere, en caso de que sea necesaria la hospitalización de un enfermo con lepra lepromatosa no tratado, algunos expertos recomiendan un aislamiento de hasta ≥72 horas desde el inicio del tratamiento. Los enfermos tratados y con lepra paucibacilar no requieren aislamiento.
2. Medidas de protección personal: estándar.
Tamizaje
La OMS no recomienda pruebas de diagnóstico para contactos asintomáticos.
Notificación obligatoria
No.
TABLAS Y FIGURAS
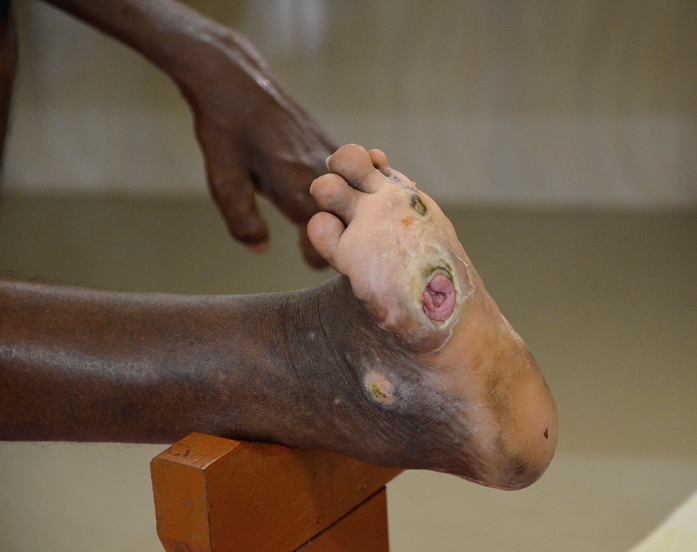
Fig. 19.2-1. Lesiones de lepra en el pie (foto: Waldemar Kus SVD)

Fig. 19.2-2. Deformidad de nariz y mano en una enferma con lepra (foto: Waldemar Kus SVD)
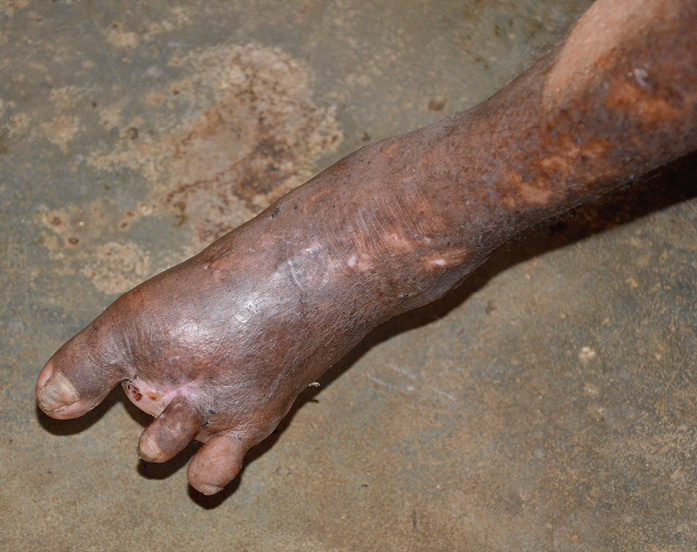
Fig. 19.2-3. Deformidad de los dedos del pie en un enfermo con lepra (foto: Waldemar Kus SVD)
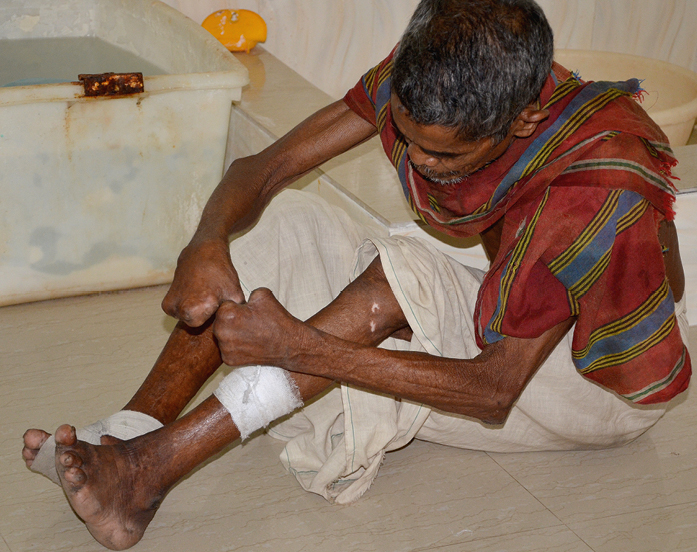
Fig. 19.2-4. Enfermo con lepra tras la autoamputación de los dedos de las manos y los pies (foto: Waldemar Kus SVD)
Clasificación de las formas de lepra a partir de la OMS y comparación con la clasificación de Ridley-Jopling
|
Formas de lepra a partir de la OMS
|
Lepra paucibacilar (LP)
|
Lepra multibacilar (LM)
|
|
Criterios
|
1-5 lesiones cutáneas
Sin micobacterias en SSS
|
>5 lesiones cutáneas
y/o
afectación nerviosa
y/o
micobacterias en SSS
|
|
Formas correspondientes a partir de la clasificación de Ridley-Jopling
|
LT, BT
|
BB, BL, LL
|
|
BB — lepra borderline, BL — lepra lepromatosa borderline, BT — lepra tuberculoide borderline, LL — lepra lepromatosa, LT — lepra tuberculoide, SSS (slit-skin smears) — frotis de material (líquido) tomado de la incisión de la piel
|
Tratamiento de la lepra resistente a la rifampicina o a la rifampicina y la ofloxacina a partir de las guías de la OMS
|
Resistencia
|
Tratamiento
|
Observaciones
|
|
Primeros 6 meses
|
Siguientes 18 meses
|
|
|
A la rifampicina
|
Ofloxacina 400 mg VO cada 24 h +
Minociclina 100 mg VO cada 24 h +
Clofacimina 50 mg VO cada 24 h
|
Ofloxacina 400 mg VO cada 24 h (o
Minociclina 100 mg VO cada 24 h) +
Clofacimina 50 mg VO cada 24 h
|
A elegir entre 1 de 2 esquemas (con minociclina o claritromicina);
La ofloxacina puede sustituirse por levofloxacina 500 mg o moxifloxacina 400 mg
|
|
Ofloxacina 400 mg VO cada 24 h +
Claritromicina 500 mg VO cada 24 h +
Clofazimina 50 mg VO cada 24 h
|
Ofloxacina 400 mg VO cada 24 h (o claritromicina 500 mg VO cada 24 h) +
Clofazimina 50 mg VO cada 24 h
|
|
|
A la rifampicina y la ofloxacina
|
Claritromicina 500 mg VO cada 24 h +
Minociclina 100 mg VO cada 24 h +
Clofacimina 50 mg VO cada 24 h
|
Claritromicina 500 mg VO cada 24 h (o minociclina 100 mg VO cada 24 h) +
Clofacimina 50 mg VO cada 24 h
|
No administrar fluoroquinolonas
|
 Español
Español
 English
English
 українська
українська








