DefiniciónArriba
El cáncer de mama (seno) es una neoplasia maligna originada en el epitelio derivado de los conductos o lobulillos mamarios.
EpidemiologíaArriba
El cáncer de mama se desarrolla sobre todo en mujeres, también de forma esporádica en hombres.
EtiopatogeniaArriba
Casi el 75 % de las enfermas con cáncer de mama no presentan factores de riesgo actualmente reconocidos. Factores de riesgo incluyen
1) Edad: aumento de la incidencia en >35 años con pico de incidencia entre los 50-70 años.
2) Factores genéticos:
a) Antecedente familiar de cáncer de mama (en ~10 % de los casos), principalmente en familiares de 1.er grado (con un familiar, el riesgo es 1,8 veces mayor; con dos familiares, ~2,9 veces mayor). El riesgo se incrementa aún más si el diagnóstico se da en <35 años.
b) Cáncer de mama hereditario: puede asociarse con otras neoplasias, como cáncer de ovario, de cuerpo uterino, próstata o colon. Se considera que se debe a mutaciones patogénicas en los genes (sobre todo BRCA1 y BRCA2, más raramente TP53, PTEN, STK11, LKB1 y CDH1, ATM, CHEK2, PALB2). En portadoras de mutaciones patogénicas en BRCA el riesgo de cáncer de mama a lo largo de la vida es del 50-85 %; en caso de mutaciones patogénicas en otros genes, el riesgo es significativamente menor. Existen varios síndromes hereditarios en los que se presenta el cáncer de mama (síndrome de Li-Fraumeni, de Lynch tipo II, de Cowden, de Peutz-Jeghers, ataxia-telangiectasia, y de Klinefelter).
3) Factores hormonales:
a) Endógenos: menarquia precoz o menopausia tardía (>55 años), nuliparidad o maternidad tardía (>30 años).
b) Exógenos: anticonceptivos orales con estrógenos (inducción de neoplasia o efecto carcinógeno en lesiones preneoplásicas preexistentes), terapia de reemplazo hormonal prolongada (en función del tiempo de exposición a los estrógenos, el riesgo que se asocia a los factores exógenos puede elevarse desde unos pocos puntos porcentuales hasta ~30 %).
4) Obesidad (en particular en mujeres posmenopáusicas) y actividad física insuficiente.
5) Enfermedades proliferativas: la hiperplasia aumenta el riesgo de cáncer de mama, mientras que la proliferación intraductal con atipia se considera lesión preneoplásica.
6) El antecedente de cáncer de mama aumenta considerablemente el riesgo de desarrollar cáncer en otro seno.
7) Dieta: en ciertos estudios prospectivos se ha demostrado que el riesgo de cáncer de mama aumenta en mujeres que consumen mayoritariamente grasas animales e ingieren alcohol, mientras que el consumo de lácteos bajos en grasa y de alimentos que contienen calcio y vitamina D puede tener un efecto protector. No existen pruebas seguras de que la dieta vegetal (incluidos los productos de soja y otros con fitoestrógenos) ejerza un efecto protector.
8) Consumo abusivo de alcohol.
PERSPECTIVA LATINOAMERICANA
Se ha reportado que en países latinos existe una mayor incidencia en pacientes jóvenes (<40 años) con respecto al resto del mundo.
Cuadro clínicoArriba
Síntomas y signos típicos:
1) tumor de mama palpable
2) cambio de tamaño, forma o elasticidad de la mama
3) retracción de la piel o de la areola (→fig. 24.5-1A)
4) lesiones cutáneas en la areola o en su alrededor (→fig. 24.5-1B)
5) secreción por el pezón (particularmente hemática)
6) enrojecimiento y engrosamiento de la piel (signo de la "piel de naranja"; →fig. 24.5-1C)
7) dilatación de las venas de la piel de mama
8) ulceración de la piel de la mama (→fig. 24.5-1D)
9) adenopatías axilares.
Historia naturalArriba
El cáncer de mama no tratado inevitablemente lleva a la muerte. En función de sus rasgos biológicos puede presentar un crecimiento lento o rápido; puede llevar paulatinamente a la aparición de ulceraciones y a la destrucción de la glándula y de las estructuras vecinas (p. ej. de la pared torácica). En caso de infección o hemorragia masiva, puede ocasionar la muerte. Si la enferma sobrevive, aparecen metástasis a distancia.
DiagnósticoArriba
La sospecha de neoplasia puede ser mediante la detección de un nódulo mamario o de una lesión cutánea, con frecuencia advertida por la propia paciente, o la detección de un cambio anormal en el tamizaje con mamografía o en una ecografía de mama realizada por otras indicaciones. El diagnóstico se confirma con el examen histológico del material extraído mediante biopsia con aguja gruesa (incluida la biopsia asistida por vacío [por mammotome]). En la actualidad, se utiliza la punción aspirativa con aguja fina y evaluación citológica únicamente para verificar los ganglios linfáticos regionales sospechosos.
Otras exploraciones complementarias (de laboratorio y de imagen) tienen por objetivo determinar el estadio de la enfermedad y el funcionamiento de los órganos antes de comenzar el tratamiento. La estadificación del cáncer de mama se determina basándose en la clasificación TNM (→tabla 24.5-1).
Exploraciones complementarias
1. Mamografía: el examen básico en el diagnóstico del cáncer de mama. Debe realizarse en 2 proyecciones: oblicua y craneocaudal. Los principales signos sugestivos de cáncer de mama visibles en la imagen mamográfica son:
1) áreas de densidad de tejidos blandos no bien delimitadas. Lo más característico son los nódulos espiculados (con un centro irregular y numerosas espículas; →fig. 24.5-2); aproximadamente un 90 % de este tipo de lesiones son de carácter invasivo; los nódulos sólidos y bien delimitados suelen ser de carácter benigno
2) microcalcificaciones: presentes en un ~60 % de los casos de cáncer de mama; las microcalcificaciones lineales o grumosas sugieren un carácter maligno, mientras que las calcificaciones en la piel y vasos sanguíneos, o las calcificaciones grandes y bien delimitadas, anulares, moteadas, redondeadas u ovales no son sospechosas de malignidad.
La sensibilidad y la especificidad de la mamografía estándar aumentan en caso de utilizar imágenes seriadas en capas (tomosíntesis) o un contraste yodado.
2. Ecografía →fig. 24.5-3. Suele complementar la mamografía y no es un método diagnóstico independiente en casos de sospecha del cáncer de mama. Permite diferenciar lesiones sólidas (fibroadenomas) y de carácter líquido (quistes), así como guiar las biopsias con aguja. Resulta útil para examinar mamas con tejido glandular muy denso (en mujeres jóvenes), cuya evaluación mamográfica es difícil.
3. RMN: es la exploración con mayor sensibilidad (~95 %), realizada en mujeres pertenecientes al grupo de riesgo del cáncer de mama alto o muy alto (p. ej. mutación de los genes BRCA1 y BRCA2), y también en mujeres previamente sometidas a cirugía plástica o de reconstrucción de senos (p. ej. prótesis mamaria). Desempeña un papel importante en la valoración de la extensión de la infiltración neoplásica (en particular cuando los resultados de la valoración mamográfica y ecográfica no concuerdan). Además, es útil para el diagnóstico diferencial de la recidiva local y de los cambios atípicos posradioterapia.
4. Estudio anatomopatológico. Clasificación histológica del cáncer de mama:
1) carcinomas preinvasivos (~20 %): ductal, lobulillar
2) carcinomas invasivos (infiltrantes) (~80 %): cáncer invasivo no especificado (invasive carcinoma of no special type, NST), lobulillar, medular, mucinoso, tubular, otros tipos poco frecuentes.
Entre los cánceres invasivos de mama, los tipos histológicos de mejor pronóstico son el cáncer medular, el mucinoso y el tubular.
El cáncer lobulillar a veces presenta mayores dificultades diagnósticas y, a diferencia del carcinoma ductal, presenta menor incidencia de microcalcificaciones. Aún queda por establecer cuáles son los criterios de valoración de su malignidad histológica, no pudiendo determinarse factores pronósticos y predictivos relevantes. Las formas in situ del cáncer lobulillar actualmente no se denominan carcinomas (se propone el nombre de "neoplasia lobulillar"), y el tratamiento quirúrgico no siempre es necesario en estos casos (a no ser que pueda coexistir con un cáncer infiltrante o con un cáncer ductal in situ).
5. Estudios moleculares. Los estudios inmunohistoquímicos permiten distinguir los principales subtipos de cáncer de mama: luminal A, luminal B, HER2-positivo no luminal y triple negativo. Esta división constituye la base para la individualización del tratamiento sistémico moderno pre- y posoperatorio. Además, se distingue un subtipo HER2-low (expresión de la proteína HER2 <3, sin amplificación del gen HER2), que supone ~50 % de todos los casos de cáncer de mama y responde a algunos fármacos anti-HER2.
6. Pruebas de laboratorio. No se recomienda determinar marcadores séricos (p. ej. CA 15-3 o CEA) en el diagnóstico rutinario del cáncer de mama.
TratamientoArriba
Tratamiento quirúrgico
En general, el tratamiento quirúrgico en el cáncer de mama consta de dos componentes: cirugía de la mama (mastectomía o cirugía conservadora de mama) y cirugía de la axila (linfadenectomía axilar o biopsia del ganglio centinela). Ambos componentes terapéuticos se seleccionan de manera independiente, en función de la estadificación de la enfermedad y de otros factores.
El procedimiento estándar en pacientes sin sospecha clínica de diseminación ganglionar axilar es la biopsia del ganglio centinela (sentinel node biopsy, SNB). Si no se detectan metástasis, se puede desistir de la linfadenectomía axilar. En algunos casos es posible no realizar la linfadenectomía axilar complementaria incluso si se ha detectado metástasis en el ganglio centinela. Ante la presencia de metástasis clínicamente evidentes en la axila el tratamiento estándar es la linfadenectomía axilar.
1. Cirugía conservadora de mama. El diagnóstico oportuno del cáncer de mama no solo permite aumentar la tasa de curación, sino que también hace posible una cirugía menos mutilante, con una menor tasa de complicaciones locales y mejor resultado estético. El tratamiento conservador (breast conserving treatment, BCT) consiste en extirpar la neoplasia rodeada de tejido sano libre de enfermedad y realizar la biopsia del ganglio centinela o en resecar los ganglios linfáticos axilares. Todos los procedimientos BCT deben complementarse con radioterapia posoperatoria de la mama.
El BCT puede tomarse en consideración en los estadios 0, I y II, normalmente con la condición de que el diámetro mayor del tumor en la imagen mamográfica no sobrepase los 3-5 cm (es importante la proporción entre las dimensiones del tumor y de la mama). Otras condiciones: posibilidad de extirpar el tumor con un margen suficientemente amplio, buen resultado estético esperado, ausencia de contraindicaciones (p. ej. cáncer multifocal, recidiva extensa tras un tratamiento conservador previo, irradiación previa de la mama). Es necesario ampliar el área de resección del tumor en caso de que los bordes de la pieza quirúrgica se encuentren afectados por focos de cáncer ductal preinvasivo o infiltrante. Actualmente se admite la aplicación de BCT en pacientes inicialmente no aptas para este tipo de tratamiento debido a las dimensiones del tumor, pero que se ha logrado reducirlo con el tratamiento sistémico inductivo.
2. Mastectomía. Entre las cirugías de amputación de la mama la más frecuente es la mastectomía radical modificada (tipo Madden), que consiste en amputar la mama junto con los ganglios linfáticos axilares conservando los músculos pectorales mayor y menor. Una contraindicación es la infiltración neoplásica de la fascia del músculo pectoral mayor.
A menudo se realiza también la mastectomía simple (es decir, la extirpación de la glándula sin disección de ganglios axilares), la cual suele combinarse con una biopsia simultánea del ganglio centinela. También se realizan cirugías que consisten en la resección de toda la glándula mamaria con una reconstrucción inmediata de la mama (la denominada mastectomía con ahorro de piel [skin-sparing mastectomy, SSM] o con ahorro de piel y pezón [nipple-sparing mastectomy, NSM]) mediante la colocación de un expansor o de una prótesis definitiva. Dichas cirugías se combinan con el pertinente tratamiento en la región axilar. A menudo la reconstrucción incluye también la llamada simetrización mamaria (es decir, el aumento o la disminución de la mama sana para conseguir la simetría de ambas mamas).
En caso de tumores de tamaño muy grande e infiltración extensa del músculo pectoral mayor, una vez administrada la terapia sistémica de inducción (quimioterapia, hormonoterapia y —en caso de HER2+ [→más adelante]— un fármaco anti-HER2), puede realizarse la mastectomía radical de tipo Madden o Halsted (extirpación de toda la mama con los músculos pectorales y el tejido de la cavidad axilar incluyendo los ganglios linfáticos).
En general, se considera que la cirugía radical debe realizarse en pacientes en estadios I y II en la primera etapa del tratamiento, y en pacientes en estadio III tras un tratamiento sistémico inductivo exitoso. No obstante, el desarrollo del tratamiento preoperatorio ha hecho que el mismo también se utilice cada vez más frecuentemente antes de la cirugía en pacientes con una neoplasia de menor extensión local (p. ej. estadio II).
3. Operaciones paliativas. Los procedimientos paliativos se realizan en casos seleccionados de cáncer de mama generalizado (p. ej. recidiva en la pared torácica o compresión medular), cuando la expectativa de supervivencia es al menos de varios meses. Se usan equipos ortopédicos en caso de fracturas patológicas o para prevenirlas. En pacientes con ulceraciones sangrantes y fétidas se realiza la denominada mastectomía de aseo (mastectomía simple, es decir, la resección de mama sin extirpar los músculos pectorales ni el contenido de la cavidad axilar). En las guías se admite la posibilidad de resección radical del foco primario en pacientes con metástasis óseas poco numerosas y buena respuesta a la quimioterapia, lo cual no es un procedimiento habitual. No se recomienda realizar tratamiento quirúrgico en pacientes con enfermedad primaria generalizada (es decir, sin tratamiento sistémico previo y sin evaluación de la respuesta al mismo).
Radioterapia
La radioterapia posoperatoria (adyuvante) se aplica en estadios localmente avanzados de la neoplasia, cuando no hay certeza en cuanto a la radicalidad de la resección, y en la fase temprana de la enfermedad tras realizar BCT.
Indicaciones para una radioterapia adyuvante:
1) metástasis en ≥4 ganglios linfáticos
2) diámetro del tumor resecado >5 cm
3) presencia de células neoplásicas en los bordes de resección.
La irradiación se puede considerar en aquellos casos con <4 ganglios linfáticos afectados en pacientes jóvenes o cuando coexistan otros factores desfavorables.
Se puede considerar la no aplicación de la radioterapia tras una cirugía conservadora de mama en pacientes mayores o en caso de cáncer ductal altamente diferenciado.
Se emplea la radioterapia paliativa en pacientes con metástasis en el SNC u óseas (efecto analgésico), y en los síndromes de compresión causados por lesiones neoplásicas.
Tratamiento sistémico
1. Tratamiento sistémico adyuvante: se utiliza en casi todos los casos con el fin de erradicar micrometástasis clínicamente no detectables, que pueden existir ya en las fases iniciales del desarrollo del cáncer. El tratamiento preoperatorio es cada vez más frecuente (sobre todo para aumentar el porcentaje de pacientes aptas para BCT).
La quimioterapia actualmente desempeña un menor papel debido a la introducción del tratamiento hormonal. Una indicación para la quimioterapia adyuvante son en particular los cánceres “triple negativos” (→Situaciones especiales). La quimioterapia también se administra de forma rutinaria en combinación con trastuzumab y pertuzumab (fármacos anti-HER2) en pacientes con sobreexpresión del receptor 2 del factor de crecimiento epidérmico humano (HER2) en las células neoplásicas o con amplificación del gen HER2 (el denominado estado HER2-positivo). Las indicaciones para la quimioterapia dependen de la presencia de factores que elevan el riesgo de recidiva (alto grado de malignidad histológica [G3], alta actividad proliferativa [Ki67], menor expresión de los receptores de estrógeno y progesterona, metástasis en ≥4 ganglios linfáticos axilares, infiltración de los vasos linfáticos y venosos peritumorales, diámetro del tumor >5 cm). En pacientes con diagnóstico de cáncer de mama hormonodependiente aptas para el tratamiento hormonal, y en las cuales, sobre la base de factores reconocidos, no se pueden determinar indicaciones adicionales para iniciar la quimioterapia o desistir de ella, pueden tomarse en consideración las llamadas firmas genéticas (p. ej. MammaPrint u Oncotype DX). En el marco de quimioterapia adyuvante se recomienda el uso secuencial de esquemas con múltiples fármacos basados en antraciclinas y taxoides, mientras que el uso de esquemas con fluorouracilo no está justificado. En pacientes HER2-negativas con metástasis en los ganglios axilares se puede considerar la utilización de esquemas con un incremento de la intensidad de dosis. En pacientes con cáncer "triple negativo" tras quimioterapia inicial en las cuales se han detectado células neoplásicas persistentes en el estudio histológico del material posoperatorio, en el tratamiento posterior se debe administrar capecitabina.
La quimioterapia (normalmente 4-6 ciclos cada 21 días) debe iniciarse dentro de las primeras 6 semanas después del tratamiento radical local. Existen varios esquemas de quimioterapia utilizados en el tratamiento adyuvante del cáncer de mama y uno de los fármacos principales es la doxorrubicina.
La hormonoterapia adyuvante puede administrarse en pacientes con expresión confirmada de receptores de estrógeno o progesterona en las células tumorales:
1) como monoterapia sistémica en el grupo de pacientes sin metástasis ganglionares, con riesgo bajo de recidiva o diseminación a distancia
2) como tratamiento independiente o secuencial con quimioterapia en pacientes sin metástasis ganglionares, con riesgo intermedio de recidiva o diseminación a distancia
3) como tratamiento independiente o secuencial con quimioterapia en pacientes con metástasis ganglionares.
La hormonoterapia adyuvante no debe administrarse simultáneamente con quimioterapia. Es controvertido prescribir exclusivamente terapia hormonal en presencia de metástasis ganglionares, pero hay cada vez más informes que demuestran la eficacia de este procedimiento.
Métodos de hormonoterapia en el cáncer de mama
1) en mujeres premenopáusicas: administración de tamoxifeno con o sin supresión de la función ovárica mediante análogos de la GnRH (leuprorelina, goserelina)
2) en mujeres posmenopáusicas: administración de un inhibidor de la aromatasa en monoterapia o en secuencia con tamoxifeno, o de tamoxifeno solo.
La hormonoterapia adyuvante se administra durante 5 años, pero en pacientes con factores que aumentan el riesgo de recidiva puede considerarse prolongar su uso hasta 10 años.
En pacientes en las que se ha confirmado cáncer HER2 positivo, la hormonoterapia adyuvante debe combinarse con trastuzumab.
2. Tratamiento sistémico de las pacientes con cáncer de mama en estadio generalizado. En muchas pacientes con buen estado general que presentan metástasis a distancia, es posible controlar con éxito el proceso neoplásico con la ayuda de un tratamiento sistémico, el cual atenúa los síntomas de la neoplasia en estadio avanzado, puede llevar a la remisión de focos metastásicos, y prolongar significativamente la supervivencia. Fármacos tales como docetaxel, vinorelbina o capecitabina permiten alcanzar un mayor porcentaje de respuestas al tratamiento, pero a costa de complicaciones, especialmente hematológicas.
En pacientes con el receptor HER2 en la superficie de las células neoplásicas se administra trastuzumab, anticuerpo monoclonal dirigido contra este receptor. En caso de progresión tras el tratamiento con trastuzumab, en pacientes en buen estado, puede administrarse pertuzumab y trastuzumab con docetaxel, o lapatinib en combinación con capecitabina, trastuzumab emtansina o trastuzumab deruxtecán (fármacos citotóxicos), lo que permite superar la resistencia al tratamiento anterior, dirigido exclusivamente hacia HER2.
En numerosas pacientes en estadio generalizado se administra hormonoterapia. Las indicaciones para este tratamiento son la presencia de receptores de estrógeno y progesterona, evolución de su enfermedad lenta, mayor intervalo de recidiva, metástasis en partes blandas, huesos y compromiso visceral en menor proporción, contraindicaciones para la quimioterapia, y edad avanzada. En el tratamiento hormonal para el cáncer de mama generalizado se emplea tamoxifeno, fulvestrant (otro antagonista del receptor estrogénico), inhibidores de la aromatasa, ablación de los ovarios (quirúrgica o farmacológica) y progestágenos. En pacientes sin sobreexpresión del receptor HER2, en caso de progresión de la enfermedad durante el tratamiento con un inhibidor de la aromatasa, puede administrarse everólimus (inhibidor de la vía de señalización mTOR) en combinación con exemestano (fármaco hormonal) o con algún inhibidor de las cinasas dependientes de ciclinas (métodos utilizados a fin de limitar la resistencia al tratamiento hormonal).
La eficacia del tratamiento hormonal puede aumentarse con la asociación de un inhibidor del sistema de reparación del ADN (inhibidores de la poli-[ADP-ribosa]-polimerasa [PARP]: olaparib, rucaparib y niraparib), especialmente en pacientes con mutaciones patogénicas en el BRCA.
Tratamiento del cáncer de mama “triple negativo” generalizado →Situaciones especiales.
Rehabilitación
Tras el tratamiento quirúrgico radical, las pacientes requieren rehabilitación física del miembro superior ipsilateral a la cirugía a fin de evitar que se produzca edema linfático, el cual aparece en un 25 % de las enfermas (→Edema linfático).
Se realiza cirugía de reconstrucción mamaria con expansor tisular, implante o tejidos propios. La mayoría de los centros recomienda aplazar la reconstrucción hasta 12-24 meses desde la cirugía primaria para poder llevar a cabo el tratamiento adyuvante y excluir las pacientes en las que se produce una recidiva rápida.
VIGILANCIAArriba
Pruebas de control tras el tratamiento radical:
1) primeros 2 años tras la cirugía: cada 3-4 meses
2) 2-5 años tras la cirugía: cada 6 meses
3) 5-10 años tras la cirugía: cada 12 meses.
Se realiza:
1) mamografía en las pacientes
a) tras mastectomía: una vez al año
b) tras el tratamiento conservador: transcurridos 6 meses y después cada 12 meses
2) examen ginecológico y citológico del frotis del cuello uterino: cada 12 meses
3) otras pruebas: en función de las indicaciones individuales.
Situaciones especialesArriba
1. Embarazo. El cáncer de mama en embarazadas y en mujeres jóvenes se suele diagnosticar en un estadio más avanzado, lo que empeora los resultados del tratamiento (si bien se considera que el embarazo en sí mismo no empeora el pronóstico en comparación con las mujeres de la misma edad y en el mismo estadio que no están embarazadas). Esta neoplasia con mayor frecuencia presenta un fenotipo más agresivo, es normalmente mal diferenciada, sin receptores de estrógenos y progesterona, a menudo con sobreexpresión del receptor HER2. El BCT puede aplicarse en el 3.er trimestre, mientras que la radioterapia adyuvante después del parto. En los dos primeros trimestres el tratamiento de elección es la mastectomía radical. La quimioterapia adyuvante, si está indicada, puede administrarse en el 2.o y 3.er trimestre. Suele componerse de doxorrubicina y ciclofosfamida por ser fármacos de baja teratogenicidad. También existen datos sobre la posibilidad de administrar taxanos y vinorelbina. A causa del riesgo de complicaciones hematológicas en el período perinatal, se debe evitar la administración de quimioterapia a partir de la 35.a semana de gestación. La interrupción del embarazo no mejora el pronóstico.
Las mujeres curadas de un cáncer de mama coexistente con un embarazo pueden considerar de nuevo el embarazo transcurridos, como mínimo, 2-3 años (riesgo de recidiva), mientras que aquellas en las que se detectaron metástasis ganglionares deben esperar incluso hasta 5 años.
2. Cáncer de mama en hombres. Constituye ~0,5 % de los casos de cáncer de mama y se caracteriza por un curso más agresivo. El tratamiento quirúrgico típico consiste en la mastectomía radical modificada, pero actualmente se admite también el tratamiento conservador con SNB. El tratamiento sistémico se realiza según las recomendaciones utilizadas en mujeres. En el 90 % de los casos el cáncer es hormonodependiente (con más frecuencia que en mujeres). En enfermos con alto riesgo de recaída/diseminación se puede valorar la administración de quimioterapia posoperatoria, aunque no se sabe si esta ofrece ventajas sobre la hormonoterapia. Los datos sobre la administración de trastuzumab en hombres son escasos, aunque el mecanismo de acción del fármaco en enfermos con sobreexpresión del receptor HER2 no está relacionado con el sexo. En hombres con cáncer diseminado se utilizan métodos de tratamiento similares a los empleados en mujeres.
3. Cáncer de mama "triple negativo". El cáncer de mama “triple negativo” (que no expresa receptores de estrógenos, progesterona ni el receptor HER2) difiere en cuanto a rasgos biológicos y se caracteriza por un curso clínico desfavorable y un mal pronóstico. El cáncer "triple negativo" constituye un 15-20 % de todos los casos de cáncer de mama. Las indicaciones de tratamiento quirúrgico son las mismas que en otros tipos de cáncer de mama, no existiendo recomendaciones diferentes en cuanto al tratamiento adyuvante. En pacientes con cáncer "triple negativo" en estadio avanzado está justificado utilizar quimioterapia combinada con inmunoterapia o sacituzumab govitecán (conjugado de anticuerpo monoclonal y fármaco citotóxico).
PronósticoArriba
El pronóstico depende, sobre todo, de la detección temprana del cáncer, su subtipo biológico y estadio. Un 85 % de las recaídas se producen en los primeros 5 años tras finalizar el tratamiento.
Los porcentajes de supervivencia a los 5 años en función del estadio son: estadio I, el 95 %; estadio II, el 50 %; estadio III, el 25 %; estadio IV, <5 %.
TABLAS Y FIGURAS
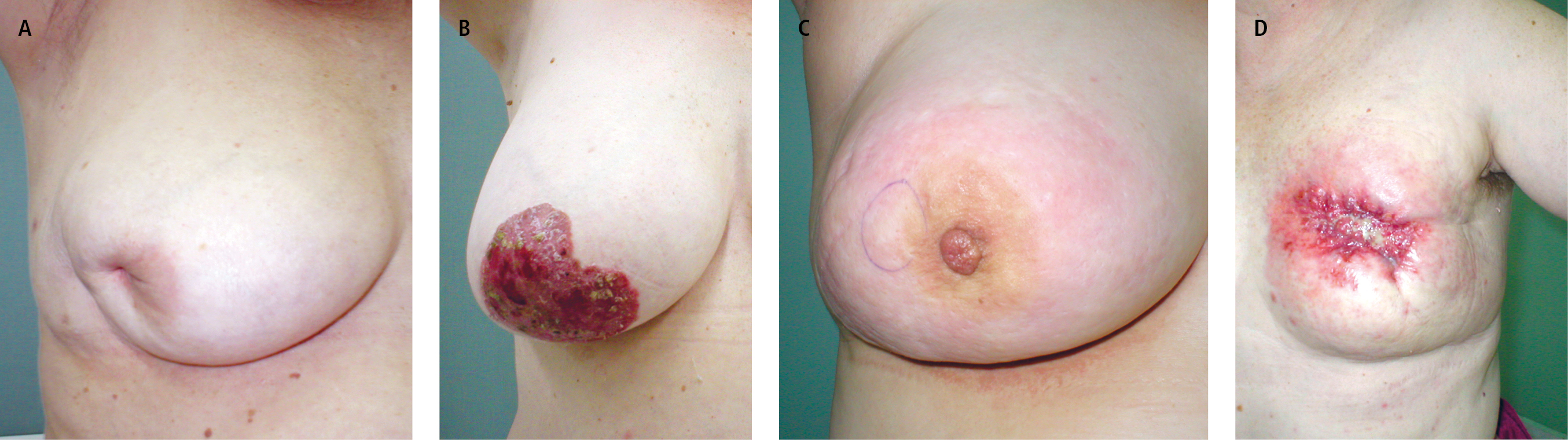
Fig. 24.5-1. Cáncer de mama. A: retracción de la piel o de la areola. B: cambios cutáneos en la areola o en su alrededor. C: enrojecimiento y engrosamiento de la piel (signo de la "piel de naranja"). D: ulceración de la piel de la mama (foto: Dr. Wojciech M. Wysocki)
Clasificación clínica de la estadificación del cáncer de mama (8.ª revisión del TNM de 2017)
|
Estadificación (anatómica)a
|
TNM
|
|
0 (in situ)
|
Tis N0 M0
|
|
I (estadio local)
|
|
|
|
IA
|
T1 N0 M0
|
|
|
IB
|
T0 N1mi M0
T1 N1mi M0
|
|
II (estadio regional temprano)
|
|
|
|
IIA
|
T0 N1 M0
T1 N1 M0
T2 N0 M0
|
|
|
IIB
|
T2 N1 M0
T3 N0 M0
|
|
III (estadio regional tardío)
|
|
|
|
IIIA
|
T0 N2 M0
T1 N2 M0
T2 N2 M0
T3 N1 M0
T3 N2 M0
|
|
|
IIIB
|
T4 N0-2 M0
|
|
|
IIIC
|
T1-4 N3 M0
|
|
IV (estadio generalizado)
|
T1-4 N1-3 M1
|
|
Rasgo T
T0: el tumor primario no se detecta
Tis: cáncer preinvasivo (in situ); cáncer ductal (ductal carcinoma in situ, DCIS), Tis [DCIS]), enfermedad de Paget sin coexistencia de un foco de cáncer infiltrante o in situ en la glándula mamaria (Tis [Paget])
T1: tumor ≤2 cm (T1mi ≤1 mm, T1a >1 mm y ≤5 mm, T1b >5 mm y ≤10 mm, T1c >10 mm y ≤20 mm)
T2: tumor >2 cm y ≤5 cm
T3: tumor >5 cm
T4: tumor de cualquier tamaño que infiltra la pared torácica o la piel (es decir, presencia de ulceración o nódulos macroscópicos cutáneos; no se consideran infiltración las retracciones de la piel o de la areola ni otras lesiones no enumeradas como infiltración; estos cambios pueden producirse en todos los estadios T1-3)
T4a: infiltración de la pared torácica (la infiltración de los músculos pectorales no se considera infiltración de la pared torácica)
T4b: infiltración de la piel (sin las características del cáncer inflamatorio)
T4c: presencia simultánea de los criterios que caracterizan T4a y T4b
T4d: cuadro de cáncer inflamatorio
|
|
Rasgo N
N0: no se detectan metástasis en los ganglios linfáticos (tras resecar ≥10 ganglios linfáticos)
N1: presencia de metástasis en los ganglios linfáticos axilares (niveles I y II) ipsilaterales al tumor, ganglios móviles (N1mi: micrometástasis [diámetro 0,2-2 mm])
N2: presencia de metástasis en los ganglios linfáticos axilares (niveles I y II) ipsilaterales al tumor; ganglios fijos entre sí o respecto a las estructuras adyacentes (N2a) o en los ganglios linfáticos mamarios internos ipsilaterales (si los ganglios axilares no están afectados) (N2b)
N3: presencia de metástasis en los ganglios axilares del nivel III (infraclaviculares) (N3a) o en los ganglios mamarios internos ipsilaterales al tumor (si los ganglios axilares de los niveles II y III están afectados) (N3b) o en los ganglios supraclaviculares ipsilaterales (N3c)
|
|
Rasgo M
M0: no se detectan metástasis a distancia en las pruebas de imagen ni en la exploración física; cM0(i+): presencia de células tumorales o depósitos de células tumorales inferiores a 0,2 mm confirmados en el examen microscópico o mediante métodos moleculares, p. ej. en la sangre circulante o en la médula ósea con ausencia de metástasis clínicas y radiológicas
M1: se detectan metástasis a distancia
|
|
a La estadificación anatómica debe aplicarse cuando no se dispone de datos sobre el perfil molecular del cáncer de mama. En caso contrario, debe utilizarse la estadificación pronóstica del cáncer de mama (debido a su complejidad, no se ha presentado aquí).
|
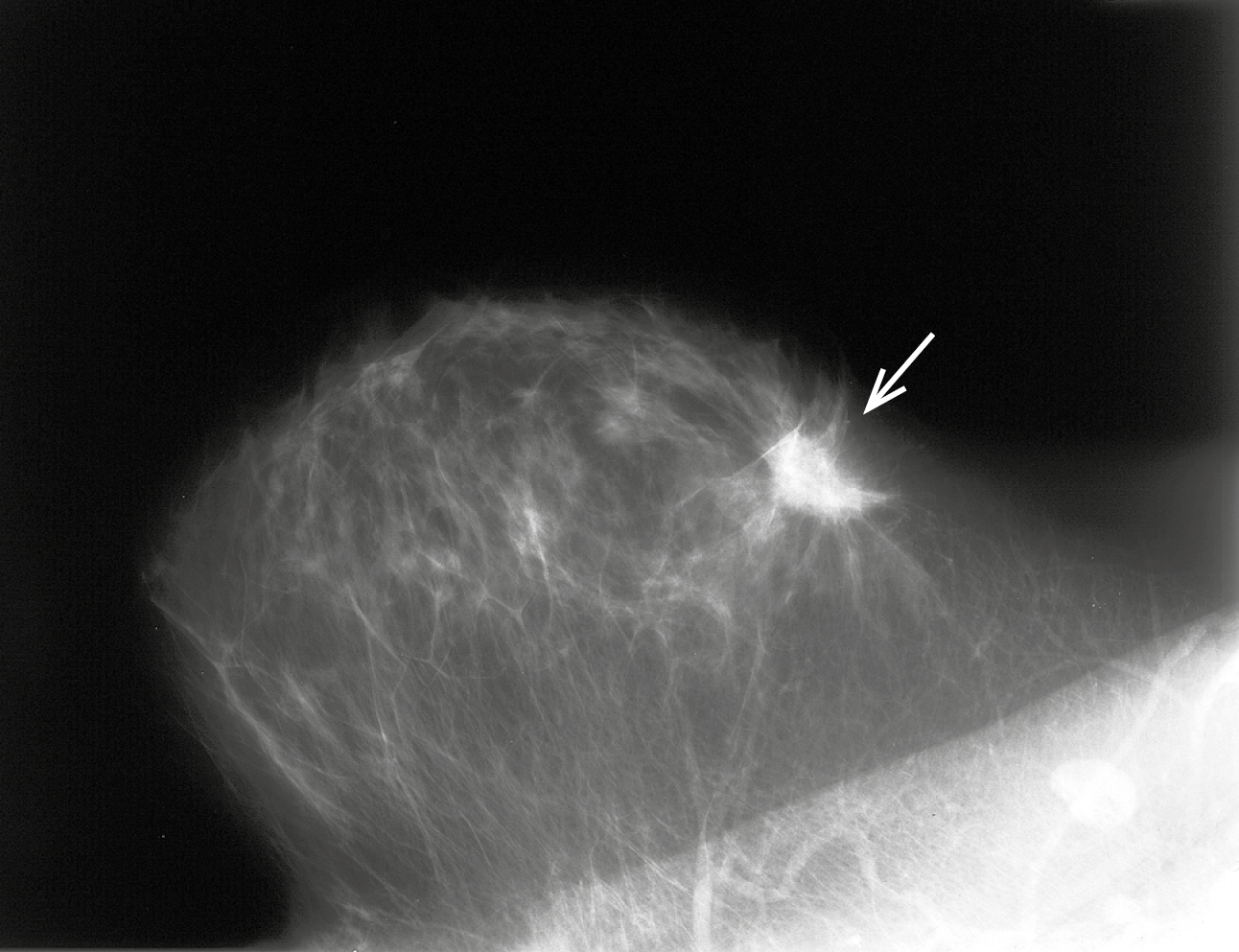
Fig. 24.5-2. Imagen mamográfica de cáncer de mama (foto: Dra. Sonia Dyczek)
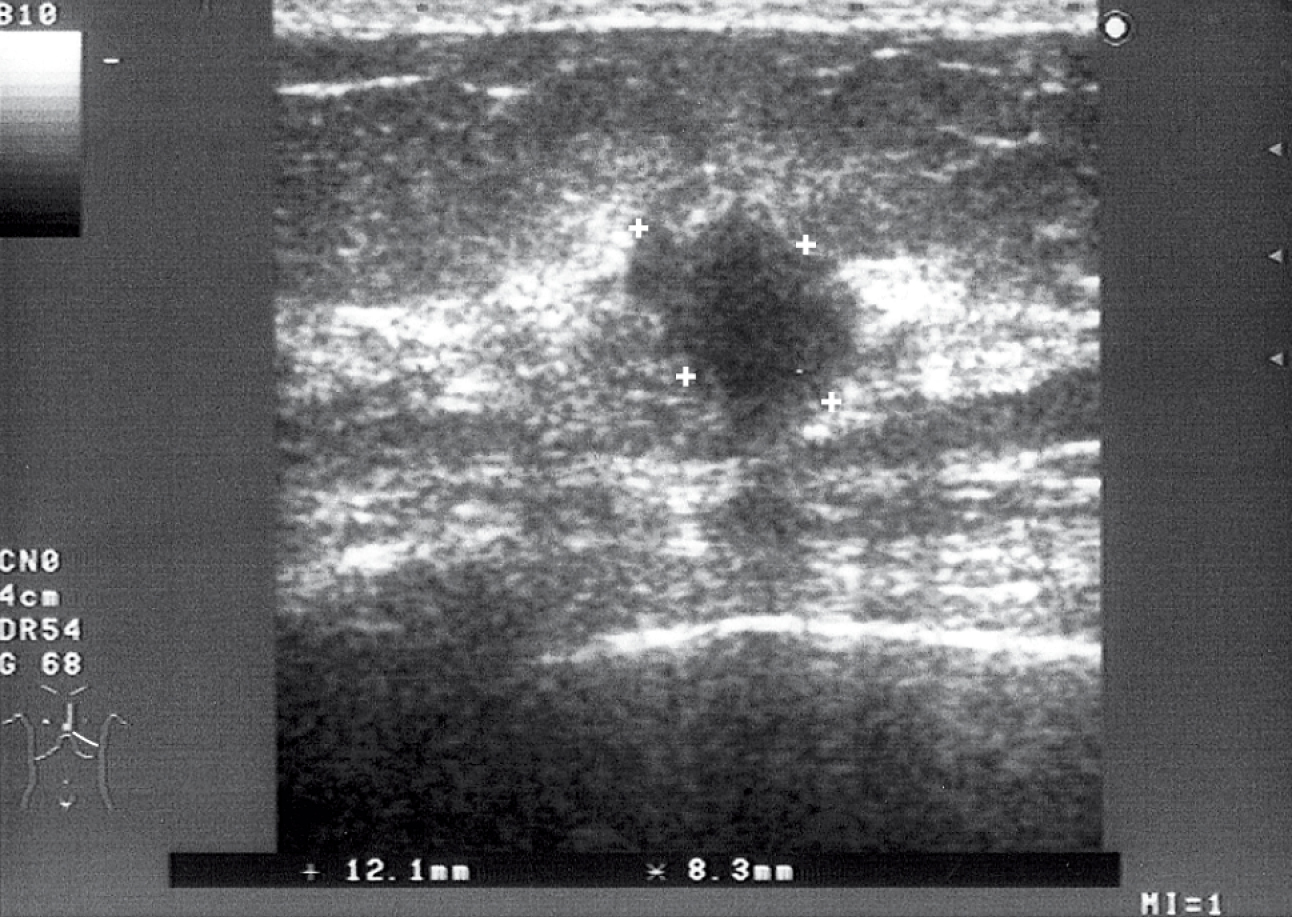
Fig. 24.5-3. La ecografía de la mama izquierda evidencia un área hipodenso e irregular (cáncer ductal) (foto: Dra. Sonia Dyczek)
 Español
Español
 English
English
 українська
українська







