En el capítulo encontrará cuadros Perspectiva Latinoamericana con información relativa al diagnóstico y tratamiento de la tuberculosis, aplicable en Argentina, Chile, Colombia y México.
Las normas específicas para Chile, según el Programa Nacional de Control y la Eliminación de la Tuberculosis del Ministerio de Salud de Chile, actualización de 2022, pueden consultarse en Tuberculosis (recomendaciones para Chile, con adaptaciones según el Programa Nacional de Control y Eliminación de la Tuberculosis del Ministerio de Salud de Chile, actualización de 2022).
DEFINICIÓN y etiopatogeniaArriba
1. Agente etiológico: bacilos acidorresistentes del grupo Mycobacterium tuberculosis complex, es decir, M. tuberculosis, M. bovis y M. africanum.
2. Mecanismo patogénico: inhalación de los bacilos → fagocitosis por macrófagos; si hay pocos bacilos, pueden ser eliminados en su totalidad por los mecanismos bactericidas inespecíficos de los macrófagos; si hay muchos bacilos o estos mecanismos están alterados → proliferación dentro del macrófago → lisis del macrófago e infección de otras células → formación de granuloma tuberculoso (entre otras, células epitelioides y células gigantes de Langhans) que rodea las células lisadas (focos de necrosis caseosa). Al mismo tiempo se desarrolla la respuesta inmunológica con participación de linfocitos Th1 CD4+, que activan los macrófagos (entre otros, a través de IFN-γ). Las lesiones pueden remitir espontáneamente por fibrosis. En los pacientes con respuesta celular deficiente se produce la fluidificación de la necrosis caseosa con intensa proliferación de bacilos pudiéndose formar cavidades. Antes de que se logre instaurar una respuesta inmunológica específica, los macrófagos que han fagocitado bacilos pueden pasar a la sangre periférica a través del sistema linfático y de esta forma causar una bacteriemia. De esta manera, los bacilos alcanzan multitud de órganos, sin embargo, permanecerán solo en aquellas localizaciones con condiciones favorecedoras para su crecimiento. Los bacilos pueden quedarse en el cuerpo humano durante mucho tiempo (infección latente por bacilo tuberculoso) y pasados muchos años de la primoinfección se pueden reactivar y dar lugar a una tuberculosis pulmonar o extrapulmonar. Solo un 5-10 % de la población infectada padecerá tuberculosis a lo largo de su vida. Si la enfermedad se desarrolla directamente después de la infección (hasta 12 meses), recibe la denominación de tuberculosis primaria; los demás casos se denominan tuberculosis posprimaria.
3. Reservorio y vías de transmisión: son la fuente de infección por micobacterias tuberculosas los enfermos que excretan los bacilos al respirar, hablar o, especialmente, toser. Los bacilos se encuentran en las gotitas pequeñas de esputo.
4. Factores de riesgo de infección. Grupos de mayor riesgo de infección por bacilo tuberculoso o de contraer tuberculosis después de la infección: infectados por VIH, personas que han tenido un contacto reciente con enfermos que producen bacilos detectados por frotis, personas con lesiones pulmonares "mínimas" (visibles en radiografía de tórax), personas que consumen ≥40 g/d de alcohol o consumen drogas, personas sin techo, inmigrantes de áreas con alta prevalencia de tuberculosis, personas con inmunodeficiencias (también a consecuencia de tratamientos inmunosupresores), uso de fármacos anti-TNF u otros fármacos biológicos con acción inmunosupresora, fumadores de tabaco o personas con antecedentes de hábito tabáquico (aumento leve del riesgo de enfermedad), personas con el IMC ≤20 kg/m2.
CUADRO CLÍNICO E HISTORIA NATURALArriba
Manifestaciones sistémicas (independientemente de la localización de la infección): temperatura elevada, pérdida de apetito, pérdida de peso, sudoración nocturna, malestar. En el curso de una infección por un bacilo de la tuberculosis pueden aparecer eritema nudoso y conjuntivitis flictenular (lesiones conjuntivales redondas, de color gris-amarillento, que aparecen alrededor del limbo).
Tuberculosis pulmonar
1. Síntomas: tos crónica (inicialmente seca, luego productiva con expectoración mucosa o purulenta), en ocasiones hemoptisis, disnea en algunas formas (p. ej. en la neumonía caseosa, tuberculosis pulmonar miliar o tuberculosis fibrocavitaria), que pueden cursar con insuficiencia respiratoria.
2. Signos: en enfermos con alteraciones avanzadas signos típicos de infiltrados o cavitaciones pulmonares.
3. Formas seleccionadas de tuberculosis pulmonar:
1) Tuberculosis miliar: es consecuencia de la diseminación hematógena de los bacilos. El curso clínico puede ser grave con fiebre alta y disnea intensa. En la radiografía de tórax: alteraciones micronodulares similares al grano de mijo (en los primeros 2-3 días de la diseminación la radiografía puede ser normal). Con frecuencia se acompaña de hepatoesplenomegalia, así como de alteraciones en la médula ósea, del fondo de ojo y del SNC.
2) Neumonía tuberculosa: predominan síntomas de toxemia con fiebre elevada héctica y disnea intensa. Es frecuente la hemoptisis. En el frotis de esputo se encuentran abundantes bacilos.
3) Tuberculosis fibrocavitaria: en casos de tuberculosis diagnosticada tardíamente o mal tratada. Los enfermos suelen ser muy bacilíferos y con frecuencia albergan micobacterias resistentes a fármacos. En las cavernas curadas pueden desarrollarse infecciones bacterianas y fúngicas.
Tuberculosis extrapulmonar
1. Pleuritis tuberculosa: normalmente se desarrolla pocos meses después de la infección primaria. El paciente presenta fiebre, tos seca, a veces disnea y dolor torácico de carácter pleurítico. El derrame pleural es generalmente unilateral, con abundantes células (inicialmente predominan neutrófilos, luego linfocitos), elevada concentración de proteínas e incremento de la actividad de la adenosina-desaminasa. En ~30 % de los casos se pueden cultivar micobacterias a partir del líquido pleural.
2. Tuberculosis ganglionar: se presenta principalmente en niños y adultos jóvenes. Los ganglios (sobre todo en regiones ganglionares anteriores y posteriores del cuello, supraclaviculares y rara vez en regiones axilares o inguinales) están aumentados de tamaño, son duros, indoloros y la piel permanece sin cambios. Con el tiempo se ablandan y se fistulizan. En ~50 % de los casos se acompañan de alteraciones pulmonares.
3. Tuberculosis urogenital: predominan síntomas locales (polaquiuria o disuria), a menudo discretos. En las mujeres la afectación del aparato genital puede manifestarse por dolor pélvico y trastornos de la menstruación. La enfermedad puede conllevar la esterilidad. En los hombres puede desarrollarse prostatitis o epididimitis.
4. Tuberculosis osteoarticular: en países con poca difusión de la tuberculosis principalmente en personas mayores. Suele presentar un curso bastante prolongado antes de comenzar las manifestaciones clínicas. Manifestaciones principales: dolor, edema y limitación funcional articular. Más frecuentemente afecta al segmento toracolumbar y sacro, puede afectar las grandes articulaciones.
5. Tuberculosis del SNC: más frecuente en niños, como meningitis tuberculosa o en forma de tuberculomas. La inflamación se localiza principalmente en la base encefálica y provoca lesiones de los nervios craneales y obstaculiza la circulación del líquido cefalorraquídeo. Manifestaciones: somnolencia, cefalea, náuseas, vómitos y rigidez de la nuca, a menudo también paresias, así como síntomas piramidales y cerebelosos; alteraciones de la conciencia y convulsiones.
6. Tuberculosis del tracto digestivo: se presenta con poca frecuencia. La tuberculosis gastrointestinal se manifiesta con febrícula, adelgazamiento, diarrea, náuseas, dolor abdominal. A veces cursa con síntomas de apendicitis u obstrucción intestinal.
7. Otras formas de tuberculosis extrapulmonar: tuberculosis pericárdica, cutánea, de grandes vasos o de la médula ósea. Son formas muy infrecuentes, pero hay que recordar que la tuberculosis puede afectar a cada órgano.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Pruebas microbiológicas:
1) Frotis (bacterioscopia): no es una prueba definitiva, requiere confirmación por cultivo.
2) Cultivo convencional (prueba básica, tiempo de espera al resultado <10 semanas).
3) Cultivo en medio líquido (prueba básica, tiempo de espera al resultado desde 5 días hasta <6 semanas).
4) Pruebas genéticas (tiempo de espera al resultado de unas horas); no deben sustituir otros métodos, sino complementarlos (interpretación del resultado de la prueba genética en función del resultado del estudio microscópico →tabla 3.15-1). Debido a la posibilidad de detectar material genético de los bacilos muertos, es posible obtener un resultado positivo en una persona que concluyó un tratamiento exitoso de tuberculosis. La secuenciación del genoma completo permite diferenciar con precisión distintas cepas de M. tuberculosis complex; esta técnica y la secuenciación enfocada en determinados genes también permiten detectar las mutaciones asociadas a la resistencia de los bacilos a los fármacos.
5) Evaluación de la farmacorresistencia: sobre la base del cultivo, también se recomienda realizar de rutina una prueba molecular rápida (indispensable en enfermos con factores de riesgo de farmacorresistencia). Permite determinar rápidamente (en unas horas) la resistencia a RMP (Xpert MTB/RIF o Xpert MTB/RIF Ultra) y a INH, fluoroquinolonas, etionamida y fármacos aminoglucósidos de administración parenteral (Xpert MTB/XDR).
2. Prueba de la tuberculina (PT): inyección intradérmica de tuberculina, se comprueba el diámetro del infiltrado a las 48-72 h. Indicaciones:
1) detección de una infección oculta por un bacilo de tuberculosis en personas en las que un resultado positivo requiere el uso de quimioprofilaxis
2) exploración complementaria en la detección de tuberculosis, en casos sin confirmación bacteriológica de la enfermedad. Una prueba de la tuberculina positiva (en Argentina, Chile y México ≥10 mm, ≥5 mm en infectados por VIH) en caso de infección por bacilos de tuberculosis (no se diferencia entre la infección y la enfermedad), después de la vacuna BCG, a veces tras la exposición a bacterias no tuberculosas. Posibles resultados falsos negativos de la prueba de tuberculina (a pesar de la infección por bacilos de tuberculosis): edad <6 meses o >65 años, inmunodeficiencia celular (infección por VIH, enfermedades linfoproliferativas), infecciones virales agudas (sarampión, varicela, parotiditis, mononucleosis infecciosa), administración hasta 6 semanas antes de la prueba de una vacuna de virus vivos (contra sarampión, poliomielitis, parotiditis, rubéola), infección bacteriana (tosferina, brucelosis), formas graves de tuberculosis (tuberculosis del sistema nervioso central y tuberculosis diseminada), uso de glucocorticoides a dosis altas (>15 mg/d en conversión a prednisona) o de otros fármacos inmunosupresores, desnutrición, enfermedades graves que alteran el estado general (p. ej. neoplasias, diabetes mellitus, insuficiencia renal), sarcoidosis, período antes de desarrollar la respuesta inmunitaria tras la infección por M. tuberculosis, factores relacionados con la prueba (almacenamiento incorrecto de la tuberculina, preparado caducado, prueba realizada de manera incorrecta o interpretación incorrecta).
3. Pruebas basadas en la secreción de interferón γ por los linfocitos T (IGRA): QuantiFERON-Tb Gold, QuantiFERON-Tb Gold In-Tube, QuantiFERON-Tb Gold Plus y T-SPOT.TB. Especificidad mayor que de la PT, la vacuna BCG no afecta al resultado. Su utilidad en la diferenciación de la tuberculosis activa de una infección oculta por bacilos de tuberculosis es baja y similar a la de la prueba de la tuberculina. Las indicaciones son como las establecidas para la prueba de la tuberculina.
4. Pruebas de imagen:
1) Radiografía de tórax: en la tuberculosis primaria (la enfermedad se produce justo después de la infección) condensaciones, con mayor frecuencia en los campos pulmonares medios e inferiores, con adenopatías hiliares y paratraqueales. En la tuberculosis posprimaria condensaciones (de diferente densidad, en estadios avanzados con frecuencia cavidades, visibles como áreas radiolúcidas rodeadas de un halo de mayor densidad), sobre todo en los segmentos apicales y posteriores de los lóbulos superiores y en los segmentos superiores de los lóbulos inferiores. En ocasiones, las lesiones infiltrantes adquieren forma de nódulos redondeados, lo que es causado por el encapsulamiento de masas caseosas (el denominado tuberculoma o caseoma). En los estados de inmunosupresión las lesiones pueden ser atípicas.
2) TC de tórax: mayor sensibilidad y especificidad que la radiografía; ganglios linfáticos con realce circinado del reborde tras la administración intravenosa de un medio de contraste. TC de alta resolución: nódulos extralobulillares difusos (que sugieren tuberculosis miliar), nódulos intralobulillares, que —junto con las opacidades lineales— pueden formar un patrón en "árbol en brote", característico de una enfermedad activa. La TC es útil también a la hora de evaluar las alteraciones pleurales.
5. Otras pruebas: resultados de pruebas de laboratorio en general normales, a veces leucopenia o leucocitosis, anemia, VHS elevada, hiponatremia, hipercalcemia. En la meningitis tuberculosa con frecuencia hay concentración de cloruros reducida y concentración de proteínas aumentada en el líquido cefalorraquídeo.
Criterios diagnósticos
El diagnóstico a veces es difícil y con frecuencia consiste en descartar otras enfermedades. El diagnóstico de tuberculosis se confirma mediante el cultivo del material tomado en función de la localización de las lesiones, o tras confirmar en una prueba molecular que el material genético de los bacilos acidorresistentes visualizados en la bacterioscopia pertenece a M. tuberculosis complex.
En los enfermos con sospecha de tuberculosis pulmonar se deben solicitar ≥3 (≥1 vez por la mañana en ayunas) muestras de esputo para frotis y cultivo sobre medios sólido y líquido (si el enfermo no expectora → inducción de esputo con solución hipertónica de NaCl). Se pueden obtener muestras realizando lavado mediante broncoscopia para pruebas bacteriológicas en casos de alta sospecha de enfermedad (solicitar un examen del esputo expectorado tras finalizar la broncoscopia). Realizar un estudio microbiológico para tuberculosis (incluido el cultivo) y un examen histológico de las muestras obtenidas de todas las localizaciones en las que se sospeche infección. Una muestra de esputo debe someterse a una prueba molecular rápida de detección del material genético de bacilos de tuberculosis, y al mismo tiempo su farmacorresistencia (la OMS recomienda la prueba Xpert MTB/RIF Ultra). En enfermos con alta sospecha clínica de tuberculosis iniciar el tratamiento antituberculoso independientemente del resultado de las pruebas listadas más arriba. Los resultados negativos no descartan una tuberculosis y no indican que se deba suspender el tratamiento.
Criterios diagnósticos de tuberculosis pulmonar sin confirmación bacteriológica:
1) resultados negativos de todas las pruebas bacteriológicas (debe obtenerse una muestra adecuada para el examen bacteriológico a través de cualquier método disponible: inducción del esputo, broncoscopia, toma de contenido gástrico)
2) en presencia de alteraciones radiológicas sospechosas de tuberculosis (realizar TC de alta resolución: típicos nódulos extralobulillares diseminados que indican la tuberculosis miliar, y/o nódulos intralobulillares en forma de un árbol en brote, pequeñas cavidades)
3) falta de respuesta al tratamiento antibiótico de amplio espectro (evitar fluoroquinolonas, ya que son activas frente a M. tuberculosis y pueden producir una respuesta temporal en los enfermos con tuberculosis).
La tuberculosis debe considerarse en el diagnóstico diferencial de todos los casos de alteración en la radiografía de tórax, incluso cuando dichas lesiones no son típicas de tuberculosis. Se debe sospechar tuberculosis en los casos de tos productiva purulenta que persiste ≥3 semanas, en casos de neumonía que no responde al tratamiento estándar, particularmente cuando se asocian cavidades o predomina derrame pleural. Las siguientes condiciones requieren descartar tuberculosis: fiebre de origen desconocido, adenopatías, piuria estéril, meningitis persistente con parálisis de pares craneales, enfermedades intestinales inflamatorias (sobre todo enfermedad de Crohn), casos seleccionados de infertilidad en mujeres y procesos inflamatorios persistentes del sistema osteoarticular.
En la tuberculosis extrapulmonar realizar radiografía de tórax y, a ser posible, también cultivos del esputo. El material extrapulmonar contiene generalmente menos bacilos, pero debe intentarse tomar una muestra adecuada y someterla a pruebas microbiológicas, incluso para la presencia del material genético de M. tuberculosis complex, de preferencia, con un test de alta sensibilidad (Xpert MTB/RIF Ultra). En algunos casos el diagnóstico se basa en el cuadro histopatológico (nota: los granulomas tuberculoides pueden encontrarse en muchas enfermedades y no en todos los casos de tuberculosis se observa una necrosis caseosa).
En infectados por VIH las alteraciones pulmonares dependen del grado de la inmunodeficiencia. Son típicas de la fase temprana de la enfermedad. En etapas avanzadas se localizan en las regiones inferiores y medias del pulmón o tienen carácter diseminado. Las cavidades se presentan raramente. A menudo la prueba de la tuberculina es negativa, el resultado de IGRA "indeterminado" y son menos frecuentes los resultados positivos del examen directo del esputo (la probabilidad aumenta junto con el número de las pruebas realizadas, sobre todo cuando el material proviene del esputo inducido o de la secreción obtenida mediante broncoscopia). En estos casos, además de los cultivos del esputo, se deben realizar hemocultivos y biopsia de los ganglios linfáticos y de la médula ósea.
TratamientoArriba
1. Reglas generales de tratamiento:
1) Los esquemas de tratamiento de tuberculosis provocada por bacilos fármacosensibles deben contener ≥3 fármacos en la fase intensiva y ≥2 fármacos en la fase de continuación, a los cuales las micobacterias aisladas son sensibles o probablemente sensibles.
2) A un esquema ineficaz no se debe añadir un único fármaco nuevo.
3) El tratamiento debe ser supervisado, especialmente cuando existe una posibilidad significativa de falta de adhesión al tratamiento por parte del enfermo y cuando se trata de casos significativos para la salud pública (p. ej. resistencia a otros fármacos, recidiva de la enfermedad). El tratamiento estrictamente supervisado (TES) consiste en supervisión directa de la toma de fármacos por parte del personal de enfermería o una persona capacitada. La toma de fármacos puede supervisarse a distancia, mediante videollamadas.
4) Antes de iniciar el tratamiento, hay que analizar el suero: actividad de enzimas hepáticas, concentración de bilirrubina, urea, creatinina y ácido úrico, y además recuento de plaquetas sanguíneas. En caso de utilizar ETB, debe solicitarse consulta oftalmológica. Considerar investigar la infección por el VIH u otras inmunodeficiencias, la probabilidad de farmacorresistencia y la capacidad de adhesión terapéutica del enfermo.
5) Vigilar la aparición de efectos adversos e interacciones medicamentosas.
En personas en estado grave por una enfermedad de la que existe sospecha de tuberculosis y en las personas con elevado riesgo de progresión para tuberculosis (infectadas por VIH, durante el tratamiento anti-TNF), se debe iniciar inmediatamente un tratamiento estándar con 4 fármacos (sin esperar los resultados de las pruebas microbiológicas).
PERSPECTIVA LATINOAMERICANA
Los casos diagnosticados que inician tratamiento deben notificarse diariamente para iniciar precozmente el estudio de contactos en casos pulmonares bacteriológicamente demostrados y garantizar la trazabilidad del tratamiento del caso índice. El registro de la información debe ser consistente, periódico y confiable, para que las decisiones en políticas de salud pública e inversiones puedan tomarse con datos reales. Al iniciar el tratamiento, se debe investigar la infección por el VIH u otras inmunodeficiencias, la probabilidad de farmacorresistencia y la capacidad de adhesión terapéutica del enfermo.
El consentimiento informado del paciente para administrar la farmacoterapia seleccionada no es necesario en Chile ni en Argentina.
2. Fármacos tuberculostáticos:
1) fármacos básicos (de elección) →tabla 3.15-2
2) fármacos de segunda elección (alternativos): rifabutina, rifapentina, levofloxacina, moxifloxacina, linezolid, bedaquilina, clofazimina, cicloserina (CS), etionamida (ETA), amikacina, estreptomicina (SM), ácido paraaminosalicílico (PAS), delamanid, etc.
PERSPECTIVA CHILENA
En la fase de continuación, la dosis máxima de isoniazida en uso diario es de 400 mg. La estreptomicina ya no se usa.
3. Glucocorticoides: tienen indicación absoluta únicamente en la insuficiencia suprarrenal en el curso de la tuberculosis de las glándulas suprarrenales. También son utilizados en los siguientes casos: pericarditis aguda (prednisona durante 6-12 semanas, inicialmente a dosis de 60 mg/d, disminuir gradualmente después de 2-3 semanas), meningoencefalitis en enfermos con alteraciones de conciencia y síntomas de presión intracraneal aumentada (prednisona durante 6-8 semanas, inicialmente a dosis de 20-40 mg/d, reducir gradualmente después de 2-3 semanas, eventualmente dexametasona a dosis de 8-12 mg/d), pleuritis y peritonitis exudativas de curso grave (prednisona a dosis de 20-40 mg/d durante 1-2 semanas), estenosis de las vías respiratorias con riesgo vital, tuberculosis ganglionar con síntomas de compresión de las estructuras adyacentes, reacciones graves por hipersensibilidad a los fármacos tuberculostáticos, en caso de no poder sustituirlos por otros fármacos, síndrome inflamatorio en el curso de reconstitución inmunológica en enfermos infectados por el VIH (→más adelante).
4. Tratamiento de nuevos casos de tuberculosis:
1) fase inicial → RMP, INH, PZA y ETB durante 2 meses
2) fase de continuación → RMP e INH durante 4 meses a diario o 3 × semana.
Excepciones:
1) sospecha de la infección por micobacterias resistentes a fármacos →más adelante
2) meningitis tuberculosa → prolongar la fase de continuación por 6 meses, y además utilizar glucocorticoides
3) tuberculosis osteoarticular → prolongar la fase de continuación en 3 meses
4) en enfermos con cavidades pulmonares y resultado positivo del cultivo del esputo al final de la fase intensiva → prolongar la fase de continuación por 3 meses
5) necesidad de usar otro esquema de tratamiento diferente al tratamiento estándar:
a) enfermos en los que no es posible usar PZA en la fase inicial del tratamiento (frecuentemente ocurre intolerancia en ancianos y en embarazadas) → usar INH, RMP y ETB durante los 2 primeros meses e INH y RMP durante los siguientes 7 meses
b) enfermos con daño hepático o con trasplante de órganos (→más adelante)
6) enfermos con contraindicaciones para el tratamiento con ETB → durante la fase intensiva es posible usar moxifloxacina o levofloxacina (la tuberculosis no figura como una indicación en la ficha técnica de estos fármacos).
En enfermos que requieren una prolongación de la fase de continuación usar fármacos tuberculostáticos diariamente. El enfermo debe tomar todas las dosis de fármacos (56 dosis de cada fármaco) en la fase intensiva durante ≤3 meses. En la fase de continuación estándar (126 dosis de cada fármaco) debe tomarlas durante hasta 6 meses. El tratamiento estándar completo (se supone que dura 6 meses) no puede durar más de 9 meses. La OMS admite para el tratamiento de la tuberculosis pulmonar y extrapulmonar (excepto en formas graves) un esquema alternativo de 4 meses, compuesto de INH, PZA, moxifloxacina y rifapentina.
PERSPECTIVA CHILENA
1) En caso de meningitis tuberculosa, se puede administrar SM y/o fluoroquinolonas en lugar de ETB y prolongar la fase de continuación por 7 meses, y además utilizar glucocorticoides al inicio.
2) En caso de cavidades pulmonares y resultado positivo del cultivo del esputo al final de la fase intensiva, se debe prolongar la fase diaria hasta negativizar cultivo o conocer la sensibilidad a isoniazida y rifampicina, y prolongar la fase de continuación a 7 meses.
3) En caso de contraindicaciones para el tratamiento con ETB, durante la fase intensiva es posible usar moxifloxacina o levofloxacina solo en casos de tuberculosis cavitaria o extensa, meningitis o resistencia inicial a isoniazida. Si hay sensibilidad a RMP y a INH puede agregarse PZA y prescindirse del ETB.
4) En enfermos que exigen una prolongación de la fase de continuación se deben usar fármacos tuberculostáticos diariamente. El enfermo debe tomar todas las dosis de fármacos (50-56 dosis de cada fármaco) en la fase intensiva durante ≤3 meses. En la fase de continuación estándar (126 dosis de cada fármaco, y en fase de continuación diaria 80-84 dosis en caso de terapia diaria de lunes a viernes) debe tomarlas durante hasta 6 meses.
5) En enfermos con tuberculosis pulmonar se realizan pruebas moleculares: GenXpert MTB/RIF de muestra inicial en los servicios de salud locales y Line Probe Assays (hibridación reversa) del cultivo inicial en el Instituto de Salud Pública Nacional. Algunos servicios utilizan además GenXpert XDR de muestra inicial para determinar resistencia a isoniazida, fluoroquinolonas, inyectables y etionamida.
5. Vigilancia de efectos adversos de fármacos tuberculostáticos: pruebas de laboratorio y consulta oftalmológica en caso de sospecha de efectos adversos de fármacos. El efecto adverso más importante del esquema básico de tratamiento de tuberculosis es la afectación hepática. Un aumento asintomático de la actividad de AST y ALT ≤5 × límite inferior de la normalidad (LIN) o ≤3 × límite superior de la normalidad (LSN) no requiere interrumpir el tratamiento. En caso de un aumento mayor de la actividad de AST y/o ALT → suspender temporalmente RMP, INH y PZA. En enfermos con alto riesgo de afectación hepática determinar las concentraciones séricas de ALT y AST transcurridos 7 y 14 días desde el inicio del tratamiento y posteriormente cada mes hasta su finalización. En el resto de los enfermos los niveles deben determinarse 1 × mes. Si la actividad de ALT/AST es ≥5 × LSN, o ≥3 × LSN con manifestaciones gastrointestinales concomitantes (ictericia, náuseas, pérdida de apetito, distensión o dolor abdominal) → suspender temporalmente RMP, INH y PZA. Si la ALT y la AST disminuyen a <2 × LSN → reintroducir los fármacos suspendidos anteriormente (excepto PZA) y controlar la actividad de AST y ALT. El tratamiento sin PZA debe durar 9 meses. A la espera de la disminución de los niveles de AST/ALT, interrumpir completamente el tratamiento antituberculoso o, si la situación clínica lo requiere, utilizar amikacina o estreptomicina y ETB.
PERSPECTIVA LATINOAMERICANA
En caso de efectos adversos de fármacos tuberculostáticos, a la espera de la disminución de los niveles de AST/ALT, en Chile —para tomar la decisión acerca de la interrupción del tratamiento antituberculoso— se requiere la evaluación del referente técnico del programa de control de la tuberculosis, que se encuentra en los diferentes servicios de salud. Lo ideal es la presencia de un referente técnico de mayor conocimiento en TBC en cada servicio de salud, que puede orientar a los médicos de atención primaria en forma directa y rápida, evitando interconsultas prolongadas.
En Argentina se puede consultar al referente local de tuberculosis (no es obligatorio). Si lo requiere la situación clínica, se utiliza SM y ETB o fluoroquinolonas.
6. Vigilancia de los resultados del tratamiento: controlar la eficacia del tratamiento mediante la realización repetida de frotis y cultivos de esputo en medio sólido o líquido. El examen microbiológico de esputo debe realizarse al final de la fase intensiva. En caso de frotis positivo → repetir el examen al final del 3.er mes de tratamiento (no prolongar la fase intensiva). Si el frotis sigue positivo → cultivo y pruebas de farmacosensibilidad. En la fase de continuación realizar baciloscopia al inicio del 5.º y al final del 6.º mes del tratamiento (se puede omitir en los enfermos con resultado inicial negativo). Un frotis positivo en el 5.º o 6.º mes significa fracaso del tratamiento. En un enfermo que retorna al tratamiento hay que realizar examen bacterioscópico, cultivo del esputo, prueba molecular de detección rápida de resistencia de micobacterias a los fármacos, y prueba de farmacosensibilidad basada en el cultivo. TB-MDR: durante todo el tratamiento realizar un examen bacterioscópico y el cultivo del esputo cada mes; volver a realizar un examen de farmacosensibilidad en caso de un resultado positivo del cultivo del esputo después de 4 meses del tratamiento. Los resultados del tratamiento de tuberculosis extrapulmonar se valoran más frecuentemente sobre la base de los estudios clínicos.
7. Enfermos tratados de tuberculosis con anterioridad: realizar inmediatamente una prueba molecular rápida y elegir un tratamiento sobre la base de los resultados. En enfermos que requieren un tratamiento inmediato debido al curso grave de enfermedad, añadir fluoroquinolona (moxifloxacina o levofloxacina) y alguno de los fármacos administrados por vía parenteral, a los fármacos usados habitualmente en la fase intensiva (INH, RMP, PZA, ETB). En enfermos en estado grave o en caso de sospecha de farmacorresistencia añadir adicionalmente 1 fármaco de segunda elección.
8. Tratamiento de la tuberculosis farmacorresistente. Se distingue tuberculosis:
1) monorresistente: resistencia a 1 fármaco de elección
2) resistente a RMP (TB-RR)
3) polirresistente: a ≥2 fármacos de elección (pero no a INH y RMP al mismo tiempo)
4) multirresistente (TB-MDR): por lo menos a INH y RMP
5) extremadamente resistente (TB-XDR): a INH, RMP, fluoroquinolona (levofloxacina, moxifloxacina) y ≥1 fármaco diferente del grupo A (bedaquilina o linezolid)
6) TB pre-XDR: a INH, RMP y fluoroquinolona (levofloxacina, moxifloxacina) o a RMP y fluoroquinolona.
Resistencia a INH → PZA, RMP, ETB y levofloxacina o moxifloxacina (tras confirmar la sensibilidad): durante 6 meses (considerar la prolongación en casos de alteraciones pulmonares extensas y producción prolongada de micobacterias). En enfermos con lesiones pulmonares leves o con efectos adversos de PZA, puede limitarse la administración de PZA hasta 2 meses. Si no es posible la administración de levofloxacina o moxifloxacina → PZA, RMP y ETB durante 6 meses.
PERSPECTIVA LATINOAMERICANA
En Chile se distingue resistencia a INH de bajo nivel (mutación del gen InhA), que requiere utilizar isoniazida a dosis de 10 mg/kg/d, y resistencia de alto nivel (mutación de gen KatG), que requiere utilizar isoniazida a dosis de 15 mg/kg/d. Si existen ambas mutaciones, no se puede usar la isoniazida. Por lo tanto, si es posible administrar la isoniazida, el esquema a usar es de 6 meses diarios a dosis modificadas (mayores dosis) asociada a ETB, RMP y PZA.
TB-RR, TB-MDR y TB-XDR:
1) En pacientes con la resistencia de los bacilos a RMP (TB-RR) confirmada en pruebas moleculares → iniciar de inmediato el mismo tratamiento que en TB-MDR.
2) Si es posible, seleccionar los fármacos según los resultados del antibiograma.
3) En la tuberculosis pre-XDR con resistencia a fluoroquinolonas, la OMS admite el uso conjunto de bedaquilina, pretomanida y linezolid (BpaL) durante 6-9 meses.
4) La primera elección en el tratamiento de TB-RR/MDR es un esquema de 6 meses compuesto de bedaquilina, pretomanida y linezolid (600 mg/d) y de moxifloxacina (BpaLM); la bedaquilina, pretomanida y linezolid están disponibles en el programa de fármacos para el tratamiento de TB-RR y TB-XDR.
5) En pacientes que no cumplen los criterios de admisión al esquema BpaLM (y en niños <14 años) se debe utilizar el esquema de 9 meses (siempre y cuando los bacilos sean sensibles a fluoroquinolonas). Durante 4-6 meses administrar: bedaquilina (esta siempre durante 6 meses), PZA, levofloxacina o moxifloxacina (800 mg/d), protionamida (750 mg/d [se puede sustituir por etionamida]), clofazimina (100 mg/d), INH a dosis altas de 600 mg/d (10-15 mg/kg) y ETB (1200 mg/d), a continuación durante los siguientes 5 meses PZA, levofloxacina o moxifloxacina, clofazimina y ETB.
PERSPECTIVA LATINOAMERICANA
El esquema para la TB-RR y en TB-MDR en Chile es conducido bajo un protocolo de investigación operacional como aconseja la OMS
En caso de TB-MDR y TB-XDR:
1) en Chile se utiliza la bedaquilina (dosis de carga de 400 mg/d x 2 semanas y dosis de mantenimiento de 200 mg trisemanal x 22 semanas), linezolida 600 mg/d, clofazimina 100 mg/d y moxifloxacina 400 mg/d durante 6 meses si se negativiza el cultivo, seguido de 3 meses con moxifloxacina 400 mg/d y clofazimina 100 mg/d; este esquema se utiliza de lunes a sábado (6 días de la semana)
2) en Chile y en Argentina no se utilizan los esquemas prolongados de tratamiento: se está aplicando la recomendación de terapia actual de la OMS de esquemas acortados para tuberculosis (excepto embarazadas y tuberculosis extrapulmonar) de 9-12 meses ya que muestran mejor eficacia (curación >80 %) que los esquemas convencionales prolongados de 18 meses (curación ~60-70 %).
6) En pacientes no aptos para el tratamiento más corto se deben utilizar esquemas de tratamiento más largos. La OMS clasifica los fármacos utilizados en estos esquemas en los siguientes grupos:
a) grupo A — en primer lugar: levofloxacina o moxifloxacina, bedaquilina y linezolid
b) grupo B — asociados en segundo lugar: clofazimina, cicloserina o terizidona
c) grupo C — utilizados como complementarios del esquema de tratamiento: etambutol, delamanid, PZA, imipenem con cilastatina, meropenem, amikacina o SM, etionamida/protionamida, PAS. En la fase intensiva utilizar ≥4-5 fármacos, a los que es sensible la cepa en cuestión. Se recomienda administrar todos los 3 fármacos del grupo A y ≥1 del grupo B. Según la ATS/ERS/IDSA, tras finalizar la administración de bedaquilina, hasta finalizar el tratamiento se administran ≥4 fármacos (según la OMS ≥3 fármacos). Duración de la fase intensiva: 5-7 meses desde obtener resultados negativos del cultivo del esputo; duración del tratamiento completo: en TB-MDR son 15-21 meses desde obtener resultados negativos del cultivo; en TB-XDR son 15-24 meses.
Tratamiento de la recidiva de TB-MDR: >24 meses.
Nota: el tratamiento de tuberculosis no se encuentra en la ficha técnica de linezolid, clofazimina, imipenem con cilastatina, meropenem ni en caso de amoxicilina con ácido clavulánico.
9. Tratamiento de tuberculosis durante el embarazo y la lactancia: utilizar tratamiento estándar (estreptomicina contraindicada). Las enfermas tratadas con INH deben recibir piridoxina (25-50 mg/d). La lactancia no constituye contraindicación y las mujeres en período de lactancia deben ser tratadas de forma estándar (los niños que solamente tienen lactancia materna y cuyas madres están bajo tratamiento antituberculoso deben recibir piridoxina a dosis de 1-2 mg/kg/d). El embarazo no es una contradicción para el tratamiento de la tuberculosis multirresistente. Si la situación clínica lo permite, el tratamiento puede iniciarse tras terminar el 1.er trimestre. Deben evitarse los fármacos administrados por vía parenteral (son ototóxicos para el feto) y la etionamida (por efecto teratógeno y riesgo aumentado de producir náuseas y vómitos) y pretomanida (seguridad no confirmada).
10. Enfermos con insuficiencia renal: utilizar RMP e INH a dosis estándar (se excretan principalmente por vía biliar). Utilizar ETB y PZA 3 × semana a dosis de 15 mg/kg y 25 mg/kg respectivamente (se refiere a los enfermos con aclaramiento de creatinina <30 ml/min). En los enfermos en hemodiálisis los fármacos se administran una vez terminada la hemodiálisis.
11. Enfermos con insuficiencia hepática:
1) sin fármacos hepatotóxicos, opciones:
a) ETB y fluoroquinolona durante 18-24 meses (y también SM durante los 2 primeros meses)
b) ETB, CS y un fármaco administrado de forma parenteral durante 18-24 meses
2) 1 fármaco hepatotóxico, opciones:
a) INH, ETB y amikacina/SM durante 2 meses, posteriormente INH y ETB durante 10 meses
b) RMP, ETB, fluoroquinolona o CS y un fármaco administrado de forma parenteral durante 12-18 meses
3) 2 fármacos hepatotóxicos, opciones:
a) INH y RMP durante 9 meses y ETB administrado hasta determinar la sensibilidad a INH
b) INH, RMP, ETB y amikacina/SM durante 2 meses y posteriormente INH y RMP durante 6 meses
c) RMP, PZA, ETB (y eventualmente fluoroquinolona) durante ≥6 meses.
PERSPECTIVA LATINOAMERICANA
En enfermos con insuficiencia hepática:
1) en Argentina (opción sin fármacos hepatotóxicos) se utiliza un esquema con RMP, ETB y SM diario con fase intermitente posterior con RMP y ETB prolongado
2) en Chile (opción con 1 fármaco hepatotóxico) se prefiere fluoroquinolona en vez de SM y RMP en vez de INH.
12. Enfermos con diabetes mellitus: normalmente se administra un esquema estándar de tratamiento. En enfermos con nefropatía diabética están contraindicados los aminoglucósidos y CAP. En enfermos con neuropatía diabética están contraindicados ETB y PAS. Hay que tener en cuenta la posibilidad de interacciones de los derivados de sulfonilureas con RMP, y de la aparición de hipoglucemia provocada por ETA.
13. Enfermos inconscientes: utilizar IM INH y SM, e iv. fluoroquinolona. A los enfermos alimentados por gastrostomía o sonda nasogástrica se les pueden administrar los fármacos antituberculosos orales molidos 2-3 h antes o después de la comida.
14. Personas después de un trasplante de órgano sólido o de células hematopoyéticas: tener precaución con interacciones de rifampicinas (RMP, rifabutina, rifapentina) con inhibidores de calcineurina (ciclosporina y tacrólimus) → incrementar la dosis 3-5 veces y monitorizar la concentración sanguínea) y con glucocorticoides (→ aumentar la dosis en el 50 %).
15. Enfermos infectados por el VIH: en enfermos tratados con fármacos antirretrovirales, utilizar un tratamiento estándar de 6 meses. Si la mejoría clínica o microbiológica se produce lentamente → prolongar el tratamiento hasta 9 meses o en ≥4 meses tras obtener cultivos negativos de esputo. En enfermos con tuberculosis extrapulmonar, el tratamiento a veces se prolonga hasta 9 meses, y en enfermos con tuberculosis del sistema nervioso central o tuberculosis osteoarticular en general hasta 12 meses. En todos los casos utilizar cotrimoxazol profilácticamente. Si el enfermo no ha recibido previamente el tratamiento antirretroviral, el diagnóstico de tuberculosis es una indicación para iniciarlo (→Infección por VIH y sida). En enfermos con meningitis tuberculosa el tratamiento antirretroviral debe retrasarse debido a la posibilidad de producirse una respuesta paradójica potencialmente mortal. En los enfermos que reciben inhibidores de proteasa no se utiliza RMP, que disminuye la concentración de estos fármacos en la sangre. En enfermos con tuberculosis infectados por el VIH, tras administrar los fármacos antirretrovirales puede producirse el síndrome inflamatorio de reconstitución inmunológica (SIRI). Manifestaciones: fiebre, intensificación de los síntomas del tracto respiratorio o SNC y progresión de alteraciones radiológicas. Antes de iniciar el tratamiento para el SIRI, hay que descartar otras infecciones oportunistas aparte de la tuberculosis y el fracaso del tratamiento antituberculoso. Tratamiento: AINE, con síntomas agravados prednisona a dosis de 1,25 mg/kg/d (50-80 mg/d) durante 2-4 semanas, que posteriormente se irá limitando hasta la suspensión del fármaco (durante 6-12 semanas o más).
16. Enfermos tratados con anti-TNF: si la tuberculosis se ha presentado durante el tratamiento con un anti-TNF → suspender el fármaco. Se puede reiniciar el tratamiento con anti-TNF después de ≥1 mes del tratamiento antituberculoso adecuado y tras confirmar la sensibilidad de los bacilos a los fármacos utilizados.
PERSPECTIVA CHILENA
En Chile en enfermos inconscientes, con malabsorción, tras una cirugía del tracto digestivo, con íleo, retención gástrica y en cualquier otro caso con compromiso o inhabilidad de la vía digestiva para la administración de fármacos VO, se puede disponer de isoniazida y rifampicina iv., linezolida iv. y carbapenémicos.
ComplicacionesArriba
Neumotórax, empiema pleural, fibrosis pleural, hemorragia pulmonar, amiloidosis.
PREVENCIÓNArriba
Métodos específicos
1. Vacuna preventiva (BCG): 1 dosis intradérmica a las 24 h del nacimiento. Ya no se utilizan rutinariamente dosis de refuerzo. Contraindicaciones: alergia a un componente de la vacuna, fiebre, dermatitis generalizada, inmunodeficiencias congénitas, uso de fármacos que originan inmunodeficiencia, neoplasias malignas, infección por VIH (la vacunación de neonatos nacidos de mujeres infectadas por VIH se realiza después de una consulta), uso de fármacos tuberculostáticos.
PERSPECTIVA LATINOAMERICANA
En Chile y en Argentina la vacuna es obligatoria solo en neonatos (con peso de nacimiento >2000 g).
2. Tratamiento profiláctico: utilizar únicamente después de descartar la tuberculosis activa, las dosis de fármacos como en el tratamiento de tuberculosis activa. Esquemas recomendados por la OMS: INH 1 × d durante 6 o 9 meses, RMP 1 × d durante 3-4 meses (la ficha técnica no incluye la profilaxis como indicación para el uso de RMP), RMP con INH 1 × d durante 3-4 meses, rifapentina e INH 1 × semana durante 3 meses, o 1 × d durante 1 mes. Durante el tratamiento control mensual; en enfermos con hepatopatía, que consumen alcohol regularmente o con infección por VIH, personas >35 años, embarazadas o <3 meses desde el parto → control de la actividad de AST y ALT y de la concentración de bilirrubina sérica. Indicado en:
1) personas de contacto con el enfermo con tuberculosis: niños <5 años, personas gravemente inmunodeprimidas (indicación absoluta, sin importancia del resultado de prueba de la tuberculina/IGRA), o niños <16 años con resultado positivo de prueba de la tuberculina/IGRA; a considerar en otras personas con un resultado positivo de prueba de la tuberculina/IGRA
PERSPECTIVA ARGENTINA
En Argentina la profilaxis de contactos usando INH se realiza en todos los niños de ≤15 años que son contactos, una vez descartada la tuberculosis activa. Si se utiliza INH en enfermos con diabetes, insuficiencia renal, sida, desnutridos y adictos al alcohol, hay que administrar vitamina B6 a dosis de 25 mg/d.
2) personas que se tratarán con anti-TNF u otros fármacos biológicos con acción antinflamatoria que aumentan el riesgo de tuberculosis, o potenciales receptores de órganos/células hematopoyéticas que:
a) tienen resultado positivo en la prueba de la tuberculina/IGRA (actualmente o en la anamnesis)
b) han tenido contacto con un enfermo bacilífero con tuberculosis o tienen antecedentes de tuberculosis (no tratada o tratada de manera inadecuada)
c) tienen cambios postuberculosos en la radiografía de tórax (cambios fibróticos, calcificaciones pulmonares y de los ganglios linfáticos, engrosamientos pleurales), y no han sido tratados previamente de tuberculosis (las personas que han finalizado correctamente el tratamiento antituberculoso no requieren el tratamiento profiláctico)
3) personas infectadas por VIH y con resultado positivo de la prueba de la tuberculina (≥5 mm) o del IGRA.
Si se utiliza INH en enfermos con diabetes, insuficiencia renal, sida, desnutridos y en personas que abusan del alcohol, se debe administrar vitamina B6 a dosis de 50 mg/d.
En personas de contacto estrecho con un enfermo con TB-MDR, del grupo de riesgo elevado de enfermedad, hay que considerar la quimioprofilaxis con levofloxacina o moxifloxacina (si no se detecta resistencia a estos fármacos en el enfermo fuente de infección).
Métodos no específicos
1. Estudio de contactos: las personas que han tenido contacto con un enfermo con tuberculosis, sobre todo bacilífero, deben someterse a pruebas con el fin de descartar la tuberculosis (observación de síntomas, radiografía de tórax, prueba de la tuberculina o IGRA). Recomendaciones →fig. 3.15-1.
2. Prevención de infecciones hospitalarias por bacilo tuberculoso: los métodos más importantes incluyen:
1) diagnóstico rápido y detección de resistencia de micobacterias mediante pruebas moleculares rápidas; hasta descartar la farmacorresistencia, los enfermos hospitalizados deben aislarse en una habitación aparte
2) aislamiento respiratorio de enfermos con tuberculosis diagnosticada, hasta el momento del cese de la producción de micobacterias confirmado por métodos microbiológicos; según la OMS los enfermos pueden tratarse en domicilio
3) en los espacios donde hay alto riesgo de transmisión de la infección por bacilo tuberculoso, la OMS recomienda el uso permanente y conjunto de lámparas bactericidas UV y de ventiladores de techo con giro lento
4) protección del personal sanitario: mascarillas respiratorias certificadas con filtro tipo FFP2 y FFP3 (de acuerdo con la normativa europea EN 149) o N95 (de acuerdo con el estándar estadounidense 42CFR84).
Hay que informar al enfermo sobre la posibilidad de transmitir la infección a otras personas y que los enfermos bacilíferos deben estar hospitalizados.
Notificación obligatoria
En la mayoría de los países de América Latina la tuberculosis es una enfermedad de notificación obligatoria a las autoridades locales correspondientes.
TABLAS Y FIGURAS
Interpretación de la prueba genética en relación al resultado del estudio microscópico
|
Resultados de examen microbiológico
|
Interpretación de los resultados
|
|
BAAR(+) y prueba genética (+)
|
Tuberculosis activa, paciente bacilífero
|
|
BAAR(+) y prueba genética (–)
|
Sospecha de la presencia de inhibidores: repetir la prueba; si no se detecta la presencia de inhibidores en las 2 siguientes pruebas con BAAR(+): sospechar MOTT
|
|
BAAR(–) y prueba genética (+)
|
Repetir la prueba genética; si el resultado vuelve a ser positivo: paciente con tuberculosis
|
|
BAAR(–) y prueba genética (–)
|
Se puede considerar que el paciente no tiene tuberculosis, pero el cuadro clínico es decisivo
|
|
BAAR — bacilos acidorresistentes, presentes (+) o ausentes (–) en la preparación microscópica, MOTT — bacilos no tuberculosos
|
Dosificación de los fármacos tuberculostáticos de elección
|
Fármacos y preparados
|
Dosificación
|
|
fase inicial
|
fase de continuación
|
|
Isoniacida (INH)a
|
5 mg/kg/d, máx. 300 mg/d
|
5 mg/kg/d o 10 mg/kg 3 × semana, máx. 900 mg/d
|
|
Rifampicina (RMP)a
|
10 mg/kg/d, máx. 600 mg/d (450 mg/d en personas <45 kg)
|
10 mg/kg/d o 3 × semana a la misma dosis
|
|
Pirazinamida (PZA)
|
25 mg/kg/d, en general 1500-2000 mg/d
|
No se utiliza en la fase de continuación
|
|
Etambutol (ETB)
|
15 mg/kg/d, en general 1000-1250 mg/d
|
Como más arriba
|
|
a La isoniazida y la rifampicina suelen administrarse en un único preparado compuesto, que contiene 100 o 150 mg de INH y 150 o 300 mg de RMP.
Todos los fármacos básicos utilizados VO se administran 1 × d, de preferencia por la mañana (pero puede ser en otro momento del día), 30 min antes de la comida.
|
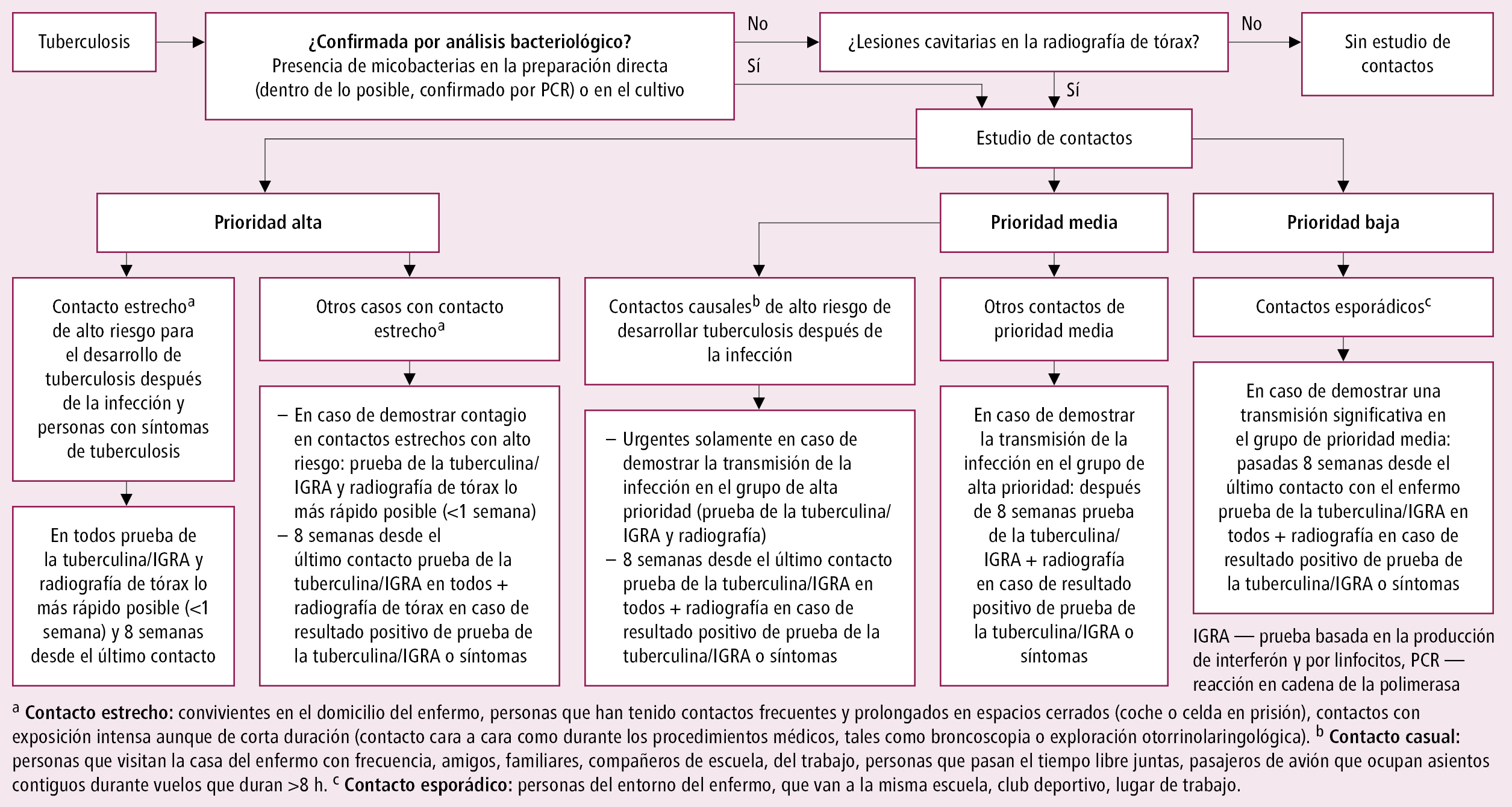
Fig. 3.15-1. Estudio de contactos: esquema de actuación (a partir del acuerdo del Consenso Europeo de 2010, modificado)
 Español
Español
 English
English
 українська
українська





