Definición y etiopatogeniaArriba
Es el adenoma hipofisario más frecuente. Se origina en las células lactotropas secretando prolactina (PRL) de una manera autónoma. El exceso de secreción de prolactina origina un hipogonadismo hipo- o normogonadotrófico. En las mujeres se manifiesta con un síndrome de amenorrea-galactorrea, y en hombres con disfunción eréctil. La concentración de PRL está notablemente aumentada sin estar sujeta a un ritmo circadiano.
Patogenia del hipogonadismo: la hiperprolactinemia altera la secreción pulsátil hipotalámica de GnRH y por tanto de las gonadotropinas hipofisarias (LH y FSH), inhibiendo a su vez los receptores gonadales de gonadotropinas → inhibición de la maduración del folículo de De Graaf y de la función endocrina de los ovarios (déficit de estradiol y progesterona en mujeres), e inhibición de la espermatogénesis y de la función endocrina de los testículos (falta de testosterona en hombres). La hiperprolactinemia actúa sobre las glándulas mamarias → galactorrea. La ginecomastia en los varones está relacionada con el hipogonadismo y con la disminución de la proporción testosterona/estrógenos.
Cuadro clínico e historia naturalArriba
Las manifestaciones clínicas dependen del tamaño del tumor (efecto de masa), y de la duración e intensidad de la hiperprolactinemia, que condicionan el hipogonadismo. La concentración de PRL es directamente proporcional al tamaño del tumor (a excepción de prolactinomas quísticos). Los microadenomas (microprolactinomas) normalmente no causan trastornos neurológicos. Sin embargo, los macroadenomas (macroprolatinomas) a menudo producen trastornos del campo visual, cefalea, y a veces incluso hipopituitarismo. En ambos sexos, el hipogonadismo lleva a la pérdida de la densidad mineral ósea, que dependerá de la duración y grado de hipogonadismo.
Los síntomas en las mujeres premenopáusicas dependen de la concentración de la PRL en el suero:
1) moderadamente elevada, pero <2,3 nmol/l (<50 μg/l; normal <1,1 nmol/l [25 μg/l]) → trastornos menstruales, insuficiencia del cuerpo lúteo, infertilidad, posible galactorrea, disminución de la libido
2) 2,3-4,5 nmol/l (50-100 μg/l) → oligomenorrea o amenorrea, a menudo galactorrea y disminución de la libido
3) >4,5 nmol/l (>100 μg/l) → amenorrea, galactorrea e hipogonadismo.
Síntomas en hombres: disminución de la libido, disfunción eréctil, infertilidad, ginecomastia e hipogonadismo (escaso vello facial y púbico, disminución de la masa muscular).
DiagnósticoArriba
Algoritmo diagnóstico →fig. 1.
Exploraciones complementarias
1. Pruebas de laboratorio: concentración sérica de PRL elevada
1) >9 nmol/l (200 μg/l): el diagnóstico de tumor es muy probable (en general, los niveles de prolactina se correlacionan con el tamaño del tumor)
2) 6,75-9 nmol/l (150-200 μg/l): diagnóstico probable
3) 1,12-6,75 nmol/l (25-150 μg/l): diagnóstico incierto (probable adenoma no funcionante con compresión del tallo hipofisario o microprolactinoma, y si los síntomas orientan hacia la presencia de prolactinoma o se ha evidenciado un macroadenoma hipofisario → determinar la concentración de PRL diluida 1:10 y 1:100 para descartar un posible error de laboratorio, un denominado efecto de gancho, es decir, un falso negativo debido a la saturación de los anticuerpos utilizados en técnicas diagnósticas inmunológicas rutinarias); determinar los niveles de PRL varias veces, p. ej. cada 30 min, o realizar una prueba de metoclopramida: administrar 10 mg VO y evaluar la concentración de PRL al inicio y después de 60 y 120 min; interpretación de la prueba →fig. 1.
La secreción de la PRL tiene un carácter pulsátil (cambia cada hora) y un ritmo circadiano, con picos secretorios durante el sueño. Aumenta también con el estrés y con el tipo de comidas y de los estupefacientes ingeridos.
PERSPECTIVA LATINOAMERICANA
La prueba con metoclopramida no suele realizarse en Argentina, Chile ni Colombia. En México se usa solo ocasionalmente y no está contemplada en el posicionamiento de prolactinoma e hiperprolactinemia de la Sociedad Mexicana de Nutrición y Endocrinología.
2. RMN de la región paraselar: es necesaria si se detecta una concentración elevada de PRL y se excluyen otras causas de la hiperprolactinemia (especialmente si en la prueba con metoclopramida la concentración de PRL no sigue aumentando o el aumento es escaso [<2 veces], o si en sucesivas pruebas se confirma el aumento de la concentración de la PRL, que se mantiene en un nivel estable).
Criterios diagnósticos
Presencia de manifestaciones del síndrome amenorrea-galactorrea en mujeres y de disfunción eréctil en hombres, concentración sérica de PRL persistentemente elevada, con la detección de un adenoma hipofisario en la RMN, tras haber excluido otras causas de hiperprolactinemia (incluidos los fármacos) y los casos de macroprolactinemia.
Diagnóstico diferencial
1. Otras causas de hiperprolactinemia
1) embarazo o lactancia
2) secreción de PRL aumentada por ausencia del efecto inhibitorio de la dopamina hipotalámica sobre las células lactotrópicas hipofisarias normales, por una disminución de la síntesis de dopamina o de su transporte desde el hipotálamo a la hipófisis:
a) tumores, lesiones inflamatorias e infiltración o traumatismo del hipotálamo o del tallo hipofisario que alteran la vía dopaminérgica: pseudoprolactinoma (hiperprolactinemia por desconexión)
b) fármacos que alteran la regulación hipotálamo-hipofisaria de la PRL: neurolépticos (clorpromazina, sulpirida, haloperidol, risperidona), antidepresivos (imipramina, amitriptilina), antagonistas de los receptores de dopamina (metoclopramida), hipotensores (verapamilo, espironolactona, metildopa), antagonistas de los receptores de histamina H2 (cimetidina, ranitidina), estrógenos, opioides
3) secreción temporal excesiva de PRL en respuesta a determinados estímulos (en personas sin enfermedades orgánicas del sistema hipotálamo-hipofisario): hiperprolactinemia funcional
4) hiperprolactinemia que acompaña al hipotiroidismo primario descompensado (el aumento de la secreción de TRH estimula la secreción de la PRL)
5) niveles elevados de PRL asociados a la insuficiencia hepática (metabolismo de PRL alterado) o renal (disminución del aclaramiento)
6) tumores hipofisarios mixtos secretores de la PRL y de otras hormonas (p. ej. GH).
2. Macroprolactinemia: se define por la presencia de una variedad de PRL de alto peso molecular, asociada a anti-PRL-IgG, sin actividad biológica y que presenta tan solo reactividad inmunológica: una concentración sérica de PRL notablemente elevada que se acompaña de síntomas inadecuados o poco pronunciados (el diagnóstico correcto permite evitar un tratamiento innecesario). Hay que tratar la muestra de suero con polietilenglicol (PEG) al 25 %, que precipita la macroprolactina.
TratamientoArriba
Algoritmo de actuación en la hiperprolactinemia →fig. 1.
Principios generales
1. El riesgo de progresión de un microadenoma a macroadenoma es de ~7 % a los 10 años, por lo que no todas las personas requieren tratamiento. Se deben tratar los pacientes en los que es importante restablecer la función gonadal. El tratamiento de elección es la administración crónica de fármacos dopaminérgicos.
2. En caso de macroadenoma, la eficacia del tratamiento farmacológico es similar a la del microadenoma. El tratamiento quirúrgico ofrece resultados limitados con elevado porcentaje de recaídas y muchas complicaciones posoperatorias. Por este motivo, está indicado en casos especiales (para restablecer el campo visual en tumores que comprimen el quiasma óptico si fracasan o no se toleran los fármacos dopaminérgicos).
Tratamiento farmacológico
Fármacos dopaminérgicos (agonistas del receptor dopaminérgico D2):
1) bromocriptina VO 2,5-30 mg/d; en caso de resistencia a la bromocriptina (definida por la falta de normalización de la PRL, o de una disminución significativa del tamaño del adenoma tras 3 meses de tratamiento con la dosis máxima tolerada), o intolerancia, sustituirla por cabergolina
2) cabergolina VO, inicialmente 0,5 mg 1 × semana, en caso de necesidad aumentar la dosis gradualmente hasta que se normalicen los niveles séricos de PRL; en general 0,5-2,0 mg/semana administrada 1-2 × semana (>1 mg/semana, se recomienda repartir en 2 dosis): es el fármaco mejor tolerado y el más eficaz para disminuir los niveles de PRL y el tamaño de prolactinoma
3) quinagolida VO a dosis de 75-600 μg/d 1 × d antes de dormir.
PERSPECTIVA LATINOAMERICANA
En Argentina, Chile y México el fármaco de primera elección es la cabergolina VO. La quinagolida no está disponible en Argentina, Chile ni en Colombia. La bromocriptina no está disponible en Argentina. En México la bromocriptina es difícil de conseguir.
En la mayoría de los enfermos se logra normalizar la PRL, prevenir el crecimiento del adenoma, disminuir su tamaño (>50 % en un año en un 90 % de los enfermos) e incluso lograr la regresión. El tratamiento se prolonga durante muchos años y en algunos casos indefinidamente. La retirada del tratamiento a menudo conduce a una recaída de la enfermedad. Se considera que después de 2-4 años de tratamiento se puede conseguir la remisión y finalizar la terapia en <10 % de los enfermos (es más probable en enfermos con tumores sin expansión extraselar inicial, que presentaron una muy buena respuesta al tratamiento al normalizar rápidamente la PRL).
En caso de administrar cabergolina a dosis altas, se recomienda realizar ecocardiografía de manera periódica, ya que existe el riesgo de fibrosis y lesiones en las válvulas cardíacas. En un 15 % de los enfermos tratados con dopaminérgicos a dosis altas se han observado comportamientos compulsivos (hipersexualidad, trastorno alimentario compulsivo, tendencia patológica a los juegos de azar o compras compulsivas). Se debe advertir al paciente sobre el riesgo de tales comportamientos y, eventualmente, disminuir la dosis del fármaco si se presentan.
Tratamiento quirúrgico
Se considera solo en casos excepcionales con resistencia o intolerancia grave a los fármacos dopaminérgicos, y en caso de compresión sobre el quiasma óptico que ocasione un defecto del campo visual que no remite con la administración de dosis altas de fármacos dopaminérgicos. Los resultados de la cirugía dependen del tamaño del tumor. En los mejores centros la cirugía transesfenoidal es eficaz en un 70 % de los casos de microprolactinoma, si bien en ~20 % se producen recidivas. En los macroprolactinomas, la eficacia de la cirugía es de ~30 %, con >50 % de recidivas.
Actuación en mujeres que planean el embarazo y en embarazadas
1. Antes del embarazo iniciar el tratamiento farmacológico e intentar disminuir al máximo el tamaño del tumor para evitar las complicaciones neurológicas provocadas por el aumento de tamaño del tumor hipofisario durante el embarazo por la elevación del estradiol placentario. Si en 3-6 meses se observa una disminución del tamaño del tumor, que permanece estable en repetidos estudios de RMN, sin exceder la silla turca, se considera que el embarazo es seguro incluso para una mujer con macroprolactinoma.
2. Durante el embarazo, retirar el tratamiento y controlar el campo visual cada trimestre. Si aparecen síntomas sugestivos de "efecto de masa" (cefalea intensa o limitación del campo visual) → reintroducir el fármaco dopaminérgico. Se acepta la posibilidad de realizar una RMN, pero sin gadolinio. No hay evidencia de aumento del riesgo de aborto ni malformaciones congénitas debidos a la ingesta de bromocriptina o cabergolina durante el embarazo. No se recomienda la determinación de la concentración sérica de PRL en las embarazadas con prolactinoma, debido al aumento fisiológico considerable de su concentración y falta de valores de referencia.
3. Durante el período periparto, se puede producir una apoplejía del tumor, que con frecuencia provoca remisión espontánea del adenoma.
FIGURAS
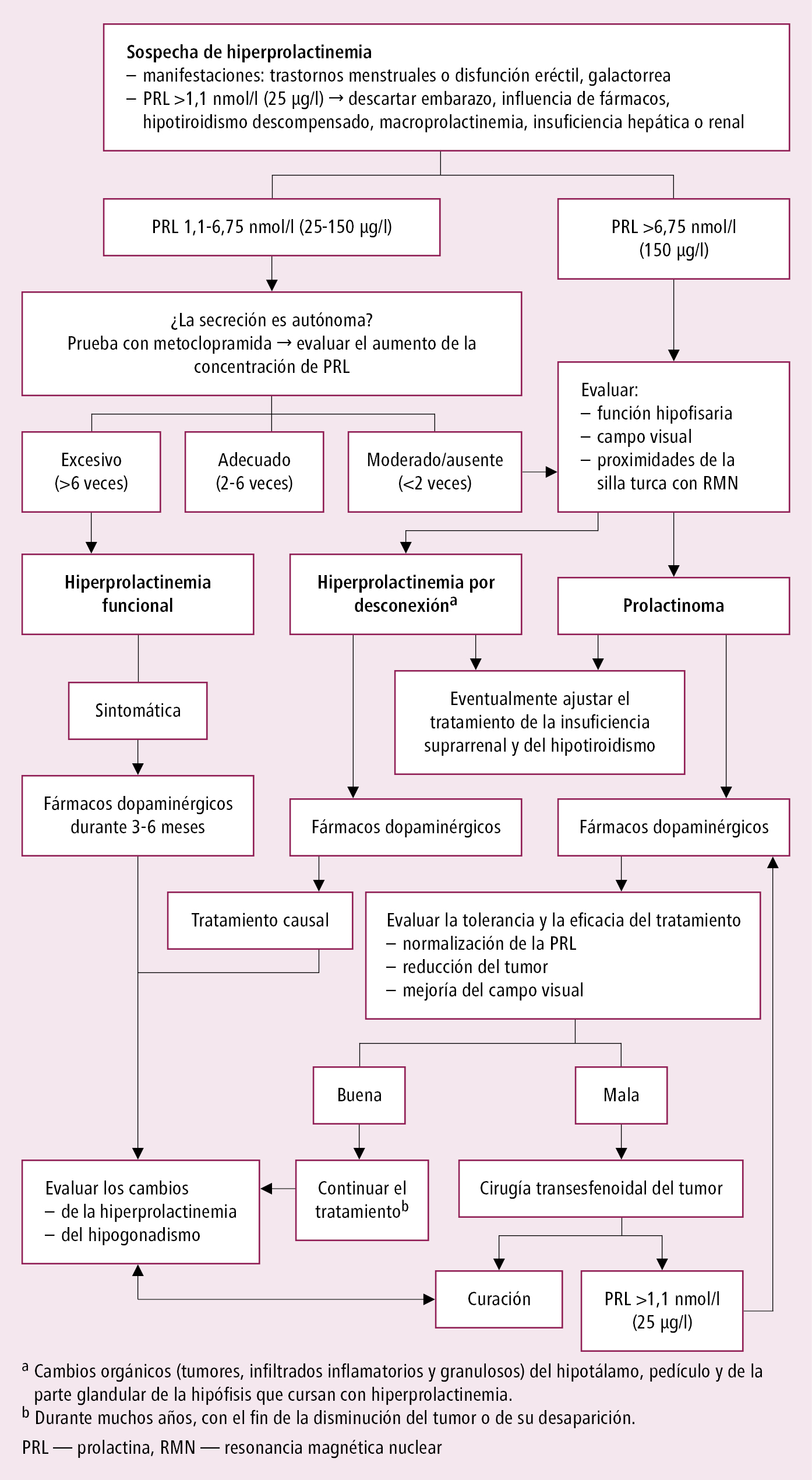
Fig. 8.4-1. Algoritmo de actuación en hiperprolactinemia
 Español
Español
 English
English
 українська
українська





