A partir de: S.V. Konstantinides, G. Meyer, C. Becattini, H. Bueno, G.J. Geersing, V.P. Harjola, M.V. Huisman, M. Humbert, C.S. Jennings, D. Jiménez, N. Kucher, I.M. Lang, M. Lankeit, R. Lorusso, L. Mazzolai, N. Meneveau, F. Ní Áinle, P. Prandoni, P. Pruszczyk, M. Righini, A. Torbicki, E. Van Belle, J.L. Zamorano; ESC Scientific Document Group, 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS), European Heart Journal, 2020, 41: 543-603
Elaborado por: Maria Referowska (MD), Wiktoria Leoniak (MD, PhD)
Consultado por: Grzegorz Kopea (MD, PhD)
Nota de la redacción: Este artículo presenta información práctica y recomendaciones seleccionadas para el diagnóstico y el tratamiento del embolismo pulmonar agudo. Después de cada recomendación se proporciona entre corchetes su fuerza y la calidad de los datos en los que se basa, de acuerdo con la clasificación presentada en la tabla 1.
Cómo citar: Referowska M., Leśniak W., Rozpoznawanie i leczenie ostrej zatorowooci p3ucnej. Podsumowanie wytycznych European Society of Cardiology 2019, Med. Prakt., 2020; 3: 08-38
Siglas y abreviaturas: AAS — ácido acetilsalicílico, ACOD — anticoagulante oral directo, ACV — accidente cerebrovascular, angio-RMN — angiografía por resonancia magnética, angio-TC — angiografía por tomografía computarizada, AVK — antagonistas de la vitamina K, BRD — bloqueo de rama derecha del haz de His, CrCl — aclaramiento de creatinina, EC — ecografía de compresión, ECG — eletrocardiograma, ECV — enfermedades cardiovasculares, EP — embolismo pulmonar, ESC — European Society of Cardiology, eTFG — tasa de filtración glomerular estimada, ETV — enfermedad tromboembólica venosa, HBPM — heparina de bajo peso molecular, HNF — heparina no fraccionada, HPTEC — hipertensión pulmonar tromboembólica crónica, IMC — índice de masa corporal, INR — índice internacional normalizado, NT-proBNP — fragmento N-terminal del propéptido natriurético tipo B, OMEC — oxigenación por membrana extracorpórea, PERT (pulmonary embolism response team) — equipo de respuesta al embolismo pulmonar, PESI (Pulmonary Embolism Severity Index) — índice de la severidad del embolismo pulmonar, RMN — resonancia magnética nuclear, SaO2 — saturación de oxígeno de la hemoglobina en sangre arterial, SPECT (single-photon emission computed tomography) — tomografía por emisión de fotón único, TC — tomografía computarizada, tPA — alteplasa, TVP — trombosis venosa profunda, V/Q — perfusión-ventilación (gammagrafía)
Tratamiento
Tratamiento en la fase aguda del embolismo pulmonar
Embolismo pulmonar de alto riesgo
El algoritmo de manejo se presenta en la fig. 2.

En pacientes con hipoxemia (SaO2 <90 %), se utiliza la oxigenoterapia y, si es necesario, la ventilación mecánica.
Para el tratamiento de la insuficiencia ventricular derecha se utiliza, según las indicaciones (véase más adelante):
1) fluidoterapia en caso de presión venosa central baja: NaCl al 0,9 % o solución Ringer lactato ≤500 ml en 15-30 minutos
2) vasoconstrictores y fármacos inotrópicos positivos: noradrenalina 0,2-1,0 µg/kg/min (atención: el aumento de la vasoconstricción puede reducir la perfusión tisular) y dobutamina 2-20 µg/kg/min (puede aumentar la hipotensión si se administra sin vasoconstrictores)
3) oxigenación por membrana extracorpórea (OMEC).
En pacientes con EP de alto riesgo:
1) se recomienda que el tratamiento anticoagulante con HNF se inicie de inmediato, incluida la inyección (bolo) iv. a una dosis ajustada al peso corporal [I/C]
2) se recomienda la terapia trombolítica sistémica [I/B] y, si está contraindicada o no es efectiva, la embolectomía pulmonar quirúrgica (si está disponible) [I/C] o se debe considerar un tratamiento percutáneo con catéter (p. ej. fragmentación o aspiración del trombo con una eventual trombólisis local) [IIa/C]
3) se debe considerar la administración de noradrenalina y/o dobutamina [IIa/C]
4) en caso de inestabilidad hemodinámica refractaria al tratamiento o paro cardíaco, se puede considerar —en caso de disponibilidad— el uso de oxigenación por membrana extracorpórea (OMEC) en combinación con embolectomía quirúrgica o tratamiento con catéter [IIb/C].
Dosificación de fármacos trombolíticos en el EP:
1) alteplasa, tPA (preferible)
a) esquema estándar: 100 mg iv. durante 2 h
b) esquema rápido: 0,6 mg/kg (máx. 50 mg) durante 15 min (no aprobado oficialmente, a veces utilizado en inestabilidad hemodinámica extrema, p. ej. paro cardíaco)
2) estreptoquinasa
a) esquema rápido: 1,5 mill. UI iv. durante 2 h
b) esquema estándar: 250 000 UI iv. durante 30 min y después 100 000 UI/h durante 12‑24 h
3) uroquinasa
a) esquema rápido: 3 mill. UI durante 2 h
b) esquema estándar: 4400 UI/kg como dosis de carga durante 10 min y después 4400 UI/kg/h durante 12‑24 h
Contraindicaciones para el tratamiento trombolítico:
1) absolutas
a) ACV hemorrágico o de causa desconocida en cualquier momento de la vida
b) ACV isquémico en los últimos 6 meses
c) neoplasia del sistema nervioso central
d) recientemente (en las últimas 3 semanas) traumatismo grave, intervención quirúrgica o traumatismo craneal
e) diátesis hemorrágica conocida o hemorragia activa
2) relativas
a) accidente isquémico transitorio en los últimos 6 meses
b) tratamiento con anticoagulante oral
c) embarazo y primera semana del puerperio
d) punción de un sitio no compresible
e) resucitación traumática
f) hipertensión arterial resistente (presión sistólica >180 mm Hg)
g) hepatopatía avanzada
h) endocarditis infecciosa
i) úlcera gástrica activa.
Embolismo pulmonar de riesgo intermedio o bajo
El algoritmo de manejo se presenta en la fig. 3.
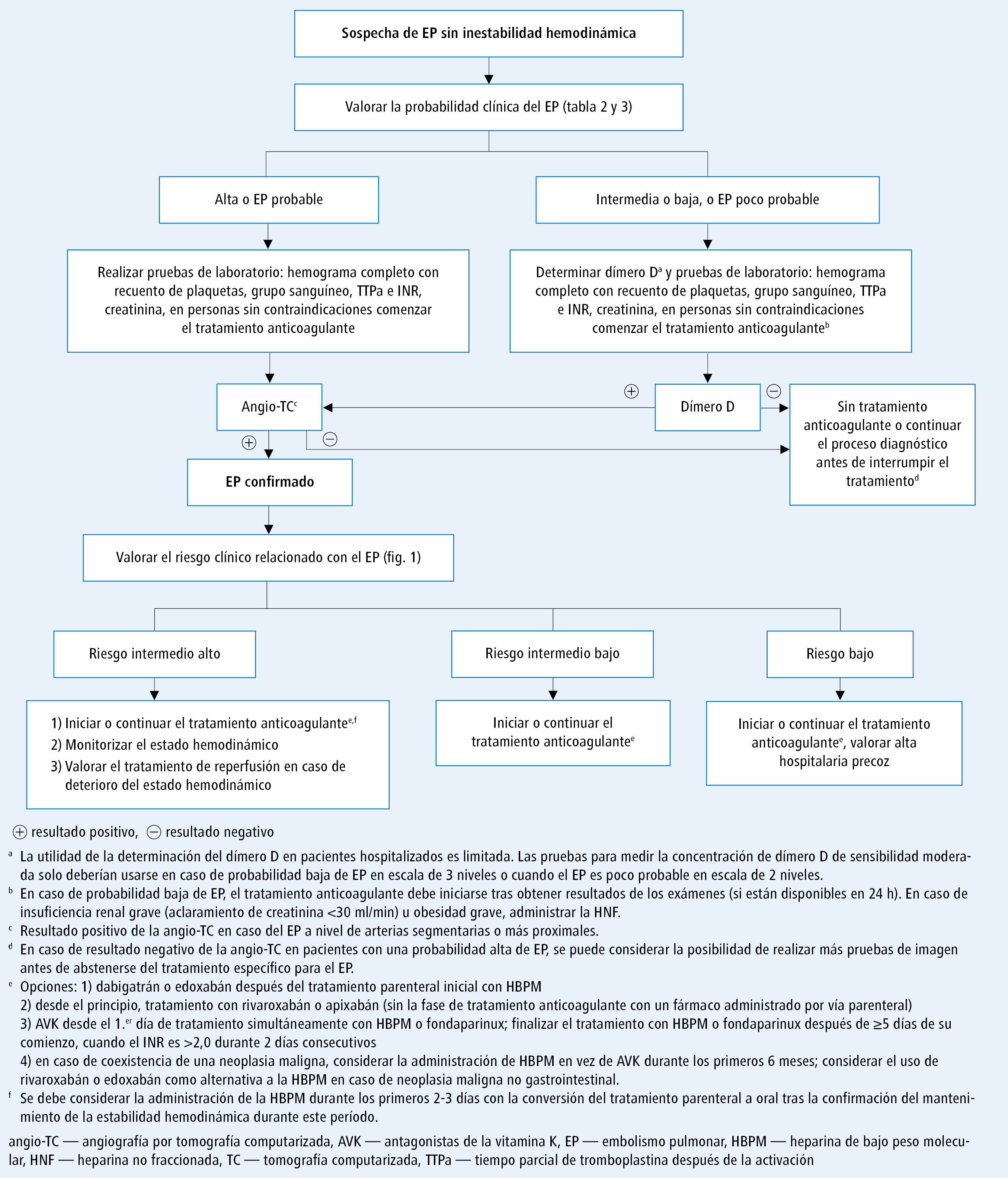
Se recomienda iniciar el tratamiento anticoagulante inmediatamente en los pacientes con probabilidad clínica alta o intermedia de EP, ya durante el proceso diagnóstico [I/C].
Si se inicia un tratamiento parenteral, en la mayoría de los pacientes se aconseja utilizar heparina de bajo peso molecular (HBPM) o fondaparinux en lugar de HNF [I/A]. La dosificación de los fármacos se presenta en la tabla 5.
| Tabla 5. Dosificación de HBPM, fondaparinux y ACOD en el tratamiento inicial del embolismo pulmonar | |
|---|---|
| Anticoagulante | Dosis anticoagulantes |
| HBPM | |
| Dalteparinaa | 100 UI/kg cada 12 h o 200 UI/kg cada 24 h (máxima dosis única 18 000 UI/ml) VSc |
| Enoxaparina | 1 mg/kg cada 12 h o 1,5 mg/kg cada 24 h VSc |
| Nadroparina | 86 UI/kg cada 12 h o 171 UI/kg cada 24 h VSc |
| Fondoparinux | |
| VSc cada 24 h
5 mg (con peso corporal <50 kg) 7,5 mg (con peso corporal 50‑100 kg) 10 mg (con peso corporal >100 kg) |
|
| ACOD | |
| Apixabán | 10 mg 2 × d durante 7 días y después 5 mg 2 × d VOb |
| Rivaroxabán | 15 mg 2 × d durante 3 semanas y después 20 mg 1 × d VOb |
| Edoxabánc | 60 mg 1 × d VO |
| Dabigatránc | 150 mg 2 × d VO |
| a En pacientes con neoplasia maligna 200 UI/kg (máx. 18 000 UI) 1 × d durante 1 mes y después 150 UI/kg 1 × d durante 5 meses
b Dosificación con función renal normal; dosificación en caso de insuficiencia renal: 1) no se recomienda el dabigatrán para pacientes con aclaramiento de creatinina (CrCl) <30 ml/min; 2) el edoxabán debe usarse a una dosis de 30 mg 1 x d en pacientes con CrCl 15-50 ml/min, y no se recomienda con CrCl <15 ml/min; 3) el rivaroxabán y el apixabán deben usarse con precaución en pacientes con CrCl 15-29 ml/min, ninguno de estos dos medicamentos debería usarse con CrCl <15 ml/min c Se usa después de un tratamiento inicial con HBPM o HNF durante ≥5 días. ACOD — anticoagulante oral directo, HBPM — heparina de bajo peso molecular, HNF — heparina no fraccionada | |
Al comenzar el tratamiento anticoagulante oral en un paciente con EP apto para la terapia con anticoagulantes orales directos (ACOD; apixabán, dabigatrán, edoxabán o rivaroxabán), se deben preferir los ACOD a los AVK [I/A]. La dosificación de los ACOD se presenta en la tabla 5.
En pacientes que reciben AVK, se recomienda el tratamiento de anticoagulación parenteral simultáneo hasta alcanzar el valor de INR 2,5 (durante 2 días consecutivos rango de 2,0-3,0) [I/A].
No se recomienda el uso de ACOD en pacientes con disfunción renal grave, mujeres durante el embarazo y la lactancia o en pacientes con síndrome antifosfolipídico [III/C].
En los pacientes con deterioro hemodinámico durante el tratamiento anticoagulante, se recomienda el tratamiento trombolítico de rescate [I/B] o, si está disponible, la embolectomía quirúrgica o el tratamiento percutáneo con catéter [IIa/C].
La trombólisis sistémica rutinaria no se recomienda para pacientes con EP de riesgo intermedio o bajo [III/B].
La relación entre los efectos adversos y los beneficios aún no se ha establecido para la embolectomía quirúrgica y el tratamiento percutáneo con catéter en el EP de riesgo intermedio y bajo.
Filtros en la vena cava inferior
No se recomienda la implantación rutinaria de filtros en la vena cava inferior [III/A].
Se debe considerar implantar tal filtro:
1) en pacientes con EP agudo y contraindicaciones absolutas para el tratamiento anticoagulante [IIa/C]
2) en casos de recurrencia de EP a pesar del uso de anticoagulantes a dosis terapéuticas [IIa/C].
Principios de atención hospitalaria
Se debe considerar la creación, de ser posible en el hospital determinado, de un equipo multidisciplinario de respuesta al embolismo pulmonar (PERT) y la elaboración de un esquema de actuación en el EP de riesgo alto y (en casos seleccionados) intermedio [IIa/C].
En pacientes cuidadosamente seleccionados con EP de riesgo bajo, puede considerarse el alta temprana del hospital, continuando el tratamiento en casa, siempre que se proporcione atención ambulatoria y tratamiento anticoagulante adecuados [IIa/A].
Los criterios de Hestia se utilizan para evaluar la posibilidad del alta temprana del hospital y el tratamiento domiciliario (una respuesta positiva a cualquiera de las siguientes preguntas excluye la posibilidad del tratamiento domiciliario)
1) ¿Está el paciente hemodinámicamente inestable, es decir, requiere ingreso en la unidad de cuidados intensivos (en la opinión del médico, según, entre otros, los siguientes criterios: presión arterial sistólica <100 mm Hg y frecuencia cardíaca >100/min)?
2) ¿Es necesaria la trombólisis o la embolectomía?
3) ¿Existe hemorragia activa o un alto riesgo de hemorragia (sangrado del tracto digestivo en los últimos 14 días, antecedentes de ACV <4 semanas, cirugía <2 semanas, trastorno hemostático, trombocitopenia [recuento de plaquetas <75 000/µl] o hipertensión no controlada [presión sistólica >180 mm Hg o diastólica >110 mm Hg])?
4) ¿Es necesaria la oxigenoterapia durante más de 24 horas para mantener la SaO2 >90 %?
5) ¿Se ha diagnosticado el EP durante el tratamiento anticoagulante?
6) ¿Hay dolor intenso que requiere la administración de analgésicos iv. durante más de 24 horas?
7) ¿Existe justificación médica o social para el tratamiento hospitalario durante >24 horas (infección, neoplasia maligna o falta de supervisión/atención domiciliaria)?
8) ¿El aclaramiento de creatinina (CrCl; según la fórmula de Cockroft-Gault) es <30 ml/min?
9) ¿Tiene el paciente una insuficiencia hepática grave (según la opinión del médico)?
10) ¿Está la paciente embarazada?
11) ¿Tiene el paciente una historia documentada de trombocitopenia inducida por heparina?
Tratamiento anticoagulante de larga duración
Pacientes sin neoplasia maligna
Duración de la terapia
En todos los pacientes con EP se recomienda el tratamiento anticoagulante a dosis terapéutica durante ≥3 meses [I/A].
En pacientes con el primer episodio de EP/ETV asociado a un factor de riesgo transitorio/reversible grave (tabla 6) se recomienda la interrupción del tratamiento anticoagulante oral después de 3 meses [I/B].
| Tabla 6. División de factores de riesgo de la enfermedad tromboembólica venosa en función del riesgo de recurrencia a largo plazoa |
|---|
| Riesgob bajo (<3 %/año) |
| Factores graves transitorios o reversibles asociados a un aumento de >10 veces del riesgo de primer incidente de EP (en comparación con los pacientes sin este factor de riesgo):
1) Cirugía bajo anestesia general con una duración de >30 min 2) Inmovilización en cama durante la hospitalización (solo posibilidad de usar el baño) durante ≥3 días, causada por una enfermedad aguda o un agravamiento repentino de una enfermedad crónica 3) Traumatismo con fracturas óseas |
| Riesgob intermedio (3-8 %/año) |
| Factores transitorios o reversibles asociados a un aumento de ≤10 veces del riesgo de primer incidente de EP:
1) cirugías pequeñas (anestesia general durante <30 min) 2) hospitalización por <3 días debido a una enfermedad aguda 3) tratamiento con estrógenos/anticoncepción 4) embarazo o puerperio 5) necesidad de encamamiento fuera del hospital durante ≥3 días debido a una enfermedad aguda 6) traumatismo de una extremidad (sin fractura) asociado a la restricción de movimiento durante ≥3 días 7) vuelo de larga duración |
| Factores de riesgo persistentes no asociados a una neoplasia maligna:
1) enfermedad inflamatoria intestinal 2) enfermedad autoinmune activa |
| Sin factor de riesgo identificable |
| Riesgob alto (>8 %/año) |
| 1) neoplasia maligna activa
2) ≥1 antecedente de ETV en ausencia de un factor de riesgo transitorio o reversible grave 3) síndrome antifosfolipídico |
| a La división de los factores de riesgo en categorías para el primer episodio de ETV está en línea con la propuesta de la International Society on Thrombosis and Haemostatis (ISTH). Las guías actuales de la ESC evitan el uso de los términos ETV "provocada", "no provocada" o "idiopática".
b Riesgo estimado de recurrencia a largo plazo si se suspende la anticoagulación después de los primeros 3 meses EP — embolismo pulmonar, ETV — enfermedad tromboembólica venosa |
Se recomienda el tratamiento anticoagulante oral indefinido en los pacientes:
1) con ETV recurrente (es decir, después de ≥1 episodio de EP o TVP), no asociado a un factor de riesgo transitorio o reversible grave [I/B]
2) con síndrome antifosfolipídico [I/B].
La prolongación del tratamiento anticoagulante después de 3 meses (la decisión sobre la duración de la prolongación del tratamiento se toma individualmente en función del riesgo de hemorragia y de las características clínicas del paciente) debe considerarse en los pacientes con el primer episodio de EP:
1) sin un factor de riesgo identificable [IIa/A]
2) asociado a un factor de riesgo persistente que no sea el síndrome antifosfolipídico [IIa/C]
3) asociado a un factor de riesgo transitorio o reversible más débil [IIa/C].
Dosificación de anticoagulantes en el tratamiento prolongado
Si se toma la decisión de prolongar el tratamiento anticoagulante después del EP en un paciente sin neoplasia maligna, se debe considerar el uso de ACOD a dosis reducidas: apixabán (2,5 mg 2 × d) o rivaroxabán (10 mg 1 × d) después de 6 meses de administración de anticoagulantes a dosis terapéuticas [IIa/A]. Si se ha seleccionado el dabigatrán o el edoxabán para el tratamiento anticoagulante prolongado después de un episodio de EP, no deberían modificarse las dosis de estos fármacos, ya que los esquemas de dosis reducidas no se han evaluado en los estudios sobre el tratamiento anticoagulante prolongado.
Terapia prolongada con anticoagulantes alternativos
En pacientes que se niegan a tomar anticoagulantes orales o que no los toleran, se puede considerar el uso de ácido acetilsalicílico (AAS) o sulodexida para la prevención prolongada de la ETV [IIb/B].
Monitorización de pacientes tratados con anticoagulantes
En pacientes que reciben un tratamiento anticoagulante prolongado, se recomienda repetir la evaluación a intervalos regulares de: la tolerancia al tratamiento, el cumplimiento, la función hepática y renal (especialmente en los que reciben ACOD) y el riesgo de hemorragia [I/C].
Pacientes con neoplasia maligna activa
En pacientes con EP y neoplasia maligna se debe considerar el uso de HBPM subcutánea a dosis ajustada al peso corporal durante los primeros 6 meses en lugar de AVK [IIa/A].
En pacientes sin neoplasia maligna del tracto digestivo, como alternativa al uso subcutáneo de HBPM a dosis ajustada al peso corporal, debe considerarse el uso de edoxabán [IIa/B] o rivaroxabán [IIa/C].
En pacientes con EP y neoplasia maligna se debe considerar
1) prolongación del tratamiento anticoagulante (más allá de los primeros 6 meses): indefinidamente o hasta la curación de la neoplasia [IIa/B]
2) el mismo procedimiento, en caso de detección accidental, como en el EP sintomático, si las lesiones embólicas incluyen ramas segmentarias o más proximales, múltiples vasos subsegmentarios o un solo vaso subsegmentario con TVP documentada [IIa/B].
Manejo en situaciones especiales
El manejo descrito en este capítulo se basa en datos de baja calidad. No se han formulado recomendaciones, sino solo propuestas de manejo.
EP subsegmentario
La detección del EP subsegmentario es difícil. A menudo hay diferencias en las descripciones de la misma prueba de imagen realizada por diferentes personas, por lo que el diagnóstico debe ser confirmado por un radiólogo con experiencia en la evaluación de los órganos torácicos.
En caso de EP en un solo vaso subsegmentario, se sugiere:
1) en pacientes ambulatorios sin neoplasia maligna o TVP proximal: vigilancia clínica
2) en pacientes hospitalizados con neoplasia maligna o EP y TVP proximal confirmada: tratamiento anticoagulante.
En el EP en numerosos vasos subsegmentarios se sugiere un tratamiento anticoagulante.
EP detectado accidentalmente
En caso de que se detecte accidentalmente EP en un solo vaso subsegmentario, el manejo depende de las características del paciente (véase más arriba). En todos los demás casos se sugiere el tratamiento anticoagulante.
EP en pacientes con hemorragia activa
En los pacientes con EP y hemorragia activa, se sugiere insertar un filtro en la vena cava inferior (preferiblemente un filtro extraíble) y volver a evaluar la posibilidad de un tratamiento anticoagulante inmediatamente después de que la hemorragia cese y se estabilice el estado del paciente. El filtro debe retirarse lo antes posible después de que se restablezca el tratamiento anticoagulante.
Pacientes de edad avanzada con síndrome de fragilidad y pacientes tratados con múltiples fármacos
Con la edad, el número de enfermedades con síntomas similares al EP aumenta, lo que lleva con más frecuencia a un retraso en el diagnóstico. Además, los pacientes de edad avanzada con síndrome de fragilidad o que toman múltiples fármacos, independientemente del anticoagulante utilizado (AVK o ACOD), tienen un alto riesgo de hemorragia.
Se sugiere evaluar la probabilidad clínica de EP como en los pacientes sin fragilidad, pero se debe tener cuidado con los residentes de centros de cuidados, ya que las escalas de predicción clínica pueden ser poco fiables en ellos. En general, se prefieren los ACOD a los AVK en pacientes de edad avanzada y en pacientes con síndrome de fragilidad, pero se evitan los ACOD en pacientes con insuficiencia renal grave. También en la ficha técnica se deben comprobar las posibles interacciones entre los ACOD y los fármacos que el paciente toma simultáneamente.
La tolerancia al tratamiento, su cumplimiento por parte del paciente, la función hepática y renal y el riesgo de hemorragia deben evaluarse regularmente.
EP agudo en mujeres que usan anticonceptivos orales
Si la paciente ha utilizado un anticonceptivo que contiene estrógenos, y especialmente si el EP se ha producido dentro de los tres primeros meses de haber iniciado la anticoncepción hormonal, se sugiere que se descontinúe después de discutir métodos alternativos de prevención del embarazo. La descontinuación de la anticoagulación debe considerarse 3 meses después del episodio de EP.
En todos los demás casos, a las mujeres que usan anticonceptivos hormonales se sugiere:
1) realizar un tratamiento anticoagulante crónico igual que después del EP agudo en pacientes sin factores de riesgo identificables
2) considerar la posibilidad de utilizar un modelo predictivo validado para cuantificar el riesgo de recurrencia de la ETV, p. ej. la escala HERDOO2, que da 1 punto por:
a) hiperpigmentación, edema o enrojecimiento del miembro inferior
b) concentración de dímero D durante el tratamiento anticoagulante ≥250 µg/l
c) obesidad con IMC ≥30 kg/m2 y
d) edad ≥65 años.
Una puntuación de 0 o 1 punto en esta escala facilita la identificación de las mujeres jóvenes que pueden interrumpir con seguridad el tratamiento anticoagulante.
En caso de embarazo, se debe aconsejar a la paciente sobre la necesidad de prevención con el uso de HBPM.
Embolismo pulmonar en embarazadas
Diagnóstico
Si se sospecha EP durante el embarazo o el puerperio, se recomiendan procesos diagnósticos utilizando métodos validados [I/B].
Para excluir el EP se debe considerar
1) durante el embarazo y el puerperio: medición de la concentración de dímero D y uso de escalas clínicas predictivas [IIa/B]
2) durante el embarazo: realizar una gammagrafía de perfusión o angio-TC de las arterias pulmonares (utilizando un protocolo con dosis bajas de radiación); la angio-TC de las arterias pulmonares debería considerarse como opción de elección en caso de alteraciones en la radiografía torácica [IIa/C].
En embarazadas con sospecha de EP (especialmente en caso de síntomas de TVP), se debe considerar el uso de EC para evitar la radiación innecesaria [IIa/B].
Tratamiento
La terapia recomendada para la mayoría de las embarazadas con EP sin inestabilidad hemodinámica es la HBPM a una dosis terapéutica fija ajustada para el peso corporal al inicio del embarazo [I/B].
En embarazadas con EP de riesgo alto se debe considerar la trombólisis o la embolectomía quirúrgica [IIa/C].
No se recomienda:
1) la inserción de una aguja en el canal espinal o el espacio epidural antes de que pasen ≥24 horas de la última dosis terapéutica de HBPM [III/C]
2) administrar HBPM en las 4 horas posteriores a la extracción del catéter epidural [III/C]
3) el uso de ACOD durante el embarazo o la lactancia [III/C].
Embolia de líquido amniótico
El diagnóstico de embolia de líquido amniótico debe considerarse en una embarazada o en el puerperio con paro cardíaco inexplicable, hipotensión persistente o deterioro de la función respiratoria, en particular con coagulación intravascular diseminada concomitante [IIa/C].
Observación
En los pacientes después 3-6 meses de un episodio de EP agudo, se recomienda una evaluación clínica de rutina de los síntomas que puedan indicar recurrencia del EP, hemorragia, neoplasia maligna o reducción de la tolerancia al esfuerzo persistente o de reciente aparición, y para decidir sobre la prolongación del tratamiento anticoagulante [I/B].
Se recomienda crear un modelo de atención integral para enfermos después del EP (incluidos especialistas hospitalarios, enfermeros debidamente calificados y médicos de atención primaria) para transferir de manera óptima la supervisión de los enfermos después del alta hospitalaria a una unidad ambulatoria [I/C].
En pacientes con disnea o tolerancia reducida al esfuerzo después de EP persistente o reciente, se debe considerar evaluar la probabilidad de hipertensión pulmonar con una ecocardiografía transtorácica. Si la probabilidad ecocardiográfica de hipertensión pulmonar es alta o si la probabilidad es intermedia y al mismo tiempo se cumple uno de los siguientes criterios adicionales: aumento de la concentración del fragmento N-terminal del propéptido natriurético tipo B (NT-proBNP), presencia de factores de riesgo de hipertensión pulmonar tromboembólica crónica (HPTEC, véase más adelante), alteraciones en el resultado de la prueba de esfuerzo cardiopulmonar, se sugiere una gammagrafía V/Q [IIa/C]. También se pueden considerar otros diagnósticos en pacientes asintomáticos con factores de riesgo de HPTEC, como antecedentes de episodios de EP o TVP, trombos extensos en las arterias pulmonares en la angio-TC de las arterias pulmonares, síntomas ecocardiográficos de hipertensión pulmonar o disfunción ventricular derecha, cambios en la angio-TC de las arterias pulmonares sugiriendo enfermedad tromboembólica crónica preexistente, comorbilidades y afecciones que predisponen a HPTEC: fístulas auriculoventriculares, infección de catéter intravenoso crónico o de estimuladores, antecedentes de esplenectomía, trombofilias (especialmente síndrome antifosfolipídico y alta concentración de factor VIII), grupo sanguíneo distinto de 0, hipotiroidismo tratado con hormonas tiroideas, antecedentes de neoplasia maligna, síndromes mieloproliferativos, enfermedad inflamatoria intestinal, inflamación crónica de la médula ósea [IIb/C].
Se recomienda remitir a los pacientes sintomáticos con pérdidas de perfusión que no coincidan con zonas de ventilación deficiente y persistan en la gammagrafía V/Q (alternativamente, se puede realizar una TC de doble energía si se dispone de ella en el sitio), después de 3 meses del episodio de EP agudo, a un centro experimentado que se ocupe de hipertensión pulmonar/HPTEC, teniendo en cuenta los resultados de la ecocardiografía, la concentración de péptidos natriuréticos y/o la prueba de esfuerzo cardiopulmonar [I/C].
A recordar
Cambios en la fuerza de las recomendaciones en comparación con las guías de 2014
• Se recomienda la terapia trombolítica de rescate en enfermos con empeoramiento del estado hemodinámico [IIa → I].
• La embolectomía quirúrgica o la terapia con catéter percutáneo deben considerarse como alternativa a la trombólisis de rescate en pacientes con empeoramiento del estado hemodinámico a pesar del tratamiento anticoagulante aplicado a causa del EP de riesgo bajo o intermedio [IIb → IIa].
• Se debe considerar la determinación del dímero D y el uso de escalas clínicas predictivas para excluir EP durante el embarazo y el puerperio [IIb → IIa].
• Se puede considerar una evaluación adicional después de un episodio de EP en personas asintomáticas con mayor riesgo de HPTEC [III → IIb].
Nuevas recomendaciones principales
• Se debe considerar la adopción de un valor de corte para un resultado negativo de dímero D ajustado a la edad o a la probabilidad clínica, como alternativa a un valor de corte fijo [IIa].
• Si se utiliza un resultado de EC positivo en el segmento proximal para confirmar el EP, se debe considerar una evaluación de riesgo para dirigir el procedimiento a seguir [IIa].
• Se puede considerar realizar un SPECT V/Q para diagnosticar el EP [IIb].
• Se debe considerar la evaluación del ventrículo derecho utilizando pruebas de imagen o biomarcadores de laboratorio, incluso con bajas puntuaciones de PESI o sPESI 0 [IIa].
• Se puede considerar la utilización de escalas validadas que incluyan factores de pronóstico clínico, de imágenes y de laboratorio para una estratificación adicional de la gravedad del EP [IIb].
• Cuando se inicia la anticoagulación oral en un enfermo con EP apto para los ACOD, se recomienda elegir el ACOD [I].
• En enfermos con síndrome antifosfolipídico se recomienda el tratamiento anticoagulante indefinido con AVK [I].
• En los pacientes con el primer episodio de EP se debe considerar la posibilidad de un tratamiento anticoagulante prolongado en caso de:
1) no encontrar ningún factor de riesgo detectable [IIa]
2) detectar un factor de riesgo permanente distinto al síndrome antifosfolipídico [IIa]
3) detectar un factor de riesgo transitorio más débil [IIa].
• Después de los primeros 6 meses de uso del apixabán o el rivaroxabán se debe considerar la reducción de la dosis [IIa].
• En pacientes con neoplasia maligna (con excepción de las neoplasias malignas del tracto digestivo), se debe considerar el uso de edoxabán o rivaroxabán en lugar de HBPM [IIa].
• En mujeres embarazadas o en el puerperio con inestabilidad hemodinámica inexplicable o deterioro de la función respiratoria y síndrome de coagulación intravascular diseminada, debe sospecharse la existencia de una embolia de líquido amniótico [IIa].
• En embarazadas con EP de alto riesgo se debe considerar la trombólisis o la embolectomía quirúrgica [IIa].
• No se recomiendan los ACOD para mujeres durante el embarazo o la lactancia [III].
• Después de 3-6 meses de un episodio de EP agudo se recomienda una evaluación clínica de rutina [I].
• Se recomienda remitir a los pacientes sintomáticos con pérdidas de perfusión que no coincidan con zonas de ventilación deficiente en la gammagrafía V/Q realizada después de >3 meses del EP agudo, a un centro experimentado que se ocupe de hipertensión pulmonar/HPTEC, teniendo en cuenta los resultados de la ecocardiografía, la determinación de péptidos natriuréticos y/o la prueba de esfuerzo cardiopulmonar [I/C].
 Español
Español
 English
English
 українська
українська





