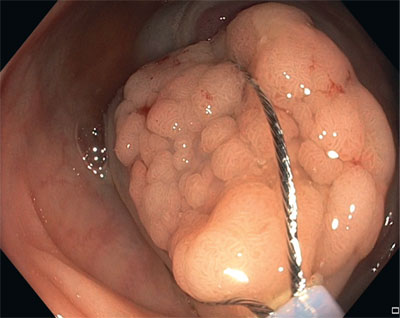
Fig. 5. Asa de diatermia colocada en una parte de la lesión
La resección debe llevarse a cabo de acuerdo con una estrategia determinada con antelación que consiste en elegir la zona de la primera incisión (fig. 5, vídeo 3), garantizando un margen libre suficiente con respecto a la lesión y cortando de forma consecutiva cada uno de los fragmentos adyacentes.
Vídeo 3
Tras finalizar la resección, es necesario analizar minuciosamente el fondo y los márgenes del defecto de mucosa (fig. 6, vídeo 4) para identificar todos los fragmentos que se hayan pasado por alto. Hay que intentar eliminar todos los fragmentos de la lesión mediante el asa, aunque esto requiera extirpar un margen de tejido sano (siempre y cuando la incisión se realice en la zona de la almohadilla formada por la inyección). Si no fuera posible extirpar el fragmento mediante el asa, ni siquiera probando con una de menor diámetro, se debe aplicar la técnica de termoablación mediante la punta del asa o dímero de argón.
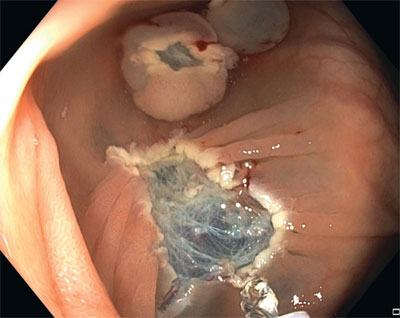
Fig. 6. Defecto de la mucosa resultante tras la resección de la lesión
Vídeo 4
Pregunta 3
La técnica presentada en el vídeo 5 se emplea paraA. reducir el riesgo de hemorragia retardada
B. aumentar las probabilidades de realizar una intervención completa
C. facilitar el sellado con clips después de la intervención
D. las respuestas A y B son correctas, la respuesta C es errónea
E. las respuestas A, B y C son correctas
Vídeo 5
La morfología de la lesión extirpada, la técnica de resección y las habilidades del cirujano influyen en el riesgo de que la intervención sea incompleta. Si la lesión ha infiltrado la submucosa, la EMR no debe ser la técnica de elección. Para garantizar una intervención completa, parece que de todas las técnicas, el método más sencillo, más universal y además aplicable por endoscopistas relativamente poco experimentados consiste en coagular los bordes del defecto mediante un asa. Se estima que, con esta técnica, el riesgo de que la intervención sea incompleta es 4 veces menor. Es fundamental utilizar el modo soft coagulation para que el riesgo de daños térmicos en las capas más profundas de la pared intestinal sea relativamente bajo. Aunque no hay datos sobre el riesgo de hemorragia retardada (asociada al daño térmico vascular que se intensifica en los días posteriores a la intervención), el uso de la coagulación "suave" parece más seguro que el modo forzado habitual (ing. forced coagulation).
Asimismo, garantizar la hemostasia después de la intervención es clave para aumentar su seguridad. En primer lugar, se deben identificar los vasos visibles en la zona del defecto. En la actualidad no hay evidencia de que la coagulación de los vasos visibles disminuya el riesgo de hemorragia retardada, pero se considera que este procedimiento es una buena práctica clínica. No obstante, cabe recordar que, por lo general, la hemorragia retardada se produce al aumentar el alcance de la úlcera y desarrollarse un proceso necrótico en los vasos. Por ese motivo, el origen de estas hemorragias suele estar en los vasos que se encuentran en el borde de la úlcera. Un método contrastado para prevenir esta complicación consiste en cerrar el defecto resultante de la resección de la lesión mediante clips endoscópicos (video 6). Si bien no hay pruebas de que este procedimiento sea eficaz en la mitad izquierda del intestino grueso, se ha observado una reducción significativa del riesgo de hemorragia en las lesiones >20 mm localizadas en la mitad derecha.
Vídeo 6
Resumen
No se observaron complicaciones después de la intervención. El estudio histológico confirmó la presencia de un adenoma tubular con displasia de bajo grado. Como no fue posible valorar con certeza si la intervención fue completa, se programó un control temprano a los 6 meses. En la evaluación de la cicatriz (mediante NBI) no se observaron indicios de recidiva local. En el estudio de control realizado a los 3 años no se detectaron lesiones nuevas.
Respuestas correctas:
1C, 2E, 3BBibliografía:
1. Ferlitsch M., Moss A., Hassan C. y cols., Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline., Endoscopy, 2017; 49: 270–2972. Burgess N.G., Hourigan L.F., Zanati S.A. y cols., Risk stratification for covert invasive cancer among patients referred for colonic endoscopic mucosal resection: a large multicenter cohort., Gastroenterology, 2017; 153: 732–742.e1
3. Puig I., López Cerón M., Arnau A. y cols., Accuracy of the narrow band imaging interŹnational colorectal endoscopic classification system in identification of deep invasion in colorectal polyps., Gastroenterology, 2019; 156: 75–87
4. Klein A., Tate D.J., Jayasekeran V. y cols., Thermal Ablation of mucosal defect margins reŹduces adenoma recurrence after colonic endoscopic mucosal resection., Gastroenterology, 2019; 156: 604–613.e3.
5. Spadaccini M., Albéniz E., Pohl H. y cols., Prophylactic clipping after colorectal endoscopic resection prevents bleeding of large, proximal polyps: meta analysis of randomized trials., Gastroenterology, 2020; 159: 148–158.e11
 Español
Español
 English
English
 українська
українська




