Manejo tras la erradicación de H. pylori
La vigilancia del enfermo con gastritis por H. pylori tras una erradicación eficaz de la bacteria depende de la gravedad de las lesiones histológicas y de la extensión de la atrofia de mucosa gástrica observadas en el estudio endoscópico.
Los pacientes con gastritis avanzada (en estadios III y IV según la clasificación OLGA u OLGIM) y/o atrofia de la mucosa extensa visible en la endoscopia están en el grupo de riesgo elevado de cáncer de estómago. El programa de vigilancia endoscópica e histológica depende del grado de lesiones inflamatorias establecido durante el último estudio de control [F/M].
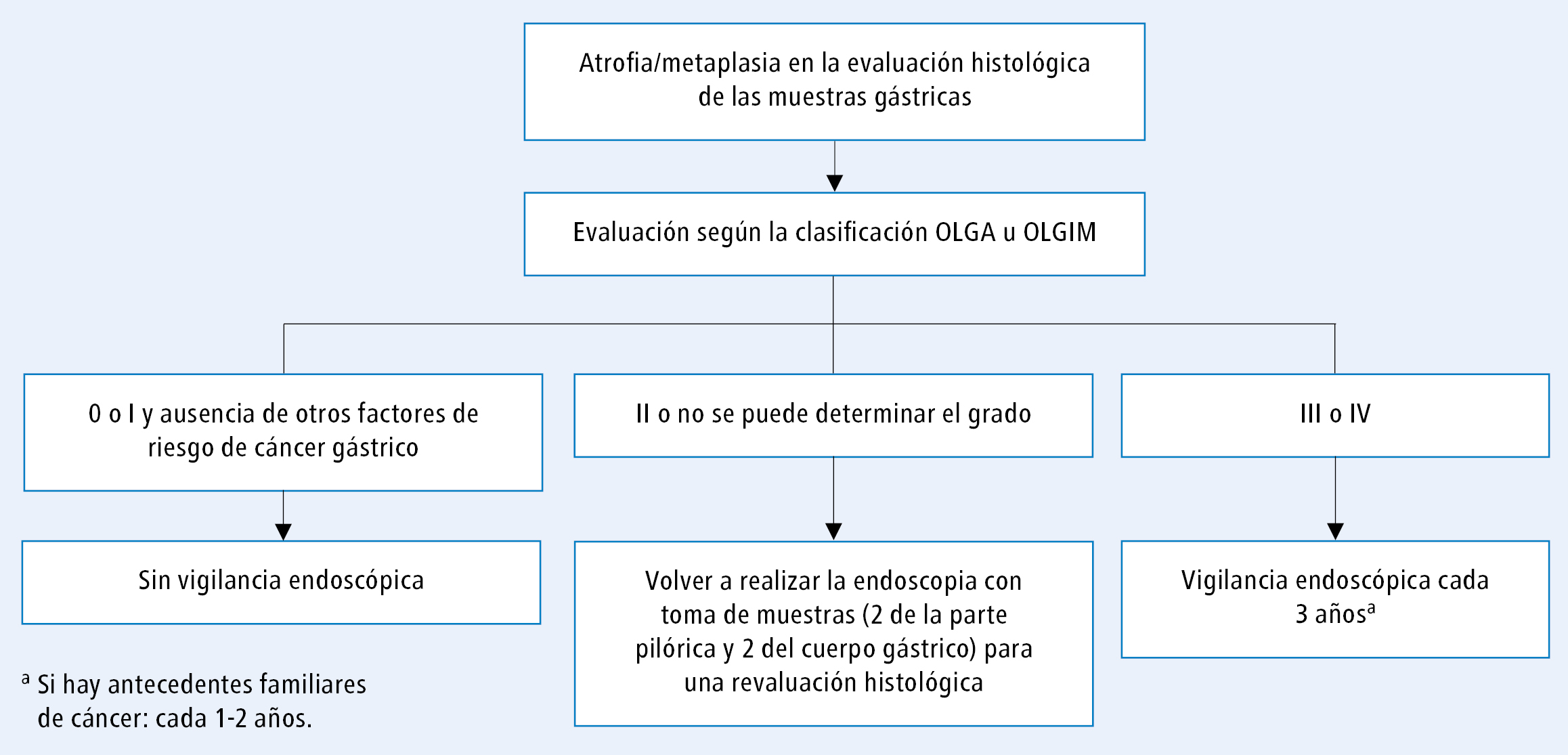
Según las guías de la European Society of Gastrointestinal Endoscopy, los enfermos con atrofia avanzada de la mucosa gástrica (estadios III o IV según la clasificación OLGA u OLGIM: véase la tabla 1) deben someterse a la vigilancia endoscópica cada 3 años. Si las lesiones extensas se presentan en una persona con antecedentes familiares de cáncer de estómago, se justifica realizar las endoscopias más a menudo (p. ej. cada 1‑2 años).24
Los enfermos después de la erradicación de H. pylori con gastritis leve (evaluada de manera correcta en un estudio endoscópico e histológico) solo requieren vigilancia clínica [D/M].
Los enfermos con lesiones clasificadas a los estadios 0‑I según OLGA sin otros factores de riesgo de cáncer (p. ej. antecedentes familiares de cáncer de estómago o gastritis atrófica autoinmune) no requieren vigilancia endoscópica, porque el riesgo de que desarrollen cáncer es bajo. Los enfermos con dispepsia y lesiones en estadio II según OLGA, así como los enfermos sin evaluación inicial adecuada de las lesiones requieren revaluación para determinar el diagnóstico correcto. Los estudios serológicos de la función de estómago (determinación de los niveles de pepsinógenos y de gastrina en el estómago) pueden ayudar a tomar decisiones clínicas, pero no sirven como tamizaje de cáncer de estómago. El esquema de manejo se presenta en la figura 3.
A recordar
La infección por H. pylori da lugar a una enfermedad infecciosa: gastritis por H. pylori (DA42.1). Por esta razón, el tratamiento de erradicación debe realizarse en todos los pacientes con la infección diagnosticada.
En la actualidad no se recomienda diagnosticar a toda la población para detectar la infección por H. pylori. Según la World Gastroenterology Organisation, el diagnóstico está indicado en los siguientes casos:
1) úlcera gástrica y/o duodenal (activa o curada), con o sin complicaciones
2) linfoma MALT de estómago
3) atrofia de mucosa gástrica y/o metaplasia intestinal
4) familiares de 1.er grado de pacientes con cáncer de estómago
5) después de la resección de estómago
6) a petición del paciente (tras realizar una consulta médica completa)
7) dispepsia (como elemento de la estrategia "examina y trata" en la dispepsia no investigada)
8) prevención del desarrollo de úlceras y de sus complicaciones antes o durante un tratamiento prolongado con antinflamatorios no esteroideos (AINE)
9) tratamiento crónico con ácido acetilsalicílico (AAS) programado en personas con riesgo alto de úlcera péptica y de sus complicaciones
10) tratamiento crónico con AAS a dosis bajas en personas con antecedentes de sangrado digestivo alto o perforación
11) enfermedad por reflujo gastroesofágico que requiere tratamiento prolongado con inhibidores de la bomba de protones (IBP)
12) anemia por déficit de hierro no explicada
13) trombocitopenia inmune.
La infección por H. pylori se confirma con el resultado positivo del test de aliento, la presencia de antígenos de H. pylori en las heces, el resultado positivo del test de ureasa y la presencia de bacterias en la muestra de la mucosa gástrica.
Los antígenos contra H. pylori en clase IgG pueden indicar una infección antigua o activa (se mantienen incluso después de la erradicación eficaz, por lo que su presencia debe confirmarse mediante otros métodos) y no pueden utilizarse para la evaluación de la eficacia del tratamiento de erradicación.
En caso de dispepsia en una persona <50 años sin factores de riesgo y sin signos de alarma se recomienda estudiar la presencia de la infección por H. pylori mediante un método no invasivo. La endoscopia digestiva alta es necesaria en pacientes >50 años o más jóvenes con manifestaciones de alarma.
En las regiones con alta (>15 %) resistencia de H. pylori a la claritromicina no se deben emplear los esquemas de erradicación con este antibiótico, a no ser que se confirme el antibiograma de la cepa del infectado (mediante técnicas moleculares o cultivo).
El tratamiento de 1.a línea recomendado en las regiones con resistencia a la claritromicina alta (>15 %) o desconocida es la terapia cuádruple con bismuto. Si esta terapia no está disponible, se puede valorar la terapia cuádruple concomitante sin bismuto. El tratamiento debe durar 14 días, a no ser que en la región determinada se haya confirmado la eficacia de la terapia de 10 días.
La eficacia de la erradicación debe controlarse mediante una prueba no invasiva (test de aliento, determinación de antígenos de H. pylori en las heces) a las 4‑6 semanas tras la finalización del tratamiento. El control mediante pruebas invasivas (test de ureasa) está indicado solo si existen indicaciones de gastroscopia de control.
La fiabilidad de los estudios mencionados en el diagnóstico de la infección está asegurada solo si los enfermos no reciben antibióticos ni bismuto durante las 4 semanas, ni IBP durante las 2 semanas previas a la prueba.
Si el tratamiento de erradicación resulta ineficaz, la selección de los siguientes esquemas de erradicación depende de los fármacos utilizados en las líneas anteriores (véase la fig. 2).
Después de la erradicación eficaz, los enfermos con lesiones atróficas de la mucosa avanzadas (OLGA/OLGIM III o IV) requieren vigilancia endoscópica cada 3 años (más a menudo, cada 1‑2 años en caso de antecedentes familiares de cáncer de estómago).
Fig. 3. Esquema de manejo después de la erradicación de H. pylori en función del grado de gastritis atrófica según el consenso Maastricht VI/Florencia y las guías de la European Society of Gastrointestinal Endoscopy24
Volver al artículo principal: Guías: efecto de Helicobacter pylori en el tracto gastrointestinal.
Bibliografía
- Malfertheiner P., Megraud F., Rokkas T. y cols., Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report, Gut, 2022; 71:1724‑1762
- Malfertheiner P., Megraud F., O’Morain C.A. y cols., Management of Helicobacter pylori infection – the Maastricht V/Florence. Consensus Report, Gut, 2017; 66: 6‑30
- Malfertheiner P., Megraud F., O’Morain C. y cols., Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report, Gut, 2007; 56: 772‑781
- Sugano K., Tack J., Kuipers E.J. y cols., Kyoto global consensus report on Helicobacter pylori gastritis, Gut, 2015; 64: 1353‑1367
- Marshall B.J., Armstrong J.A., McGechie D.B. y cols., Attempt to fulfil Koch’s postulates for pyloric Campylobacter, Med. J. Aust., 1985; 142: 436‑439
- Bisschops R., Areia M., Coron E. y cols., Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) quality improvement initiative, Endoscopy, 2016; 48: 843‑864
- Stanghellini V., Chan F.K., Hasler W.L. y cols., Gastroduodenal disorders, Gastroenterology, 2016; 150: 1380‑1392
- Black C.J., Paine P.A., Agrawal A. y cols., British Society of Gastroenterology guidelines on the management of functional dyspepsia, Gut, 2022; 71: 1697‑1723
- Moayyedi P., Lacy B.E., Andrews C.N. y cols., ACG and CAG Clinical Guideline: management of dyspepsia, Am. J. Gastroenterol., 2017; 112: 988‑1013
- Dyspepsia and Gastro‑Oesophageal Reflux Disease: Investigation and management of dyspepsia, symptoms suggestive of gastro‑oesophageal reflux disease, or both. London, National Institute for Health and Care Excellence (NICE), 2014
- Rugge M., Meggio A., Pennelli G. y cols., Gastritis staging in clinical practice: the OLGA staging system, Gut, 2007; 56: 631‑636
- Sugano K., Spechler S.J., El‑Omar E.M. y cols., Kyoto international consensus report on anatomy, pathophysiology and clinical significance of the gastro‑oesophageal junction, Gut, 2022; 71: 1488‑1514
- Chiang T.H., Chang W.J., Chen S.L. y cols., Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: a long‑term cohort study on Matsu Islands, Gut, 2021; 70: 243‑250
- Krajowy Rejestr Nowotworów. https://onkologia.org.pl/sites/default/files/%C5%BBo%C5%82%C4%85dek.pdf (acceso: 6.03.2023)
- Zucca E., Arcaini L., Buske C. y cols., ESMO Guidelines Committee: Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up, Ann. Oncol., 2020; 31: 17‑29
- Ko C.W., Siddique S.M., Patel A. y cols., AGA Clinical Practice Guidelines on the Gastrointestinal Evaluation of Iron Deficiency Anemia, Gastroenterology, 2020; 159: 1085‑1094
- World Gastroenterology Organisation: Global guidelines Helicobacter pylori. 2021. https://www.worldgastroenterology.org/UserFiles/file/guidelines/helicobacter-pylori-english-2021.pdf (acceso: 6.03.2023)
- Ding S.‑Z., Du Y.‑Q., Lui H. y cols., Chinese consensus report on family‑based helicobacter pylori infection control and management (2021 edition), Gut, 2022; 71: 238‑253
- Ferenc S., Gnus J., Koscielna M. y cols., High antibiotic resistance of Helicobacter pylori and its effect on tailored and empiric eradication of the organism in Lower Silesia, Poland, Helicobacter, 2017; doi: 10.1111/hel.12 365
- Binkowska A., Biernat M.M., Laczmanski L., Gosciniak G., Molecular patterns of resistance among Helicobacter pylori strains in South‑Western Poland, Front Microbiol., 2018; doi: 10.3389/fmicb.2018.03 154
- Wasielica‑Berger J., Gugnacki P., Mlynarczyk M. y cols., Comparative effectiveness of various eradication regimens for Helicobacter pylori infection in the Northeastern Region of Poland, Int. J. Environ. Res. Public Health, 2022; doi: 10.3390/ijerph19 116.921
- Nyssen O.P., Vajra D., Pérez Aísa A. y cols., Empirical second‑line therapy in 5000 patients of the European Registry on Helicobacter pylori Management (Hp‑EuReg), Clin. Gastroenterol. Hepatol., 2022; 20: 2243‑2257
- Nyssen O.P., Pérez Aísa A., Castro‑Fernandez M. y cols., European Registry on Helicobacter pylori management: single‑capsule bismuth quadruple therapy is effective in real‑world clinical practice, United European Gastroenterol. J., 2021; 9: 38‑46
- Pimentel‑Nunes P., Libânio D., Marcos‑Pinto R. y cols., Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019, Endoscopy, 2019; 51: 365‑388
 Español
Español
 English
English
 українська
українська