Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертвуСкорочення: БАЛ — бронхоальвеолярний лаваж, ЗІП — звичайна інтерстиціальна пневмонія, ІІП — ідіопатична інтерстиціальна пневмонія, ІХЛ — інтерстиціальна хвороба легень, ІЛФ — ідіопатичний легеневий фіброз, КТВР — комп’ютерна томографія високої роздільної здатності, ЛЗ — лікарські засоби
Ідіопатичний легеневий фіброз (ІЛФ) є однією з багатьох інтерстиціальних хвороб легень (ІХЛ). Відповідно до актуальної класифікації ІЛФ належить до ідіопатичних інтерстиціальних пневмоній (ІІП) з хронічним фіброзуючим перебігом (табл. 1).
|
відомої етіології медикаментозні захворювання сполучної тканини системні васкуліти фактори зовнішнього середовища |
|
ідіопатичні інтерстиціальні пневмонії (ІІП) основні: – ідіопатичний легеневий фіброз (ІЛФ) – ідіопатична неспецифічна інтерстиціальна пневмонія (НСІП) – респіраторний бронхіоліт, асоційований з інтерстиціальною хворобою легень (RB‐ILD) – десквамативна інтерстиціальна пневмонія (ДІП) – криптогенна організуюча пневмонія (КОП) рідкісні: – лімфоцитарна інтерстиціальна пневмонія (ЛІП) – ідіопатичний плевропаренхіматозний фіброеластоз (PPFE) некласифіковані |
|
при гранулематозних захворюваннях саркоїдоз гіперсенситивний пневмоніт (ГП; hypersensitivity pneumonitis — HP; попередня назва — алергічний альвеоліт [АА]) |
|
інші рідкісні лімфангіолейоміоматоз (ЛАМ) гістіоцитоз із клітин Лангерганса еозинофільна пневмонія легеневий альвеолярний протеїноз |
Причини деяких ІХЛ відомі; це зокрема: вплив шкідливих факторів зовнішнього середовища, вживання ЛЗ або системні захворювання сполучної тканини. ІХЛ невідомої етіології називають ідіопатичним. До цієї останньої групи належить ІЛФ.
На даний момент існує декілька гіпотез щодо етіопатогенезу ІЛФ, однак жодна з них не була остаточно підтвердженою. Дослідження, метою яких є визначення потенційних причин ІЛФ, стосуються зокрема:
1) хронічних інфекцій, в основному вірусних (EBV, HSV, HCV)1-5
2) гастро-езофагеального рефлюксу6,7
3) генетичних факторів (ризик легеневого фіброзу збільшують зокрема мутації генів теломеразного комплексу, генів, що кодують білки сурфактанту C i A2, та поліморфізм гену MUC5B).8,9 У близько 5 % хворих фіброз має спадковий характер.10
Ризик захворіти на ІЛФ збільшується з віком.13 Вік більшості хворих на момент постановки діагнозу ІЛФ складає >60-ти років, а середній вік оцінюють на 66 років.14,15 Частіше хворіють чоловіки.14,16 Це зазвичай активні або колишні курці тютюну, ризик захворіти особливо зростає в групі осіб зі стажем паління >20 пачко-років.16,17 ІХЛ належить до рідкісних захворювань. ІЛФ є найчастішою ІІП та займає друге місце серед найчастіших ІХЛ (на першому місці саркоїдоз). Оцінюють, що в Польщі щорічна захворюваність на ІЛФ становить 1600–1800 осіб, а на даний момент хворіє близько 5000.
Прогрес знань та розвиток візуалізаційних технологій призвів до еволюції бачення проблеми діагностики ІЛФ i до чергових модифікацій рекомендацій щодо діагностики. Останні міжнародні клінічні протоколи опубліковано в 2018 році.14 Нижче представлено найважливіші практичні інформації з цього документу.
Діагноз ІЛФ вимагає виявлення:
1) відповідної клінічної картини
2) структурних порушень легень з наявністю радіологічної картини ЗІП (при комп’ютерній томографії високої роздільної здатності — КТВР) або відповідної комбінації змін на радіологічній та патоморфологічній картині
3) виключення інших причин виявлених аномалій.
Хворі з ІЛФ часто скаржаться на задишку (початково) під час навантаження і/або стійкий кашель (найчастіше сухий), вираженість яких поступово збільшується впродовж багатьох місяців. Також можуть спостерігатись неспецифічні прояви, зокрема слабкість і втрата маси тіла. Ймовірність діагнозу зростає у разі виявлення під час аускультації легень двосторонніх крепітацій, особливо, якщо додатково спостерігаються пальці у формі «барабанних паличок». Зміни, виявлені на рентгенограмі (РГ) грудної клітки, залежать від запущеності хвороби. Початково характеризуються ледь помітними ретикулярними затемненнями, які у ранній фазі візуалізуються лише на РГ в бічній проекції, в задніх діафрагмально-реберних синусах. Враз із прогресуванням хвороби спостерігаються виражені ознаки фіброзу з наявною картиною «стільникої легені», бронхоектази внаслідок розтягування, а також зменшення легеневих полів і вище стояння обидвох куполів діафрагми. Під час функціональних досліджень переважно виявляють зниження трансфер-фактора для оксиду вуглецю (TLCO) та іноді рестрикційний характер вентиляційних порушень при спірометрії та/або рестрикцію під час плетизмографії (хоча виявлення вказаних змін не є обов’язковим для постановки діагнозу).
Симптоми ІЛФ є нехарактерними, у зв’язку з чим диференційна діагностика вимагає виключення інших захворювань, що протікають із задишкою (напр. хронічного обструктивного захворювання легень — з огляду на задишку під час навантаження, яка є провідним симптомом, та тютюнопаління в анамнезі), чи серцевої недостатності (у зв’язку з крепітаціями над нижніми легеневими полями). Необхідно пам’ятати про те, що ІЛФ стосується в основному людей похилого віку із частою коморбідністю, яка може утруднювати як діагностику, так і відбір до антифіброзної терапії.
Початок захворювання буває підступним, зміни можуть повільно прогресувати, у зв’язку з чим є непомітними або недооцінюваними впродовж довшого часу. Захворювання найчастіше має стабільно прогресуючий перебіг. З огляду на необоротний характер уражень прогноз поганий — медіану виживаності оцінюють на 3–5 років. Дуже рідко дебют ІЛФ відбувається раптово (т. зв. раптове загострення) або в молодшому віці (в основному у випадку сімейного фіброзу).18 Захворювання може протікати з загостреннями, які зазвичай суттєво пришвидшують втрату функціональної здатності легень та погіршують прогноз.
Суттєвим елементом діагностики ІЛФ є виключення інших відомих причин інтерстиціальних змін в легенях. До них належать: системні захворювання сполучної тканини, саркоїдоз, перенесені неопластичні захворювання та терапія цитостатиками, тривале вживання ЛЗ (також у минулому, напр. аміодарон), фактори ризику зовнішнього середовища, професійні фактори, тваринництво та інші. Немає лабораторних досліджень, які б дозволяли діагностувати ІЛФ, однак деякі з них відіграють допоміжну роль під час пошуку інших причин інтерстиціального легеневого фіброзу (антиядерні антитіла, ревматоїдний фактор, антицитрулінові антитіла, антитіла до антигенів, що містяться в органічному пилі). Якщо ідентифікувати причину інтерстиціальних змін у легенях не вдалося, можна перейти до подальших етапів діагностики з метою виключення ІЛФ.
Другий після виключення інших причин інтерстиціальних змін у легенях основний діагностичний критерій ІЛФ становить виявлення морфологічних змін у легенях, які вказують на звичайну інтерстиціальну пневмонію (ЗІП). Необхідно підкреслити те, що вказані порушення архітектоніки легень не є патогномонічними для ІЛФ, оскільки можть бути спричинені іншими хворобами (напр., саркоїдозом, алергічним альвеолітом, захворюваннями сполучної тканини), однак їх наявність є необхідною умовою для постановки діагнозу ІЛФ. Картину ЗІП можна підтвердити за допомогою двох методів — КТВР та гістологічного дослідження легеневої паренхіми. Першими проводять неінвазивні дослідження, тобто КТВР. Схему діагностичного алгоритму, рекомендованого в міжнародних клінічних протоколах ATS/ERS/JRS/ALAT 2018, представлено на рисунку 1.
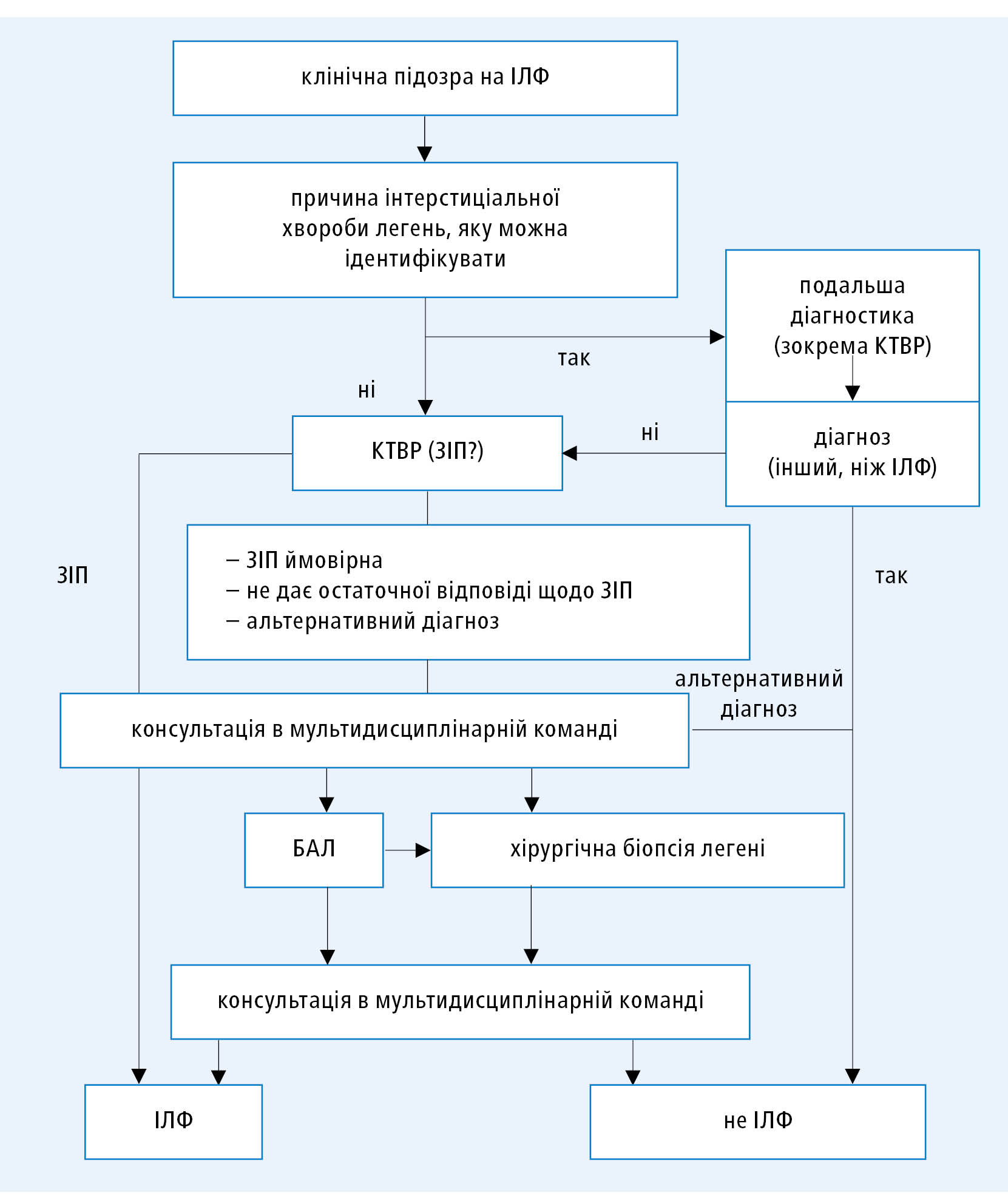
Рисунок 1.
Діагностична схема ІЛФ (на основі міжнародних клінічних протоколів ATS/ERS/JRS/ALAT 2018, змодифіковано)
КТВР дозволяє точно оцінити характер, розподіл та обширність уражень при ІХЛ. На її основі досвідчений радіолог може поставити діагноз (точної, типової) картини ЗІП, а також вказати групу хворих, які вимагають проведення диференційної діагностики.19,20 Рекомендованою технікою дослідження є багатозрізова спіральна томографія, що базується на об'ємній візуалізації шарів, які накладаються один на одний, що дає можливість зокрема отримати багатовимірну реконструкцію та більш детальну радіологічну оцінку характеру уражень. Стандартно дослідження проводять на піку вдиху у хворого, що лежить на спині, однак на ранній фазі фіброзу також рекомендується дослідження в положенні лежачи на животі. Під час дифереційної діагностики також можуть бути допоміжними додаткові скани, виконані під час видиху, які дають можливість ідентифікувати ділянки т. зв. повітряної пастки. Під час проведення діагностики ІЛФ слід перевірити, чи КТВР відповідає технічним вимогам, які рекомендуються в міжнародних клінічних протоколах. Ознаки ЗІП на картині КТВР формують:
1) ретикулярний характер ураження
2) типовий розподіл — ураження домінують субплеврально та у базальних відділах
3) наявність картини «стільникої легені» (скупчення дрібних повітряних порожнин, зазвичай схожого розміру (3–10 мм), з субплевральною локалізацією, з чіткими стінками21) з наявністю або без наявності бронхоектазів чи ектазії бронхіол внаслідок розтягування (рис. 2)
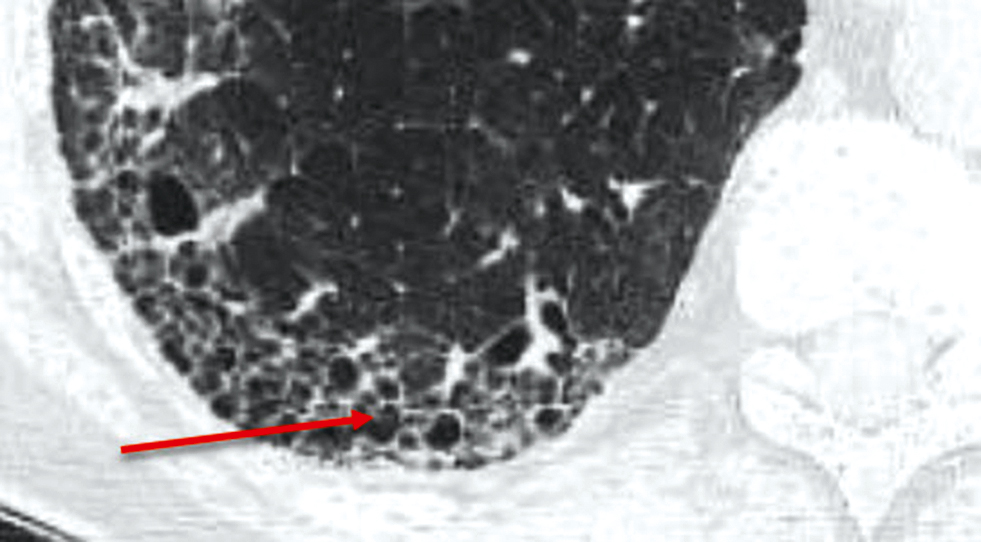 Рисунок 2. Картина «стільникової легені» під час КТВР.
Рисунок 2. Картина «стільникової легені» під час КТВР.
4) відсутність нетипових для ЗІП уражень (наприклад домінуючого розподілу в верхніх і середніх легеневих полях, по ходу бронхів і судин, обширних ділянок за типом «матового скла», численних дрібновузликових змін, кист – множинних, двосторонніх, поза ділянками стільникової легені, картини дифузної мозаїки/повітряної пастки, паренхіматозних інфільтратів у сегментах/долях)
Якщо під час КТВР у хворого, у якого виключено інші потенційні причини інтерстиціальних змін, виявляють картину ЗІП, то можна поставити діагноз ІЛФ без проведення подальших інвазивних досліджень (достатньо співпраці клініциста і радіолога). Не у всіх хворих вдається виявити всі вищевказані радіологічні критерії ЗІП. Актуальні міжнародні клінічні протоколи пропонують чотири категорії змін, що вказують на різну ймовірність діагнозу ІЛФ (табл. 2).
|
Категорії змін |
Критерії КТВР |
Патоморфологічні критерії |
|
ЗІП |
ретикулярні зміни, домінує субплевральна та базальна локалізація картина «стільникової легені» з бронхоектазами/ектазіями бронхіол внаслідок розтягування або без них |
густо розміщений, щільний фіброз з порушенням архітектоніки (тобто деструкційні рубці і/або картина «стільникової легені») зміни локалізуються головним чином субплеврально і/або вздовж міждолькових перегородок вогнищевий фіброз присутні фібробластичні вогнища відсутність змін, які б вказували на інший діагноз |
|
ЗІП ймовірна |
ретикулярні зміни, домінує субплевральна та базальна локалізація наявність бронхоектазів/ектазій бронхіол внаслідок розтягування можлива наявність слабко виражених змін за типом «матового скла» |
присутні деякі з вище перерахованих гістологічних ознак, однак їх вираженість не дає можливості поставити точний діагноз ЗІП/ІЛФ, а також відсутність змін, що б вказували на інший діагноз, або ж присутня лише картина «стільникової легені» |
|
не дає остаточної відповіді щодо ЗІП
|
домінує субплевральна та базальна локалізація змін ледь помітні ретикулярні зміни, можлива наявність слабко виражених змін за типом «матового скла» та деформації бронхів («рання ЗІП») характер і розподіл змін не вказують на жодну етіологію («справді невизначена картина») |
фіброз з порушенням архітектоніки паренхіми (або без вказаних порушень) з домінуючими ознаками інших, ніж ЗІП, змін, або ознаки ЗІП, вторинної до іншої причиниа наявні деякі гістологічні ознаки ЗІП з ознаками, що вказують на інший діагнозб |
|
альтернативний діагноз |
порушення або їх розподіл типові для інших інтерстиціальних хвороб (кисти, вузлики, мозаїчнісь картини, ділянки консолідації, зміни за типом «матового скла», перибронхіальна локалізація, збільшені лімфатичні вузли, рідина в плевральній порожнині/зміни в плеврі, стравоході, ребрах, зміни, що домінують у верхніх і/або середніх долях) |
мікроскопічні ознаки, що вказують на іншу ІІП (напр. відсутність фібробластичних вогнищ чи доконаного фіброзу) у всіх біоптатах гістологічні ознаки, що вказують на інший діагноз (напр. АА, гістіоцитоз, саркоїдоз, ЛАМ) |
|
а гранульома, гіалінові мембрани, зміни навколо бронхіол, організуюче запалення, інтерстиціальне запалення без фіброзу б Клітинний запальний інфільтрат, віддалений від ділянок, що мають структуру «стільникової легені», явна лімфоїдна гіперплазія, явна бронхіолоцентрична структура, яка може включати обширну метаплазію навколо бронхіол. | ||
В актуальному діагностичному алгоритмі ІЛФ також згадано бронхоальвеолярний лаваж (БАЛ). Однак у випадку ІЛФ даний метод має обмежену діагностичну цінність, радше відіграє допоміжну роль під час диференційної діагностики, особливо в разі підозри на легеневі еозинофілії чи інфекції.14
Іншим способом підтвердження наявності в легенях змін за типом ЗІП є патоморфологічна оцінка. Доцільність її проведення слід зважити у хворих, у яких зміни на картині КТВР не дозволяють однозначно виявити «точну» ЗІП (напр. відсутність картини «стільникової легені»). Проведення біопсії легені у хворих із підозрою на ІЛФ все ж таки несе за собою ризик. З одного боку дає шанс поставити діагноз і застосувати антифіброзну терапію, з другого боку збільшує ризик загострень ІЛФ та ускладнень самої процедури (хворі похилого віку, часто з супутніми захворюваннями). Аналіз даних з багатьох досліджень вказує на те, що ймовірність діагнозу ІЛФ є високою навіть у вибраних хворих із КТВР-картиною «ймовірної ЗІП» за умови наявності відповідного клінічного контексту (вік >60-ти років, відсутність значущого впливу факторів зовнішнього середовища, впливу ЛЗ, ознак хвороби сполучної тканини22). У решті випадків слід зважити проведення біопсії. Найбільш значущі мікроскопічні зміни під час гістологічного дослідження біоптату легені, які дозволяють поставити діагноз ЗІП:
1) дифузні вогнища колагенового фіброзу, розділені фрагментами нормальної (здорової) легеневої паренхіми
2) ділянки тотальної деструкції і перебудови паренхіми з формуванням кістозних повітряних порожнин (картина «стільникової легені»)
3) фібробластичні вогнища — характеризуються активним фіброзом, зазвичай розміщені на периферії завершеного фіброзу, на межі з повітряною легеневою паренхімою.
Схоже як і у випадку КТВР, гістопатологічна картина також може різною мірою відповідати критеріям зразка ЗІП (табл. 2).
Актуальні міжнародні клінічні протоколи підкреслюють роль дискусії в мультидисциплінарній команді, яку рекомендують у випадку всіх хворих, у яких проводиться діагностика ІХЛ нез’ясованої етіології, із клінічною підозрою на ІЛФ.12 Виявлено, що така дискусія збільшує ймовірність постановки правильного діагнозу ІХЛ, що протікають з фіброзом.23‑28 Має найважливіше значення в ситуації відсутності однозначного радіологічного діагнозу ЗІП (під час КТВР).
Якщо радіологічна картина не відповідає критеріям ЗІП, ІЛФ можна діагностувати на основі відповідної комбінації результатів КТВР і патоморфологічного дослідження (табл. 3).
|
Гістологічне дослідження КТВР |
ЗІП |
ЗІП ймовірна |
Не дає остаточної відповіді щодо ЗІП |
Альтернативний діагноз |
|
ЗІП |
ІЛФ |
ІЛФ |
ІЛФ |
не ІЛФ |
|
ЗІП ймовірна |
ІЛФ |
ІЛФ |
ІЛФ можливий |
не ІЛФ |
|
Не дає остаточної відповіді щодо ЗІП |
ІЛФ |
ІЛФ можливий |
невизначений фіброз |
не ІЛФ |
|
Альтернативний діагноз |
ІЛФ можливий/не ІЛФ |
не ІЛФ |
не ІЛФ |
не ІЛФ |
Рекомендована тактика дій під час діагностики хворих із підозрою на ІЛФ представлена на рисунку 3.

Рисунок 3. Рекомендації щодо досліджень, які застосовують під час діагностики ІЛФ (на основі міжнародних клінічних протоколів ATS/ERS/JRS/ALAT14)
1. Кожний хворий із підозрою на ІЛФ повинен бути детально обстежений з метою виключення відомих причин інтерстиціальних змін у легенях. У випадку підозри на вторинний характер уражень слід відповідним чином розширити діагностику (напр. провести консультацію ревматолога).
2. Якщо КТВР-картина відповідає характеристикам ЗІП (не викликає сумнівів), тоді, після виключення інших причин вказаних змін, немає необхідності у проведенні інвазивних діагностичних процедур.
3. Якщо КТВР-картина не вказує на ЗІП, тоді показана консультація мультидисциплінарної команди і продумання доцільності виконання інвазивних діагностичних процедур.
4. Не слід визначати маркери фіброзу (сильна рекомендація), оскільки немає доказів того, що їх оцінка відіграє роль у постановці діагнозу ІЛФ, диференційній діагностиці та терапевтичній тактиці.
У зв’язку з можливістю лікування ІЛФ лікарськими засобами антифіброзної дії (пірфенідон і нінтеданіб) ідентифікація хворих із ІЛФ та постановка правильного діагнозу набули особливого значення. Хворих із підозрою на ІЛФ необхідно направляти у спеціалізовані центри з метою швидкої постановки діагнозу і призначення лікування. У цьому місці варто підкреслити те, що імуносупресивна терапія (преднізон з азатіоприном і N‑ацетилцистеїн), які впродовж багатьох років застосовувались у хворих із ІЛФ, є категорично протипоказаною, оскільки приблизно у 10 разів збільшує ризик смерті.29
Діагноз ІЛФ в особи з клінічною підозрою на це захворювання вимагає підтвердження наявності структурних порушень в легенях за типом звичайної інтерстиціальної пневмонії (ЗІП) за допомогою КТВР або відповідної комбінації змін на КТВР та патоморфологічних змін (біоптат легені), а також виключення інших причин вказаних змін.
Хворих із підозрою на ІЛФ слід направляти у спеціалізовані центри з метою постановки діагнозу та застосування адекватного лікування.
1.Ueda T., Ohta K., Suzuki N. i співавт.: Idiopathic pulmonary fibrosis and high prevalence of serum antibodies to hepatitis C virus. Am. Rev. Respir. Dis., 1992; 146: 266–268
2.Egan J.J., Stewart J.P., Hasleton P.S. i співавт.: Epstein‑Barr virus replication within pulmonary epithelial cells in cryptogenic fibrosing alveolitis. Thorax, 1995; 50: 1234–1239
3.Wangoo A., Shaw R.J., Diss T.C. i співавт.: Cryptogenic fibrosing alveolitis: lack of association with Epstein‑Barr virus infection. Thorax, 1997; 52: 888–891
4.Tang Y.W., Johnson J.E., Browning P.J. i співавт.: Herpesvirus DNA is consistently detected in lungs of patients with idiopathic pulmonary fibrosis. J. Clin. Microbiol., 2003; 41: 2633–2640
5.Lasithiotaki I., Antoniou K.M., Vlahava V.M. i співавт.: Detection of herpes simplex virus type1 in patients with fibrotic lung diseases. PLoS One, 2011; 6: e27 800
6.Lee J.S., Collard H.R., Raghu G. i співавт.: Does chronic microaspiration cause idiopathic pulmonary fibrosis? Am. J. Med., 2010; 123: 304–311
7.Downing L., Sawarynski K.E., Li J. i співавт.: A simple quantitative method for assessing pulmonary damage after x irradiation. Radiat. Res., 2010; 173: 536–544
8.Talbert J.L., Schwartz D.A., Steele M.P.: Familial Interstitial Pneumonia (FIP). Clin. Pulm. Med., 2014; 21: 120–127
9.Seibold M.A., Wise A.L., Speer M.C. i співавт.: A common MUC5B promoter polymorphism and pulmonary fibrosis. N. Engl. J.Med., 2011; 364: 1503–1512
10.Raghu G., Collard H.R., Egan J.J. i співавт.: An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidencebased guidelines for diagnosis and management. Am. J. Respir. Crit. Care Med., 2011; 183: 788–824
11.American Thoracic Society, European Respiratory Society: American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am. J. Respir. Crit. Care Med., 2002; 165: 277–304
12.Travis W.D., Costabel U., Hansell D.M. i співавт.: An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am. J. Respir. Crit. Care Med., 2013; 188: 733–748
13.Le J., Gribbin J., West J. i співавт.: The incidence of cancer in patients with idiopathic pulmonary fibrosis and sarcoidosis in the UK. Respir. Med., 2007; 101: 2534–2540
14.Raghu G., RemyJardin M., Myers J.L. i співавт.: Diagnosis of idiopathic pulmonary fibrosis. An official ATS/ERS/JRS/ALAT clinical practice guideline. Am. J. Respir. Crit. Care Med., 2018; 198: e44–e68
15.Salisbury M.L., Xia M., Murray S. i співавт.: Predictors of idiopathic pulmonary fibrosis in absence of radiologic honeycombing: a cross sectional analysis in ILD patients undergoing lung tissue sampling. Respir. Med., 2016; 118: 88–95
16.Behr J., Kreuter M., Hoeper M.M. i співавт.: Management of patients with idiopathic pulmonary fibrosis in clinical practice: the INSIGHTSIPF registry. Eur. Respir. J., 2015; 46: 186–196
17.Baumgartner K.B., Samet J.M., Stidley C.A. i співавт.: Cigarette smoking: a risk factor for idiopathic pulmonary fibrosis. Am. J. Respir. Crit. Care Med., 1997; 155: 242–248
18.Allen R.J., Porte J., Braybrooke R. i співавт.: Genetic variants associated with susceptibility to idiopathic pulmonary fibrosis in people of European ancestry: a genomewide association study. Lancet Respir. Med., 2017; 5: 869–880
19.Wolter N.J., Kunkel S.L., Lynch J.P. III, Ward P.A.: Production of cyclooxygenase products by alveolar macrophages in pulmonary sarcoidosis. Chest, 1983; 83 (5 suppl.): 79S–81S
20.Johkoh T., Muller N.L., Cartier Y. i співавт.: Idiopathic interstitial pneumonias: diagnostic accuracy of thinsection CT in 129 patients. Radiology, 1999; 211: 555–560
21.Hansell D.M., Bankier A.A., MacMahon H. Fleischner Society: glossary of terms for thoracic imaging. Radiology, 2008; 246: 697–722
22.Lynch D.A., Sverzellati N., Travis W.D. i співавт.: Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. Lancet Respir. Med., 2018; 6: 138–153
23.Flaherty K.R., King T.E. Jr, Raghu G. i співавт.: Idiopathic interstitial pneumonia: what is the effect of a multidisciplinary approach to diagnosis? Am. J. Respir. Crit. Care Med., 2004; 170: 904–910
24.Flaherty K.R., Andrei A.C., King T.E. Jr i співавт.: Idiopathic interstitial pneumonia: do community and academic physicians agree on diagnosis? Am. J. Respir. Crit. Care Med., 2007; 175: 1054–1060
25.Chaudhuri N., Spencer L., Greaves M. i співавт.: A review of the multidisciplinary diagnosis of interstitial lung diseases: a retrospective analysis in a single UK specialist centre. J. Clin. Med., 2016; 5
26.Thomeer M., Demedts M., Behr J. i wsp.: Multidisciplinary interobserver agreement in the diagnosis of idiopathic pulmonary fibrosis. Eur. Respir. J., 2008; 31: 585–591
27.Theegarten D., Muller H.M., Bonella F. i співавт.: Diagnostic approach to interstitial pneumonias in a single centre: report on 88 cases. Diagn. Pathol., 2012; 7: 160
28.Jo H.E., Glaspole I.N., Levin K.C. i співавт.: Clinical impact of the interstitial lung disease multidisciplinary service. Respirology, 2016; 21: 1438–1444
29.Idiopathic Pulmonary Fibrosis Clinical Research: Prednisone, azathioprine, and N‑acetylcysteine for pulmonary fibrosis. N. Engl. J. Med., 2012; 366: 1968–1977