Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертвуВИЗНАЧЕННЯ Тa ЕТІОПАТОГЕНЕЗвгору
1. Етіологічний фактор: кислотостійкі мікобактерії з групи Mycobacterium tuberculosis complex — M. tuberculosis, M. bovis i M. africanum.
2. Патомеханізм: вдихання мікобактерій → фагоцитоз макрофагами; якщо мікобактерій мало, їх можна повністю видалити за допомогою неспецифічних бактерицидних механізмів макрофагів; у разі великої кількості мікобактерій або порушення цих механізмів → розмноження всередині макрофага → розпад макрофага та інфікування наступних клітин → утворення туберкульозної гранульоми (містить, у т. ч. епітеліоїдні клітини та гігантські клітини Лангерганса), яка оточує зруйновані клітини (вогнища казеозного некрозу). Паралельно розвивається імунологічна відповідь за участю Th1 CD4+ лімфоцитів (Т-хелперів 1), які активують макрофаги (у т. ч. опосередковано через гамма-інтерферон [ІФН-γ]). Ушкодження можуть загоюватися самостійно, шляхом фіброзу. У осіб з порушенням клітинного імунітету спостерігається виділення розріджених казеозних мас, надзвичайно інтенсивне розмноження збудника і утворення порожнин. Допоки розвинеться специфічна імунологічна відповідь, макрофаги, наповнені фагоцитованими мікобактеріями, можуть через лімфатичну систему потрапляти у кров і викликати бактеріємію. У такий спосіб мікобактерії потрапляють до багатьох органів, але затримуються лише у місцях з добрими для їх росту умовами. Мікобактерії тривалий час можуть залишатись в організмі людини (латентна туберкульозна інфекція) і, навіть, через багато років спричинити ТБ легень або позалегеневий ТБ. Лише 5–10 % інфікованого населення протягом життя хворіють на туберкульоз. Захворювання безпосередньо (до 12 міс.) після зараження є первинним туберкульозом; решта випадків — постпервинний туберкульоз.
3. Резервуар і шлях передачі: джерелом туберкульозних паличок є хворий, який виділяє мікобактерії при диханні, розмові і особливо при кашлі. Мікобактерії знаходяться в дрібних краплинах мокротиння.
4. Фактори ризику інфікування: підвищеним ризиком інфікування мікобактерією туберкульозу (МБТ) або розвитку захворювання після інфікування обтяжені: ВІЛ-інфіковані; особи, які нещодавно перебували в контакті з хворими, які виділяють МБТ, що підтверджено при мікроскопії мазка; особи з «мінімальними» змінами у легенях (що візуалізуються при РГ грудної клітки); особи, які вживають алкоголь ≥40 г/день або вживають наркотики; безхатченки, імігранти з регіонів з високою захворюваністю на ТБ; особи з імунодефіцитними станами (у т. ч. внаслідок імуносупресивного лікування); особи, які вживають інгібітори ФНП або інші біологічні ЛЗ з імуносупресивною дією; курці або тютюнопаління в анамнезі (незначне підвищення ризику захворіти); особи з ІМТ ≤20 кг/м2.
КЛІНІЧНА КАРТИНА ТА ПРИРОДНИЙ ПЕРЕБІГвгору
Загальносистемні симптоми (можуть з’являтися, незалежно від локалізації патологічних змін): підвищення температури тіла, втрата апетиту, зниження маси тіла, нічне потовиділення, погане самопочуття. Під час туберкульозної інфекції може виникнути вузлувата еритема та фліктенульозний кон’юнктивіт (округлі, випуклі сіро-жовті ураження на кон’юнктиві біля лімба рогівки).
В осіб з факторами ризику туберкульозу, з випадково виявленими ураженнями при візуалізації легень, слід розглядати туберкульоз, навіть якщо об’єктивні та суб’єктивні симптоми мінімальні або відсутні.
1. Суб’єктивні симптоми: хронічний кашель (спочатку сухий, у подальшому — вологий з відхаркуванням слизистого або гнійного секрету), інколи — кровохаркання, при деяких формах (зокрема при казеозній пневмонії, міліарному ТБ легень або фіброзно-кавернозному ТБ) може розвинутись дихальна недостатність. На початковій стадії туберкульоз не викликає симптомів (проте передача інфекції може відбуватися).
2. Об’єктивні симптоми: у хворих із занедбаними змінами прояви, характерні для інфільтрату або каверн у легенях.
3. Окремі форми туберкульозу легень:
1) міліарний ТБ — наслідок дисемінації збудника ТБ через кров. Клінічний перебіг важкий, з високою гарячкою і вираженою задишкою. При РГ грудної клітки — дрібновузликові зміни, подібні до зерен проса (перші 2–3 дні після дисемінації зміни при РГ можуть не виявлятися). Часто спостерігаються гепато- і спленомегалія, а також зміни в кістковому мозку, очному дні і ЦНС.
2) казеозне запалення легень — переважають симптоми токсемії з високою гарячкою гектичного характеру і вираженою задишкою, часто буває кровохаркання. При мікроскопічному дослідженні мазка мокротиння — значна кількість паличок ТБ.
3) фібринозно-кавернозний ТБ — розвивається у випадку пізно діагностованого або погано лікованого ТБ. Зазвичай, хворі виділяють велику кількість мікобактерій, часто резистентних до протитуберкульозних ЛЗ. У кавернах може розвиватися бактерійна і грибкова інфекція.
1. ТБ плеври: зазвичай розвивається через кілька місяців після первинного інфікування. Спостерігається гарячка, сухий кашель, інколи — задишка і біль у грудній клітці плеврального характеру. Рідина у плевральній порожнині, зазвичай однобічна, з великою кількістю клітин (спочатку переважають нейтрофіли, потім лімфоцити) і високим вмістом білка та підвищеною активністю аденозин-дезамінази. У ≈30 % випадків — позитивне дослідження рідини на наявність МТБ.
2. ТБ лімфатичних вузлів: виникає, найчастіше, у дітей та осіб молодого віку. Лімфовузли (в основному, передньошийні, задньошийні та надключичні, рідко — пахвові і пахвинні) на початку — збільшені, щільні, не болючі, шкіра над ними не змінена; з часом розм’якшуються, утворюються нориці. У ≈50 % випадків наявні також зміни у легенях.
3. ТБ сечостатевої системи: переважають локальні симптоми (часте сечовипускання або біль під час сечовипускання), часто приховані. У жінок ураження статевої системи може проявлятися болем у тазовій ділянці і розладами менструального циклу; захворювання може призвести до безпліддя. У чоловіків може розвинутись туберкульозний простатит або епідидиміт.
4. ТБ кісток і суглобів: у країнах з низькою поширеністю ТБ, переважно в осіб похилого віку, зазвичай має тривалий латентний період. Основні симптоми: біль, набряк та обмеження рухів у суглобі. Переважно уражає грудний, поперековий та крижовий відділи хребта, також може спостерігатись ураження великих суглобів.
5. ТБ ЦНС: спостерігається, частіше, у дітей у формі туберкульозного менінгіту або туберкульоми. Запалення розвивається, в основному, на основі мозку і призводить до ушкодження черепно-мозкових нервів і порушень ліквородинаміки. Симптоми: сонливість, головний біль, нудота, блювання, ригідність потилиці, часто бувають парези, пірамідальні та мозочкові симптоми; порушення свідомості та судоми.
6. ТБ травної системи: спостерігається рідко. ТБ шлунку і кишківника проявляється субфебрилітетом, схудненням, діареєю, блюванням, болем у животі. Інколи — симптоми апендициту або кишкової непрохідності.
7. Інші форми позалегеневого ТБ: перикарда, шкіри, великих судин або кісткового мозку — спостерігаються дуже рідко, однак пам’ятайте про те, що ТБ може уражати кожний орган.
ДІАГНОСТИКАвгору
1. Мікробіологічні дослідження (→розд. 28.1.2):
1) мікроскопія мазка (бактеріоскопія) — не є вирішальним дослідженням і потребує підтвердження в культуральному дослідженні;
2) стандартний посів (основне дослідження, час очікування на результат <10 тиж.);
3) посів на рідке середовище (основне дослідження, час очікування на результат від 5 днів до <6 тиж.);
4) генетичні дослідження (час очікування результату кілька годин); вони повинні не замінювати інші методи, а доповнювати їх (інтерпретація результату генетичного дослідження залежно від результату мікроскопічного дослідження →табл. 3.15-1е). Через можливість виявлення генетичного матеріалу мертвих мікобактерій можливим є позитивний результат у людини, яка пройшла належне лікування туберкульозу. Секвенування повного геному дозволяє детально диференціювати штами M. Tuberculosis complex; цей метод і секвенування, націлене на конкретні гени, також дають змогу виявити мутації, пов’язані зі стійкістю мікобактерій до ЛЗ.
5) оцінка чутливості до ЛЗ: на основі посіву, також рутинно рекомендується виконання швидкого молекулярного тесту, обов’язково у хворих з факторами ризику резистентності до ЛЗ; дозволяють швидко (протягом кількох годин) визначити медикаментозну резистентність до RMP (Xpert MTB/RIF або Xpert MTB/RIF Ultra) або до RMP, INH (MTBDRplus), фторхінолонів, етіонаміду та парентеральних ЛЗ (Xpert MTB/XDR). Доступні також тести на основі лінійних генетичних зондів (напр., GenoType MTBDRplus, GenoType MTBDRsl), секвенування WGS та tNG (напр., система Deeplex® Myc-TB, рекомендована ВООЗ).
|
Результат мікробіологічного дослідження |
Інтерпретація результату |
|
AFB(+) і генетичне дослідження (+) |
активний туберкульоз, хворий виділяє МБТ |
|
AFB(+) і генетичне дослідження (-) |
підозра на наявність інгібіторів — повторіть дослідження; якщо 2 дослідження поспіль не виявили інгібіторів при AFB(+) — підозрюйте MOTT |
|
AFB(–) і генетичне дослідження (+) |
повторіть генетичне дослідження; якщо результат теж позитивний — хворий має туберкульоз |
|
AFB(–) і генетичне дослідження (–) |
можна припустити, що у пацієнта немає туберкульозу, але вирішальною є клінічна картина |
|
AFB — кислотостійкі палички (acid-fast bacilli), присутні (+) або відсутні (-) в мікроскопічному препараті, MOTT — нетуберкульозні мікобактерії, МБТ — мікобактерії туберкульозу |
|
2. Туберкулінова проба (ТП): внутрішньошкірне введення туберкуліну, оцінка діаметру інфільтрату через 48–72 год. Показання:
1) виявлення латентної туберкульозної інфекції в осіб, яким у разі підтвердження такого інфікування показана хіміопрофілактика;
2) допоміжні дослідження при діагностиці туберкульозу, коли немає бактеріологічного підтвердження захворювання. Позитивний результат ТП (в Україні ≥5 мм) у разі зараження мікобактеріями туберкульозу (не дозволяє віддиференціювати інфікування та захворювання) після вакцинації БЦЖ, інколи після контакту з нетуберкульозними мікобактеріями. Можливі причини хибнонегативного результату ТП (незважаючи на туберкульозну інфекцію): вік <6 міс. або >65 р., порушення клітинного імунітету (ВІЛ-інфекція, лімфопроліферативні захворювання), гостра вірусна інфекція (кір, віспа, епідемічний паротит, інфекційний мононуклеоз), прийом до 6 тиж. до ТП вакцини, що містить живі віруси (проти кору, поліомієліту, епідемічного паротиту, краснухи), бактеріальна інфекція (кашлюк, бруцельоз), тяжкі форми туберкульозу (туберкульоз центральної нервової системи та дисемінований туберкульоз), застосування ГК у високій дозі (>15 мг/добу, в перерахунку на преднізон) або інших імуносупресивних препаратів, гіпотрофія, тяжкі захворювання, що погіршують загальний стан (напр., новоутворення, цукровий діабет, ниркова недостатність), саркоїдоз, період до появи імунної відповіді після інфікування M. tuberculosis, фактори, пов’язані з тестуванням (неналежне зберігання туберкуліну, закінчення терміну придатності препарату, неправильне виконання тесту або неправильне його читання).
3. Тести, що базуються на виділенні лімфоцитами інтерферону γ (IGRA): QuantiFERON-Tb Gold, QuantiFERON-Tb Gold In-Tube, QuantiFERON-Tb Gold Plus i T-SPOT.TB — більш специфічні, ніж туберкулінова проба, а вакцинація БЦЖ не впливає на результат. Значення щодо розрізнення активного туберкульозу та латентної мікобактеріальної інфекції невелике і подібне до такого при ТП. Показання такі ж, як для ТП.
4. Візуалізаційні дослідження:
1) РГ органів грудної клітки — при первинному туберкульозі (захворювання безпосередньо після інфікування) консолідація найчастіше спостерігається в середніх і нижніх ділянках легеневих полів зі збільшенням прикореневих і паратрахеальних лімфовузлів. При постпервинному туберкульозі консолідація (різного ступеня інтенсивності, на занедбаних стадіях часто каверни, що мають вигляд просвітлень, обмежених тіньовою обвідкою), головним чином у верхівкових і задніх сегментах верхніх часток легень і у верхніх сегментах нижніх часток. Іноді інфільтративні ураження мають вигляд округлих тіней, що є наслідком інкапсуляції казеозних мас (так звана туберкульома або казеома); при імуносупресивних станах можуть спостерігати нетипові зміни.
2) КТ грудної клітки — вища чутливість і специфічність, ніж РГ; характерне маргінальне кільцеподібне підсилення лімфатичних вузлів після внутрішньовенного введення контрастної речовини. КТВРЗ — розсіяні екстралобулярні вузлики (вказують на міліарний туберкульоз), інтралобулярні вузлики, які разом із лінійними затемненнями можуть створювати картину «дерева в бруньках», характерну для активного процесу захворювання. КТ також допомагає оцінити ураження плеври.
5. Інші дослідження: результати лабораторних досліджень зазвичай в нормі, іноді лейкопенія або лейкоцитоз, анемія, підвищення ШОЕ, гіпонатріємія, гіперкальціємія. При туберкульозному менінгіті часто спостерігають зниження концентрації глюкози і підвищення концентрації білка в спинномозковій рідині.
Діагностика іноді важка і часто передбачає виключення інших захворювань. Діагноз туберкульозу підтверджується посівом матеріалу, отриманого залежно від локалізації вогнища ураження, або демонстрацією за допомогою молекулярного тесту того, що генетичний матеріал кислотостійких мікобактерії, видимих за допомогою бактеріоскопії, належить до M. tuberculosis complex.
У хворих з підозрою на ТБ легень проводять ≥3-разове (≥1 разу рано натще) дослідження харкотиння — мікроскопію мазка і культивування на щільному та рідкому середовищі (якщо хворий не відкашлює харкотиння → індукція харкотиння гіпертонічним розчином NaCl), а у пацієнтів із високою ймовірністю ТБ — бронхоскопія з метою забору змивів для бактеріологічного дослідження (призначте дослідження харкотиння, викашляного після бронхоскопії). Проведіть бактеріологічне дослідження на наявність ТБ (зокрема культуральне дослідження) та гістологічне дослідження біоптату з кожного підозрюваного ураження. Один зразок мокротиння використайте для проведення молекулярного експрес-тесту, який виявляє генетичний матеріал мікобактерій туберкульозу та одночасно їх медикаментозну стійкість (ВООЗ рекомендує тест-систему Xpert MTB/RIF Ultra). У хворих із високою клінічною підозрою на ТБ розпочинайте протитуберкульозну терапію, незважаючи на результат вищевказаних досліджень. Негативні результати посівів не виключають ТБ і на їх основі не слід припиняти лікування.
Діагностичні критерії ТБ легень без бактеріологічного підтвердження:
1) негативні результати усіх бактеріологічних досліджень (слід отримати відповідний матеріал для бактеріологічного дослідження, з використанням доступних методів, таких як індукція мокротиння, бронхоскопія, забір промивних вод шлунка);
2) радіологічні зміни, що вказують на ТБ (виконайте КТВР — типові дифузні позачасточкові вузлики, що вказують на міліарний туберкульоз, та/або внутрішньочасточкові вузлики, що створюють картину «дерева в бруньках», дрібні каверни);
3) немає покращення після спроби лікування антибіотиком широкого спектру (уникайте фторхінолонів, оскільки ці препарати проявляють активність щодо M. tuberculosis, і можуть викликати тимчасове покращення у пацієнтів з туберкульозом).
Диференційну діагностику з ТБ потрібно проводити у кожному випадку змін на РГ грудної клітки, навіть, якщо вони не є типовими для ТБ. Запідозрити ТБ слід у хворих, у яких кашель сухий або з виділенням харкотиння зберігається ≥3 тиж., у хворих на пневмонію, яка не піддається стандартному лікуванню, особливо, якщо при РГ виявляють каверни, або переважає рідина у плевральній порожнині. Виключити ТБ слід у випадках: лихоманки неясної етіології, лімфаденопатії, стерильної піурії, затяжного перебігу менінгіту з ураженням черепно-мозкових нервів, запальних захворювань кишківника (особливо, хвороби Крона), окремих випадках безпліддя у жінок і затяжного перебігу запальних процесів кістково-суглобового апарату.
При позалегеневому ТБ проведіть РГ легень і, якщо це можливо, посіви харкотиння. Позалегеневий матеріал зазвичай містить МБТ у незначній кількості, але слід прагнути здійснити забір відповідного зразка, який буде використано для мікробіологічних досліджень, зокрема для виявлення генетичного матеріалу M. tuberculosis complex, бажано за допомогою високочутливої тест-системи (Xpert MTB/RIF Ultra). У частині випадків діагноз базується на гістопатологічній картині (примітка: туберкульозоподібні гранульоми можуть спостерігатись при багатьох захворюваннях і не в кожному випадку ТБ виявляють казеозні зміни).
У ВІЛ-інфікованих зміни в легенях залежать від ступеня імунодефіциту — у ранній стадії захворювання зміни типові, але в пізній стадії ураження займають нижні і середні відділи легень та мають дисемінований характер. Каверни утворюються рідко. Туберкулінова проба часто негативна, результат тесту IGRA «невизначений», а позитивні результати прямого дослідження мокротиння зустрічаються рідше (достовірність зростає зі збільшенням кількості проведених досліджень, а особливо, коли матеріалом є індуковане мокротиння чи виділення, зібрані під час бронхоскопії). У цих пацієнтів, окрім посівів мокротиння, необхідно ще виконати посів крові, а також біопсію лімфатичних вузлів та кісткового мозку.
ЛІКУВАННЯвгору
1. Загальні принципи лікування:
1) схеми лікування туберкульозу, викликаного чутливими до ЛЗ мікобактеріями, повинні включати в інтенсивній фазі ≥3-х ЛЗ, а в фазі продовження ≥2-х ЛЗ, до яких є чутливими або ймовірно чутливими виявлені у хворого МБТ;
2) до схеми лікування, яка виявилася неефективною, ніколи не слід додавати по одному новому препарату;
3) лікування повинно проходити під наглядом, особливо у випадку значної ймовірності недотримання хворим рекомендацій та у випадках, значущих для громадського здоров’я (напр., резистентність до ЛЗ, рецидив захворювання). Лікування під безпосереднім наглядом (DOT) передбачає безпосереднє спостереження медсестри або іншої навченої особи за прийомом ЛЗ пацієнтом. Нагляд щодо вживання ЛЗ можна здійснювати дистанційно за допомогою відеотехніки.
4) перед лікуванням слід визначити активність печінкових ферментів, рівень білірубіну, сечовини, креатиніну і сечової кислоти у сироватці крові, рівень тромбоцитів у крові, у випадку призначення етамбутолу (Е) скерувати хворого на консультацію до окуліста, слід продумати тестування на ВІЛ-інфекцію або інші імуносупресивні стани, оцінити ймовірність резистентності до ЛЗ та готовність пацієнта до співпраці;
5) проводити моніторинг небажаних ефектів та взаємодії ЛЗ.
В осіб, які перебувають у тяжкому стані з приводу хвороби, щодо якої є підозра на ТБ, та в осіб з високим ризиком прогресування ТБ (ВІЛ-інфековані, хворі під час терапії анти-ФНП) негайно призначте стандартну терапію 4-ма ЛЗ (не очікуючи на результати мікробіологічних досліджень).
2. Протитуберкульозні препарати:
1) базисні препарати (першого ряду) →табл. 3.15-2;
2) препарати другого ряду (резервні) — рифабутин, рифапентин, левофлоксацин, моксифлоксацин, лінезолід, бедаквілін, клофазимін, циклосерин (CS), етіонамід (ETA), амікацин, капреоміцин (SM), парааміносаліцилова кислота (PAS), деламанід та ін.
|
ЛЗ i препарати |
Дозування |
|
|
початкова фаза |
фаза продовження |
|
|
ізоніазид (INH)a |
5 мг/кг/добу, макс., 300 мг/добу |
5 мг/кг/добу або 10 мг/кг 3 × на тиж., макс. 900 мг/добу |
|
рифампіцин (RMP)a |
10 мг/кг/добу, макс. 600 мг/добу (450 мг/добу пацієнтам <45 кг) |
10 мг/кг/добу або 3 × на тиж. у тій самій дозі |
|
піразинамід (PZA) |
25 мг/кг/добу, зазвичай 1500–2000 мг/добу |
не застосовують у фазі продовження |
|
етамбутол (EBM) |
15 мг/кг/добу, зазвичай 1000–1250 мг/добу |
як вказано вище |
|
a Ізоніазид і рифампіцин призначають, зазвичай, у формі комбінованого препарату, який містить100 або 150 мг ІNH та 150 або 300 мг RMP. Усі базисні пероральні препарати призначають 1 × на день, бажано вранці (хоча можна і в інший час доби), за 30 хв до вживання їжі! |
||
3. ГК: абсолютним показанням є тільки гіпокортицизм, що виникає внаслідок туберкульозу наднирників; окрім того, призначають при наведених нижче станах: гострий перикардит (преднізон впродовж 6–12 тиж., початкова доза 60 мг/добу, поступово зменшуйте кожні 2–3 тиж.); менінгоенцефаліт у пацієнтів з порушеннями свідомості та симптомами підвищеного внутрішньочерепного тиску (преднізон впродовж 6–8 тиж., початкова доза 20–40 мг/добу, поступово зменшуйте кожні 2–3 тиж.; при потребі — дексаметазон 8–12 мг/добу); туберкульозний перитоніт і ексудативний плеврит з тяжким перебігом (преднізон 20–40 мг/добу впродовж 1–2 тиж.); небезпечна для життя обструкція дихальних шляхів; туберкульоз лімфатичних вузлів із симптомами компресії сусідніх структур; тяжкі реакції гіперчутливості на протитуберкульозні ЛЗ, якщо немає можливості замінити їх іншими препаратами; запальний синдром відновлення імунної системи (СВІС) у ВІЛ-інфікованих пацієнтів (→нижче).
4. Лікування нових випадків ТБ:
1) початкова фаза — рифампіцин (RMP), ізоніазид (INH), піразинамід (PZA) i етамбутол (EMB) впродовж 2 міс.;
2) підтримуюча фаза — RMP i INH впродовж 4 міс. щоденно або 3 × на тиж.
Винятки:
1) підозра на те, що хворий міг бути інфікований МБТ, резистентними до ЛЗ →нижче;
2) туберкульозний менінгіт → пролонгуйте тривалість підтримуючої фази на 6 міс. та застосуйте ГК;
3) ТБ кісток та суглобів → пролонгуйте фазу продовження на 3 міс.;
4) хворі з кавернами і позитивним результатом посіву харкотиння під кінець інтенсивної фази → пролонгуйте фазу продовження на 3 міс.;
5) необхідність застосування іншої, ніж стандартна, схеми лікування:
a) хворі, у яких не можна застосувати PZA у початковій фазі лікування (часто непереносимість в осіб похилого віку та вагітних жінок) → призначте INH, RMP і EMB впродовж перших 2-х міс. та INH і RMP протягом наступних 7-ми міс.;
б) хворі з пошкодженням печінки або після органної трансплантації (→нижче);
6) хворі з протипоказаннями до застосування EMB → можна застосовувати в інтенсивній фазі моксифлоксацин або левофлоксацин (застосування off-label).
У хворих, які потребують пролонгації фази продовження протитуберкульозні ЛЗ застосовують щодня. Усі дози ЛЗ в інтенсивній фазі (56 доз кожного ЛЗ) хворий повинен прийняти протягом ≤3-х міс., а у стандартній фазі продовження (126 доз для кожного ЛЗ) — до 6-ти міс. Усе стандартне лікування (згідно з планом 6 міс.) не може тривати довше ніж 9 міс. ВООЗ дозволяє для лікування легеневого та позалегеневого туберкульозу (за винятком тяжких форм) альтернативну 4-місячну схему, що складається з INH, PZA, моксифлоксацину та рифапентину.
5. Моніторинг побічних реакцій на протитуберкульозні препарати: при появі симптомів, підозрілих на побічну дію ЛЗ, необхідні лабораторні дослідження і консультація окуліста. Основним небажаним ефектом базисної терапії ТБ є ураження печінки; безсимптомне підвищення показників АСТ і АЛТ, яке не перевищує у 5 разів нижню або у 3 рази верхню межу норми (ВМН) не потребує припинення лікування. Більший ріст показників АСТ і/або АЛТ → тимчасово відмініть RMP, INH i PZA. У пацієнтів з підвищеним ризиком ураження печінки слід контролювати активність АЛТ і АСТ в сироватці на 7 і 14 дні лікування, надалі щомісячно до закінчення лікування; у решти хворих — раз на місяць. Якщо активність АЛТ/АСТ становить ≥5 × ВМН або ≥3 × ВМН за наявності симптомів з боку ШКТ (жовтяниця, нудота, втрата апетиту, здуття чи болі в животі) → тимчасово відмініть RMP, INH i PZA. Якщо показники АСТ і АЛТ зменшаться до значення <2 × ВМН → призначте попередньо відмінені препарати (за винятком PZA) і контролюйте показники АСТ і АЛТ. Терапія без PZA має тривати 9 міс. На час очікування зниження активності ALT/AST слід повністю перервати протитуберкульозну терапію, або, якщо вимагає клінічна ситуація, призначити амікацин або стрептоміцин та EMB.
6. Моніторинг ефективності лікування: контроль ефективності лікування шляхом повторного дослідження мазка та посіву мокротиння на тверді та рідкі середовища. Наприкінці інтенсивної фази проведіть мікробіологічне дослідження харкотиння. У разі позитивного результату мікроскопії мазка → повторіть дослідження наприкінці 3-го міс. курсу лікування (інтенсивної фази не продовжуйте). Якщо мікроскопія мазка надалі позитивна → культуральне дослідження і тести на чутливість до ЛЗ. У фазі продовження слід виконати мікроскопію мазка на початку 5-го та наприкінці 6-го міс. лікування (можете не проводити у пацієнтів з початково негативним результатом дослідження харкотиння). Позитивний результат мікроскопії мазка на 5-й або 6-й міс. свідчить про неефективність лікування. У хворого, який відновлює терапію після перерви, проведіть бактеріоскопічне дослідження і посів харкотиння, молекулярний експрес-тест для виявлення медикаментозної стійкості МБТ і дослідження чутливості до ЛЗ на основі посіву. МРТБ: впродовж усього лікування щомісяця повторюйте бактеріоскопічне дослідження і посів харкотиння; дослідження чутливості до ЛЗ повторіть у випадку позитивного результату посіву харкотиння через 4 міс. від початку лікування. Результати лікування позалегеневого ТБ найчастіше оцінюють на основі клінічного обстеження.
7. Хворі, які раніше проходили лікування ТБ: негайно проведіть швидкий молекулярний тест і виберіть лікування на основі його результату. У хворих, які у зв’язку з тяжким перебігом захворювання вимагають негайного лікування, додайте до ЛЗ, які стандартно застосовують в інтенсивній фазі (INH, RMP, PZA і EMB) фторхінолон (моксифлоксацин або левофлоксацин) та парентеральний ЛЗ. У хворих в тяжкому стані або у разі підозри на резистентність до ЛЗ, додатково призначте ще 1 ЛЗ другої лінії.
8. Лікування резистентного до антимікобактеріальних препаратів ТБ: розрізняють резистентність
1) монорезистентність — до 1-го ЛЗ першої лінії;
2) до RMP (RR-TB);
3) полірезистентність — резистентність до ≥2-х препаратів першої лінії (але не для INH і RMP одночасно);
4) мультирезистентність (MDR-TB) — мікобактерії резистентні принаймні до INH і RMP;
5) розширену мультирезистентність (XDR-TB) — мікобактерії резистентні до INH і RMP, фторхінолону (левофлоксацину, моксифлоксацину) та ≥1 іншого препарату групи А (бедаквіліну або лінезоліду);
6) пре-XDR-TB — мікобактерії резистентні до RMP (можл. до INH), фторхінолону.
Резистентність до INH → протягом 6 міс. PZA, RMP, EMB і левофлоксацин або моксифлоксацин (після підтвердження медикаментозної чутливості МБТ).
RR-TB, MDR-TB i XDR-TB:
1) 1-й вибір — бедаквілін, претоманід, лінезолід (600 мг/добу) та моксифлоксацин (BPaLM) протягом 6 міс. У разі мікобактерій, стійких до моксифлоксацину (pre-XDR-TB), використовуйте вищезазначений режим без цього препарату (BPaL). Рекомендовано для всіх пацієнтів з MDR/RR-TB, окрім: дітей віком <14-ти р., вагітних та жінок, що годують груддю, пацієнтів з туберкульозом ЦНС, кістково-суглобовим або дисемінованим туберкульозом, пацієнтів, які раніше отримували бедаквілін, лінезолід, претоманід або деламанід протягом ≥1 міс., за винятком випадків, коли резистентність до будь-якого з цих ЛЗ не була продемонстрована.
2) альтернативна схема – протягом 6-ти міс. бедаквілін, деламанід, лінезолід (600 мг), левофлоксацин та клофазимін;
3) 9-місячні схеми лікування
а) з використанням всіх ЛЗ, які приймаються протягом 9-ти міс.
– бедаквілін, лінезолід, моксифлоксацин і PZA;
– бедаквілін, лінезолід, левофлоксацин, клофазимін і PZA;
– бедаквілін, деламанід, лінезолід, левофлоксацин і PZA;
б) двоетапна (9–11 міс.)
– протягом 4–6 міс.: бедаквілін (завжди протягом 6-ти міс.), PZA, левофлоксацин або моксифлоксацин, етіонамід або лінезолід, INH у високій дозі 600 мг/добу (10–15 мг/кг) та EMB (1200 мг/добу);
– потім протягом наступних 5 міс. PZA, левофлоксацин або моксифлоксацин, клофазимін та EМВ;
4) довготривалі схеми лікування — у пацієнтів, які не кваліфікуються до коротких схем лікування. ЛЗ, що застосовують, поділяють на 3 групи:
а) група А — ЛЗ, яким надають перевагу : левофлоксацин або моксифлоксацин, бедаквілін та лінезолід;
б) група В — ЛЗ, які додаються як наступні: клофазимін, циклосерин або теризидон;
в) група С — ЛЗ, які використовуються за потреби, як доповнення до схеми лікування: етамбутол, деламанід, PZA, іміпенем з циластатином, меропенем, амікацин або SM, етіонамід/протіонамід, PAS.
Згідно з клінічними настановами ATS/CDC/ERS/IDSA, інтенсивна фаза передбачає використання ≥5-х ЛЗ (згідно з ВООЗ ≥4-х ЛЗ), до яких чутливий даний штам. Рекомендується призначати всі 3 ЛЗ з групи А та ≥1 з групи B. Інтенсивна фаза повинна тривати 5–7 міс. з моменту отримання негативних результатів посіву мокротиння, а весь курс лікування має тривати 15–24 міс., залежно від клінічної картини та форми захворювання.
9. Лікування ТБ під час вагітності та годування грудьми: призначте стандартне лікування. Пацієнтки, яких лікували INH, повинні отримувати піридоксин (25–50 мг/добу). Годування грудьми не протипоказане, а жінки, які годують грудьми, повинні отримувати стандартну терапію (діти, що перебувають виключно на грудному вигодовуванні жінками, які отримують протитуберкульозне лікування, повинні вживати піридоксин у дозі 1–2 мг/кг/добу). Вагітність не є протипоказанням до лікування мультирезистентного ТБ. Якщо цього дозволяє клінічна ситуація, терапію можна розпочати вже після завершення І триместру. Слід уникати парентеральних ЛЗ (мають ототоксичний вплив на плід), етіонаміду (тератогенний ефект, а також підвищення ризику нудоти та блювання) і претоманіду (безпека не підтверджена).
10. Пацієнти з нирковою недостатністю: RMP і INH призначайте у стандартних дозах (виводяться, в основному, з жовчю); EMB і PZA призначайте 3 × на тиж. у дозах 15 мг/кг i 25 мг/кг (стосується хворих з кліренсом креатиніну <30 мл/хв). У хворих, які перебувають на гемодіалізі, ЛЗ застосовують після закінчення процедури гемодіалізу.
11. Пацієнти з печінковою недостатністю:
1) без гепатотоксичних ЛЗ — варіанти:
a) EMB і фторхінолон впродовж 18–24 міс. (та амікацин/SM впродовж перших 2-х міс.);
б) EMB і CS та парентеральний ЛЗ впродовж 18–24 міс.;
2) 1 гепатотоксичний ЛЗ — варіанти:
a) INH, EMB і амікацин/SM впродовж 2-х міс., у подальшому INH і EMB впродовж 10 міс.;
б) RMP, EMB, фторхінолон протягом 9 міс.;
в) INH, EMB CS впродовж 12–18 міс. та парентеральний ЛЗ впродовж 2 перших міс.;
3) 2 гепатотоксичні ЛЗ — варіанти:
a) INH i RMP впродовж 9 міс. та EMB, який призначають до часу підтвердження чутливості до INH;
б) INH, RMP, EMB i амікацин/SM впродовж 2 міс., у подальшому INH i RMP впродовж 6 міс.;
в) RMP, PZA, EMB і фторхінолон впродовж 6 міс.
12. Хворі з цукровим діабетом: переважно стандартна схема лікування. У хворих із діабетичною хворобою нирок протипоказаними є аміноглікозиди і CAP, а у хворих з діабетичною нейропатією — EMB і PAS. Пам’ятайте про взаємодію похідних сульфонілсечовини і RMP та про те, що ETA може індукувати гіпоглікемію.
13. Пацієнти без свідомості: призначайте в/м INH та SM, а також в/в фторхінолони. Пацієнтам, яких годують через гастростому чи шлунковий зонд, можна цим шляхом вводити подрібнені пероральні протитуберкульозні препарати за 2–3 год до прийому їжі, чи після прийому їжі.
14. Особи після трансплантації органа або гемопоетичних клітин: звертайте увагу на взаємодію рифаміцинів (R, рифабутину, рифапентину) з інгібіторами кальциневрину (циклоспорином і такролімусом → збільшіть дозу 3–5-кратно та проводьте моніторинг концентрації в крові), а також з ГК (→ збільшіть дозу на 50 %).
15. ВІЛ-інфіковані пацієнти: у хворих, які лікуються антиретровірусними препаратами, дотримуйтеся стандартного 6-місячного лікування. Якщо клінічне чи мікробіологічне поліпшення настає повільно → слід продовжити лікування до 9 міс., або на ≥4 міс. від отримання негативних результатів посівів мокротиння. У хворих на позалегеневий туберкульоз лікування іноді продовжують до 9 міс., а у хворих на туберкульоз центральної нервової системи або туберкульоз кісток і суглобів зазвичай до 12 міс. Всім хворим профілактично призначають котримоксазол. Якщо хворий до цього моменту не отримував антиретровірусної терапії, встановлення діагнозу ТБ є показанням до її ініціації →розд. 18.7. У хворих на туберкульозний менінгіт у зв’язку з ризиком розвитку загрозливої для життя парадоксальної реакції необхідно відтермінувати антиретровірусну терапію). Пацієнтам, що приймають інгібітори протеази, не призначають RMP, бо він знижує концентрацію даних ЛЗ в крові. У ВІЛ-інфікованих пацієнтів, хворих на ТБ, після призначення антиретровірусних препаратів може виникнути синдром імунної реактивації (IRIS). Симптоми: гарячка, посилення симптомів з боку дихальної системи або ЦНС і прогресування радіологічних змін. Перед лікуванням IRIS виключіть інші, окрім ТБ, опортуністичні інфекції та невдачу при лікуванні ТБ. Лікування: НПЗП, при виражених симптомах преднізон (преднізолон) 1,25 мг/кг/добу (50–80 мг/добу) впродовж 2–4 тиж., дозу у подальшому зменшують до відміни ЛЗ включно (впродовж 6–12 тиж. або довше).
16. Пацієнти, що отримують інгібітори ФПН: якщо ТБ виявлено під час лікування інгібітором ФНП — препарат слід відмінити. Відновити прийом інгібіторів ФНП можна щонайменше через місяць від початку належної протитуберкульозної терапії, і після підтвердження чутливості мікобактерій до призначених ЛЗ.
УСКЛАДНЕННЯвгору
пневмоторакс, емпієма плеври, фіброз плеври, легенева кровотеча, амілоїдоз
ПРОФІЛАКТИКАвгору
1. Вакцинація (БЦЖ): підлягають усі новонароджені діти, що не мають до цього протипоказань — на 3–5-ту добу життя дитини (не раніше 48-ї години після народження); ревакцинації проти туберкульозу підлягають діти віком 7 років, не інфіковані МБТ та з негативним результатом проби Манту. Протипоказання: алергія на складник вакцини, гарячка, генералізований дерматит, вроджені імунні порушення, вживання ЛЗ, які порушують імунітет, злоякісні новоутворення, ВІЛ-інфекція (вакцинація новонароджених, народжених ВІЛ-інфікованими жінками — після консультації), вживання протитуберкульозних ЛЗ.
2. Профілактичне лікування: використовуйте тільки тоді, коли виключено активний туберкульоз, дозування ЛЗ, як при лікуванні активного ТБ; cхеми, рекомендовані ВООЗ INH 1 × на день впродовж 6-ти або 9-ти міс., RMP 1 × на день впродовж 3–4 міс. (застосування RMP off-label), RMP з INH 1 × на день впродовж 3–4 міс., рифапентин та INH 1 ×/тиж. впродовж 3-х міс. або 1 × на тиж. впродовж 1-го міс. Під час лікування контроль щомісяця; в осіб із захворюванням печінки, які регулярно вживають алкоголь або ВІЛ-інфікованих, осіб віком >35-ти років, вагітних жінок або жінок <3-х міс. після пологів → контроль активності АСТ і АЛТ та рівня білірубіну в сироватці крові. Показане:
1) особам, які були у контакті з хворим на туберкульоз: діти у віці <5-ти р., особи з тяжкою імуносупресією (абсолютне показання, без огляду на результат туберкулінової проби/IGRA), і діти у віці <16-ти р. з позитивним результатом туберкулінової проби/IGRA; необхідно зважити у решти осіб з позитивним результатом туберкулінової проби/IGRA;
2) особам, яким призначено лікування інгібітором ФНП, або іншими біологічними препаратами з протизапальною дією, які збільшують ризик ТБ, а також потенційним реципієнтам органів/гемопоетичних клітин, які:
а) мають позитивний результат туберкулінової проби або IGRA (на даний момент або в анамнезі);
б) мали контакт з хворим на ТБ, який виділяє МБТ, або в минулому перенесли ТБ (без лікування або з невідповідним лікуванням);
в) мають посттуберкульозні зміни на РГ органів грудної клітки (фіброзні зміни, кальцинати в легенях та лімфатичних вузлах, потовщення плеври) та раніше не отримували лікування проти туберкульозу (особи, які завершили адекватну протитуберкульозну терапію, не потребують профілактичного лікування);
3) ВІЛ-інфікованим особам з позитивною туберкуліновою пробою (≥5 мм) чи IGRA.
Під час застосування INH хворими на цукровий діабет, ниркову недостатність, СНІД, особам, які зловживають алкоголем та особам з гіпотрофією призначте віт. B6 10–20 мг/добу.
У осіб з близького контакту з хворим на MDR‑TB, з групи високого ризику захворювання, розгляньте можливість хіміопрофілактики левофлоксацином (якщо у хворого, який є джерелом інфекції, не виявлено резистентності до цього ЛЗ).
1. Дослідження контактів: особам, що контактували з хворим на туберкульоз, який виділяє МБТ, необхідно пройти обстеження для виключення туберкульозу (спостереження щодо появи симптомів, РГ грудної клітки, туберкулінова проба або IGRA). Рекомендації →рис. 3.15-1.
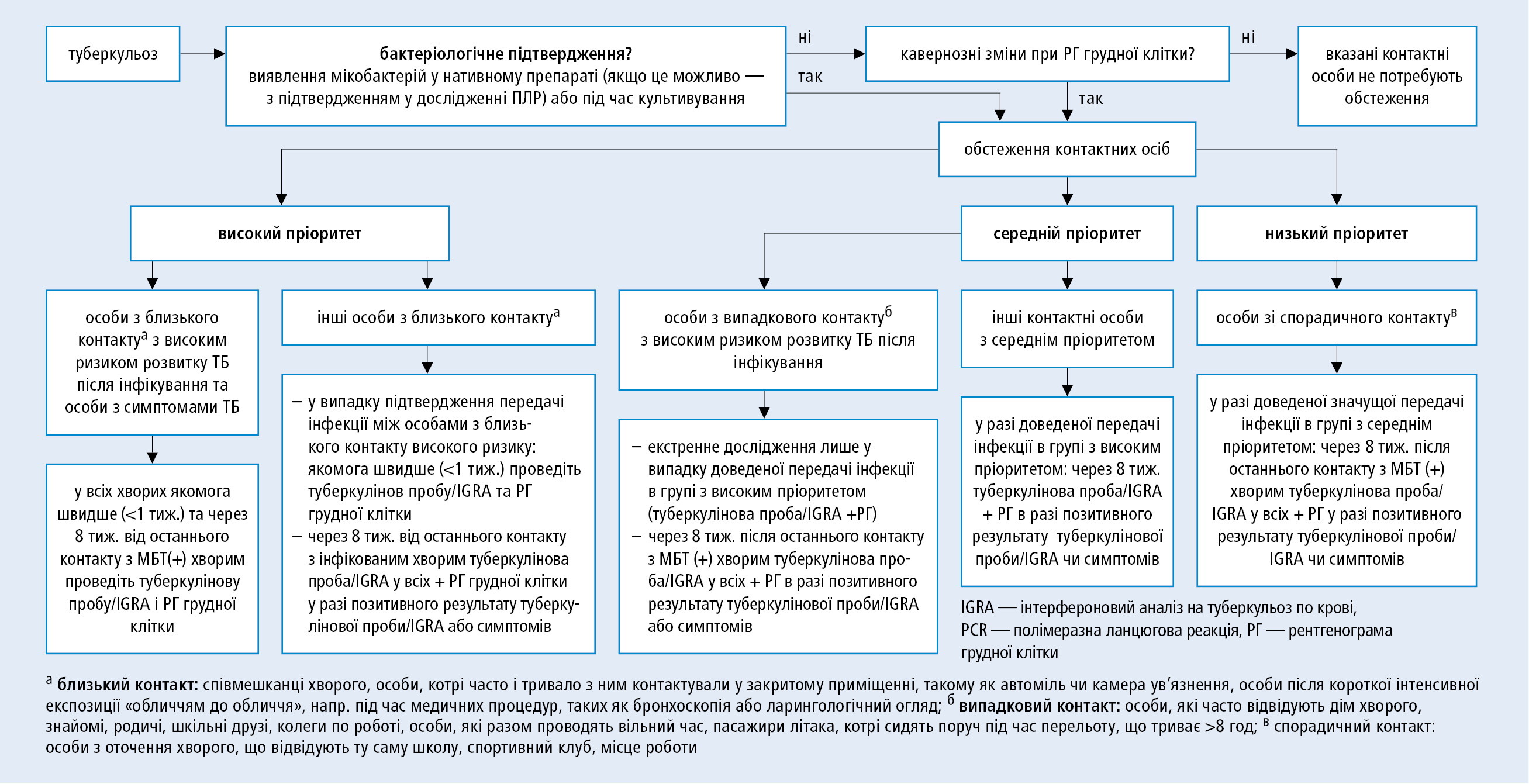
Рисунок 1. Обстеження контактних осіб — схема алгоритму дій (за постановою Європейського Консенсусу 2010; модифіковано)
2. Профілактика нозокоміальних інфекцій, викликаних M. tuberculosis: найважливіші методи
1) швидка діагностика та виявлення стійкості мікобактерій до ЛЗ за допомогою швидких молекулярних тестів; ізолювати госпіталізованих пацієнтів в окрему палату до моменту виключення резистентності до ЛЗ;
2) респіраторна ізоляція хворих на туберкульоз до моменту підтвердження бактеріологічними методами припинення виділення МБТ. За даними ВООЗ, вони можуть лікуватися вдома.
3) у приміщеннях, де високий ризик передачі інфекції, викликаної M. tuberculosis, ВООЗ рекомендує постійне комбіноване використання ультрафіолетових бактерицидних стельових ламп і низькошвидкісних стельових вентиляторів;
4) засоби захисту персоналу — сертифіковані респіраторні маски з фільтрами FFP2 і FFP3 (відповідно до європейського стандарту EN 149) або N95 (відповідно до американського стандарту 42CFR84).
Повідомте хворому про можливість передачі інфекції іншим людям, а хворого, який виділяє МБТ — про необхідність госпіталізації!
Виявлення хворих з підозрою на ТБ проводять в лікувальних закладах первинної медичної допомоги (ПМД) і в будь-яких інших медичних закладах персоналом цих установ. Діагноз ТБ підтверджується у спеціалізованому протитуберкульозному закладі. Пацієнта направляють до лікаря-фтизіатра, який здійснює моніторинг ДОТ-лікування в амбулаторних умовах. Відстеження контактів у осередках ТБ відбувається під наглядом фтизіатра та лікаря епідеміолога.