Se puede obtener médula ósea mediante aspirado (para estudio citológico y otros) o mediante biopsia percutánea (para el estudio histológico).
Indicaciones
1. Aspirado medular: pancitopenia; citopenia de una o dos series de etiología no precisada; presencia de células inmaduras en sangre periférica, sobre todo de blastos; aumento del recuento de células en sangre periférica de etiología desconocida; gammapatías monoclonales; lesiones osteolíticas focales de etiología desconocida en estudios radiológicos; diagnóstico diferencial de la fiebre, esplenomegalia o adenopatías de etiología no precisada; diagnóstico diferencial de enfermedades por depósito y metabólicas; leucemias agudas, síndromes mielodisplásicos (SMD), neoplasias mieloproliferativas y del sistema linfático; vigilancia de la respuesta al tratamiento de enfermedades hematológicas; evaluación del retorno de la hematopoyesis después del trasplante de células hematopoyéticas; evaluación del cariotipo constitutivo en los casos en los que la evaluación basada en el análisis de células de la sangre periférica no es posible; evaluación de las reservas de hierro en caso de obtener resultados de laboratorio insuficientes.
2. Biopsia de médula ósea: imposibilidad de obtener médula mediante aspirado (la denominada "biopsia seca"); sospecha de mielofibrosis, SMD, neoplasia linfoproliferativa, enfermedad por depósito, metástasis en la médula, infiltración medular por neoplasias linfoproliferativas; sospecha de aplasia o hipoplasia de la médula; vigilancia de la respuesta al tratamiento o de la evolución de la enfermedad.
Contraindicaciones
En principio no existen contraindicaciones para realizar el aspirado de médula ósea. No realizarlo en el esternón si se sospecha mieloma u otras enfermedades que causan la resorción ósea. La púrpura trombocitopénica no es una contraindicación absoluta.
Una contraindicación para la biopsia es la diátesis hemorrágica grave. No se recomienda realizar transfusiones profilácticas de concentrados de plaquetas antes de una biopsia de médula ósea, aunque algunos lo hacen para conseguir un recuento de plaquetas ≥20 000/µl. No se recomienda la suspensión rutinaria del tratamiento anticoagulante antes de este procedimiento. Se deben evitar áreas previamente irradiadas o afectadas por un estado inflamatorio.
Complicaciones
Rotura de la aguja o separación de la aguja del mango, sangrado prolongado (puede ser masivo), inflamación local. Relacionadas con la punción del esternón (también raras): neumopericardio, punción del ventrículo derecho o de la aurícula derecha y taponamiento cardíaco, lesión de la aorta, embolismo pulmonar (graso), mediastinitis y neumomediastino.
Preparación del paciente
Consentimiento informado del paciente. Colocación: para la punción de la espina ilíaca posterosuperior en decúbito prono (si no es posible, en decúbito lateral); para la punción del esternón y de la espina ilíaca anterosuperior, en decúbito supino.
Equipo y asistente
1. Equipo para preparar el campo operatorio →Preparación del campo operatorio para cirugía menor y la anestesia por infiltración →Anestesia local por infiltración.
2. Agujas para biopsia, 3 tipos: para el aspirado del esternón, para el aspirado del ala del ilion y para la biopsia de médula ósea.
3. Jeringas de 10 o 20 ml, tubos con EDTA, tubos con heparina de litio, placas de Petri, portaobjetos para realizar frotis.
4. Asistente (debido a la necesidad de mantener la esterilidad del campo de punción, asegurar simultáneamente la hemostasia local y realizar frotis, y posteriormente mezclar el aspirado con anticoagulantes en los tubos).
Lugar de la punción
1. Ala del ilion:
1) espina ilíaca posterosuperior en el lugar donde la cresta ilíaca se encuentra más cerca de la piel, generalmente a 5-15 cm de la línea media del cuerpo (lugar de preferencia debido al menor riesgo de complicaciones)
2) cresta ilíaca cercana (1-2 cm hacia atrás) a la espina ilíaca anterosuperior.
Durante el mismo procedimiento se pueden realizar el aspirado y biopsia de médula ósea. Si ambas pruebas se realizan en el mismo lugar, hay que utilizar 2 agujas diferentes y realizar las punciones a una distancia de 0,5-1 cm; no realizar el aspirado con aguja para biopsia de médula.
2. Esternón: cuerpo del esternón en la línea media del cuerpo a la altura del 2.º espacio intercostal, justo por debajo del ángulo del esternón (mayor riesgo de complicaciones; únicamente para el aspirado; es la localización de preferencia en casos con antecedentes de radioterapia de pelvis, o de punción seca del íleon y cuando no hay indicaciones para una biopsia de médula).
Técnica de aspirado
1. Preparar el campo operatorio →Preparación del campo operatorio para cirugía menor; anestesiar por infiltración →Anestesia local por infiltración la piel, el tejido subcutáneo y el periostio en el sitio de la punción (al inyectar bajo el periostio se percibe resistencia), esperar unos 2-5 min.
2. Mantener con una mano la espina ilíaca y con la otra realizar la punción a una profundidad de 15-20 mm. Al realizar la punción de la espina posterior direccionar la aguja perpendicularmente a la superficie cutánea (→fig. 1), y si se realiza la punción de la cresta cerca de la espina anterior, bajo un ángulo de 45-60°. Punzar el esternón perpendicularmente a su superficie a una profundidad de 10-15 mm. Atravesar el hueso haciendo presión con la aguja y al mismo tiempo realizando movimientos de rotación del eje de la aguja (menos dolorosos); la entrada de la aguja en la cavidad medular se percibe como una disminución de la resistencia.
3. Retirar el estilete y colocarlo sobre una gasa estéril para poder utilizarlo si no se obtiene médula y es necesaria una nueva punción.
4. Conectar herméticamente la aguja con una jeringa estéril y realizar el aspirado (un dolor punzante durante el aspirado indica la exactitud de la punción y la presencia de la aguja en la cavidad medular).
5. Retirar la aguja del hueso con movimientos de rotación (si se retira la aguja con demasiada fuerza se puede romper o separar de su base de sujeción).
6. Colocar un apósito estéril por 6-12 h.
Técnica de biopsia de médula ósea
1. Procedimiento igual que en caso de aspirado del ala del ilion.
2. Sujetar la espina ilíaca con una mano, con la otra puncionar perpendicularmente en el caso de espina ilíaca posterior o en ángulo de 45-60° en caso de la cresta ilíaca junto a la espina ilíaca anterior. Atravesar el hueso presionando la aguja y al mismo tiempo realizar movimientos de rotación en el eje de la aguja hasta una profundidad de 30-40 mm, luego realizar algunos movimientos pendulares hacia los lados con el fin de separar el material presente en aguja del hueso de la cadera.
3. Con movimientos de rotación retirar la aguja del hueso. Con el estilete depositar delicadamente el material de la aguja en una gasa estéril. Para el estudio histológico tomar el material de 1,5-2 cm de largo.
4. Colocar un apósito estéril por 6-12 h.
5. Colocar al paciente de tal manera que comprima el lugar de la biopsia (debe permanecer en esta posición por 5-10 min).
Manejo del citoaspirado
1. Estudio citomorfológico. Tomar 0,5-1 ml de médula y colocarla en un tubo estéril (mayor cantidad aumenta el riesgo de dilución con la sangre periférica) e inmediatamente realizar algunos frotis, de preferencia con los dos siguientes métodos (≥2 preparados con el primer método y 6 con el segundo).
1) Verter la médula de la jeringa en el portaobjetos con un ángulo de ~30º (→fig. 2A) de tal forma que el contenido escurra libremente hacia abajo. Con el borde pulido de la otra lámina tocar la lámina con la médula vertida en el sitio donde están los grumos blanquecinos (no en el sitio más bajo por donde ha escurrido la médula →fig. 2B). Apoyar la lámina con los grumos en el borde sobre la otra lámina en 1/3 de su longitud (→fig. 2C). Aplicando una leve presión realizar el frotis con un movimiento longitudinal a lo largo de la lámina de vidrio (→fig. 2D).
2) Colocar una pequeña gota de la médula sobre la lámina portaobjetos (→fig. 3A) y cubrirla con otra lámina portaobjetos (en 1/3 de su largo; →fig. 3B). Aplicando una leve presión deslizar ambas láminas en direcciones opuestas (→fig. 3C, →fig. 3D).
Hay que secar los frotis rápidamente (para prevenir una excesiva contracción celular), fijar en metanol y proceder con tinción de May-Grünwald-Giemsa o con el método estandarizado de Romanowski. Evaluación de la diferenciación y de la maduración de las distintas líneas celulares (mielograma) →tabla 1.
2. Otros estudios. Para el estudio inmunofenotípico, citogenético o molecular tomar 1-2 ml de médula, que deberá colocarse en tubo con anticoagulante (estudio del inmunofenotipo — heparina o EDTA, estudio citogenético — heparina, prueba molecular — EDTA). Mezclar bien el material con el anticoagulante para prevenir su coagulación. El material obtenido y transportado a temperatura ambiente debe llegar al laboratorio en las 24 h siguientes a su toma.
Manejo del material de biopsia
Traspasar el material retirado de la aguja de la gasa estéril al tubo con formol (solución al 10 %) y enviar para su estudio.
TABLAS Y FIGURAS
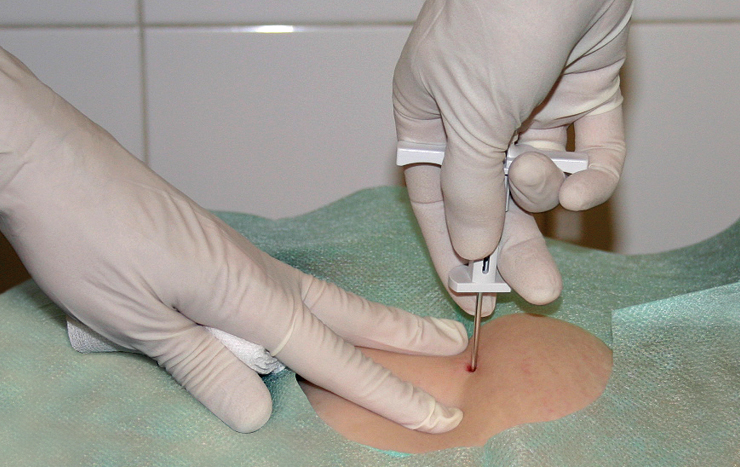
Fig. 27.24-1. Técnica de aspirado
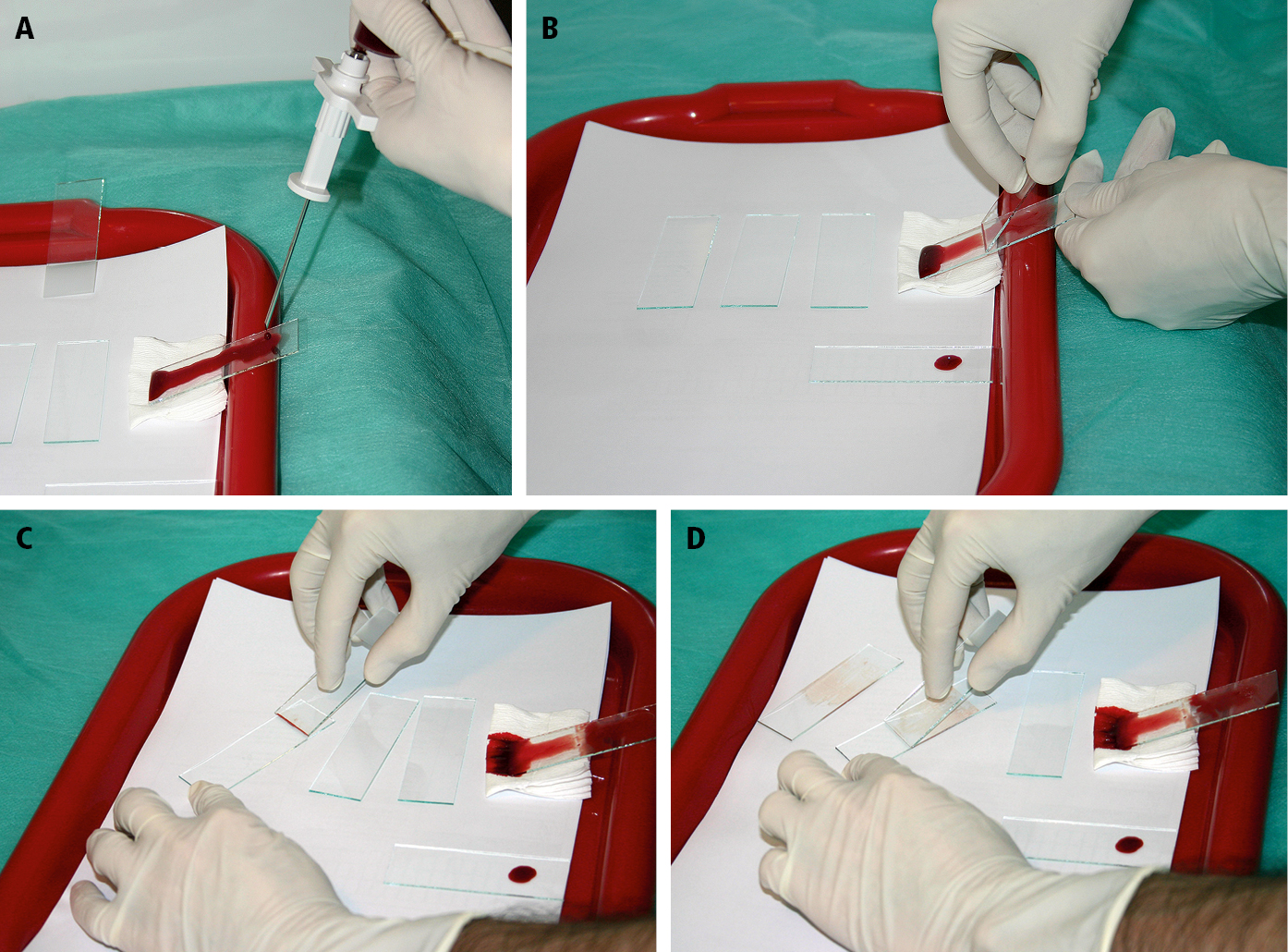
Fig. 27.24-2. Manejo del citoaspirado, método 1
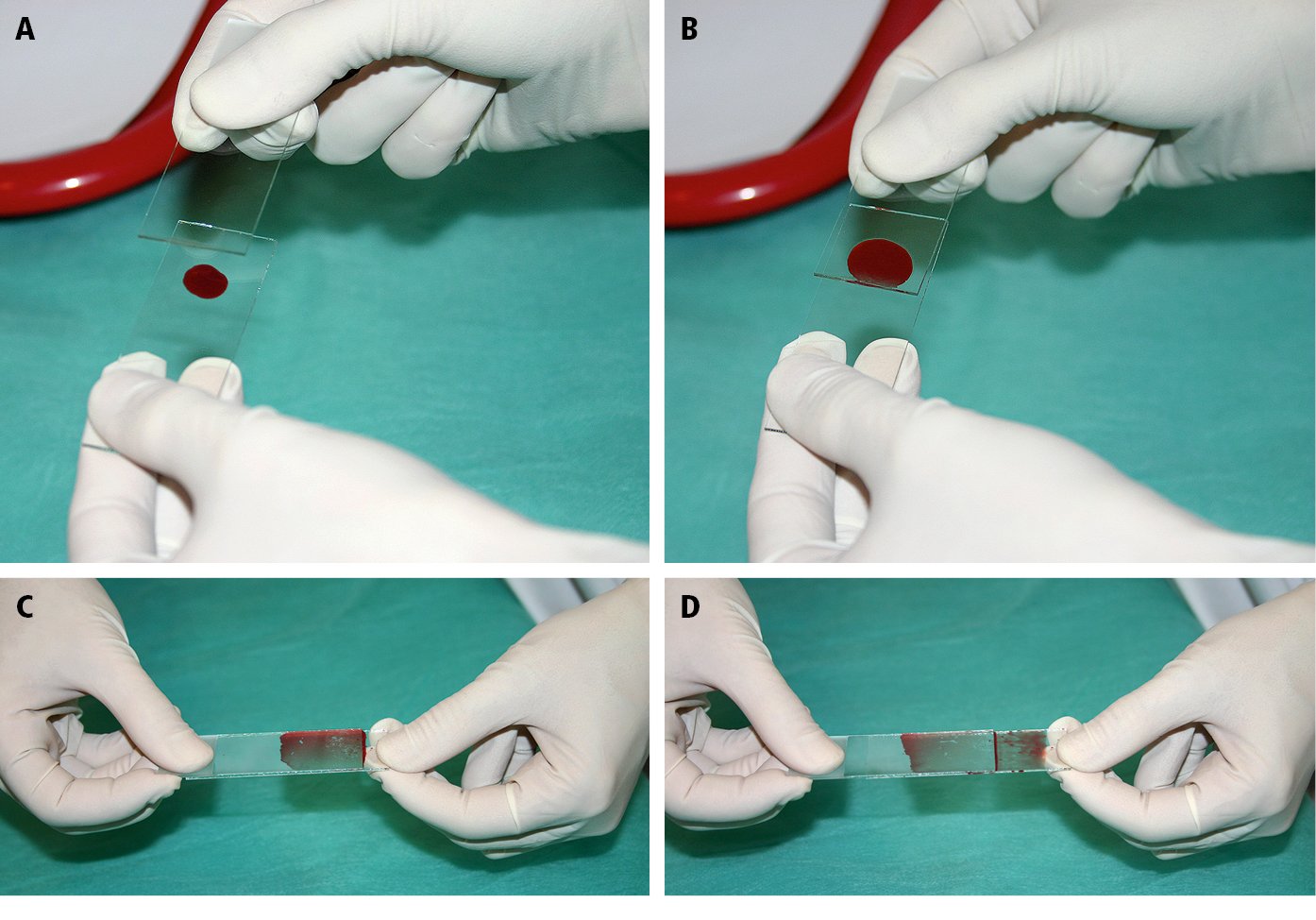
Fig. 27.24-3. Manejo del citoaspirado, método 2
Mielograma normal
|
Celularidad de la médula
|
50-90 % (40 000-100 000/µl)
|
|
Línea eritropoyética
|
10-40 %
|
|
Proeritroblastos
|
0-1,5 %
|
|
Eritroblastos basófilos
|
0,2-8 %
|
|
Eritroblastos policromatófilos
|
5-15 %
|
|
Eritroblastos eosinófilos (ortocromatófilos)
|
5-15 %
|
|
Línea mielopoyética
|
40-70 %
|
|
Mieloblastos
|
0-3 %
|
|
Promielocitos
|
0-5 %
|
|
Mielocitos neutrófilos
|
5-20 %
|
|
Mielocitos eosinófilos
|
0,2-3 %
|
|
Mielocitos basófilos
|
0-1,0 %
|
|
Metamielocitos neutrófilos
|
8-20 %
|
|
Metamielocitos eosinófilos
|
0-2 %
|
|
Metamielocitos basófilos
|
0-1 %
|
|
Granulocitos en banda
|
10-20 %
|
|
Granulocitos segmentados neutrófilos (neutrófilos)
|
10-30 %
|
|
Granulocitos segmentados eosinófilos (eosinófilos)
|
0,5-3 %
|
|
Granulocitos segmentados basófilos (basófilos)
|
0-0,5 %
|
|
Línea linfopoyética
|
8-20 %
|
|
Linfocitos
|
3-18 %
|
|
Plasmocitos
|
0,5-4 %
|
|
Células linfoides inmaduras
|
0-3 %
|
|
Monocitos
|
0,5-3 %
|
|
Macrófagos
|
0,1-2 %
|
|
Línea megacariopoyética (megacariocitos)
|
0,1-0,5 %
|
|
Relación M:E
|
2,5-4:1
|
 Español
Español
 English
English
 українська
українська







