EtiopatogeniaArriba
1. Agente etiológico: subespecies del protozoo Trypanosoma brucei, perteneciente a los flagelados; T. brucei gambiense, presente en África Occidental y Central (tripanosomiasis africana occidental) y T. brucei rhodesiense, en África Oriental (tripanosomiasis africana oriental). Ambas especies se encuentran solo en Uganda, especialmente en el Parque Nacional de la Reina Isabel. La forma móvil del protozoo circula en el humano por la sangre, la linfa y el líquido cefalorraquídeo (LCR) en forma de tripomastigote fusiforme o en forma de hoja, de 12-35 µm de largo y 1,5-3,5 µm de ancho, con una membrana larga ondulada y un flagelo libre, y configurando las letras S, C o V (→fig. 19.4-1).
2. Reservorio y vía de transmisión: el parásito se desarrolla en artiodáctilos domésticos y salvajes (ganado vacuno, porcino, cabras, ovejas, antílopes, cebras). La infección se produce por la picadura de la mosca hematófaga tsé-tsé (género Glossina spp. →fig. 19.4-2), activa durante el día. La saliva contiene formas de tripomastigotes infectivas para el ser humano. Tanto el macho como la hembra son hematófagos. En las zonas endémicas, ~3 % de las moscas Glossina spp. están infectadas. En África occidental, el principal reservorio es la persona enferma, mientras que en África oriental el protozoo circula principalmente entre los animales salvajes y domésticos como una antropozoonosis típica, causando infecciones animal-vector-humano. Con menos frecuencia, la transmisión se produce por medio de transfusiones de sangre o hemoderivados, agujas y jeringas contaminadas, o en forma congénita.
3. Factores de riesgo: estancia en áreas endémicas en África subsahariana, especialmente en casas rurales, granjas o plantaciones, y actividades recreativas (p. ej. excursiones) en estas áreas.
4. Período de incubación e infectividad: tras la picadura de una mosca tsé-tsé infectada las lesiones cutáneas aparecen días más tarde. Las manifestaciones de la primera fase de la enfermedad se asocian a la parasitemia generalizada y aparecen 1 a 3 semanas tras la infección por T. brucei rhodesiense. Los síntomas generales de la invasión por T. brucei gambiense se presentan más tarde, generalmente meses después (en algunos enfermos, sobre todo en viajeros que visitaron África, el período de incubación es más corto, de <1 mes). La afectación del sistema nervioso central (SNC) se produce muchos meses o incluso años después de la infección por T. brucei gambiense, en el caso de T. brucei rhodesiense sucede transcurridas apenas unas semanas. Durante la parasitemia en sangre periférica, la cual cursa con fiebre, el enfermo es infectivo para el vector hematófago.
EpidemiologíaArriba
La enfermedad es endémica solo en el África subsahariana, en la sábana, en las zonas de cría de ganado y en los parques nacionales y reservas naturales. En áreas no endémicas, se observan casos aislados importados de los trópicos, principalmente entre inmigrantes y refugiados de África, soldados, trabajadores humanitarios, misioneros y, con menor frecuencia, turistas que visitan reservas y ranchos con animales salvajes (safaris). Las áreas endémicas se están expandiendo como resultado de la migración del ganado de las zonas de pastos naturales a los mercados remotos. El número de casos en humanos está en descenso, en 2018 se reportaron menos de 1000 casos de los cuales el 95 % se debió a T. brucei gambiense. La mayoría de todas las infecciones se registran en la República Democrática del Congo, Guinea, Angola y la República Centroafricana. Entre los viajeros a África, el mayor número de casos se registró entre aquellos que visitaron parques nacionales.
Cuadro clínico e historia naturalArriba
La tripanosomiasis africana occidental, causada por T. brucei gambiense, tiene un curso crónico y más leve, mientras que la tripanosomiasis africana oriental, causada por T. brucei rhodesiense, es aguda, de rápido desarrollo y grave, con manifestaciones de fallo multiorgánico similares a la sepsis.
1. Manifestaciones locales: a los 3-7 días, en el sitio de la picadura de una mosca tsé-tsé infectada, aparece una lesión cutánea característica de tipo chancro (→fig. 19.4-3). La lesión es redondeada u ovalada, de borde eritematoso, con una depresión central y área de necrosis en el sitio de la multiplicación del protozoo. El chancro puede ser doloroso o no, causando dolor en caso de sobreinfección bacteriana. Inicialmente, el chancro se agranda periféricamente durante 2-3 semanas, luego se resuelve espontáneamente sin tratamiento antiparasitario en 2 meses. La lesión cutánea puede ir acompañada de linfadenopatía local.
2. Fase aguda de la infección: en caso de infección por T. brucei gambiense, la parasitemia en sangre periférica cursa con fiebre alta, cefalea, artralgia, exantema, prurito generalizado y esplenomegalia. Un signo típico es la linfadenopatía significativa de los ganglios cervicales y occipitales (signo de Winterbottom). La etapa aguda de la enfermedad puede persistir durante muchos meses, incluso hasta 2 años.
En la infección por T. brucei rhodesiense la fase aguda de la enfermedad se caracteriza por fiebre alta y manifestaciones de fallo multiorgánico. El exantema generalizado se acompaña de anemia hemolítica, ictericia, hepatoesplenomegalia, miocarditis, insuficiencia respiratoria, insuficiencia renal y síndrome de coagulación intravascular diseminada. Los ganglios linfáticos no están inflamados.
3. Fase crónica de la infección: en la etapa tardía de la enfermedad, los protozoos penetran en el espacio subaracnoideo y provocan manifestaciones de encefalitis (manifestaciones indicativas de curso grave de esta fase de la invasión por T. gambiense →tabla 19.4-1). Esta última etapa se denomina habitualmente enfermedad africana del sueño. La afectación del SNC se caracteriza por una intensa cefalea que no responde a los AINE, trastornos de la personalidad, del nivel de conciencia, y por signos focales del SNC a nivel cerebeloso y extrapiramidal. Son comunes los temblores en las extremidades, cabeza y lengua, la hipertonía muscular, especialmente en las extremidades inferiores, la hiperreflexia, la aparición de reflejos patológicos, movimientos involuntarios, alteraciones sensoriales, cambios del comportamiento, ataxia, apatía, trastornos del habla, dificultad de movimiento, crisis convulsivas y trastornos psiquiátricos en forma de depresión, delirios y alucinaciones. Es característica la inversión del ritmo vigilia-sueño. El paciente está agitado, agresivo y sufre de insomnio; se encuentra agotado, apático, somnoliento y muestra cambios de comportamiento durante el día. Son frecuentes la deshidratación y la caquexia por una deficiente ingesta de líquidos y alimentos.
DiagnósticoArriba
Exploraciones complementarias
1. Identificación del agente etiológico:
1) examen microscópico de preparaciones de gota gruesa y frotis fino de sangre periférica para detectar los tripomastigotes, mediante tinción de Giemsa
2) examen microscópico del sedimento del LCR para detectar la forma de tripomastigote en la fase tardía de la invasión
3) examen histológico de material de biopsia de ganglios linfáticos agrandados, médula ósea o chancros cutáneos para tripanosomas
4) detección de antígenos específicos de tripanosoma en sangre periférica mediante aglutinación indirecta (CATT), prueba de tamizaje ampliamente utilizada en los trópicos
5) detección de anticuerpos IgM e IgG específicos o del conjunto total de anticuerpos contra tripanosomas en sangre periférica mediante ELISA o inmunofluorescencia indirecta
6) detección de anticuerpos IgM específicos en LCR en la fase neurológica de la infección
7) diferenciación intraespecífica de tripanosomas mediante PCR utilizando sangre periférica, LCR o material de biopsia.
2. Otras:
1) proteinorraquia y aumento de celularidad en el LCR
2) VHS acelerada y elevación de proteína C reactiva y procalcitonina en el suero
3) leucocitosis moderada con monocitosis y linfocitosis en sangre periférica.
Criterios diagnósticos
Los antecedentes epidemiológicos de una estancia en África y una picadura de mosca tsé-tsé, la presencia de una lesión cutánea típica (chancro), fiebre alta y manifestaciones del SNC, son útiles para establecer el diagnóstico. La infección se confirma detectando los tripanosomas en sangre periférica o en el LCR.
Diagnóstico diferencial
1) enfermedades infecciosas agudas que ocurren en África tropical y cursan con fiebre y manifestaciones sistémicas y/o compromiso del SNC: entre otras, malaria (especialmente causada por P. falciparum), fiebres hemorrágicas, fiebre tifoidea y paratifoidea, infección por VIH
2) enfermedades que cursan con linfadenopatía: tuberculosis ganglionar, infección por VIH, peste bubónica, enfermedades no transmisibles
3) meningoencefalitis: vírica, bacteriana y fúngica
TratamientoArriba
Tratamiento causal
1. Infección por T. b. gambiense:
1) Menores de 6 años y/o < 20 kg: en enfermos con celularidad en el LCR <5/ml, en los cuales no se observan tripanosomas, se recomienda administrar pentamidina (4 mg/kg/d IM o iv. por 7 días). En enfermos con celularidad >5/ml y/o presencia de tripanosomas en LCR está indicada la administración de una combinación de nifurtimox + eflornitina (nifurtimox 15 mg/kg/d VO dividido en 3 dosis/día por 10 días; eflornitina 400 mg/kg/d EV dividida en dos infusiones/día de 2 horas cada una por 7 días.
2) Mayores de 6 años y >20 kg: si el enfermo no presenta síntomas que hagan sospechar una enfermedad grave (→tabla 19.4-1), hay que utilizar fexinidazol VO: en personas de >20 y <35 kg la dosis de carga es de 1200 mg/d durante 4 días y la dosis de mantenimiento es de 600 mg/d durante 6 días; en caso de pacientes ≥35 kg, la dosis de carga es de 1800 mg/d durante 4 días, y luego 1200 mg/d durante 6 días). El fármaco debe ingerirse con la comida o justo después para favorecer la absorción. Ante la sospecha de enfermedad grave (→tabla 19.4-1) se debe realizar una punción lumbar. En pacientes con celularidad <100/ml pautar fexinidazol VO, y en enfermos con citosis ≥100/ml, o si no es posible realizar la punción lumbar, se debe administrar nifurtimox + eflornitina.
2. Infección por T. b. rhodesiense: el fármaco de elección es la suramina; el 1.er día debe administrarse con cuidado a dosis de 4-5 mg/kg iv. (dosis de prueba), y luego en 5 dosis de 20 mg/kg (máx. 1 g) iv. los días 1, 3, 7, 14 y 21 (esquema recomendado por los CDC, la OMS recomienda administrar las siguientes dosis cada 7 días); de forma altertnativa puede utilizarse pentamidina IM o iv. 4 mg/kg durante 7 días.
3. Fase neurológica tardía de la infección por T. b. rhodesiense: melarsoprol iv. 2,2 mg/kg/d (máx. 180-200 mg/d) durante 10 días. Se debe considerar la administración de glucocorticoides antes de iniciar el tratamiento para reducir el riesgo de reacción encefalopática al melarsoprol.
Tratamiento sintomático
Utilizar antipiréticos y antinflamatorios, analgésicos opioides, líquidos para infusiones, anticonvulsivos, antipsicóticos, fármacos que disminuyan la presión intracraneal (manitol, glucocorticoides), nutrición parenteral, transfusión de hemoderivados, y la ventilación mecánica si es necesario.
vigilanciaArriba
Se necesitan ≥2 años de seguimiento clínico y de laboratorio para excluir la reactivación de la infección. La remisión de la parasitemia, la desaparición de los anticuerpos IgG específicos en sangre periférica, y la ausencia de anticuerpos IgM al final de la terapia confirman la eficacia del tratamiento.
ComplicacionesArriba
Caquexia y neumonía por aspiración en la fase de letargo, fallo multiorgánico y desarrollo de sobreinfecciones bacterianas generalizadas, especialmente en casos de infección por T. brucei rhodesiense.
PronósticoArriba
La tripanosomiasis africana mal tratada tiende a recurrir y no deja inmunidad permanente. La fase neurológica tardía en forma de enfermedad del sueño suele terminar con la muerte.
PrevenciónArriba
Métodos específicos
No hay.
Métodos no específicos
1. Usar medios de protección contra las picaduras de insectos durante la estancia en regiones endémicas →Métodos no específicos de protección contra insectos y garrapatas.
2. Evitar el alojamiento (campamento o área de autocaravanas) en las inmediaciones de animales salvajes durante el viaje a regiones endémicas.
3. Actividades organizadas en forma de programas nacionales e internacionales para la eliminación del vector mediante trampas especiales para moscas tsé-tsé instaladas en África en granjas rurales, a lo largo de carreteras, cerca de abrevaderos y de mercados con animales vivos.
Notificación obligatoria
No.
TABLAS Y FIGURAS
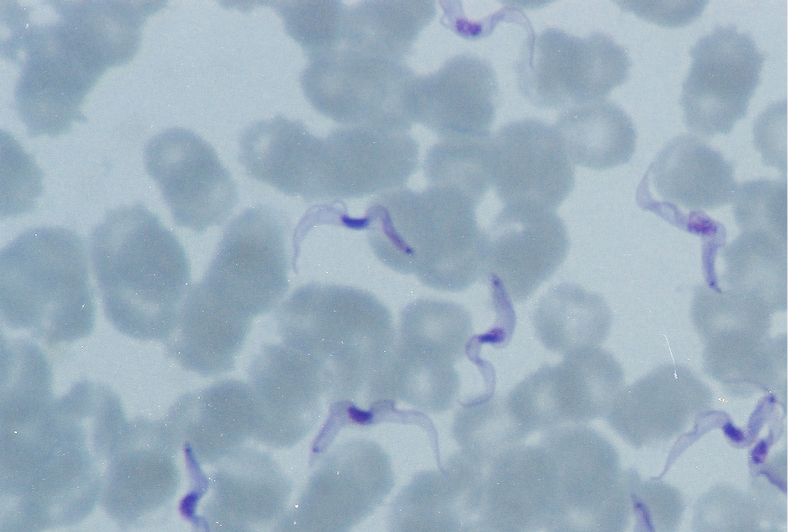
Fig. 19.4-1. Formas de tripomastigote de T. brucei rhodesiense en sangre periférica en un paciente al regreso de Uganda. Frotis fino de sangre periférica teñido con Giemsa

Fig. 19.4-2. Mosca del género Glossina (tsé-tsé), vector de la tripanosomiasis africana
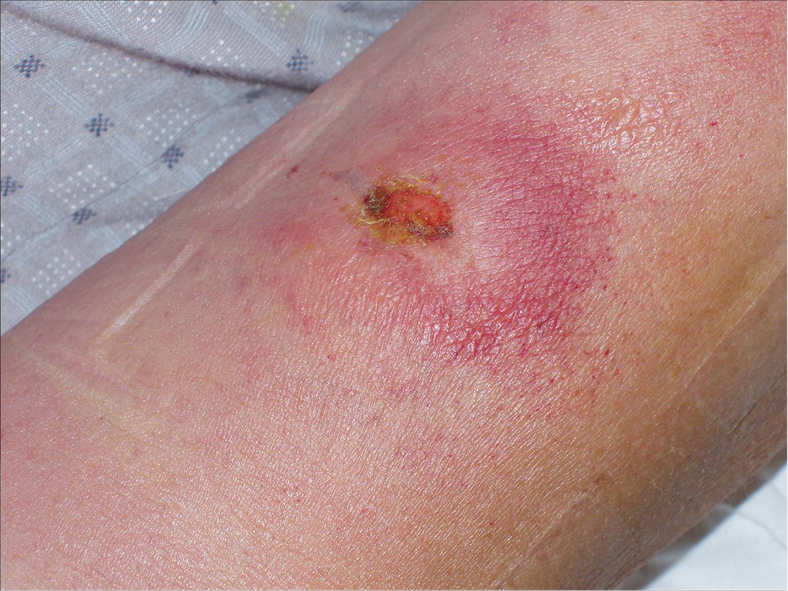
Fig. 19.4-3. Chancro característico en la piel del brazo izquierdo en un paciente infectado por T. brucei rhodesiense durante su estancia en Uganda
Manifestaciones que indican un curso grave de la fase tardía de la infección por T. gambiense a partir de la OMS (2019)
|
1) Alteraciones de la conciencia (confusión)
2) Trastornos del comportamiento
3) Verborrea
4) Trastornos por ansiedad
5) Ataxia
6) Temblor
7) Disminución del tono muscular
8) Trastornos del habla
9) Alteraciones de la marcha
10) Movimientos involuntarios
11) Crisis epilépticas
|
|
A partir de: WHO interim guidelines for the treatment of gambiense human African trypanosomiasis, August 2019. World Health Organization (https://apps.who.int/iris/bitstream/handle/10665/326178/9789241550567-eng.pdf)
|
 Español
Español
 English
English
 українська
українська







