Cómo citar: Prejbisz A., Kołodziejczyk Kruk S., Januszewicz A., Diagnostyka i leczenie hiperaldosteronizmu pierwotnego. Podsumowanie stanowiska European Society of Hypertension 2020, Med. Prakt., 2020; 11: 32-41
Siglas y abreviaturas: ARM — antagonista del receptor de mineralocorticoides, ARP — actividad de la renina plasmática, DRC (direct renin concentration) — concentración de renina directa, ESH — European Society of Hypertension, FA — fibrilación auricular, HAP — hiperaldosteronismo primario, HTA — hipertensión arterial, IAR — índice aldosterona renina, TC — tomografía computarizada
Introducción y definición
En 2020, el Grupo de Trabajo sobre la Hipertensión Arterial de Origen Endocrino de la European Society of Hypertension (ESH) publicó su posición sobre el manejo del hiperaldosteronismo primario (HAP; definición y formas: véase recuadro). (...) La premisa para publicar esta posición fue el gran avance en cuanto al conocimiento del origen de la enfermedad, el perfeccionamiento del diagnóstico y la comprensión de la participación del exceso de aldosterona en numerosas complicaciones sistémicas. Hasta entonces, el manejo del HAP se basaba en la postura de la Endocrine Society estadounidense. La posición de la ESH que presentamos es el primer trabajo europeo que aborda esta cuestión.1-3
Las formas más comunes del HAP son el aldosteronoma unilateral y la hiperplasia suprarrenal bilateral (hiperaldosteronismo idiopático bilateral).
Prevalencia y cuadro clínico del hiperaldosteronismo primario
La prevalencia del HAP se estima en 3,2-12,7 % de los pacientes de atención primaria y 1‑30 % de los pacientes de atención especializada. Los autores de la posición de la ESH subrayan que existe una continuidad entre la hipertensión arterial (HA) primaria de baja renina y el HAP. El HAP es una enfermedad de carácter progresivo. Comienza por una fase con presión arterial adecuada, pero con una concentración baja de renina sérica y una concentración ligeramente elevada de aldosterona, y va progresando paulatinamente hasta una fase con HTA y alteraciones más graves del perfil hormonal.
En qué casos se debe sospechar el hiperaldosteronismo primario
HTA resistente y HTA de grado 3: la prevalencia del HAP aumenta a medida que la HTA se agrava. Se estima que hasta el 20 % de los pacientes con HTA resistente sufre HAP.
HTA en edad joven: los pacientes jóvenes (<40 años) pueden presentar formas más leves de HAP y, a veces, no se observan las indicaciones típicas para el diagnóstico del HAP. Este grupo de pacientes puede obtener beneficios importantes en cuanto al riesgo cardiovascular y la calidad de vida gracias al diagnóstico y el tratamiento del HAP, aunque no hay suficientes datos que confirmen esta hipótesis.
Hipopotasemia: en numerosos ensayos se ha analizado la prevalencia de la hipopotasemia en los pacientes con HAP. Sin embargo, no se ha estudiado la prevalencia de la HAP en los pacientes con HTA e hipopotasemia. En cualquier caso, diagnosticar hipopotasemia a un paciente con HTA (sin otra causa conocida) siempre debería despertar la sospecha de HAP. Esto también se aplica a la hipopotasemia inducida por diuréticos.
Tumor suprarrenal detectado de forma accidental: se estima que el 1,6-4,3 % de los pacientes con un tumor suprarrenal detectado de forma accidental presentan HAP (prevalencia total en personas con y sin HTA). El HAP puede presentarse con más frecuencia en los pacientes con un tumor suprarrenal detectado de forma accidental y HTA.
Antecedentes familiares de hiperaldosteronismo primario o ACV en edad joven: las formas familiares de HAP son bastante raras. El HAP podría sospecharse si hubiera antecedentes de ACV en edad joven o HAP diagnosticado en un familiar de 1.er grado. El HAP familiar debe sospecharse únicamente en caso de confirmar antecedentes de HAP en familiares en edad joven. Teniendo en cuenta la prevalencia relativamente alta del HAP, que se haya diagnosticado en familiares de edad avanzada puede ser casualidad y no tiene por qué indicar una predisposición genética.
Diabetes, síndrome metabólico y apnea obstructiva del sueño: los autores de la posición de la ESH señalan que los pacientes con HAP presentan trastornos del metabolismo de la glucosa, diabetes incluida, con más frecuencia que la población general de pacientes con HTA. Asimismo, han subrayado que la gran mayoría de pacientes con apnea obstructiva del sueño y HAP poseen alguna de las indicaciones para el diagnóstico de HAP mencionadas en la posición.
La fibrilación auricular (FA) incide con bastante más frecuencia en los pacientes con HAP que en la población general de pacientes con HTA. Un ensayo que incluyó a pacientes con FA no relacionada con una enfermedad estructural cardíaca u otra afección ha revelado que la proporción de pacientes con HAP es relativamente grande en este grupo (42 %).4 No obstante, debemos interpretar los resultados de este ensayo con bastante cautela, ya que los criterios de inclusión de pacientes con FA de etiología desconocida despiertan ciertas dudas: solo un 18 % de los pacientes incluidos en el ensayo presentaban FA y HA, aunque al mismo tiempo los autores reconocieron que la mera concomitancia de HTA no explica la incidencia de la FA. Es posible que los criterios de inclusión confusos hayan dado lugar a una población poco representativa y que, por consiguiente, sea difícil extrapolar los resultados a la población total de pacientes con FA.
Pruebas de cribado del hiperaldosteronismo primario
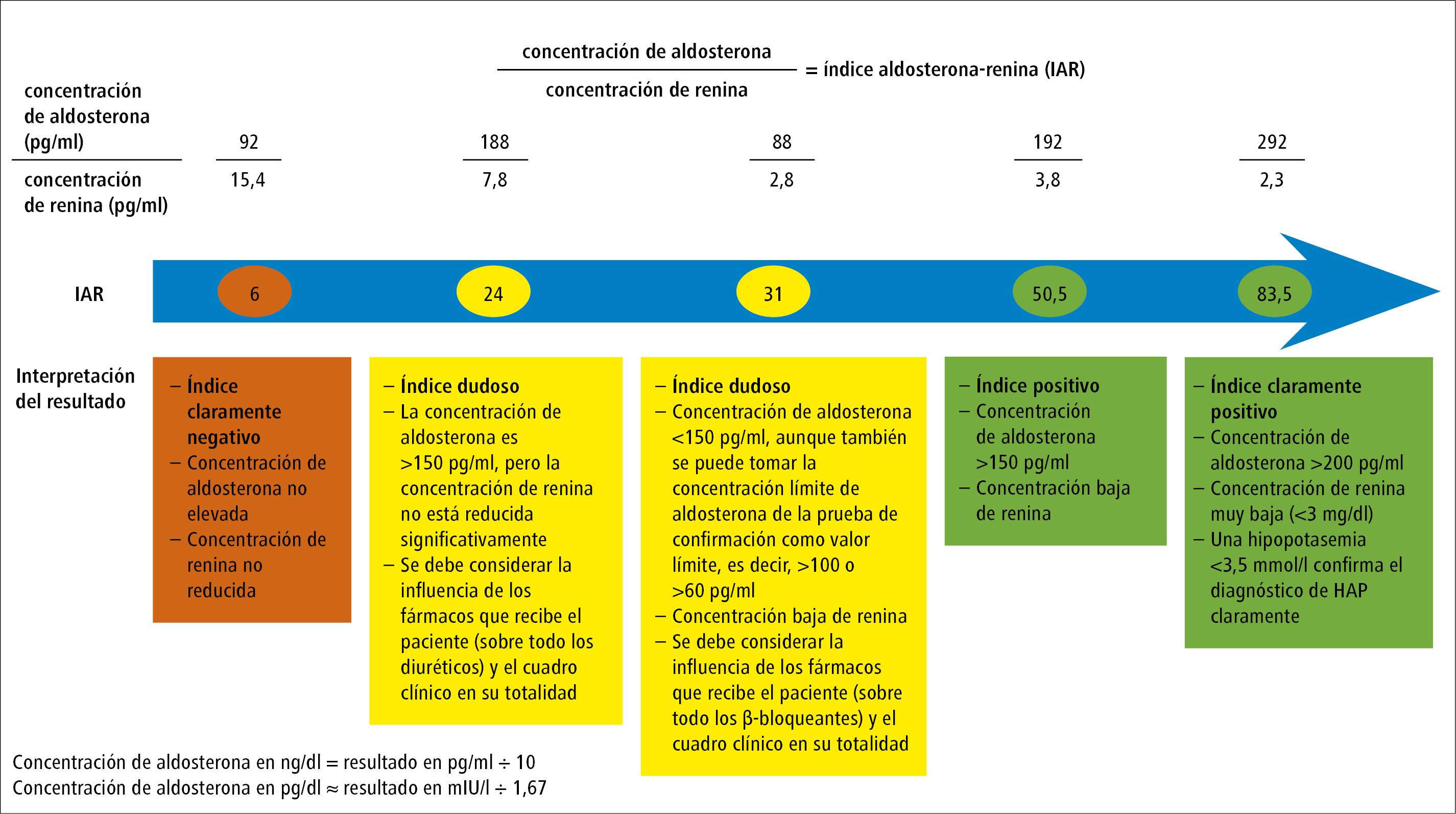
Las pruebas de tamizaje indicadas en los pacientes con sospecha de HAP son, en primer lugar, la determinación de aldosterona y renina en plasma, y en segundo lugar, el cálculo del índice aldosterona renina (IAR, cociente de las concentraciones de aldosterona y renina en plasma), que se sigue considerando el método de tamizaje más fiable y accesible. Dadas las diferencias entre los métodos que sirven para determinar la concentración de renina directa (DRC), la actividad de renina plasmática (ARP) y la concentración de aldosterona, no es posible fijar un punto de corte del IAR; en caso de expresar la concentración de aldosterona en ng/dl y la ARP en ng/ml/h, el punto de corte del IAR se suele fijar en 30 (pero se permiten valores en un intervalo 20-40): véase tabla. Por lo tanto, cada laboratorio y centro desarrolla sus propias normas.
| Tabla. Puntos de corte del índice aldosterona-renina (IAR) como indicaciones para seguir realizando pruebas de diagnóstico en función del método de medición y las unidades utilizadas en las determinaciones de renina y aldosterona en plasma | ||
|---|---|---|
| ARP (ng/ml/h) | DRC (mUI/l) | |
| Concentración de aldosterona (ng/dl) | 20 | 1,3 |
| 30 | 2 | |
| 40 | 2,7 | |
| Concentración de aldosterona (pmol/l) | 550 | 36 |
| 830 | 55 | |
| 1100 | 74 | |
|
ARP — actividad de la renina plasmática, DRC — concentración de renina directa A partir de la posición de la ESH1 | ||
Se recomienda determinar las concentraciones de aldosterona y renina en plasma después de haber retirado los fármacos que influyan en ellas. En caso de necesidad, el paciente puede tomar verapamilo, doxazosina y moxonidina. Si no se pudieran retirar los fármacos que influyen en las concentraciones de aldosterona y renina (β-bloqueantes, calcioantagonistas dihidropiridínicos, diuréticos, inhibidores de la enzima convertidora de angiotensina (IECA), antagonistas de los receptores de angiotensina [sartanes]), se debe evaluar el IAR e interpretar el resultado considerando la influencia de dichos fármacos. No se debe realizar esta prueba en los pacientes que estén recibiendo algún antagonista de la aldosterona. Antes de determinar las concentraciones de aldosterona y renina, se debe corregir la hipopotasemia sin limitar la ingesta de sodio. Las muestras de sangre deben extraerse antes del mediodía, con el paciente sentado después de al menos 2 h de posición vertical (el paciente puede permanecer sentado durante este período, pero no puede tumbarse).
En el centro representado por los autores de este trabajo, el punto de corte del IAR es de 30 para las concentraciones de aldosterona y renina expresadas en pg/ml. Si los valores del laboratorio están expresados en otras unidades, se pueden convertir a pg/ml: solo hay que multiplicar por 10 la concentración de aldosterona expresada en ng/dl y dividir por 1,67 la concentración de renina expresada en mUI/l. Si el IAR se sitúa en un intervalo de 20-30, el siguiente paso consiste en analizar el cuadro clínico y, con base en él, realizar más pruebas de diagnóstico del HAP en los pacientes que así lo requieran.
La figura 1 presenta ejemplos de interpretación de los resultados de las determinaciones del IAR. En esta interpretación, se debe valorar si la concentración de aldosterona se encuentra elevada. No obstante, no se trata de analizar si supera el límite superior de la normalidad, es decir, el intervalo de referencia adoptado en cada laboratorio. Se considera que la concentración de aldosterona debe ser >150 pg/ml (15 ng/dl). Sin embargo, algunos autores recomiendan marcar el punto de corte en 100 pg/ml o un valor límite para el diagnóstico del HAP en la prueba de confirmación (es decir >100 pg/ml o >60 pg/ml en la prueba de sobrecarga salina). La concentración de renina debe ser baja, es decir, debe encontrarse por debajo o cerca del límite inferior del intervalo de referencia.
Pruebas de confirmación del diagnóstico de hiperaldosteronismo primario
Si el IAR indica un resultado positivo, es obligatorio llevar a cabo una de las pruebas de confirmación del HAP. Sin embargo, los autores de la postura de la ESH sugieren que si los pacientes con hipopotasemia espontánea presentan una concentración de renina plasmática por debajo del umbral de detección o muy baja y una concentración de aldosterona en reposo >200 pg/ml (20 ng/dl), se puede diagnosticar el HAP sin necesidad de realizar ninguna prueba de confirmación.
En la postura de la ESH se mencionan las 4 pruebas de confirmación más utilizadas, esto es, la prueba de sobrecarga salina oral e intravenosa, la prueba de captopril y la prueba de fludrocortisona. Asimismo, se subraya que la elección del método debe depender de su disponibilidad y de la experiencia del centro. Como en la determinación del IAR, se deben tener en cuenta los fármacos que influyan en el sistema renina-angiotensina-aldosterona y valorar las contraindicaciones para la prueba. Por ejemplo, la prueba de sobrecarga salina está contraindicada en los casos de presión arterial muy elevada, insuficiencia cardíaca grave e insuficiencia renal.
Los autores de la posición de la ESH debatieron sobre la posibilidad de recomendar una prueba y unos valores límite para el diagnóstico del HAP. Sin embargo, debido a la insuficiencia de datos, decidieron no fijar ningún valor concreto. En la figura 2 se propone un algoritmo de diagnóstico del HAP que se ha elaborado con base en la posición de la ESH y la experiencia de los autores de este trabajo. Por lo general, en la práctica se realiza una prueba de sobrecarga salina en posición sentada. En este caso, el valor de corte que permite diagnosticar el HAP suele ser una concentración de aldosterona >60 pg/ml (170 nmol/l) y una concentración de cortisol reducida después de administrar una infusión de una solución de NaCl al 0,9 %. Los valores límite de la prueba de sobrecarga salina en posición sentada son: >100 pg/ml (diagnóstico seguro) y 50-100 pg/ml (diagnóstico probable). La postura de la ESH señala que la prueba de sobrecarga salina en posición sentada puede tener preferencia, y que en caso de que esté contraindicada, se puede realizar la prueba de captopril.

Recuadro
Definición y formas de hiperaldosteronismo primario
El HAP es un conjunto de estados clínicos patológicos relacionados con una secreción alta de aldosterona inadecuada a la ingesta de sodio y relativamente independiente de la actividad del sistema renina-angiotensina y la concentración de potasio en plasma.
Las formas más comunes del HAP son el aldosteronoma unilateral y la hiperplasia suprarrenal bilateral (hiperaldosteronismo idiopático bilateral).
Bibliografía:
1. Mulatero P., Monticone S., Deinum J. y cols., Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of The European Society of Hypertension, J. Hypertens., 2020; 38: 1919–19282. Mulatero P., Sechi L.A., Williams T.A. y cols., Subtype diagnosis, treatment, complications and outcomes of primary aldosteronism and future direction of research: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension, J. Hypertens., 2020; 38: 1929–1936
3. Funder J.W., Carey R.M., Mantero F. y cols., The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline, J. Clin. Endocrinol. Metab., 2016; 101: 1889–1916 4. Seccia T.M., Letizia C., Muiesan M.L. y cols., Atrial fibrillation as presenting sign of primary aldosteronism: results of the Prospective Appraisal on the Prevalence of Primary Aldosteronism in Hypertensive (PAPPHY) Study, J. Hypertens., 2020; 38: 332–339 5. Hundemer G.L., Curhan G.C., Yozamp N. y cols., Cardiometabolic outcomes and mortality in medically treated primary aldosteronism: a retrospective cohort study, Lancet Diabetes Endocrinol., 2018; 6: 51–59
 Español
Español
 English
English
 українська
українська






