Tratamiento invasivo de las cardiopatías congénitas más frecuentes
Comunicación interauricular (nativa o residual)
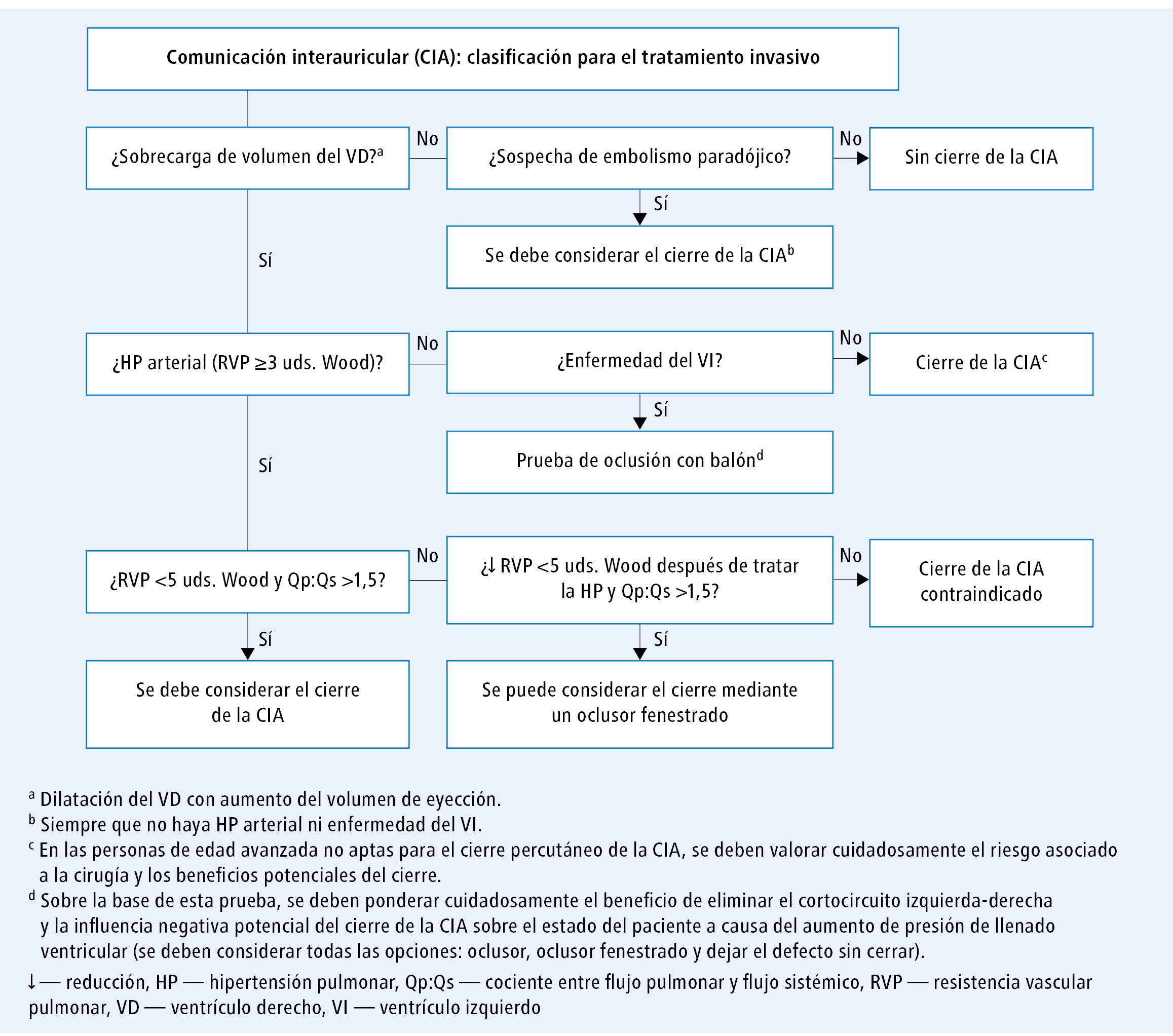
La figura 1 presenta el protocolo para determinar la aptitud para el tratamiento invasivo de los pacientes con CIA.
Fig. 1. Algoritmo de toma de decisiones sobre el tratamiento invasivo de la comunicación interauricular (a partir de las guías de la ESC 2020, modificado)En los pacientes con signos de sobrecarga ventricular derecha (dilatación ventricular con aumento del volumen sistólico), sin HP (sin signos de aumento de la PAP en una prueba no invasiva o con RVP <3 uds. Wood en una prueba invasiva en caso de presentarse esos signos) y sin enfermedad del ventrículo izquierdo, se recomienda cerrar la CIA independientemente de los síntomas [I/B]. El método de elección en los casos de CIA secundaria (CIA II) consiste en realizar un cierre percutáneo siempre y cuando sea técnicamente posible [I/C]. En los pacientes de edad avanzada que no sean aptos para el cierre del defecto mediante este método, se recomienda ponderar con cuidado el riesgo asociado a la operación en relación con los beneficios potenciales del cierre de la CIA [I/C].
En los pacientes con signos de PAP elevada en una prueba no invasiva, es imprescindible realizar una medición invasiva de la RVP [I/C].
En los pacientes con enfermedad del ventrículo izquierdo, se recomienda realizar una prueba de oclusión con balón (nota de la editorial: imita el estado hemodinámico después de un posible cierre permanente del defecto mediante el implante de un oclusor) y ponderar con cuidado los beneficios derivados de la eliminación del cortocircuito izquierda-derecha en relación con la posible influencia negativa del cierre de la CIA en el estado del paciente a causa de un aumento de la presión de llenado ventricular (se deben considerar todas las opciones: usar un dispositivo de cierre [oclusor], usar un oclusor fenestrado y no cerrar el defecto) [I/C].
En los pacientes con sospecha de embolismo paradójico (después de descartar otras causas), se debe considerar el cierre de la CIA independientemente de su magnitud, siempre y cuando no se diagnostique HP ni una enfermedad del ventrículo izquierdo [IIa/C].
En los pacientes con una RVP de 3-5 uds. Wood, se debe considerar el cierre de la CIA si existe un cortocircuito izquierda-derecha significativo (Qp:Qs >1,5) [IIa/C].
En los pacientes con una RVP de ≥5 uds. Wood, se puede considerar el cierre de la CIA mediante un oclusor fenestrado si la RVP disminuye <5 uds. Wood después de un tratamiento dirigido de la HP y existe un un cortocircuito izquierda-derecha significativo (Qp:Qs >1,5) [IIb/C].
No se recomienda cerrar la CIA en los pacientes con fisiología de Eisenmenger (nota de la editorial: es decir, con cortocircuito derecha-izquierda y cianosis), con HP y una RVP ≥5 uds. Wood a pesar del tratamiento dirigido de la HP, o con una reducción de la SaO2 en la prueba de esfuerzo (los datos sobre el valor de corte exacto son limitados, pero con base en la experiencia clínica se puede establecer en <90 %) [III/C].
Comunicación interventricular (nativa o residual)
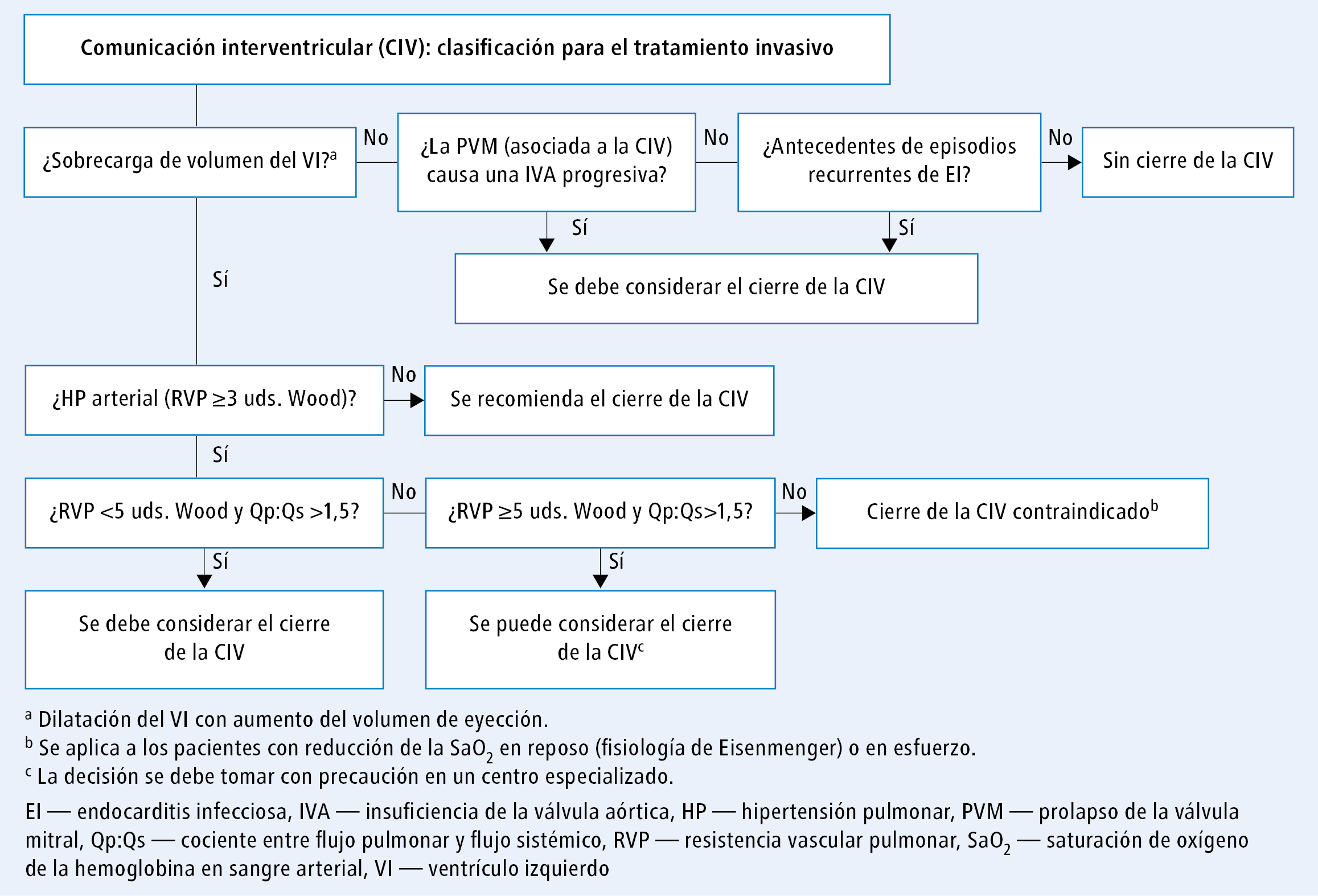
La figura 2 presenta el protocolo para determinar la aptitud para el tratamiento invasivo de los pacientes con CIV.
Fig. 2. Algoritmo de toma de decisiones sobre el tratamiento invasivo de la comunicación interventricular (a partir de las guías de la ESC 2020, modificado)En los pacientes con sobrecarga volumétrica del ventrículo izquierdo confirmada (dilatación ventricular con aumento del volumen sistólico) y sin HP arterial (sin signos de aumento de la PAP en una prueba no invasiva o con RVP <3 uds. Wood en una prueba invasiva en caso de presentarse esos signos), se recomienda cerrar la CIA independientemente de los síntomas [I/ C].
En los pacientes que no presenten un cortocircuito izquierda-derecha importante, pero con antecedentes de episodios recurrentes de EI, se debe considerar el cierre de la CIV [IIa/C].
En los pacientes con prolapso de la válvula aórtica asociado a CIV que causa una insuficiencia aórtica progresiva, se debe considerar la cirugía [IIa/C].
En los pacientes que hayan desarrollado HP y presenten un cortocircuito de izquierda a derecha significativo y persistente (Qp:Qs >1,5):
1) se debe considerar el cierre de la CIV en caso de que la RVP sea de 3-5 uds. Wood [IIa/C]
2) se puede considerar el cierre de la CIV con una RVP ≥5 uds. Wood, pero la decisión se debe tomar en un centro especializado [IIb/C].
No se recomienda cerrar la CIV en los enfermos con fisiología de Eisenmenger ni en los pacientes con una HP grave (RVP ≥5 uds. Wood) que se manifieste mediante una reducción de la SaO2 durante el esfuerzo (los datos sobre el valor de corte exacto son limitados, pero con base en la experiencia clínica se puede establecer en <90 %) [III/C].
Defecto septal auriculoventricular
1. DSAV completo: no se recomienda la corrección quirúrgica en los pacientes con fisiología de Eisenmenger ni en los pacientes con una HP arterial (RVP ≥5 uds. Wood) que se manifieste mediante una reducción de la SaO2 durante el esfuerzo (los datos sobre el valor de corte exacto son limitados, pero con base en la experiencia clínica se puede establecer en <90 %) [III/C]. Indicaciones para el tratamiento invasivo: véase también más arriba (sección Comunicación interventricular).
2. DSAV parcial (CIA tipo ostium primum): el cierre quirúrgico está indicado en los pacientes con una sobrecarga significativa del ventrículo derecho, y solo debe llevarlo a cabo un cirujano especializado en el tratamiento de CC [I/C]. Indicaciones posteriores para el tratamiento invasivo: véase también más arriba (sección Comunicación interauricular).
3. Insuficiencia de la válvula AV: en los pacientes sintomáticos con insuficiencia de la válvula AV moderada o grave, se recomienda que un cirujano cardíaco especializado en el tratamiento de CC opere la válvula (a ser posible una corrección de la válvula AV) [I/C]. En los pacientes asintomáticos con insuficiencia de la válvula AV izquierda grave:
1) se recomienda operar la válvula si el diámetro telesistólico del ventrículo izquierdo (DTDVI) es ≥45 mm (en las personas de complexión media; este punto de corte puede cambiar en las personas de superficie corporal muy pequeña o muy grande) y/o la fracción de eyección ventricular izquierda (FEVI) es ≤60 %, siempre y cuando se hayan descartado otras causas de la disfunción ventricular izquierda [I/C]
2) se debe considerar el tratamiento invasivo en caso de FA o PAP sistólica >50 mm Hg si la función del ventrículo izquierdo está conservada (DTDVI <45 mm y/o FEVI >60 %), las probabilidades de reparar la válvula con éxito son grandes y el riesgo de la cirugía es bajo [IIa/C].
4. Estenosis del tracto de salida del ventrículo izquierdo: véase más adelante (sección Estenosis aórtica subvalvular).
Conducto arterioso persistente
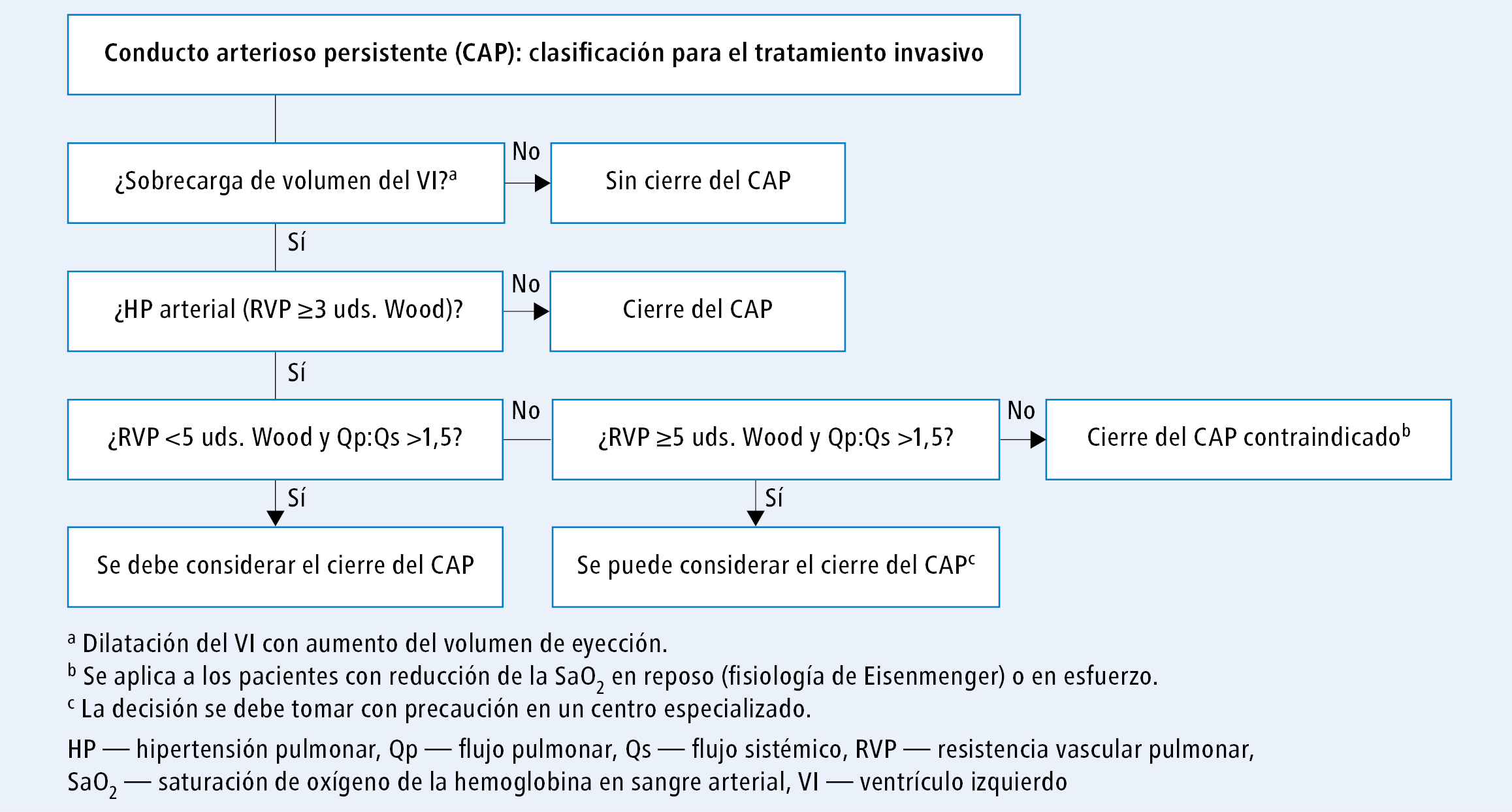
La figura 3 presenta el protocolo para determinar la aptitud para el tratamiento invasivo de los pacientes con CAP.
Fig. 3. Algoritmo de toma de decisiones sobre el tratamiento invasivo del conducto arterioso persistente (a partir de las guías de la ESC 2020, modificado)En los pacientes con síntomas de sobrecarga volumétrica del ventrículo izquierdo y sin HP arterial (sin signos de aumento de la PAP en una prueba no invasiva o con RVP <3 uds. Wood en una prueba invasiva en caso de presentarse esos signos), se recomienda cerrar el CAP independientemente de los síntomas [I/C]. El método de elección es el cierre percutáneo con oclusor, siempre y cuando sea técnicamente posible [I/C].
En los pacientes que hayan desarrollado HP y presenten un cortocircuito izquierda-derecha significativo y persistente (Qp:Qs >1,5):
1) se debe considerar el cierre del CAP en caso de que la RVP sea de 3-5 uds. Wood [IIa/C]
2) se puede considerar el cierre del CAP con una RVP ≥5 uds. Wood, pero la decisión se debe tomar con cautela y en un centro especializado [IIb/C].
En los casos de síndrome de Eisenmenger secundario a CAP, se debe evitar cerrar el CAP si el paciente sufre una reducción de la SaO2 de miembros inferiores durante el esfuerzo (los datos sobre el valor de corte exacto son limitados, pero con base en la experiencia clínica se puede establecer en <90 %) [III/C].
Obstrucción del tracto de salida del ventrículo izquierdo
Estenosis aórtica
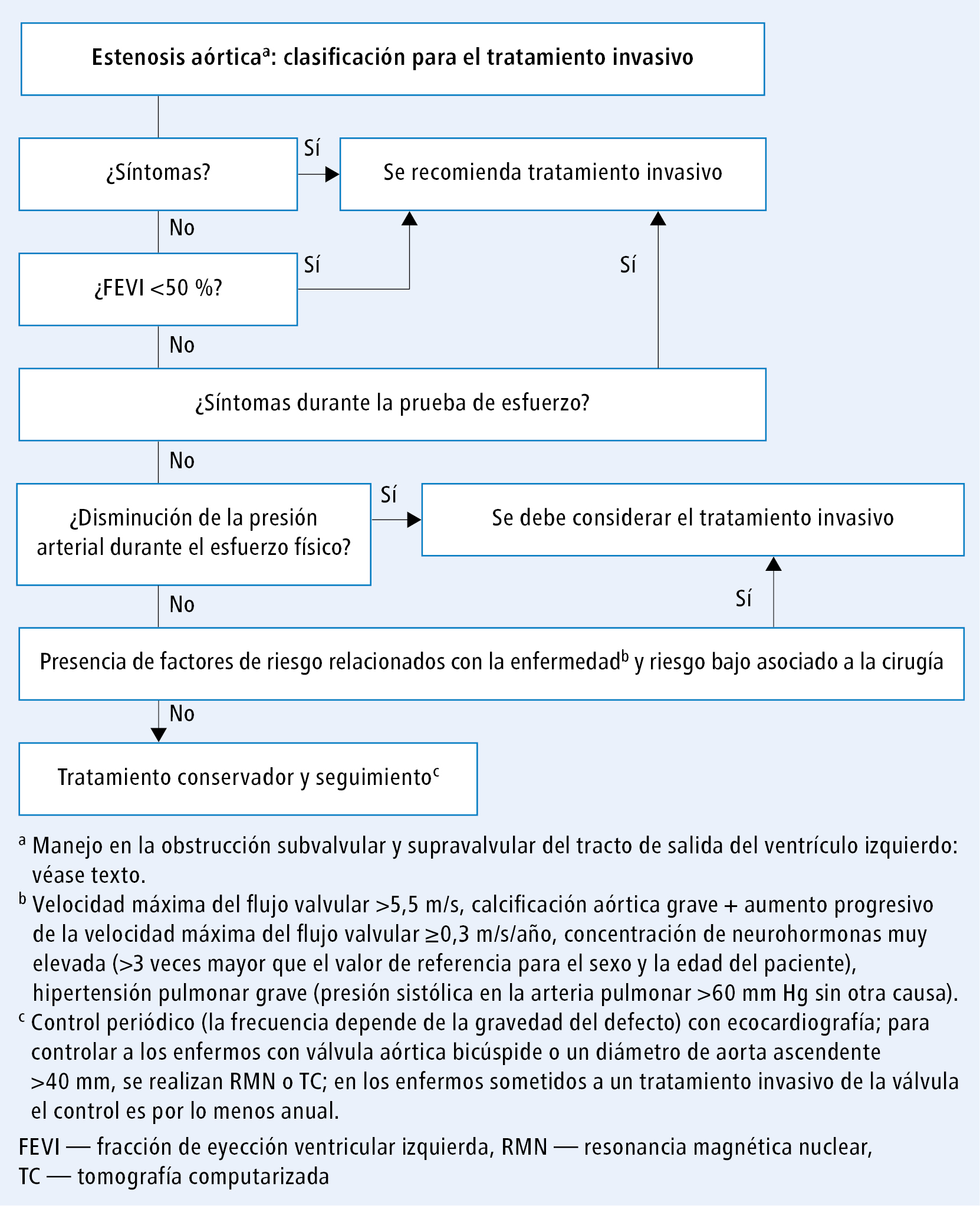
La figura 4 presenta el protocolo para determinar la aptitud para el tratamiento invasivo de los pacientes con estenosis aórtica (EA).
Fig. 4. Algoritmo de toma de decisiones sobre el tratamiento invasivo de la estenosis aórtica (a partir de las guías de la ESC 2020, modificado)En los pacientes sintomáticos con EA, el tratamiento invasivo está indicado si la EA es:
1) grave de alto gradiente (gradiente transvalvular medio ≥40 mm Hg) [I/B]
2) grave de bajo flujo y bajo gradiente (gradiente medio <40 mm Hg), con una FE reducida e indicios que apuntan a una reserva de flujo (contractilidad) conservada después de descartar una EA pseudograve [I/C].
En los enfermos asintomáticos con EA grave, el tratamiento invasivo:
1) está indicado en caso de que la prueba de esfuerzo señale que los síntomas en esfuerzo están claramente relacionados con la EA [I/C] o que la disfunción sistólica del ventrículo izquierdo (FEVI <50 %) no se deba a otra causa [I/C]
2) se debe considerar si la presión arterial disminuye por debajo de los valores iniciales durante la prueba de esfuerzo [IIa/C].
El tratamiento invasivo también se debe considerar en los pacientes asintomáticos, con FE normal y sin ninguna de las anomalías mencionadas más arriba en la prueba de esfuerzo, siempre y cuando el riesgo de la operación sea bajo y se presente uno de los siguientes síntomas:
1) EA muy grave, definida como velocidad transvalvular máxima (Vmáx) >5,5 m/s
2) calcificación valvular grave o aumento de Vmáx a un ritmo de ≥0,3 m/s/año
3) concentración muy elevada de PNB (>3 mayor que el resultado normal para la edad y el sexo del paciente; confirmada en varias mediciones) que no se pueda atribuir a otros factores
4) HP grave (PAP sistólica en reposo >60 mm Hg confirmada por una medición invasiva) sin otra explicación [IIa/C].
En los pacientes sometidos a una cirugía en la aorta ascendente o en otra válvula sin derivación coronaria (CABG):
1) la cirugía de EA está recomendada si la EA no es grave [I/C]
2) se debe considerar el reemplazo de la válvula si la EA es moderada [IIa/C].
Estenosis aórtica supravalvular
En los pacientes con síntomas de valvulopatía (espontáneos o inducidos por la prueba de esfuerzo) y un gradiente medio por Doppler ≥40 mm Hg, se recomienda el tratamiento quirúrgico [I/C].
En los pacientes con gradiente medio por Doppler <40 mm Hg, se recomienda la cirugía si presentan ≥1 de las siguientes manifestaciones [I/C]:
1) síntomas que pueden atribuirse a estenosis (disnea de esfuerzo, angina, síncopes)
2) disfunción sistólica del ventrículo izquierdo (FEVI <50 % sin otra explicación)
3) se requiere cirugía de una EC significativa o una valvulopatía [I/C].
En los pacientes asintomáticos con un gradiente medio por Doppler ≥40 mm Hg, con disfunción sistólica del ventrículo izquierdo, hipertrofia ventricular izquierda o resultados anómalos en la prueba de esfuerzo, se puede considerar el tratamiento quirúrgico si el riesgo asociado a la operación es bajo [IIb/C].
Conviene recordar que la medición del gradiente por Doppler puede sobrestimar la estenosis y precisar de confirmación mediante cateterismo cardíaco.
Estenosis aórtica subvalvular
En los pacientes con síntomas de valvulopatía (espontáneos o inducidos por la prueba de esfuerzo), un gradiente medio por Doppler ≥40 mm Hg e insuficiencia aórtica grave se recomienda el tratamiento quirúrgico [I/C].
En los pacientes asintomáticos, se debe considerar la operación si presentan ≥1 de los siguientes factores:
1) gradiente medio <40 mm Hg, pero FEVI <50 %
2) insuficiencia aórtica grave y DTDVI >50 mm (o 25 mm/m2 y/o FE <50 %)
3) gradiente medio por Doppler ≥40 mm Hg e hipertrofia clara del ventrículo izquierdo
4) gradiente medio por Doppler ≥40 mm Hg y disminución de la presión arterial por debajo del valor inicial durante la prueba de esfuerzo [IIa/C].
La operación se puede considerar en los enfermos asintomáticos si presentan ≥1 de los siguientes factores:
1) gradiente medio por Doppler ≥40 mm Hg, ventrículo izquierdo normal (FE >50 % y sin hipertrofia), resultado normal en la prueba de esfuerzo y bajo riesgo asociado a la cirugía
2) se ha documentado una progresión de la insuficiencia aórtica y la valvulopatía deja de ser leve (para evitar que siga progresando) [IIb/C].
Coartación y recoartación aórtica
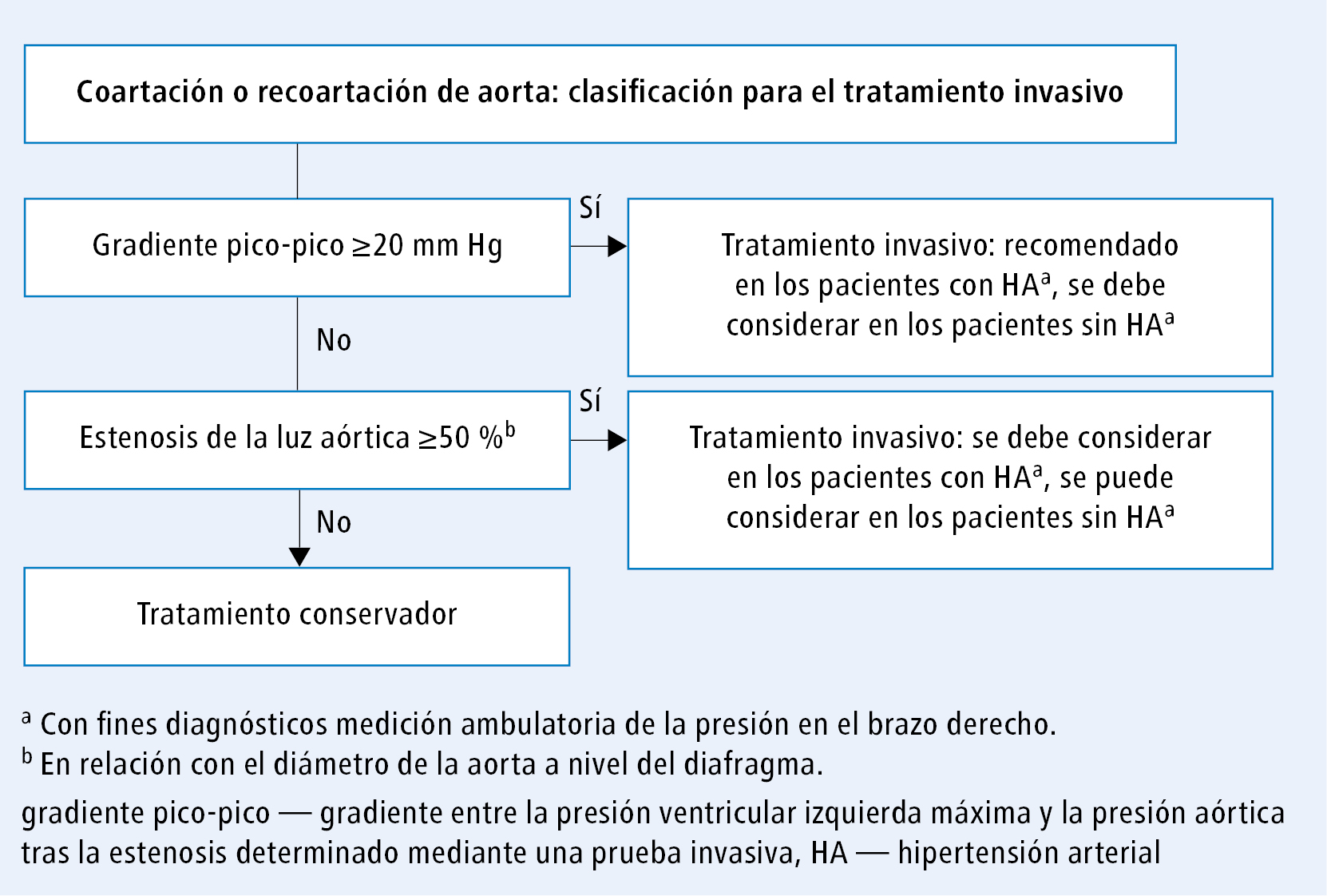
La figura 5 presenta el protocolo para determinar la aptitud para el tratamiento invasivo de los pacientes con coartación o recoartación aórtica.
Fig. 5. Algoritmo de toma de decisiones sobre el tratamiento invasivo de la coartación o recoartación aórtica (a partir de las guías de la ESC 2020, modificado)El tratamiento quirúrgico o percutáneo de la coartación o recoartación aórtica está indicado en los pacientes con hipertensión arterial (al diagnosticar la hipertensión, se debe considerar un control ambulatorio de la presión arterial en el brazo derecho) y un gradiente de presión entre los miembros inferiores y superiores elevado, medido en una prueba no invasiva y confirmado por una medición invasiva (diferencia entre la presión pico en el ventrículo izquierdo y la presión en la aorta con estenosis [gradiente pico-pico] ≥20 mm Hg). Siempre que sea técnicamente posible, se prefiere el tratamiento percutáneo (implante de stent) [I/C].
Siempre y cuando sea técnicamente posible, el tratamiento percutáneo (implante de stent) se debe considerar en los pacientes:
1) con hipertensión arterial y estenosis del istmo aórtico ≥50 % en relación con el diámetro de la aorta en su paso a través del diafragma, aunque el gradiente pico-pico medido en la prueba invasiva sea <20 mm Hg [IIa/C]
2) con hipertensión arterial normal y gradiente de presión elevado, medido en una prueba no invasiva y confirmado por una medición invasiva (gradiente pico-pico ≥20 mm Hg) [IIa/C].
Además, se puede considerar en los pacientes con presión arterial normal y estenosis ístmica ≥50 % en relación con el diámetro de la aorta al nivel del diafragma, aunque el gradiente pico-pico medido en la prueba invasiva sea <20 mm Hg [IIb/C].
 Español
Español
 English
English
 українська
українська