Manejo y seguimiento posoperatorios
Después del procedimiento, se puede aplicar una compresa fría para reducir la hemorragia local y minimizar el daño térmico de la piel. Poco después de la intervención, hay que realizar una ecografía para comprobar que no se hayan producido complicaciones tempranas (hematoma, daño de la cápsula) y controlar el estado de la piel buscando quemaduras residuales. El foco sometido a la ablación suele verse como una lesión de ecogenicidad reducida y heterogénea, con numerosas áreas pequeñas de hiperecogenicidad que se forman como resultado de la evaporación del tejido (fig.). En el Doppler color, el área de ablación aparece desprovista de vasos. La ecografía con contraste permite visualizar mejor la desaparición de señal de los vasos pequeños, así como la perfusión en las zonas periféricas del nódulo en las que la ablación no ha sido suficiente. Después del procedimiento, se puede administrar un antinflamatorio no esteroideo parenteral (p. ej. ketoprofeno 100 mg), y a continuación paracetamol oral (p. ej. 1000 mg 2 × d en las 24 h siguientes a la intervención). Hay que informar al paciente de que acuda al médico si en la semana posterior a la intervención sufre dolores fuertes en la zona del cuello, edema o fiebre. En las consultas de control —después de 3, 6 y 12 meses— se debe llevar a cabo un análisis clínico y bioquímico de la función tiroidea, y una ecografía para controlar la eficacia de la intervención (el grado de reducción del volumen de la lesión). En la mayoría de pacientes, el tamaño del nódulo ya se ha reducido al mínimo en este período. Los siguientes controles se recomiendan cada 1-2 años; en caso de nódulo simple, por lo menos deben incluir un control ecográfico, y en caso de nódulo hiperactivo, se debe añadir de forma rutinaria una determinación de TSH en suero. Debido al riesgo de rebrote de la lesión, que se estima en 5-24 % a los 3 años, se recomienda la observación a largo plazo. El rebrote se define como un aumento del volumen de la lesión de más del 50 % en comparación con el menor tamaño registrado del foco después de la intervención. Los factores de riesgo de rebrote son: lesión de gran tamaño, presencia de NTA, poca energía suministrada y ablación incompleta de las zonas periféricas de la lesión. Por lo tanto, si se detecta de forma temprana un rebrote de la lesión en las zonas periféricas, el paciente debe someterse a otra TA. Antes de la intervención, se debe considerar repetir la biopsia, ya que este potencial de rebrote puede apuntar a una lesión maligna que se haya pasado por alto. En función del resultado, se decidirá repetir la TA o llevar a cabo una intervención quirúrgica. Los médicos encargados de las pruebas de control deben ser conscientes de los cambios que induce la TA anterior en la imagen ecográfica (reducción de la ecogenicidad de la lesión, aparición de calcificaciones) para no preocupar al paciente de forma innecesaria durante la ecografía de control. No hay ningún indicio de que la TA pueda estimular la formación de neoplasias de tiroides.
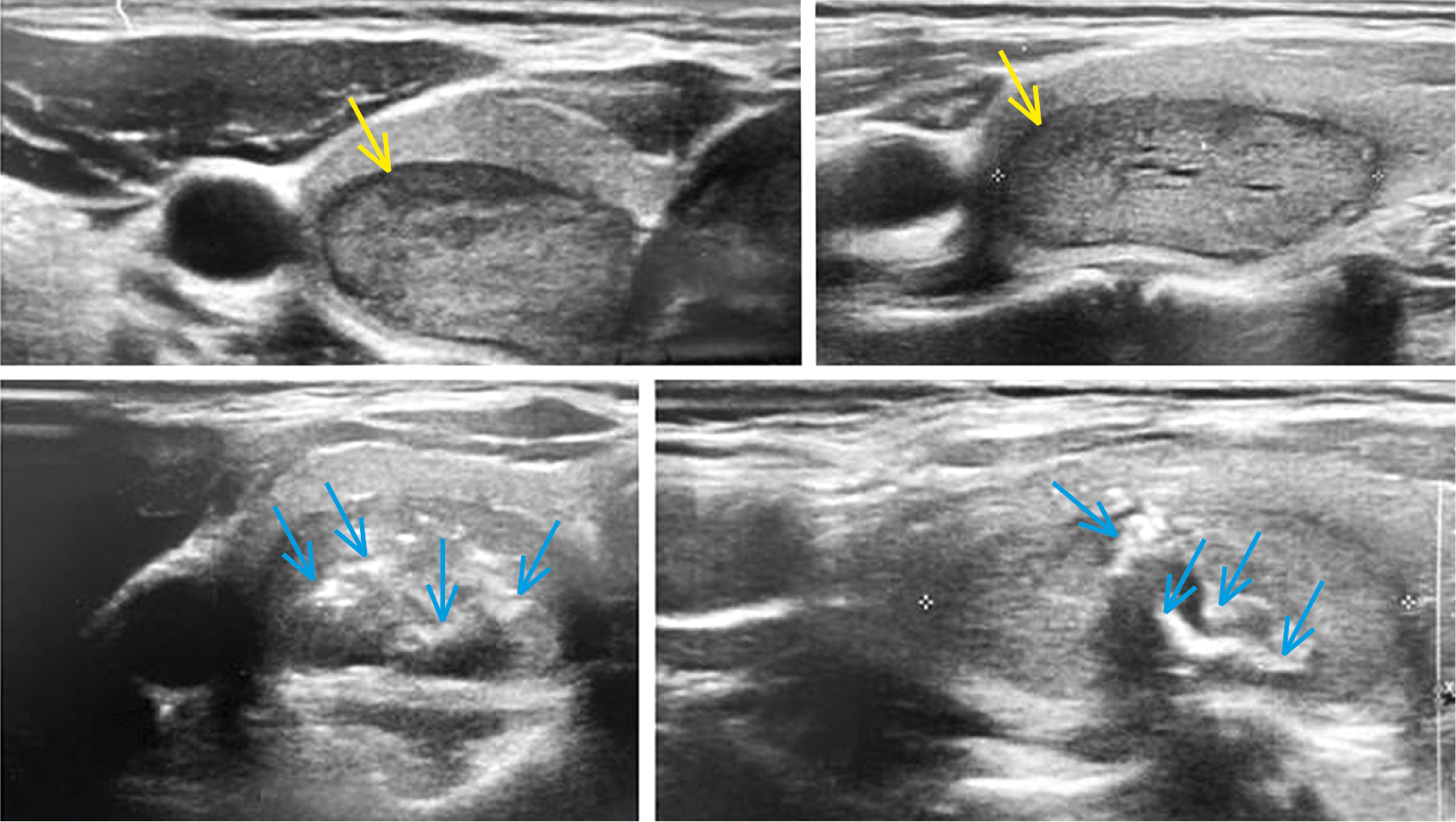
Fig. El panel superior presenta una lesión en el lóbulo derecho de la tiroides (en proyecciones transversal y longitudinal: flechas amarillas) sometida a termoablación con láser. El panel inferior muestra una ecografía de control de la tiroides 4 semanas después de la intervención. Las lesiones regresivas hiperecogénicas (flechas azules) son típicas de la ablación del tejido. En una observación de 12 meses, se registró una reducción del 60 % del volumen de la lesión gracias al tratamiento.
Bibliografía:
1. Russ G., Bonnema S.J., Erdogan M.F. y cols., European Thyroid Association guidelines for ultrasound malignancy risk stratification of thyroid nodules in adults: the EU-TIRADS, Eur. Thyroid. J., 2017; 6: 225-2372. Papini E., Monpeyssen H., Frasoldati A., Hegedüs L., 2020 European Thyroid Association clinical practice guideline for the use of image-guided ablation in benign thyroid nodules, Eur. Thyroid J., 2020; 9: 172-185
3. Dietrich C.F., Müller T., Bojunga J. y cols., Statement and recommendations on interventional ultrasound as a thyroid diagnostic and treatment procedure, Ultrasound. Med. Biol., 2018; 44: 14-36
4. Kim J.H., Baek J.H., Lim H.K. y cols., Guideline Committee for the Korean Society of Thyroid Radiology (KSThR) and Korean Society of Radiology. 2017 thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology, Korean J. Radiol., 2018; 19: 632-655
5. Papini E., Pacella C.M., Solbiati L.A. y cols., Minimally-invasive treatments for benign thyroid nodules: a Delphi-based consensus statement from the Italian minimally-invasive treatments of the thyroid (MITT) group, Int. J. Hyperthermia, 2019; 36: 376-382
6. Mauri G., Pacella C.M., Papini E. y cols., Image-guided thyroid ablation: proposal for standardization of terminology and reporting criteria, Thyroid, 2019; 29: 611-618
7. Wu W., Gong X., Zhou Q. y cols., US-guided percutaneous microwave ablation for the treatment of benign thyroid nodules, Endocr. J., 2017; 64: 1079-1085
8. Wang B., Han Z.Y., Yu J. y cols., Factors related to recurrence of the benign non-functioning thyroid nodules after percutaneous microwave ablation, Int. J. Hyperthermia, 2017; 33: 459-464
9. Trimboli P., Castellana M., Sconfienza L.M. y cols., Efficacy of thermal ablation in benign non-functioning solid thyroid nodule: A systematic review and meta-analysis, Endocrine, 2020; 67: 35-43
10. Chen F., Tian G., Kong D. y cols., Radiofrequency ablation for treatment of benign thyroid nodules: a PRISMA-compliant systematic review and meta-analysis of outcomes, Medicine (Baltimore), 2016; 95: e4659
11. Deandrea M., Trimboli P., Garino F. y cols., Long term efficacy of a single session RFA of benign thyroid nodules: a longitudinal 5-year observational, J. Clin. Endocrinol. Metab., 2019; 104: 3751-3756
12. Deandrea M., Garino F., Alberto M. y cols., Radiofrequency ablation for benign thyroid nodules according to different ultrasound features: an Italian multicentre prospective study, Eur. J. Endocrinol., 2019; 180: 79-87
13. Guang Y., He W., Luo Y. y cols., Patient satisfaction of radiofrequency ablation for symptomatic benign solid thyroid nodules: our experience for 2-year follow up, BMC Cancer, 2019; 19: 147
14. Zheng B.W., Wang J.F., Ju J.X. y cols., Efficacy and safety of cooled and uncooled microwave ablation for the treatment of benign thyroid nodules: a systematic review and meta-analysis, Endocrine, 2018; 62: 307-317
15. Trimboli P., Pelloni F., Bini F. y cols., High-intensity focused ultrasound (HIFU) for benign thyroid nodules: 2-year follow-up results, Endocrine, 2019; 65: 312-317
16. Lang B.H., Woo Y.C., Chiu K.W., Two-year efficacy of single-session high-intensity focused ultrasound (HIFU) ablation of benign thyroid nodules, Eur. Radiol., 2019; 29: 93-101
17. Negro R., Greco G., Quality of life and outcomes in patients with a large toxic adenoma undergoing laser ablation plus radioiodine vs lobectomy, Int. J. Hyperthermia, 2019; 36: 191-195
18. Ha E.J., Baek J.H., Kim K.W. y cols., Comparative efficacy of radiofrequency and laser ablation for the treatment of benign thyroid nodules: systematic review including traditional pooling and bayesian network meta-analysis, J. Clin. Endocrinol. Metab., 2015; 100: 1903-1911
19. Chung S.R., Suh C.H., Baek J.H. y cols., Safety of radiofrequency ablation of benign thyroid nodules and recurrent thyroid cancers: a systematic review and metaanalysis, Int. J. Hyperthermia, 2017; 33: 920-930
Volver al artículo principal: Guías: termoablación de nódulos tiroideos benignos
 Español
Español
 English
English
 українська
українська