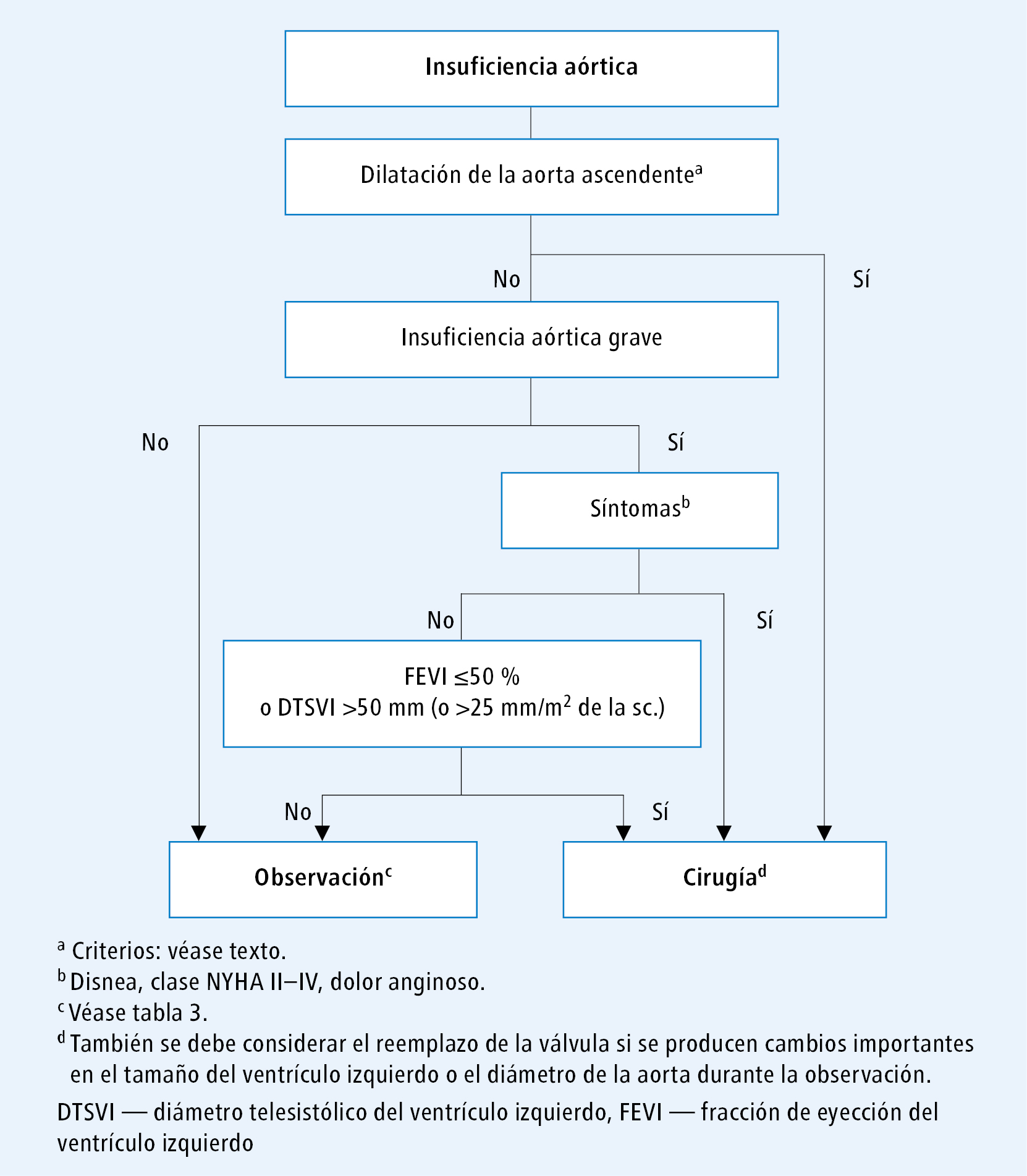
Indicaciones para la cirugía en el aneurisma de la raíz o la parte distal de la aorta ascendente (independientemente de la gravedad de la insuficiencia)
Antes de tomar la decisión de operar, es necesario confirmar las dimensiones de la aorta obtenidas en la ecocardiografía mediante una TC cardíaca con sincronización ECG.
Se recomienda:
1) reemplazar la raíz aórtica conservando la válvula en los pacientes jóvenes con dilatación de la raíz aórtica, siempre y cuando la intervención se lleve a cabo en un centro especializado y se prevea que los efectos de la cirugía serán duraderos [I/B]
2) operar la aorta ascendente en los pacientes con síndrome de Marfan y enfermedad de la raíz aórtica con un diámetro máximo de la aorta ascendente ≥50 mm [I/C].
Se debe considerar la cirugía de la aorta ascendente en los pacientes con enfermedad de la raíz aórtica con un diámetro máximo de la aorta ascendente [IIa/C]:
1) ≥55 mm en todos los pacientes
2) ≥50 mm en caso de válvula bicúspide y factores de riesgo adicionales (antecedentes familiares de disección aórtica o antecedentes personales de disección espontánea de la pared vascular, IA grave o insuficiencia mitral grave, planificación de embarazo, hipertensión arterial descontrolada y/o aumento del diámetro de la aorta >3 mm/año [observado mediante una serie de ecocardiografías o RMN cardíacas con medición de la aorta en el mismo nivel, confirmado mediante TC cardíaca con sincronización ECG]) o coartación aórtica
3) ≥45 mm en caso de síndrome de Marfan y factores de riesgo adicionales (véanse más arriba) o en los pacientes con mutación de TGFBR1 o TGFBR2 (incluido el síndrome de Loeys-Dietz); se puede usar un valor de corte menor (40 mm) en las mujeres con baja superficie corporal, así como en los pacientes con mutación de TGFBR2 o con síntomas extraaórticos graves.
En caso de indicaciones primarias para la cirugía de la válvula aórtica, se debe considerar el reemplazo de la raíz o la parte distal de la aorta ascendente si su diámetro es ≥45 mm, teniendo en cuenta la edad, la superficie corporal, la etiología de la valvulopatía, la presencia de válvula aórtica bicúspide, y la forma y el grosor de la pared de la aorta ascendente en el análisis intraoperatorio [IIa/C].
Tratamiento conservador
El tratamiento farmacológico, sobre todo el uso de inhibidores de la enzima convertidora de angiotensina (IECA) y calcioantagonistas pertenecientes al grupo de los derivados de la dihidropiridina, puede reducir la intensidad de los síntomas en los pacientes con IA crónica grave en los que no sea posible operar. En los pacientes asintomáticos, no se recomienda usar estos fármacos para postergar la cirugía. En los pacientes con insuficiencia cardíaca persistente tras la cirugía o hipertensión arterial, el uso de IECA, antagonista de los receptores de la angiotensina II (ARA-II) o β-bloqueantes es beneficioso.
En los pacientes con síndrome de Marfan, el tratamiento básico consiste en administrar β-bloqueantes, que pueden retrasar el proceso de dilatación de la raíz aórtica; el uso de estos fármacos se debe considerar tanto antes, como después de la cirugía. En caso de intolerancia a los β-bloqueantes, se puede considerar el uso de ARA-II. Los β-bloqueantes o los BRA también se usan en los pacientes con válvula aórtica bicúspide en caso de que presenten dilatación de la raíz aórtica y/o de la parte distal de la aorta ascendente, aunque este manejo no está respaldado por datos científicos adecuados.
Actividad física
No hay datos científicos sobre los que se puedan basar recomendaciones en cuanto al nivel de actividad física y deportiva permitida en los pacientes con dilatación de la aorta. Se recomienda evitar especialmente el ejercicio isométrico. Este enfoque está totalmente justificado en las enfermedades del tejido conectivo.
Seguimiento
La tabla 3 presenta las normas del seguimiento de los pacientes con IA.En caso de dilatación de la aorta ascendente >40 mm, se recomienda realizar una TC o una RMN cardíaca. El ecocardiograma y la RMN cardíaca sirven para controlar el diámetro de la aorta. Cada aumento de diámetro de la aorta >3 mm observado en un ecocardiograma se debe verificar mediante una TC/RMN cardíaca y comparar con los datos iniciales.
Tamizaje de familiares
Teniendo en cuenta del riesgo familiar de aneurismas de aorta torácica en caso de presentarse enfermedades del tejido conectivo, se recomienda realizar pruebas de tamizaje en los familiares de 1.er grado, así como las pruebas de imagen y los estudios genéticos correspondientes.
Asimismo, es razonable realizar ecocardiografías de tamizaje en los familiares de 1.er grado de los pacientes con válvula aórtica bicúspide.
| Tabla 2. Criterios ecocardiográficos de las insuficiencias valvulares graves | ||||
|---|---|---|---|---|
| Parámetro | ||||
| aórtica | mitral | tricúspide | ||
| Criterios de calidad | ||||
| Morfología de la válvula | Anómala / prolapso de velo / defecto grande de coaptación | Primaria: prolapso de velo, ruptura del músculo papilar, estiramiento considerable de los velos valvulares, perforación grande Secundaria: velos normales pero con estiramiento considerable, coaptación de velos insuficiente |
Anómala / prolapso de velo | |
| Chorro de regurgitación en el Doppler color | Grande en caso de regurgitación central, de anchura variable en caso de regurgitaciones excéntricasa | Chorro central grande (>50 % de la aurícula izquierda) o chorro excéntrico de distinto tamaño que contacta con la pared auricular | Chorro central muy grande o chorro excéntrico que contacta con la pared auriculara | |
| Espectro de regurgitación en el Doppler de onda continua | Muy saturado | Holosistólico / muy saturado / forma triangular | Muy saturado / forma triangular con alcance temprano del pico de velocidad | |
| Otros | Flujo retrógrado holodiastólico en la aorta descendente (VTD >20 cm/s) | Zona amplia de convergencia de flujo durante toda la sístole | - | |
| Criterios semicuantitativos | ||||
| Vena contracta (mm) | >6 | ≥7 (≥8 en caso de transductor biplanar) | >7a,b | |
| Flujo venoso | - | Inversión de flujo sistólico en venas pulmonares | Inversión de flujo sistólico en venas hepáticas | |
| Flujo de entrada | - | Onda E dominante >1,2 m/s | Onda E dominante ≥1 m/sc | |
| Otros | Tiempo medio de presión <200 msd | IVT mitral / IVT aórtica >1,4 | Radio PISA >9 mme | |
| Criterios cuantitativos | ||||
| Insuficiencia primaria | Insuficiencia secundaria | |||
| ORE (mm2) | ≥30 | ≥40 | ≥40 (puede ser ≥30 en caso de orificio regurgitante elíptico) | ≥40 |
| RVol (ml/atido) | ≥60 | ≥60 | ≥60 (puede ser ≥45 en condiciones de flujo bajo) | ≥45 |
| Fracción de regurgitación (%) | ≥50% | ≥50% | ||
| Agrandamiento de las cavidades cardíacas y vasodilatación | Ventrículo izquierdo | Ventrículo izquierdo (DTSVI) y aurícula izquierda (diámetro ≥55 mm o volumen ≥60 ml/m2) | Ventrículo izquierdo y aurícula izquierda | Ventrículo derecho, aurícula derecha, vena cava inferior |
| a A un límite de Nyquist de 50-60 cm/s. b Preferentemente transductor biplanar. c En ausencia de otras causas para la presión elevada en la aurícula derecha. d El tiempo medio de presión disminuye cuando incrementa la presión diastólica ventricular izquierda, en los enfermos que reciben vasodilatadores y en los con aorta dilatada y distensible; y aumenta en caso de insuficiencia aórtica crónica. e Cambio de 28 cm/s del límite de Nyquist basal. DTSVI — diámetro telesistólico del ventrículo izquierdo, IVT — integral de velocidad-tiempo, ORE — orificio regurgitante efectivo, PISA — área proximal de superficie de isovelocidad, RVol — volumen de regurgitación, VTD — velocidad telediastólica | ||||
| Tabla 3. Seguimiento de la insuficiencia aórtica en los pacientes asintomáticos | ||
|---|---|---|
| Grado de insuficiencia | Función ventricular izquierda | Frecuencia del controlb |
| Leve o moderada | FEVI y diámetros del ventrículo izquierdo normales | Cada año, ETE cada 2 años |
| Grave | FEVI y dimensiones del ventrículo izquierdo normales | Cada añoa |
| La FEVI y/o las dimensiones del ventrículo izquierdo han disminuido significativamente o se acercan a los valores de corte (para la cirugía) | Cada 3-6 mesesb | |
| DTDVI >65 mm o aumento progresivo de las dimensiones del ventrículo izquierdo o disminución de la FEVI | Por lo menos cada 3-6 mesesc | |
| a Primera prueba de control 3-6 meses después del diagnóstico. b En los casos dudosos, puede ser útil determinar la concentración del péptido natriurético tipo B (BNP), ya que su aumento durante el seguimiento puede estar asociado a un empeoramiento de la función ventricular izquierda. c Se debe considerar el tratamiento quirúrgico. DTDVI — diámetro telediastólico del ventrículo izquierdo, ETE — ecocardiografía transesofágica, FEVI — fracción de eyección del ventrículo izquierdo | ||
Bibliografía:
1. Hahn R.T., Zamorano J.L., The need for a new tricuspid regurgitation grading scheme. Eur.Heart J. Cardiovasc. Imaging , 2017; 18: 1342–13432. Coats A.J.S., Anker S.D., Baumbach A. y cols., The management of secondary mitralregurgitation in patients with heart failure: a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur. Heart J., 2021; 42: 1254–1269
3. Musumeci G., Colopi M., Coronary arterial disease in patients undergoing percutaneous edge-to-edge mitral valve repair: handle with care, Catheter Cardiovasc. Interv., 2021; 97: 925–926
4. Mohamed M.M.G., Faisaluddin M., Kheiri B., Osman M., Meta-analysis of surgical left atrial appendage occlusion during cardiac surgery, Am. J. Cardiol., 2021; 155: 150–151
5. Otto C.M., Alignment and divergence in European and North American aortic stenosis guidelines, EuroIntervention, 2022, 17: e1123–e1125
6. Magro P.L., Sousa-Uva M., In low-risk patients aged >70–75 with severe aortic stenosis,is transcatheter superior to surgical aortic valve replacement in terms of reported cardiovascular composite outcomes and survival? Interact. Cardiovasc. Thorac. Surg., 2022; 34: 40–44
7. Yerasi C., Rogers T., Forrestal B.J. y cols., Transcatheter versus surgical aortic valve replacement in young, low-risk patients with severe aortic stenosis. JACC Cardiovasc.Interv., 2021; 14: 1169–1180
8. Banovic M., Putnik S., Penicka M. y cols., Aortic Valve replAcemenT versus conservative treatment in Asymptomatic seveRe aortic stenosis: the AVATAR trial, Circulation, 2021; doi:10.1161/CIRCULATIONAHA.121.057 639
9. Kang D.H., Park S.J., Lee S.A. y cols., Early surgery or conservative care for asymptomatic aortic stenosis, N. Engl. J. Med., 2020, 382:111–119
 Español
Español
 English
English
 українська
українська