La presencia de anticuerpos contra las células parietales del estómago y el factor interno confirma la etiología autoinmune de la gastritis atrófica, y la detección de Helicobacter pylori en el estómago indica la atrofia de la mucosa en el curso de la infección por esta bacteria.
En caso de sospechar MEN1, se deben determinar también los niveles séricos de calcio (ionizado o total), parathormona, prolactina y factor de crecimiento insulinoide tipo 1 (IGF-1), y además es necesario valorar los estudios moleculares para detectar la mutación en el gen MEN1 que codifica la menina. En el caso descrito, basándose en los estudios realizados, se determinó el diagnóstico de la NEN de estómago de tipo 1, a pesar de que el cuadro clínico no fuera plenamente típico de este tipo de NEN: la lesión en el estómago fue aislada, de grado histológico G2 (NET G2). No obstante, otras características fueron típicas del tipo 1, tales como gastritis atrófica autoinmune (presencia de anticuerpos contra las células parietales y FI) y niveles elevados de gastrina. Debido a su grado, se decidió extirpar la lesión a pesar de su pequeño tamaño (<10 mm).
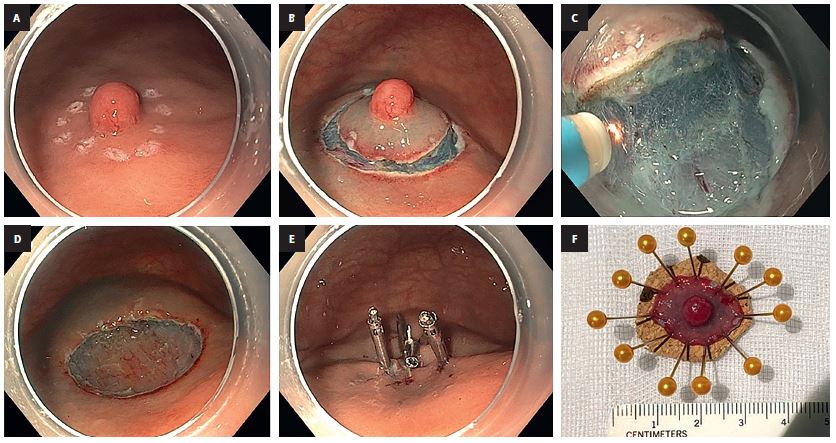
En caso de NEN de estómago <20 mm, en primer lugar se debe valorar el tratamiento endoscópico con una técnica que permita eliminar la lesión de la membrana submucosa, p. ej. la disección endoscópica de la submucosa (DESM; la respuesta C es correcta). La DESM consiste en cortar las capas profundas de la membrana submucosa hasta la capa muscular con un cuchillo diatérmico, bajo control visual. Se debe agregar que en la polipectomía estándar, en la cual la lesión es extirpada con un asa diatérmica y sin elevación con una solución (inyección), a menudo la extirpación no es completa (margen positivo en la profundidad), por lo que no es el método adecuado para la eliminación de las NEN (la respuesta B no es correcta). El tratamiento con análogos de somatostatina, a su vez, es utilizado en las NEN no resecables o metastásicas (la respuesta E no es correcta).
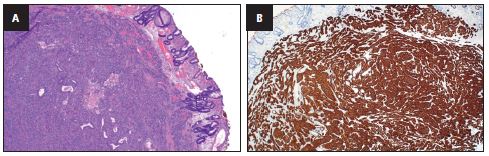
La lesión fue eliminada por completo mediante la DESM (fig. 2). El estudio histológico del preparado confirmó la presencia de una lesión proliferativa en la mucosa y submucosa gástrica, y la evaluación de la expresión de sinaptofisina y CgA confirmó su carácter neuroendocrino (fig. 3). El marcador de proliferación Ki-67 fue evaluado en un 3-4 %, lo que se corresponde con el grado histológico G2. La lesión fue resecada totalmente y no se observó la presencia de angioinvasión ni invasión linfovascular (LVI). Diagnóstico final: NEN de estómago G2, pT1N0M0, R0, LVI (–).
El posoperatorio fue sin complicaciones.
La vigilancia después de la extirpación endoscópica de la NEN de estómago debe consistir en una endoscopia cada 1-2 años, con una toma de muestras de las potenciales lesiones nuevas y de la mucosa gástrica (idealmente por separado del antro y del cuerpo gástrico). Se debe tener en cuenta que debido a la gastritis atrófica autoinmune es necesario monitorizar los niveles séricos de vitamina B12 y el hemograma.
| Tabla 1. Clasificación de las neoplasias neuroendocrinas de estómago | |||
|---|---|---|---|
| Tipo 1: asociado a la hipergastrinemia debida a la gastritis atrófica autoinmune | Tipo 2: asociado a la hipergastrinemia debida al síndrome de Zollinger-Ellison o MEN1 | Tipo 3: esporádico | |
| Prevalencia | 70-80 % | 5-10 % | 15-20 % |
| Morfología | Lesiones polipomatosas, en general pequeñas (<1-2 cm) y múltiples | Lesiones polipomatosas, en general pequeñas (<1-2 cm) y múltiples | Tumor aislado y grande (>2 cm) |
| Mucosa gástrica circundante | Gastritis atrófica / metaplasia intestinal | Como en el tipo 1, pero a menudo pliegues engrosados y lesiones inflamatorias avanzadas (úlceras) en caso del síndrome de Zollinger-Ellison | Inalteradas |
| Grado |
En general G1 Raramente G2 |
En general G1 Raramente G2 |
En general G3, más raramente NEC |
| Nivel sérico de gastrina | Elevado | Elevado | Normal |
| pH gástrico | Elevado | Reducido | Normal |
| Enfermedades concomitantes | Gastritis atrófica autoinmune, otras enfermedades autoinmunes | Síndrome de Zollinger-Ellison o MEN1 | No hay |
| Riesgo de metástasis | 3-7 % | 10-30 % | 70 % |
| Pronóstico (supervivencia a los 5 años) | Muy bueno (aprox. 100 %) | Medianamente bueno, depende de la presencia de otras neoplasias en caso de MEN1 (60-90 %) | Malo (<50 %) |
|
CNE — cáncer neuroendocrino, MEN1 — neoplasia endocrina múltiple tipo 1 A partir de las publicaciones 1 y 2 de la bibliografía | |||
| Tabla 2. Clasificación de las neoplasias neuroendocrinas según la OMS 2019: versión simplificada | ||||
|---|---|---|---|---|
|
Tipo de NEN según la OMS 2019, 5.a edición |
Grado de diferenciación |
Grado histológico (G) |
Marcador de proliferación Ki-67 |
Recuento mitótico / 10 HPF |
| NET G1 | Bien diferenciado | G1 | <3 % | <2 |
| NET G2 | Bien diferenciado | G2 | 3-20 % | 2-20 |
| NET G3 | Bien diferenciado | G3 | >20 % | >20 |
| NEC | Pobremente diferenciado | No se recomienda determinar el rasgo G | >20 % | >20 |
|
HPF — campo de gran aumento, NEC — cáncer neuroendocrino, NEN — neoplasia neuroendocrina A partir de la publicación 2 de la bibliografía | ||||
Bibliografía:
- Deprez P.H., Moons L.M.G., O’Toole D. y cols., Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastrointestinal Endoscopy (ESGE) Guideline, Endoscopy, 2022; 54: 412-429
- Nagtegaal I.D., Odze R.D., Klimstra D. y cols., WHO Classification of Tumours Editorial Board. The 2019 WHO classification of tumours of the digestive system, Histopathology, 2020; 76: 182-188
- Rydzewska G., Strzelczyk J., Bednarczuk T. y cols., Gastroduodenal neuroendocrine neoplasms including gastrinoma – update of the diagnostic and therapeutic guidelines (recommended by the Polish Network of Neuroendocrine Tumours), Endokrynol. Pol., 2022; 73: 455-490
- Kos-Kudła B., Foltyn W., Malczewska A. y cols., Update of the diagnostic and therapeutic guidelines for gastro-entero-pancreatic neuroendocrine neoplasms (recommended by the Polish Network of Neuroendocrine Tumours), Endokrynol. Pol., 2022; 73; 387-454
- Exarchou K., Howes N., Pritchard D.M., Systematic review: management of localised low-grade upper gastrointestinal neuroendocrine tumors, Aliment. Pharmacol. Ther., 2020; 51: 1247-1267
- Dasari A., Shen C., Halperin D. y cols., Trends in the incidence, prevalence, and survival outcomes in patients with neuroendocrine tumors in the United States, JAMA Oncol., 2017; 3: 1335-1342
- Wiedenmann B., Franke W.W., Kuhn C. y cols., Synaptophysin: a marker protein for neuroendocrine cells and neoplasms, Proc. Natl. Acad. Sci. USA, 1986; 83: 3500-3504
- Fuksiewicz M., Kowalska M., Kolasińska-Ćwikła A. y cols., Prognostic value of chromogranin A in patients with GET/NEN in the pancreas and the small intestine, Endocr. Connect., 2018; 7: 803-810
- Klimstra D.S., Modlin I.R., Coppola D. y cols., The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems, Pancreas, 2010; 39: 707-712
- Basturk O., Yang Z., Tang L.H. y cols., The high-grade (WHO G3) pancreatic neuroendocrine tumor category is morphologically and biologically heterogenous and includes both well differentiated and poorly differentiated neoplasms, Am. J. Surg. Pathol., 2015; 39: 683-690
 Español
Español
 English
English
 українська
українська