Anticoagulantes orales directos
- Se sugiere que los enfermos durante la preparación para las intervenciones endoscópicas con bajo riesgo de sangrado no reciban la dosis matutina de ACOD el día de la intervención, independientemente de si reciben el fármaco 1 o 2 veces al día [D/B].
- Se sugiere que los enfermos durante la preparación para las intervenciones endoscópicas con alto riesgo de sangrado reciban la última dosis de ACOD 3 días antes del procedimiento [F/B], y los enfermos con aclaramiento de creatinina (CrCl) de 30‑50 ml/min que reciben dabigatrán, 5 días antes de la intervención [F/B]
(nota del consultor: de acuerdo con las guías de la ESC, si CrCl en un enfermo que recibe dabigatrán es de 50‑79 ml/min, la última dosis del fármaco debe recibirse 4 días antes de la intervención, y 5 días antes de la intervención en caso de CrCl de 30‑49 ml/min). - Es necesario consultar con un hematólogo todos los casos con empeoramiento rápido de la función renal [F/B].
En los enfermos que reciben ACOD no es necesario monitorizar de rutina el efecto anticoagulante, y el INR y TTPa son indicadores poco fidedignos del efecto anticoagulante de ACOD. A diferencia de warfarina, los fármacos de este grupo se caracterizan por su acción rápida: llegan a tener el efecto anticoagulante completo en las 3 horas desde la administración de la primera dosis. Los ACOD tienen una semivida relativamente corta, pero puede prolongarse (especialmente en caso de dabigatrán) en las personas con insuficiencia renal.
La seguridad de la discontinuación temporal de la terapia con ACOD fue confirmada por los resultados del estudio PAUSE, en el cual los enfermos que reciben dabigatrán, apixabán o rivaroxabán fueron sometidos a las intervenciones planificadas.19 Se les aplicó la pausa terapéutica estándar: la última dosis de ACOD fue administrada 2 días antes de las intervenciones de bajo riesgo de sangrado (incluida la endoscopia del tracto digestivo) y 3 días antes de las intervenciones de alto riesgo de sangrado (incluidas las terapéuticas, como la polipectomía), y el tratamiento fue restablecido después de 1 y 2‑3 días, respectivamente. En los enfermos con CrCl <50 ml/min que reciben dabigatrán, se prolongó la pausa hasta 5 días antes de una intervención de alto riesgo. En el estudio se observó una baja frecuencia tanto de sangrados graves, como de complicaciones tromboembólicas. El estudio también llevó a la conclusión de que es seguro discontinuar ACOD incluso 1 día antes de la endoscopia de bajo riesgo de sangrado, y no solo omitir la dosis matutina. La ESC mantiene esta posición en lo referente a las intervenciones que en sus guías se clasifican en el grupo de bajo riesgo de sangrado. En cuanto a la omisión de solo la dosis matutina de ACOD el día de la intervención, la recomiendan en caso de intervenciones de riesgo de sangrado muy bajo.5
En las personas sometidas a la terapia puente con heparina tras la discontinuación de ACOD, los sangrados graves fueron más frecuentes que en aquellas que no la recibieron: el porcentaje fue de, respectivamente, el 2,7 % y 0,5 % (p = 0,01) en el denominado registro de Dresde20 y del 6,5 % y 1,8 % (p <0,001) en el estudio RE‑LY21. Simultáneamente, no se observó la disminución de la frecuencia de eventos tromboembólicos en estos pacientes.
Los enfermos con antecedentes de ETV pertenecen al grupo de alto riesgo de recidiva trombótica en los 3 meses siguientes al evento tromboembólico, por lo que no deben discontinuar los anticoagulantes. En estos pacientes, las intervenciones de bajo riesgo de sangrado pueden realizarse sin interrumpir la terapia, y en caso de intervenciones de alto riesgo de sangrado puede resultar más beneficioso posponerlas y realizarlas >3 meses después del episodio de ETV. La mayoría de los enfermos anticoagulados después de un episodio de ETV recibe ACOD: en caso de discontinuarlos, la terapia puente no está indicada.
Desgraciadamente, es muy común que no se sigan las recomendaciones relativas a la modificación de tratamiento con ACOD en el período perioperatorio —incluso en la versión simplificada (que no toma en cuenta muchas variables mencionadas en las guías de la European Heart Rhythm Association de 202122), proporcionada en el documento comentado de la BSG y la ESGE— y a menudo se observa un error que consiste en discontinuar los ACOD e introducir la terapia puente con HBPM.
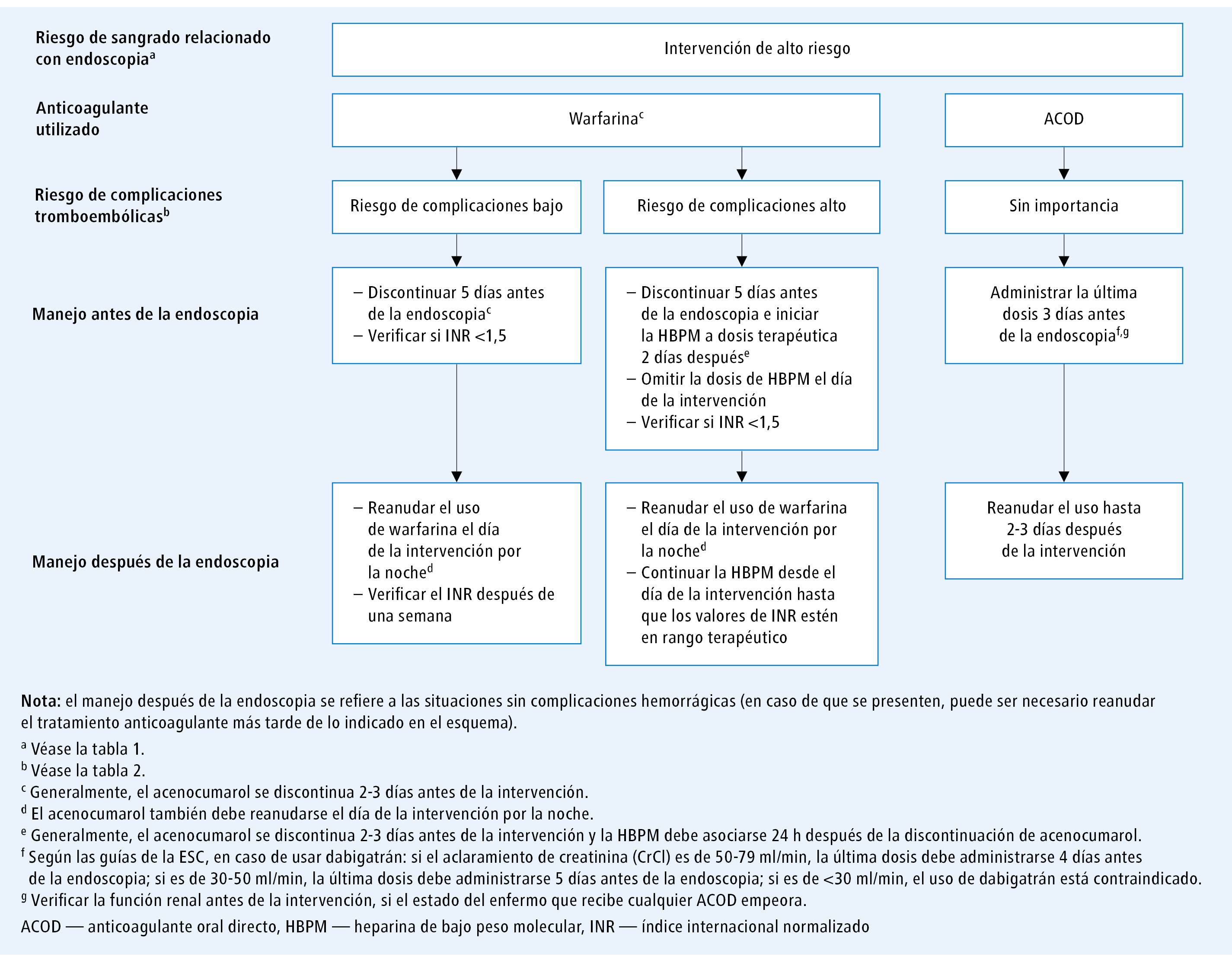
El algoritmo de manejo perioperatorio en función del riesgo de sangrado asociado a la intervención endoscópica y del tipo de tratamiento anticoagulante utilizado se presenta en las figuras 2 y 3.
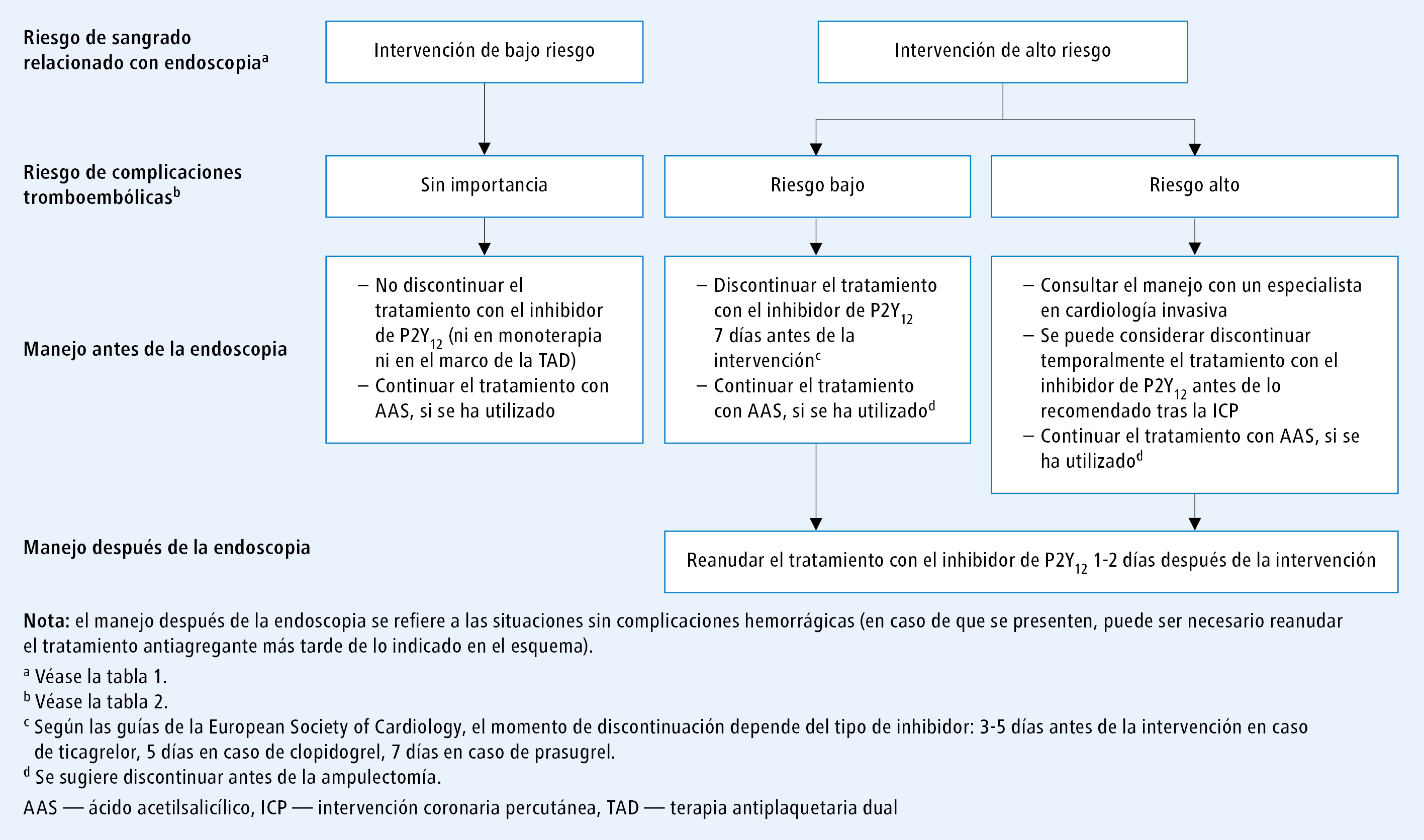
Fig. 1. Algoritmo de manejo durante el período posoperatorio en los pacientes que reciben antiagregantes
Fig. 2. Algoritmo de manejo en el período perioperatorio en los pacientes sometidos a intervenciones con bajo riesgo de sangrado y que reciben anticoagulantes orales
Fig. 3. Algoritmo de manejo en el período perioperatorio en los pacientes sometidos a intervenciones con alto riesgo de sangrado y que reciben anticoagulantes orales
Volver al artículo principal: Guías: endoscopia del tracto digestivo en los pacientes que reciben anticoagulantes
Parte siguiente: Guías: endoscopia del tracto digestivo en los pacientes que reciben anticoagulantes. Manejo perioperatorio según el tipo de endoscopia
Bibliografía:
- Veitch A.M., Radaelli F., Alikhan R. y cols., Endoscopy in patients on antiplatelet or anticoagulant therapy: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guideline update, Gut, 2021; 70: 1611‑1628
- Veitch A.M., Vanbiervliet G., Gershlick A.H. y cols., Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines, Gut, 2016; 65: 374‑389
- Abraham N.S., Barkun A.N., Sauer B.G. y cols., American College of Gastroenterology‑Canadian Association of Gastroenterology Clinical Practice Guideline: management of anticoagulants and antiplatelets during acute gastrointestinal bleeding and the periendoscopic period, Am. J. Gastroenterol., 2022; 117: 542‑558
- Douketis J.‑D., Spyropoulos A.C., Murad H. y cols., Perioperative management of antithrombotic therapy: An American College of Chest Physicians Clinical practice guideline, Chest, 2022; 162: e207‑e243
- Halvorsen S., Mehilli J., Cassese S. y cols., 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non‑cardiac surgery, Eur. Heart J., 2022; 43: 3826‑3924
- Acosta R.D., Abraham N.S., Chandrasekhara V. y cols., The management of antithrombotic agents for patients undergoing Gi endoscopy, Gastrointest. Endosc., 2016; 83: 3‑16
- Hindricks G., Potpara T., Dagres N. y cols., ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio‑Thoracic Surgery (EACTS): the Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC, Eur. Heart J., 2021; 42: 373‑498
- Oscarsson A., Gupta A., Fredrikson M. y cols., To continue or discontinue aspirin in the perioperative period: a randomized, controlled clinical trial, Br. J. Anaesth., 2010; 104: 305‑312
- Knuuti J., Wijns W., Sarante A. y cols., 2019 Guidelines for the diagnosis and managment of chronic coronary syndromes, Eur. Heart. J., 2020; 41: 407‑477
- Yasuda S., Kaikita K., Akao M. y cols., Antithrombotic therapy for atrial fibrillation with stable coronary disease, N. Engl. J. Med. Overseas Ed., 2019; 381: 1103‑1113
- Gori T., Polimeni A., Indolfi C. y cols., Predictors of stent thrombosis and their implications for clinical practice, Nat. Rev. Cardiol., 2019; 16: 243‑256
- Dasa O., Pepine C.J., Pearson T.A., Aspirin in primary prevention: what changed? A critical appraisal of current evidence, Am. J. Cardiol., 2021; 141: 38‑48
- Valgimigli M., Bueno H., Byrne R.A. y cols., 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: the task force for dual antiplatelet therapy in coronary artery disease of the European Society of cardiology (ESC) and of the European association for Cardio‑Thoracic surgery (EACTS), Eur. Heart J., 2018; 39: 213‑260
- Witt D.M., Nieuwlaat R., Clark N.P. y cols., American Society of Hematology 2018 guidelines for management of venous thromboembolism: optimal management of anticoagulation therapy, Blood Adv., 2018; 2: 3257‑3291
- Otto C.M., Nishimura R.A., Bonow R.O. y cols., 2020 ACC/AHA guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines, Circulation, 2021; 143: e72‑e227
- Douketis J.D., Spyropoulos A.C., Kaatz S. y cols., Perioperative bridging anticoagulation in patients with atrial fibrillation, N. Engl. J. Med. Overseas Ed., 2015; 373: 823‑833
- Keeling D., Tait R.C., Watson H., et al y cols., Perioperative management of anticoagulation and antiplatelet therapy, Br. J. Haematol., 2016; 175: 602‑613.
- Chan F.K.L., Goh K.‑L., Reddy N. y cols., Management of patients on antithrombotic agents undergoing emergency and elective endoscopy: joint Asian Pacific association of gastroenterology (APAGE) and Asian Pacific Society for digestive endoscopy (APSDE) practice guidelines, Gut, 2018; 67: 405‑417
- Douketis J.D., Spyropoulos A.C., Duncan J. y cols., Perioperative management of patients with atrial fibrillation receiving a direct oral anticoagulant, JAMA Intern. Med., 2019; 179: 1469‑1478
- Beyer‑Westendorf J., Gelbricht V., Förster K. y cols., Peri‑interventional management of novel oral anticoagulants in daily care: results from the prospective Dresden NOAC registry, Eur. Heart J., 2014; 35: 1888‑1896
- Douketis J.D., Healey J.S., Brueckmann M. y cols., Perioperative bridging anticoagulation during dabigatran or warfarin interruption among patients who had an elective surgery or procedure. substudy of the RE‑LY trial, Thromb. Haemost., 2015; 113: 625‑632
- Steffel J., Collins R., Antz M. y cols., 2021 European Heart Rhythm Association. Practical guide on the use of non‑vitamin K antagonist oral anticoagulants in patients with atrial fibrillation, Europace, 2021; 23: 1612‑1676
- Yuki T., Ishihara S., Yashima K. y cols., Bleeding risk related to upper gastrointestinal endoscopic biopsy in patients receiving antithrombotic therapy: a multicenter prospective observational study, Curr. Ther. Res. Clin. Exp., 2017; 84: 32‑36
- Radaelli F., Fuccio L., Paggi S. y cols., Periendoscopic management of direct oral anticoagulants: a prospective cohort study, Gut, 2019; 68: 969‑976
- Takeuchi Y., Mabe K., Shimodate Y. y cols., Continuous anticoagulation and cold SNARE polypectomy versus heparin bridging and hot SNARE polypectomy in patients on anticoagulants with Subcentimeter polyps, Ann. Intern. Med., 2019; 171: 229‑237
- Li D.‑F., Chang X., Fang X. y cols., Colonoscopic post‑polypectomy bleeding in patients on uninterrupted clopidogrel therapy: a systematic review and meta‑analysis, Exp. Ther. Med., 2020; 19: 3211‑3218
- Dong J., Wei K., Deng J. y cols., Effects of antithrombotic therapy on bleeding after endoscopic submucosal dissection, Gastrointest. Endosc., 2017; 86: 807‑816
- Jaruvongvanich V., Sempokuya T., Wijarnpreecha K. y cols., Continued versus interrupted aspirin use and bleeding risk after endoscopic submucosal dissection of gastric neoplasms: a meta‑analysis, Ann. Gastroenterol., 2018; 31: 344‑349
- Seo M., Song E.M., Cho J.W. y cols., A risk‑scoring model for the prediction of delayed bleeding after colorectal endoscopic submucosal dissection, Gastrointest. Endosc., 2019; 89: 990‑998
- Tomida H., Yoshio T., Igarashi K. y cols., Influence of anticoagulants on the risk of delayed bleeding after gastric endoscopic submucosal dissection: a multicenter retrospective study, Gastric Cancer, 2021; 24: 179‑189
- Nagata N., Yasunaga H., Matsui H. y cols., Therapeutic endoscopy‑related Gi bleeding and thromboembolic events in patients using warfarin or direct oral anticoagulants: results from a large nationwide database analysis, Gut, 2018; 67: 1805‑1812
- Andriulli A., Loperfido S., Napolitano G. y cols., Incidence rates of post‑ERCP complications: a systematic survey of prospective studies, Am. J. Gastroenterol., 2007; 102: 1781‑1788
- Dumonceau J.‑M., Kapral C., Aabakken L. y cols., ERCP‑related adverse events: European Society of Gastrointestinal Endoscopy (ESGE) guideline, Endoscopy, 2020; 52: 127‑149
- Lee M.G., Kim J., Lee S.H. y cols., Effect of sustained use of platelet aggregation inhibitors on post‑endoscopic sphincterotomy bleeding, Dig. Endosc., 2014; 26: 737‑744
- Spadaccini M., Fugazza A., Frazzoni L. y cols., Endoscopic papillectomy for neoplastic ampullary lesions: a systematic review with pooled analysis, United European Gastroenterol. J., 2020; 8: 44‑51
- Chung K.H., Lee S.H., Choi J.H. y cols., Effect of submucosal injection in endoscopic papillectomy of ampullary tumor: propensity‑score matching analysis, United European Gastroenterol. J., 2018; 6: 576‑585
- Polkowski M., Jenssen Ch., Kaye Ph. y cols., Technical aspects of endoscopic‑ultrasound (EUS)‑guided sampling. European Society of Gastrointestinal Endoscopy (ESGE) Technical Guideline – 2017, Endoscopy, 2017; 49: 989‑1006
- Li D.‑F., Wang J.‑Y., Yang M.‑F. y cols., Factors associated with diagnostic accuracy, technical success and adverse events of endoscopic ultrasound‑guided fine‑needle biopsy: a systematic review and meta‑analysis, J. Gastroenterol. Hepatol., 2020; 35: 1264‑1276
- Ogura T., Nishioka N., Ueno S. y cols., Antiplatelet and/or anticoagulant treatment does not increase hemorrhagic adverse events during EUS‑guided biliary drainage, Gastrointest. Endosc., 2020; 92: 659‑666
- Atukorale Y.N., Church J.L., Hoggan B.L. y cols., Self‑expanding metallic stents for the management of emergency malignant large bowel obstruction: a systematic review, J. Gastrointest. Surg., 2016; 20: 455‑462
- Anderloni A., Di Leo M., Barzaghi F. y cols., Complications and early mortality in percutaneous endoscopic gastrostomy placement in lombardy: a multicentre prospective cohort study, Dige. Liver Dis., 2019; 51: 1380‑1387
- Noujaim M.G., Parish A., Raines D. y cols., Use, yield, and risk of device‑assisted enteroscopy in the United States: results from a large retrospective multicentre cohort, J. Clin. Gastroenterol., 2021; 55: 792‑797
- Biondi‑Zoccai G.G.L., Lotrionte M., Agostoni P. y cols., A systematic review and meta‑analysis on the hazards of discontinuing or not adhering to aspirin among 50 279 patients at risk for coronary artery disease, Eur. Heart J., 2006; 27: 2667‑2674
- Sung J.J.Y., Lau J.Y.W., Ching J.Y.L. y cols., Continuation of low‑dose aspirin therapy in peptic ulcer bleeding: a randomized trial, Ann. Intern. Med., 2010; 152: 1‑9
- Siau K., Hannah J.L., Hodson J. y cols., Stopping antithrombotic therapy after acute upper gastrointestinal bleeding is associated with reduced survival, Postgrad. Med. J., 2018; 94: 137‑142
- Oakland K., Kothiwale S., Forehand T. y cols., External validation of the Oakland score to assess safe hospital discharge among adult patients with acute lower gastrointestinal bleeding in the US, JAMA Netw. Open, 2020; 3: e209 630
- Strate L.L., Orav E.J., Syngal S., Early predictors of severity in acute lower intestinal tract bleeding, Arch. Intern. Med., 2003; 163: 838‑843
- Radaelli F., Dentali F., Repici A. y cols., Management of anticoagulation in patients with acute gastrointestinal bleeding, Dig. Liver Dis., 2015; 47: 621‑627
- Nagata N., Sakurai T., Moriyasu S y cols., Impact of INR monitoring, reversal agent use, heparin bridging, and anticoagulant interruption on rebleeding and thromboembolism in acute gastrointestinal bleeding, PLoS One, 2017; 12: e0 183 423
- Cuker A., Burnett A., Triller D. y cols., Reversal of direct oral anticoagulants: guidance from the anticoagulation forum, Am. J. Hematol., 2019; 94: 697‑709
- Tomaselli G.F., Mahaffey K.W., Cuker A. y cols., 2020 ACC expert consensus decision pathway on management of bleeding in patients on oral anticoagulants: a report of the American College of Cardiology solution set oversight Committee, J. Am. Coll. Cardiol., 2020; 76: 594‑622
- Connolly S.J., Crowther M., Eikelboom J.W. y cols., Full study report of Andexanet alfa for bleeding associated with factor Xa inhibitors, N. Engl. J. Med., 2019; 380: 1326‑1335
- Choudari C.P., Rajgopal C., Palmer K.R., Acute gastrointestinal haemorrhage in anticoagulated patients: diagnoses and response to endoscopic treatment, Gut, 1994; 35: 464‑466
- Little D., Chai‑Adisaksopha C., Hillis C. y cols., Resumption of anticoagulant therapy after anticoagulant‑related gastrointestinal bleeding: a systematic review and meta‑analysis, Thromb. Res., 2019; 175: 102‑109
- Tapaskar N., Pang A., Werner D.A. y cols., Resuming anticoagulation following hospitalization for gastrointestinal bleeding is associated with reduced thromboembolic events and improved mortality: results from a systematic review and meta‑analysis, Dig. Dis. Sci., 2021; 66: 554‑566
- Qureshi W., Mittal C., Patsias I. y cols., Restarting anticoagulation and outcomes after major gastrointestinal bleeding in atrial fibrillation, Am. J. Cardiol., 2014; 113: 662‑668
 Español
Español
 English
English
 українська
українська