Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертвуСкорочення: ІЛА — інтерстиціальні легеневі аномалії, ІЛФ — ідіопатичний легеневий фіброз, ІХЛ — інтерстиціальна хвороба легень, КТ — комп’ютерна томографія, FS — Fleischner Society
Fleischner Society (FS) — це міжнародне наукове співтовариство експертів в галузі радіології, що займаються захворюваннями грудної клітки. Одне з основних завдань цієї організації — публікувати узгоджені позиції (Fleischner Position Papers) щодо складних або нових питань, в тому числі в області захворювань легенів. Про високий рейтинг цих документів свідчить той факт, що вони публікуються в найкращих журналах у сфері пульмонології, а представлені в них концепції відображаються в клінічних настановах, розроблених найбільш важливими асоціаціями пульмонологів на світі, такими як American Thoracic Society (ATS) або European Respiratory Society (ERS). У середині 2020 року журнал «The Lancet Respiratory Medicine», який має найвищий імпакт-фактор в пульмонології, опублікував позицію FS щодо інтерстиціальних уражень легень, випадково виявлених при комп'ютерної томографії (КТ),1 ключові концепції якої будуть представлені і прокоментовані в цій статті.
У зв’язку з тим, що КТ проводять усе частіше, ураження, які можуть відповідати інтерстиціальній хворобі легенів (ІХЛ), виявляються у людей без симптомів захворювання легенів і без результатів інших досліджень, що вказують на ІХЛ. Така ситуація часто виникає, наприклад, у людей, яким робили КТ в рамах скринінгу раку легенів або за іншими показаннями, і навіть під час КТ черевної порожнини (коли виявляються зміни в нижніх відділах легень). Багато досліджень, опублікованих в останні роки, описують інтерстиціальні легеневі аномалії (ІЛА), часто інтерпретуючи їх як доклінічні зміни, що передують розвитку ІХЛ. Наприклад, в когорті Framingham Heart Study 7 % досліджуваних мали ІЛА, а цей відсоток був значно вище у пацієнтів із мутацією, при якій є схильність до розвитку ідіопатичного легеневого фіброзу (ІФЛ).2 В іншому дослідженні ІЛА були пов'язані з вищою частотою респіраторних симптомів і гіршими результатами функціональних досліджень легень.3 У великому проспективному дослідженні за участю 4 когорт пацієнтів ІЛА були виявлені у 7–9 % досліджуваних, які пройшли КТ, а наявність ІЛА асоціювалася зі значно вищим ризиком смерті від будь-якої причини.4 Виявлення ІЛА має значення, оскільки при подальшому спостереженні ці зміни прогресують протягом 2 років приблизно в 20 % випадків і протягом 5 років приблизно в 40 % випадків.1 Оскільки усе частіше описуються зміни за типом ІЛА, виникла потреба в розробленні діагностичних критеріїв для ІЛА і рекомендацій для клініцистів щодо ведення пацієнтів, у яких виявлено такі зміни.
Позиція FS щодо ІЛА включає інформацію про:
1) визначення і термінологію ІЛА
2) стандартизацію радіологічних протоколів, використовуваних у пацієнтів із ІЛА
3) кореляцію ІЛА з результатами гістопатологічних досліджень
4) фактори ризику виникнення ІЛА
5) ризик прогресування ІЛА, вплив діагностування ІЛА на ризик смерті і ризик ускладнень хіміотерапії та променевої терапії у пацієнтів із раком легені
6) подальше ведення пацієнта з діагностованими ІЛА
7) значення автоматичних кількісних вимірювань щільності легеневої тканини на КТ
8) напрямки подальших наукових досліджень.
У цій статті я зосереджуся лише на пунктах 1 і 6, які суттєвими для лікарів, що займаються діагностикою та лікуванням пацієнтів із ІЛА, виявленими при КТ. Особам, зацікавленим іншими питаннями (особливо радіологам і дослідникам), рекомендую звернутися до першоджерела.
ІЛА визначалися як випадково виявлені на КТ грудної клітки (в осіб без підозри на ІХЛ) ураження за типом:
1) матового скла (рис. 1А)
2) кіст легень (крім емфіземи легень; рис. 1Б)
3) ретикулярних змін (рис. 1В)
4) тракційних бронхоектазів (рис. 1Г)
5) стільникової легені (рис. 1Д).
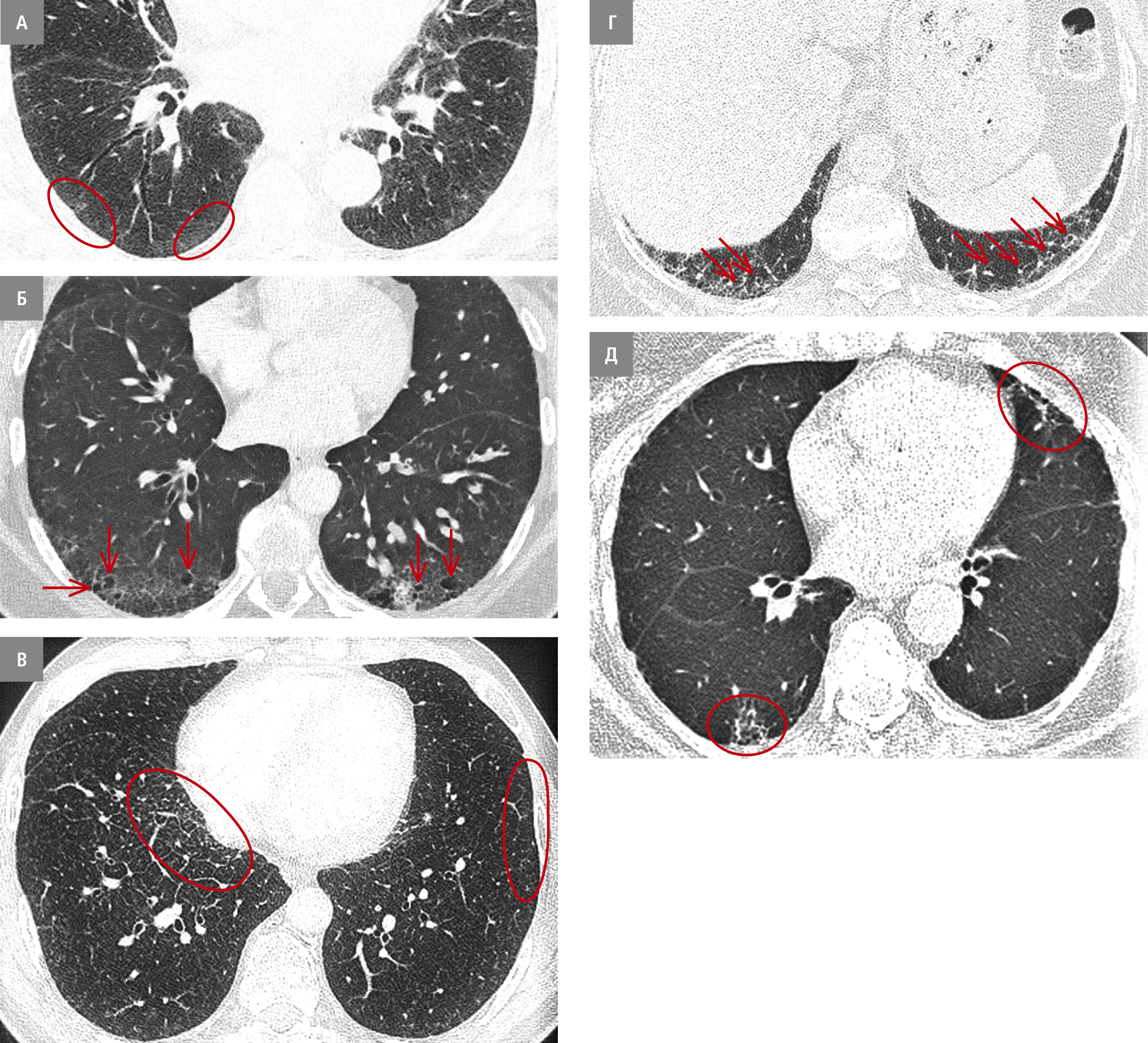
Рисунок 1. ІЛА. А — тіні за типом матового скла (червоні овали), розташовані субплеврально; Б — кісти (стрілки) мають неправильну форму і більш товсті стінки. В — ретикулярні ураження (червоний овал). Г — тракційний бронхоектаз (стрілки). Д — зміна за типом стільникової легені (червоні овали)
Ці ураження повинні займати ≥5% верхнього, середнього або нижнього легеневого поля і не повинні залежати від гравітації. Під час оцінки КТ легеневі поля слід розділити на рівні нижнього краю дуги аорти і правої нижньої легеневої вени. Автори позиції FS виключили дрібновузликову дисемінацію середостіння, яка в минулому були класифікована як ІЛА, оскільки вона часто відповідає індукованому тютюнопалінням бронхіоліту. Ці зміни здебільшого не прогресують і не призводять до фіброзу легенів. Крім того, ІЛА не включають:
1) вогнищевий фіброз легенів поблизу остеофітів хребта (рис. 2А)
2) односторонні, вогнищеві та доброякісні ураження, наприклад, зміни за типом дерева в бруньках, що виникли ймовірно внаслідок аспірації (рис. 2Б)
3) доклінічні зміни, що передують ІХЛ (рис. 2В), виявлені під час скринінгу у пацієнтів із груп ризику (напр. родини пацієнтів із генетично детермінованою ІХЛ, люди, які зазнали професійного впливу, або пацієнти із захворюванням сполучної тканини).
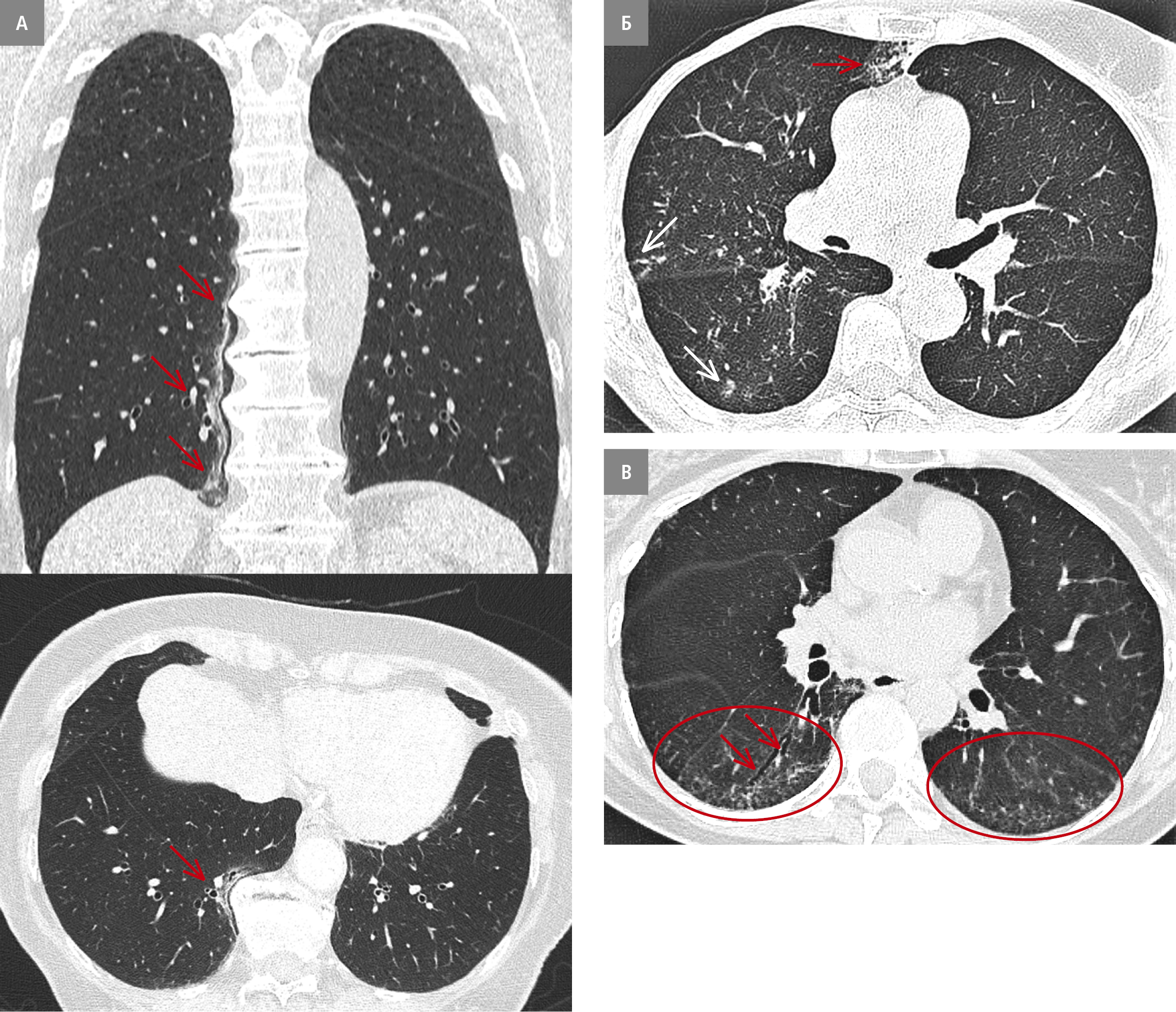
Рисунок 2. Ураження, що не відповідають критеріям ІЛА. А — вогнищевий фіброз легені поблизу остеофітів хребта (стрілки). Б — односторонні ураження з інтралобулярними затемненнями за типом дерева в бруньках (стрілки). В — невеликі інтерстиціальні ураження (червоні овали) і тракційні бронхоектази (стрілки) у пацієнта з системною склеродермією
Не виключається можливість постановки діагнозу ІЛА у людей із респіраторними симптомами або порушеннями, виявленими при функціональних дослідженнях легень, проте автори позиції FS пропонують зберігати в таких ситуаціях обережність, оскільки це можуть бути особи з легкою формою ІХЛ.
Диференціювання ІЛА (діагноз, поставлений радіологом на підставі аналізу КТ грудної клітки) та легкої форми ІХЛ, яку повинен проводити клініцист, буде обговорюватися нижче.
Виділяють 3 типи ІЛА:
1) несубплевральний — зміни не переважають в субплевральних областях (рис. 3А)
2) субплевральний без фіброзу — зміни розташовані в субплевральних областях, але відсутні ознаки легеневого фіброзу (рис. 3Б)
3) субплевральний з фіброзом — основні зміни знаходяться в субплевральних областях і є ознаки фіброзу легень (рис. 3В).
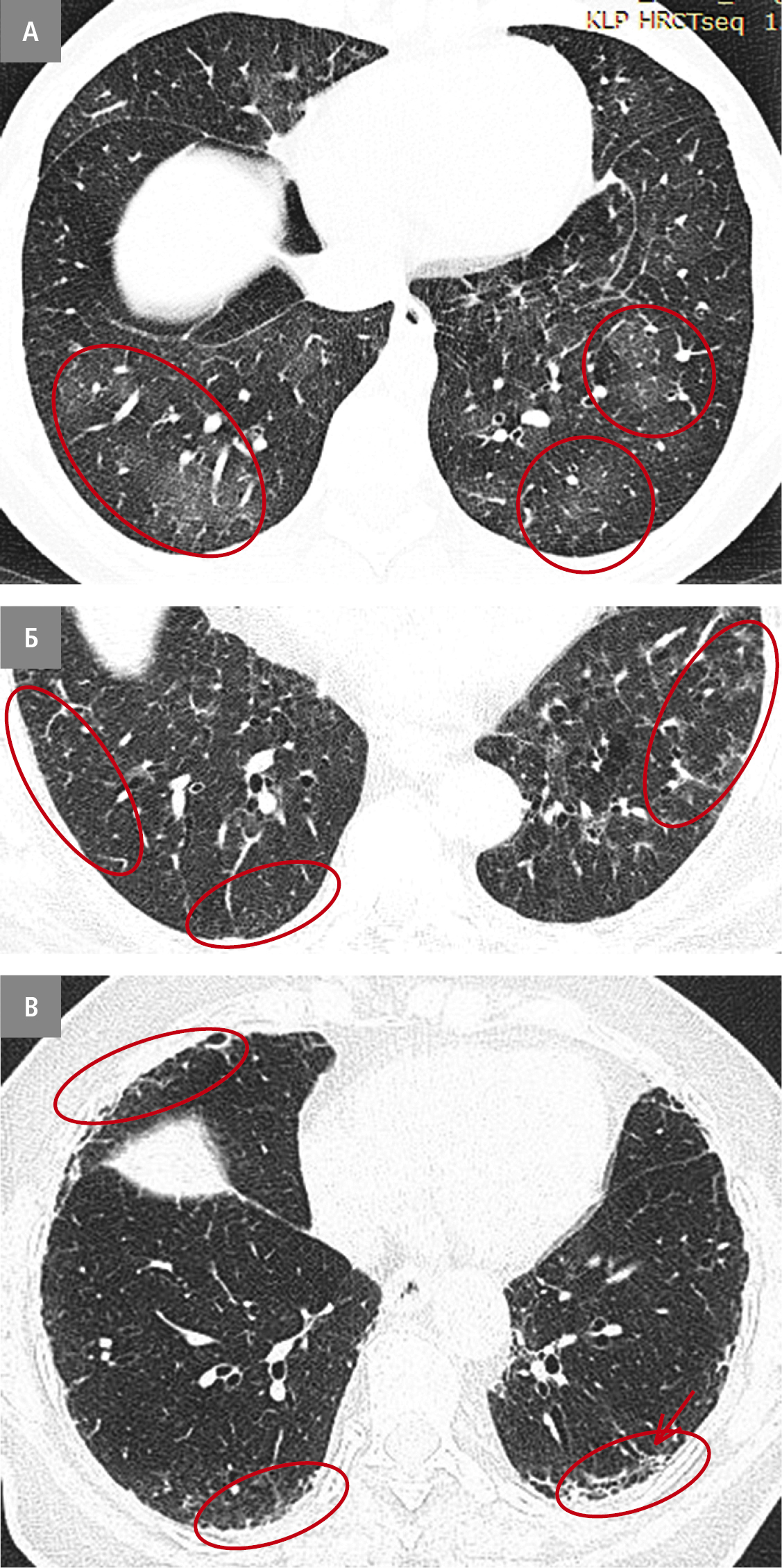
Рисунок 3. Види ІЛА. А — несубплевральний (червоні овали). Б — субплевральний без фіброзу (червоні овали). В — субплевральний з фіброзом паренхіми легень (овали — ділянки стільникової легені; стрілка — бронхоектази)
ІЛА несубплеврального типу зазвичай не прогресують і не асоціюються з підвищеним ризиком смерті. Натомість визначення ІЛА субплеврального типу з фіброзом має практичне значення, оскільки в таких випадках значно підвищується ризик прогресування зуражень і смерті пацієнта.
Коли при КТ грудної клітки виявляються зміни, які можуть відповідати ІЛА, першим і найважливішим кроком є виключення ранньої форми ІХЛ. Рекомендується, щоб це завдання виконував пульмонолог, який має досвід діагностики ІХЛ, бажано за підтримки багатопрофільної команди фахівців, що включає радіолога та патологоанатома. Слід врахувати фактори ризику та клінічні симптоми ІХЛ, результати функціональних досліджень легень, а також характер і поширеність змін, виявлених при КТ грудної клітки. Після виключення ІХЛ слід визначити ризик прогресування ІЛА з урахуванням наявних у пацієнта факторів ризику і клінічних симптомів, а також результатів функціональних досліджень легень і характеру змін на КТ грудної клітки (особливо субплевральна ІЛА з фіброзом). Клінічні фактори ризику прогресування ІЛА включають: значення, наближені до нижньої межі норми в функціональних дослідженнях легень, куріння сигарет, професійний вплив і стани після онкологічного лікування (хіміо- або променевої терапії) або торакохірургічних операцій.
У пацієнтів із низьким ризиком прогресування уражень подальше спостереження не рекомендується, за винятком випадків появи нових клінічно значущих (або погіршення легких) респіраторних симптомів. В інших пацієнтів контрольні огляди (суб'єктивне і об'єктивне обстеження та функціональні дослідження легень) рекомендуються кожні 3–12 місяців, а радіологічні дослідження — кожні 12–24 місяці (в залежності від ризику прогресування уражень). Автори позиції FS підкреслюють, що наведені вище рекомендації були сформульовані на основі їх власного клінічного досвіду, а не результатів наукових досліджень. У майбутньому, враз із публікацією даних проспективних досліджень, ці рекомендації обов'язково будуть переглянуті. На рисунку 4 представлена схема ведення хворих з ІЛА, запропонована авторами позиції FS.
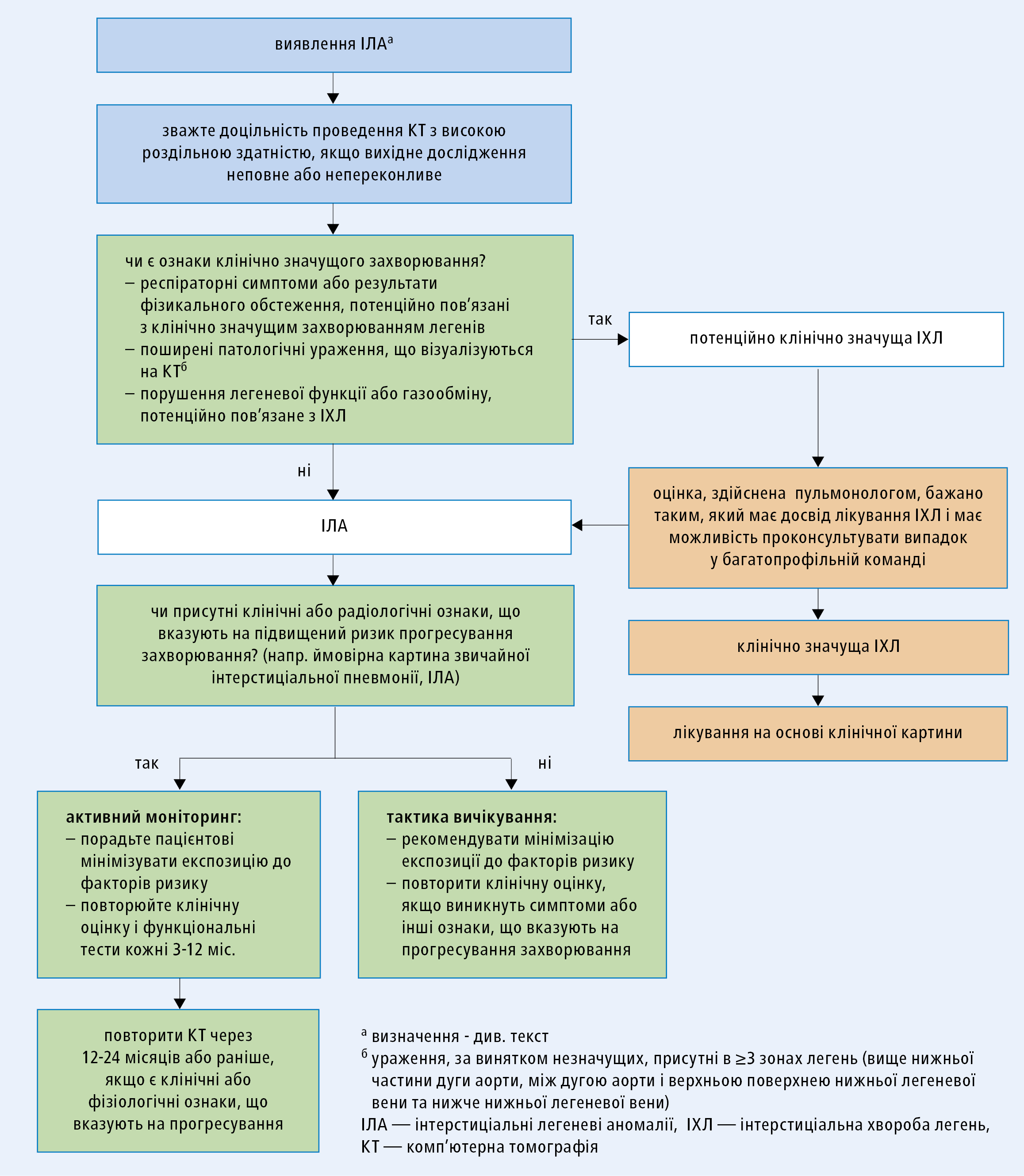
Рисунок 4. Пропонована тактика дій при виявленні за результатами комп'ютерної томографії інтерстиціальних змін у легенях. Елементи, що стосуються радіологів, виділені синім кольором, лікуючого лікаря або пульмонолога — зеленим, а відібрані для пульмонолога, бажано з досвідом лікування інтерстиціальних захворювань легенів, — оранжевим (передруковано з дозволу з 1-ї позиції літератури. Translated from Lancet Respir Med. Vol.8(7):726-737. doi: 10.1016/S2213-2600(20)30168-5. © 2020, with permission from Elsevier Ltd.)
1. Hatabu H., Hunninghake G.M., Richeldi L. i співавт.: Interstitial lung abnormalities detected incidentally on CT: a Position Paper from the Fleischner Society. Lancet Respir. Med., 2020; 8: 726–737
2. Hunninghake G.M., Hatabu H., Okajima Y. i співавт.: MUC5B promoter polymorphism and interstitial lung abnormalities. N. Engl. J. Med., 2013; 368: 2192–2200
3. Doyle T.J., Dellaripa P.F., Batra K. i співавт.: Functional impact of a spectrum of interstitial lung abnormalities in rheumatoid arthritis. Chest, 2014; 146: 41–50
4. Putman R.K., Hatabu H., Araki T. i співавт.: Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE) Investigators; COPDGene Investigators. Association between interstitial lung abnormalities and all‑cause mortality. JAMA, 2016; 315: 672–681