Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертвуПРИЧИНИ вгору
1) проростання або стискання пухлиною різних структур та їх ускладнення (напр., патологічний перелом хребця внаслідок метастатичного ураження);
2) стани пов’язані з рецидивуючим онкологічним захворюванням, напр., розпад пухлини (часта причина мязево-фасціального болю);
3) специфічне лікування (напр., невропатія після хіміотерапії, плексит після радіотерапії, больовий синдром після мастектомії);
4) інші супутні (напр., біль голови, коронарний бiль, остеоартроз).
ЛІКУВАННЯвгору
1. Призначайте ЛЗ п/o, а якщо це неможливо (через нудоту, блювання, порушення ковтання або всмоктування) — п/ш, в/в (особливо у пацієнтів з внутрішньовенним доступом) або ч/ш. У термінальних хворих, які вже не можуть ковтати ЛЗ, замініть призначення п/o на п/ш, а не починайте лікування з ч/ш введення. У пацієнтів, які раніше не приймали опіоїди або погано контролюють біль, не розпочинайте трансдермального лікування.
2. При постійному больовому синдромі — слід призначати регулярний прийом ЛЗ (а не лише у разі посилення болю) з проміжками часу, які залежать від фармакокінетики ЛЗ; хворого також необхідно забезпечити ЛЗ у формі препарату з негайним вивільненням, щоб він зміг його прийняти при появі проривного болю (біль, що з’являється, незважаючи на регулярне застосуванні анальгетику).
3. Індивідуалізація лікування залежно від виду болю (соматичний, вісцеральний, нейропатичний, кістковий, змішаний) та його походження — застосування препаратів у дозах, що знижують інтенсивність болю до прийнятного для пацієнта рівня.
4. Увага до деталей — напр., час прийому першої та останньої дози болезаспокійливого протягом дня має бути скоригований відповідно до часу сну пацієнта.
5. Схема знеболювального лікування повинна бути ретельно розписана для хворого та його родичів і містити назви ЛЗ, причини їх застосування, дози та інтервали між ними, а також можливі побічні ефекти. Може допомогти знеболююча драбина →рис. 22.1-1. При незначному болю слід починати лікування з неопіоїдного анальгетику, якщо немає протипоказів. Якщо ефект незадовільний — потрібно перейти до вищої «сходинки». У пацієнта з пухлиною, який страждає від сильного болю, як правило, від початку терапії слід застосувати опіоїди, незалежно від механізму виникнення болю. На кожному рівні (сходинці) анальгетичної терапії необхідно оцінити покази до застосування ЛЗ, які посилюють ефекти анальгетиків, а також ЛЗ, що зменшують побічні ефекти. Якщо було досягнуто задовільного контролю болю за допомогою препаратів на ІІ і ІІІ анальгетичних сходинках і пацієнт продовжує отримувати неопіоїдний анальгетик, переоцініть подальше його використання (це можна зробити через зменшення дози або припинення прийому препарату).

Рисунок 1. Сходинки знеболення (ВООЗ) у поєднанні з іншими методами лікування болю
1. Парацетамол: діє швидко (15–30 хв) та коротко (до 4–6 год); не перевищуйте 15 мг/кг м. т. (1 г) на 1 дозу п/о або в/в; дозу можна повторити макс. 4 × на день, макс. добова доза для дорослого становить 4 г. При наявності факторів ризику гепатотоксичності, таких як: ураження печінки, літній вік, особливо з синдромом старечої астенії, низька маса тіла, кахексія, голодування, зловживання алкоголем, що спричиняє дефіцит глутатіону, одночасне застосування індукторів печінкових ферментів (напр., карбамазепіну, рифампіцину, фенітоїну, фенобарбіталу або звіробою) або важкому порушенні функції нирок обмежити добову дозу до 3 г (на думку деяких експертів — до 2 г). Протягом 2 днів після початку прийому парацетамолу оцініть, чи достатньо він ефективний, щоб виправдати його застосування.
2. Метамізол: не має протизапальної дії, діє спазмолітично; у онкологічних хворих найчастіше використовується для лікування кольок і проривного болю. Його щоденне застосування протягом >7 днів не рекомендується через побічні ефекти, особливо з боку кровотворної системи.
3. НПЗП: найсильніший протибольовий ефект при болях, що зумовлені запальними змінами, болями кісток і м’язово-фасціальними болями. Потрібно зважати на ризик небажаних ефектів з боку системи кровообігу, травлення і нирок, ускладнень з боку ШКТ →розд. 4.7.
Переваги лікування низькими дозами морфіну на II сходинці анальгетичної драбини, ймовірно, більші та швидші, ніж лікування слабкими опіоїдами. Застосування слабких опіоїдів дітям не рекомендується.
1. Кодеїн: у випадку призначення препарату, що містить виключно кодеїн — спочатку п/о починаючи напр., від дози 10–20 мг кожні 4–6 год (деякі автори рекомендують 10–30 мг кожні 4–6 год), при потребі, поступово збільшуйте дозу до макс. 240 мг/добу.
2. Дигідрокодеїн: п/о від 60 мг кожні 12 год, при потребі, поступово збільшуйтн дозу до макс. 240 мг/добу.
3. Трамадол: спочатку, зазвичай, п/о 25–50 мг кожні 8–6–4 год у формі препарату з негайним вивільненням, в осіб старшого віку, кахектичних і/або порушенням функції нирок чи печінки слід починати з дози 12,5–25 мг; при потребі поступово збільшуйте до макс. 400 мг/добу (для осіб віком >75 років ≤300 мг/добу). Препарати з пролонгованим вивільненням застосовуйте кожні 12 год. Викликає закрепи рідше, ніж кодеїн і дигідрокодеїн, однак на початку лікування часто викликає нудоту і/або блювання. Додатково гальмує зворотнє захоплення серотоніну і у разі застосування у комбінації з іншими ЛЗ, які збільшують рівень серотоніну, може індукувати серотонінергічний синдром. Не можна застосовувати разом з інгібіторами МАО і протягом 14 днів з дня припинення їх застосування, чи з трициклічними антидепресантами та інгібіторами зворотнього захоплення серотоніну, а також на термінальній стадії ниркової недостатності (рШКФ ≤10 мл/хв/1,73 м2), та у хворих із епілепсією в анамнезі (через підвищений ризик судомних нападів). Змінюйте тактику залежно від ступеня печінкової та ниркової недостатності.
4. Малі дози сильних опіоїдів: морфіну (≤30 мг/добу), оксикодону (≤20 мг/добу) або гідроморфону (≤4 мг/добу): вони є опіоїдами ІІ ступеню анальгетичної драбини (напр., морфін у формі препарату з негайним вивільненням 2,5 мг кожні 4 год п/о у хворого з болем і задишкою, хоча це є опіоїд вибору для полегшення задишки.
1. Морфін: через його низьку ціну та широку доступність у всьому світі, ВООЗ все ще вважає його основним опіоїдом. Титрування дози п/о шляхом можна здійснити, призначаючи препарати негайного (особливо показані у випадках погано контрольованого болю, враховуючи їх швидкий ефект), або з контрольованого вивільнення. Анальгетичний ефект препаратів з негайним вивільненням з’являється швидше, ніж у випадку препарату з контрольованим вивільненням. Розпочніть з низької дози і поступово її збільшуйте →табл. 22.1-1. Припиніть підвищувати дозу у тому випадку, якщо досягнуто задовільного знеболення, або якщо спостерігаютьсянебажані ефекти, які складно контролювати → тоді слід розглянути можливість зміни лікування (відміна морфіну і призначення іншого опіоїду, або зменшення дози морфіну і додавання інших ЛЗ, застосування нефармакологічних методів і т. п.). Підбір оптимальної дози триває, зазвичай, впродовж кількох днів (під час титрування із застосуванням п/о препарату морфіну негайного вивільнення кожні 4 год можете зважити призначення перед сном дози, яка є на 50 % вищою, щоб забезпечити анальгезію до ранкових годин, завдяки чому не потрібно будити хворого вночі для введення ЛЗ). Після встановлення ефективної добової дози із застосуванням препаратів з негайним вивільненням, можна їх замінити морфіном з контрольованим вивільненням (призначають кожні 12 год) або іншим сильним опіоїдом у еквівалентнійі дозі і формі з пролонгованим вивільненням →нижче. Завжди забезпечте хворому можливість вживання рятувальних доз (зазвичай, у формі морфіну з негайним вивільненням в індивідуально титрованій дозі, найчастіше 1/10–1/6 добової дози, яку розраховано як еквівалентну по відношенню опіоїду, що систематично застосовувався). Якщо необхідно змінити шлях введення з п/о на п/ш → слід зменшити добову дозу у 2–3 рази і призначити у вигляді постійної інфузії або розділити на прийом через кожні 4 год. При нирковій недостатності може розвинутись кумуляція активних метаболітів морфіну → краще призначити інший опіоїд (бупренорфін, фентаніл або метадон). Якщо особливо показаний морфін (напр., хворий з легкою або помірною нирковою недостатністю, який страждає від задишки) → слід зменшити дозу, збільшити проміжки часу між наступними прийомами, або застосовувати дози виключно в разі необхідності або обміркуйте зміну шляху дозування на парентеральний та ретельно моніторуйте лікування.
|
1. Відмінити слабкі опіоїди. 2. Розпочати з дози морфіну 5–10 мг кожні 4 год п/о (пацієнтам у старшому віці, в поганому загальному стані та/або кахектичним пацієнтам — 2,5–5 мг). Пацієнтам у похилому віці слід збільшити інтервал між дозами до 6 год, інколи — до 8 год. Підбираючи дозу, слід розглянути, чи хворий не належить до осіб, які повільно метаболізують з огляду на активність CYP2D6 (у таких пацієнтів кодеїн не проявляє анальгетичного ефекту, а трамадол діє набагато слабше). У такому випадку початкова доза морфіну має бути менша, як у пацієнтів, що не приймали опіоїдів. Найкраще оцінювати ефективність морфіну п/о з огляду на його максимальний анальгетичний ефект, іншими словами, через 60–90 хв після прийому (якщо до цього часу ефект не є задовільним, не треба очікувати, що пізніше стане краще). 3. Призначити додаткові дози морфіну, коли з’вляється біль, зазвичай, 50–100 % дози кожні 4 год. 4. Якщо біль недостатньо пом’якшений і хворий додатково приймає >2 рятувальні дози/добу збільшуйте дозу макс. на 25–50 % кожні 1–2 дні (на основі оцінки анальгетичного ефекту та суми додаткових доз), поки не буде досягнуто задовільного контролю болю з добре контрольованими небажаними ефектами. 5. Після визначення потреби у морфіні із швидким вивільненням перейти на препарат з контрольованим вивільненням: морфін п/о або, залежно від ситуації, на оксикодон п/о із контрольованим вивільненням, трансдермальний фентаніл чи трансдермальний бупренорфін (при зміні діючої речовини — необхідно розрахувати еквівалентну дозу). 6. Пам’ятати про рятувальні дози, напр., морфін з негайним вивільненням, як правило, 1/12–1/6 добової дози (враховуючи еквівалентну дозу). |
||
|
Примітка: на початку терапії морфіном (та будь-яким іншим опіоїдом) слід пояснити пацієнтові переваги такого рішення. Запитайте його, що він думає, які його погляди і переконання щодо цих препаратів. Якщо він має побоювання і перестороги — потрібно спробувати дізнатися про їх природу та провести бесіду з пацієнтом на цю тему. Поясніть пацієнту та його близьким, які побічні ефекти можна очікувати і як діяти у разі їх виникнення (варто підготувати письмову пам’ятку). Необгідно навчити хворого оцінювати інтенсивність болю і вести щоденник. |
||
2. Оксикодон: препарат, що може бути використаний як альтернатива морфіну, з якого можна також розпочати призначення сильних опіоїдів. Форми випуску:
1) таблетки, вкриті оболонкою;
2) препарат з контрольованим вивільненням (увага — препарати різних виробників відрізняються за характеристиками вивільнення діючої речовини). Якщо оксикодон п/о призначають після стартової терапії морфіном п/о, візьміть перерахунок дози за співвідношенням 1,5–2:1 (напр., 15 мг/добу морфіну п/о → 10 мг/добу оксикодону).
Стартове дозування на початку терапії оксикодоном, як першим сильним опіоїдом, після відміни максимальних доз «слабких» опіоїдів (коли немає підозри на повільний метаболізм CYP2D6 →табл. 22.1-1):
1) препарат з негайним вивільненням — 5 мг кожні 4–6 год; виснажені пацієнти, особи похилого віку, пацієнти з невеликими порушеннями функції печінки чи нирок — від 2,5 мг кожні 6 год;
2) препарат з контрольованим вивільненням — напр., від 10 мг кожні 12 год; виснажені пацієнти, особи похилого віку, пацієнти з невеликими порушеннями функції печінки чи нирок — від 5 мг кожні 12 год.
У випадку якщо лікування опіоїдами починається з оксикодону без попереднього призначення слабких опіоїдів (тобто низьких доз оксикодону — II ступінь аналгетичної драбини) призначте препарат у формі з негайним вивільненням (напр., від 2,5 мг кожні 4–6 год) або у формі з контрольованим вивільненням (напр., від 5 мг кожні 12 год).
Для лікування проривного болю у хворого, що приймає оксикодон, на початку можна використовувати препарати оксикодону або морфіну з негайним вивільненням (у разі проривного болю, що досягає високої інтенсивності протягом кількох хвилин зважте призначення трансмукозної форми фентанілу). Для тривалого прийому доступний комбінований пероральний препарат з пролонгованим вивільненням, що містить оксикодон і налоксон, у якому налоксон зменшує частоту виникнення індукованих опіоїдами кишкових розладів. Уникайте застосування налоксону пацієнтам із порушенням функції печінки.
3. Фентаніл (трансдермальна терапевтична система; пластирі, які не можна розрізати): застосовується, коли слабкі опіоїди неефективні, і вже розраховано потребу в сильних опіоїдах. Дозування найкраще визначати, застосовуючи препарат морфіну з негайним вивільненням →вище. Процедура заміни морфіну п/о на трансдермальний фентаніл →табл. 22.1-2. Також доступні таблетки в буккальній і сублінгвальній формах та інтраназальні препарати для використання у разі проривного болю у онкологічних хворих, які постійно приймають ≥60 мг/добу морфіну п/о або еквівалентну дозу іншого сильного опіоїду протягом ≥7 днів; рятувальні дози, які застосовуються трансмукозним шляхом, потребують окремого титрування (починаючи з найменшої рекомендованої дози). З огляду на потенційний резидуальний вміст у пластирі феромагнітних речовин, його необхідно зняти перед дослідженням МРТ та аплікувати новий пластир після його завершення.
|
1. Перерахуйте добову дозу морфіну для перорального прийому у фентаніл (напр., використовуючи співвідношення 150:1а, 90 мг морфіну п/о відповідає 0,6 мг трансдермального фентанілу = 25 мкг/год) і виберіть пластир, який вивільняє таку саму або найближчу кількість фентанілуб. 2. Після застосування першого пластиру ефективна анальгетична концентрація досягається протягом 12 год, тому при переході від морфіну: а) що вводиться у вигляді пероральної форми негайного вивільнення → застосовуйте регулярні дози морфіну під час наклеювання пластиру та через 4 та 8 год; б) що вводиться у формі 12-годинного контрольованого вивільнення → використовуйте останню дозу морфіну під час наклеювання пластиру; 3. Порадьте пацієнту прийняти екстрені дози морфіну (у формі негайного вивільнення) за потреби. 4. На 3-ю добу після застосування першого пластиру підрахуйте потребу в екстрених дозах морфіну та оцініть необхідність зміни дози фентанілу. Не проводьте можливу зміну на пластир із вищою дозою частіше, ніж після застосування 1 або 2 послідовних пластирів. 5. У зв’язку з меншою запорною дією фентанілу порівняно з морфіном при переході з морфіну на фентаніл зменшують дозу проносних ЛЗ вдвічі (а потім титрують їх дозу). 6. Міняйте пластирі кожні 72 год. 7. Пам’ятайте про рятувальні дози опіоїдів із негайним вивільненням (зазвичай морфіну) ≈1/10–1/6в добової дози фентанілу (включаючи коефіцієнт перетворення). Напр., при використанні пластиру 25 мкг/год екстрена доза морфіну п/о у препаратах із негайним вивільненням зазвичай становить 5–10 мг (якщо використовується співвідношення 1:100) або 7,5–15 мг (якщо використовується співвідношення 1:150); іноді достатньо меншої дози. |
|
a Виробник фентанілу рекомендує співвідношення 150:1 або 100:1 залежно від клінічної ситуації; Palliative Care Formulary 6 пропонує 100:1. б Примітка: залежно від показань для переходу на інший опіоїд слід враховувати зменшення початкової дози другого опіоїду по відношенню до значення, розрахованого на основі таблиць еквівалентності анальгетика (початкова доза зменшується на 25–75 %; зменшення дози тим більше, чим вища доза раніше використовуваного опіоїду, заміна опіоїду або показання до заміни опіоїду — недосягнення знеболюючого ефекту, розвиток толерантності до першого опіоїду, опіоїдна гіпералгезія). Польські експерти (2017) також нагадують, що у пацієнтів із периферичним набряком та/або асцитом дозу гідрофільного морфіну не можна легко конвертувати в ліпофільні опіоїди, оскільки у таких випадках висока доза морфіну може бути результатом великого об’єму розподілу. в згідно з Palliative Care Formulary 8; згідно з польськими рекомендаціями (2017) 10–20 % |
4. Бупренорфін: трансдермальна терапевтична система показана при стабільному болю; визначення дози можна провести, використовуючи напр., препарат морфіну з негайним вивільненням (→вище); початкова доза 17,5–35 мкг/год або адекватно розрахована у разі заміни іншого сильного опіоїду на бупренорфін, застосований трансдермально; макс. доза 140 мкг/год. Заміна морфіну п/о на бупренорфін у трансдермальній формі →табл. 22.1-3. Бупренорфін може бути застосований у хворих з нирковою недостатністю, які перебувають на хронічному діалізі.
|
1. Перерахувати добову дозу морфіну на бупренорфін за коефіцієнтом середньо 100:1а і вибрати пластир з такою ж, або з найбільш близькою добовою дозою бупренорфін (напр., для 84 мг морфіну — бупренорфін 35 мкг/год)б. 2. Після аплікації першого пластиру знеболююча концентрація досягається після 12–24 год, але він продовжує накопичуватися протягом 32–54 год. Продовжуйте лікування морфіном протягом ≥12 год; можете застосувати: а) препарат із негайним вивільненням п/о — після аплікації пластиру та через 4 і 8 год; б) препарат, що забезпечує контрольоване вивільнення протягом 12 год — коли пластир буде наклеїний. 3. Призначити пацієнту, при необхідності, рятувальну дозу морфіну (у вигляді препарату з негайним вивільненням). 4. Потреба у рятувальній дозі на 4-й день після застосування пластирав. Через тривале досягнення фармакологічної рівноваги (>9 днів), не збільшуйте дозу бупренорфіну раніше ніж через 7 днів (після другого пластиру). 5. Через менш виражений скріплюючий ефект бупренорфіну, у порівнянні з морфіном, при переході з морфіну на бупренорфін зменшіть вдвічі дозу проносних препаратів (а потім титрувати їхню дозу). 6. Змінюйте пластир кожні 72–96 год; у випадку препаратів, які допускають застосування кожні 96 годин)г; щоб зменшити ризик помилок дозування, можете встановити фіксовані дні та години (напр., понеділок 8:00, четвер 20:00). 7. Пам’ятайте про рятувальні дози опіоїдів з негайним вивільненням (зазвичай, морфін), складаючих 1/12–1/6д добової дози бупренорфіну (після перерахунку на морфін). Напр., при застосуванні пластиру 35 мкг/год рятувальна доза п/о морфіну з негайним вивільненням, як правило, 5–10 мг (при використанні коефіцієнту 75:1) або 7,5–15 мг (при використанні коефіцієнту 100:1), деколи достатньо меншої дози. Можна також використати сублінгвальний бупренорфін (50 % біодоступність). |
|
a в Palliative Care Formulary рекомендується співвідношення 100:1; European Association for Palliative Care — 75:1; виробник ЛЗ 75–115:1. б Примітка: залежно від показань для переходу на інший опіоїд слід враховувати зменшення початкової дози другого опіоїду по відношенню до значення, розрахованого на основі таблиць еквівалентності анальгетичної (початкова доза зменшується на 25–75 %; зменшення дози тим більше, чим вища доза першого опіоїду, яку раніше вводили або показанням до заміни опіоїду була відсутність знеболюючого ефекту, розвиток толерантності до першого опіоїду, опіоїдна гіпералгезія). Польські експерти (2017) також нагадують, що у пацієнтів із периферичним набряком та/або асцитом дозу гідрофільного морфіну не слід у простий спосіб конвертувати в ліпофільні опіоїди, оскільки у таких випадках висока доза морфіну може бути результатом великого об’єму розподілу. в У зв’язку з відмінностями у фармакокінетиці препаратів, цей опис відноситься до препарату бупренорфіну, який дозволяє застосовувати препарат кожні 96 год. г Пластирі генеричного препарату слід змінити макс. після 72 год. ґ згідно з Palliative Care Formulary 8; за польськими рекомендаціями (2017) 10–20 % |
У ≈10 % пацієнтів після переводу з морфіну на фентаніл або бупренорфін виникає абстиненція, яка триває декілька днів, в основному, у вигляді шлунково-кишкових розладів. Призначення додаткових доз морфіну, зазвичай, призводить до полегшення цих симптомів. Якщо потрібно зняти пластир, слід пам’ятати, що концентрація препарату у крові утримується протягом ≥24–30 год. Через можливу наявність у пластирі слідів феромагнітних речовин його слід зняти перед МР-дослідженням і наклеїти новий пластир після цього.
5. Тапентадол: агоніст опіоїдного μ-рецептора та інгібітор зворотного захоплення норадреналіну. Комплексний механізм його дії пояснюється не тільки позитивним анальгетичним ефектом, особливо при невропатичному болі, але також нижчою (у порівнянні з типовими опіоїдами) вираженістю і частотою появи небажаних ефектів з боку ШКТ. Макс. доза 250 мг 2 × на день.
6. Метадон: опіоїд показаний, якщо необхідно замінити сильний опіоїд (як правило, морфін) на інший препарат через непереносимість небажаних ефектів або розвиток толерантності. Можна застосовувати при нирковій недостатності та у хворих, які перебувають на програмному діалізі. Враховуючи фармакокінетику, зокрема тривалий період напіввиведення, лікування метадоном повинен проводити фахівець.
Титрування «сильного» опіоїду після переходу з ІІ ступеню анальгетичної драбини зазвичай переводиться із використанням п/о препаратів із швидким вивільненням діючої речовини або із модифікованим вивільненням. Найчастіше із цією метою використовується морфін; як альтернативу можна застосувати оксикодон. Вибір між титруванням із застосуванням препаратів морфіну із швидким або контрольованим виведенням залежить головним чином від преференції хворого, але також і клінічної ситуації:
1) класичне титрування (→табл. 22.1-1) із застосуванням препаратів морфіну з негайним вивільненням є особливо рекомендованим у хворих, які страждають через погано контрольований біль (аналгетичний ефект починає з’являтись вже після 30 хв від прийому ЛЗ і триває ≈4 год);
2) якщо слабкі опіоїди у максимальних дозах перестануть бути ефективними, а біль наростає дуже повільно, можна виконати заміну слабкого опіоїду на сильний, використовуючи препарат з контрольованим (а не швидким) вивільненням, напр., морфін 20 мг (10–30 мг) п/о кожні 12 год, оксикодон 10 мг кожні 12 год. Завжди потрібно забезпечити можливість призначення дози сильного опіоїду (як правило, морфіну) у формі з швидким вивільненням і, у разі потреби (на основі кількості прийнятих рятувальних доз), збільшуйте дозу на регулярній основі. Темпи зростання регулярної дози залежать від фармакокінетики (напр., для морфіну з контрольованим вивільненням, вводять кожні 12 год — не частіше, ніж кожні 48–72 год);
3) у разі дуже сильних болів може бути призначено швидке титрування сильних опіоїдів, зазвичай, вводять парентерально, напр., морфін в/в 1–2 мг кожні 10 хв (в екстремальних ситуаціях інтервал між наступними дозами в/в можна скоротити до 5 хв) або 2–5 мг п/ш кожні 30 хв (в екстремальній ситуації інтервал між послідовними дозами п/ш можна скоротити до 20 хв) аж до початку помітного зниження болю або появи побічних ефектів (сонливість). Продовження лікування — безперервна інфузія в/в чи п/ш, або фракціоновано п/ш чи п/о. Необхідно постійно стежити за пацієнтом та забезпечити доступність налоксону. У пацієнтів з порушеною периферичною перфузією (напр., зневоднення, шок, гіпотермія) всмоктування підшкірно введених препаратів може сповільнюватися, а поліпшення перфузії може призвести до раптового всмоктування препарату з «депо» у підшкірній клітковині.
1. Сонливість у денний час — зазвичай, з’являється на початку лікування опіоїдами чи після значного збільшення дози і зникає через кілька днів. Якщо сонливість утримується або збільшується → потрібно спробувати зменшити дозу опіоїду до такої, при якій біль починає повертатися; у подальшому потрібно взяти до уваги інші можливі причини сонливості (напр., інші ЛЗ, дегідратація, ниркова недостатність, гіперкальціємія) і у разі їх виявлення — потрібно вжити відповідних заходів. Стійка сонливість може бути показом до зміни ЛЗ на інший опіоїд (→нижче).
2. Нудота і блювання — можуть виникнути у перші кілька днів застосування опіоїдів і, зазвичай, минають самостійно. Завжди попереджуйте хворого про можливість появи нудоти і блювання раннього типу, а також узгодьте з ним алгоритм дій у випадку їх виникнення (напр., забезпечте пацієнта протиблювотними ЛЗ для короткотривалого регулярного прийому або прийому «на вимогу»). Призначте з лікувальною метою метоклопрамід п/о або п/ш у дозі 10 мг 3 × на день (макс. 30 мг/добу, до 5 днів; окрім випадків коли призначався трамадол) або галоперидол 0,5–1,5 мг/добу п/ш, або п/о чи п/ш на ніч, а також «на вимогу» — не частіше, ніж кожні 2 год, а в подальшому — відповідне титрування; діапазон добових доз становить 0,5–5 мг. Якщо ЛЗ буде неефективним → зважте можливість заміни галоперидолу на левомепромазин (п/ш); почніть від 3–5 мг п/о, уникаючи надмірної седації (одноразові дози 1,25–2,5 мг можуть бути ефективними). Зважте використання інших протиблювотних ЛЗ. Завжди виключте інші причини нудоти, а якщо вона зберігається → зважте можливість заміни на інший опіоїд з даної групи.
3. Закреп — найбільш поширений небажаний ефект; зазвичай окрім немедикаментозного лікування, слід регулярно запобіжно застосовувати проносні засоби →табл. 1.20-1;
4. Інші: сухість у роті, свербіж, затримка сечовипускання, пітливість, порушення когнітивних функцій і концентрації уваги, іноді — нейротоксичність (з міоклонією, сплутаністю свідомості і гіперальгезіями), пригнічення секреції ЛГ, ФСГ, АКТГ і GH, опіоїдні гіперальгезії.
Зміна одного опіоїду на інший необхідно використовувати у разі нестерпних і резистентних до лікування побічних ефектів або розвитку толерантності до даного опіоїду. У зв’язку із неповною перехресною толерантністю між опіоїдами, потрібно знизити початкову дозу опіоїду до меншої величини, що розраховується на основі таблиці еквівалентності знеболюючого ефекту (початкова доза зменшується на 25–75 %; тим більше зниження дози, чим більша доза раніше вживаного опіоїду або показанням до зміни опіоїду було недосягнення знеболювального ефекту, розвиток толерантності до першого опіоїду, опіоїдна гіпералгезія). Показана консультація фахівця з паліативної медицини або медицини болю.
Занепокоєння повинно викликати зменшення частоти дихання <8–10/хв, точкові, слабо реагуючі на світло зіниці та порушення свідомості. У такому випадку потрібно скерувати хворого до лікарні (якщо він вдома), відмінити чергову дозу опіоїду або видалити патч, забезпечити адекватну гідратацію хворого з метою збільшення діурезу, забезпечити прохідність дихальних шляхів та доступ до кисневої терапії. У разі проявів пригнічення центру дихання — застосувати налоксон в/в. У випадку безпосередньої загрози для життя (напр., непритомний хворий, з поодинокими дихальними рухами, або який не дихає) лікування зазвичай починається з дози 0,4 мг. В інших ситуаціях використовуйте нижчі дози (для запобігання рецидиву болю та гострого абстинентного синдрому): 0,04–0,1 мг в/в кожні ≈2 хв і контролюйте ступінь свідомості (можливість легкого розбудження хворого), і відновлення ефективного дихання (зазвичай частота дихання >10/хв і відсутність ціанозу). Слід пам’ятати про те, що якщо опіоїд продовжує всмоктуватись, може бути необхідним введення додаткових доз налоксону в/в; це особливо стосується трансдермальних форм опіоїдів. У зв’язку із високою афінністю бупренорфіну до опіоїдного рецептора, при його передозуванні доза налоксону в/в повинна бути набагато більшою і вводитись впродовж тривалішого часу (продовження як безперервна інфузія).
ЛЗ, які не є анальгетиками, але при певних типах болю виявляють свою знеболюючу дію або підтримують дію анальгетиків. Використовуються, переважно, для лікування невропатичного болю.
1. Протиепілептичні препарати:
1) габапентин — зареєстрований для лікування невропатичного болю, краще переноситься, ніж старіші протиепілептичні ЛЗ, має менше взаємодій з іншими ЛЗ; застосовувати спочатку у вечірній час 200–300 мг (100 мг — у осіб похилого віку або кахектичних пацієнтів), збільшуючи на початку дозу кожні 2–3 дні на 300 мг/добу (на 100 мг/добу — у осіб похилого віку або кахектичних пацієнтів), залежно від ефекту. Найбільш поширеним побічним ефектом збільшення дози є сонливість. У молодих пацієнтів без кахексії та ниркової недостатності, які не приймають ЛЗ, що пригнічують ЦНС, можна швидко (протягом декількох днів) збільшити дозу до 300 мг 3 × на день. Максимальна доза — 1200 мг 3 × на день. Потрібно корегувати дозу при нирковій недостатності та під час гемодіалізу.
2) прегабалін — зареєстрований для лікування невропатичного болю; зазвичай краще переноситься ніж габапентин, має менше взаємодій з іншими ЛЗ; застосовується спочатку 75 мг 2 × на день; за необхідності дозу поступово збільшують кожні 3–7 днів → 150 мг 2 × на день → 225 мг 2 × на день → 300 мг 2 × на день (макc. доза); слабким, виснаженим пацієнтам слід починати із 25–50 мг 2 × на день і обережно збільшувати дозування. Потрібно корегувати дозу при нирковій недостатності та під час гемодіалізу.
3) карбамазепін — спочатку 50–100 мг 2 × на день; повільно і поступово дозу збільшують до макс. 800–1200 мг/добу; слід пам’ятати про чисельні побічні ефекти та істотні взаємодії між ЛЗ (напр., карбамазепін не рекомендується застосовувати пацієнтам із сильним нейропатичним болем, що потребує застосування опіоїдів).
2. Антидепресанти: при невропатичному болі, спричиненому новоутворенням, підтверджено ефективність застосування дулоксетину, венлафаксину та трициклічних антидепресантів. З трициклічних антидепресантів у вказаній ситуації найчастіше застосовують амітриптилін (не поєднуйте з трамадолом або з метадоном). Схема підвищення дози в залежності від ефекту і небажаних проявів (ЛЗ призначають перед сном): початково 10 мг, з хорошою переносимістю через 3–7 днів — 25 мг, потім при необхідності підвищуйте дозу на 25 мг/добу кожні 1–2 тиж. Як правило, при лікування нейропатичного болю добова доза не перевищує 100 мг (в осіб віком >65 р. дози >75 мг/добу не рекомендовані). Дулоксетин зареєстрований для лікування болю при периферичній діабетичній нейропатії у дорослих і іноді пропонується як допоміжний анальгетик першого вибору для інших невропатичних болів у початковій дозі 30 мг/добу та збільшеній через 1–2 тижні до 60 мг/добу (макс. 60 мг 2 × на день). Венлафаксин застосовують у дозі 37,5 мг/добу, збільшуючи через 1 тиж. до 75 мг/добу, а потім, за необхідності, через 2 тиж. до дози 150 мг/добу. Деякі пацієнти можуть отримати користь від збільшення дози до 225 мг/добу. Дулоксетин і венлафаксин не можна застосовувати разом з трамадолом або метадоном.
3. Ад’ювантні ЛЗ (коанальгетики наступного вибору, або показані в особливих ситуаціях): антагоністи NMDA-рецептора (кетамін, декстрометорфан), блокатори натрієвих каналів (лідокаїн в/в), клонідин, баклофен, а у разі оссалгії — бісфосфонати, деносумаб і ГК. Ефективними для лікування різних видів периферичного невропатичного болю є пластирі з лідокаїном (особливо з супутньою аллодінією) і капсаїцин у пластирі і гелі.
1. Блокади і операції нейродеструкції (невроліз, термоліз, кріоліз, нейрохірургічні операції), можна розглянути, якщо: фармакологічне лікування неефективне чи неможливе, або у пацієнта є непереносимість ЛЗ; характер болю є показом для цього виду лікування, і пацієнт погоджується на інвазивні процедури і може бути відібраний до цього виду лікування.
1) невроліз сонячного сплетіння — показаний для лікування болю, що викликаний раком підшлункової залози, шлунку, печінки, жовчевого міхура, кишківника, нирок, заочеревинними метастазами або гепатомегалією та спленомегалією;
2) блокади і невроліз підчеревного сплетення — при раку, інших больових синдромах малої миски, болючих спазмах анусу;
3) блокади і невроліз шийно-грудного ганглію, поперекового симпатичного стовбуру, непарного ганглію Вальтера;
4) центральна блокада (спінальна і епідуральна) безперервним методом — виконується, якщо системне введення опіоїдів є малофективним або призводить до побічних явищ, які важко контролювати;
5) периферична блокада нервової системи за допомогою ін’єкцій тригерних точок, невролізу міжреберного нерву.
2. Променева терапія: метод першого вибору для локалізованого болю, що пов’язаний з метастазами у кістки (численні, розсіяні кісткові метастази можна виявити скануванням із в/в введенням радіоізотопів, напр., стронцій). Іноді, при лікуванні невропатичного болю, що, найчастіше, локалізується у ділянці малої миски (пухлини пресакральної ділянки, інфільтрація попереково-крижового з’єднання), у руці або плечі (пухлина Панкоста, метастази у пахвові, шийні і надключичні лімфатичні вузли).
3. Хірургічне лікування: напр., ятрогенні невропатичні болі — видалення нейробластоми, синдром перерізаного нерву; спинний мозок — декомпресія спинного мозку і стабілізація хребта; при болю, що викликаний метастазами у кістки — профілактична стабілізація кістки або ортопедична консервативна тактика, а також мініінвазивні методи, такі як вертебропластика, кіфопластика.
4. Черезшкірна електростимуляція нервів (TENS): у першу чергу, при післяопераційному болю і хронічних непухлинних болях.
5. Фізіотерапія (масаж, ЛФК, фізіотерапія): зменшує, в основному, м’язово-фасціальні болі або запобігає їхній появі.
6. Трудотерапія (навчити хворого функціонувати таким чином, щоб не індукувати біль, а також як відволікатись від болю) і психологічні методи.
ОСОБЛИВІ СИТУАЦІЇвгору
Біль, пов’язаний з пошкодженням або захворюванням сенсорної частини нервової системи, напр., в процесі інфільтрації пухлини, при паранеопластичному синдромі, після лікування пухлини (напр., постторакотомічний чи постмастектомічний синдром, полінейропатії після хіміотерапії, плексопатії після променевої терапії), як наслідок пошкодження (напр., компресійна мононевропатія), та при супутніх захворюваннях (напр., оперізуючий лишай, діабет, уремія, стан після інсульту).
Лікування:
1) «чистий» периферичний невропатичний біль внаслідок пошкодження периферичного нерву (напр., постгерпетична невралгія, больовий синдром після мастектомії) →рис. 22.1-2;
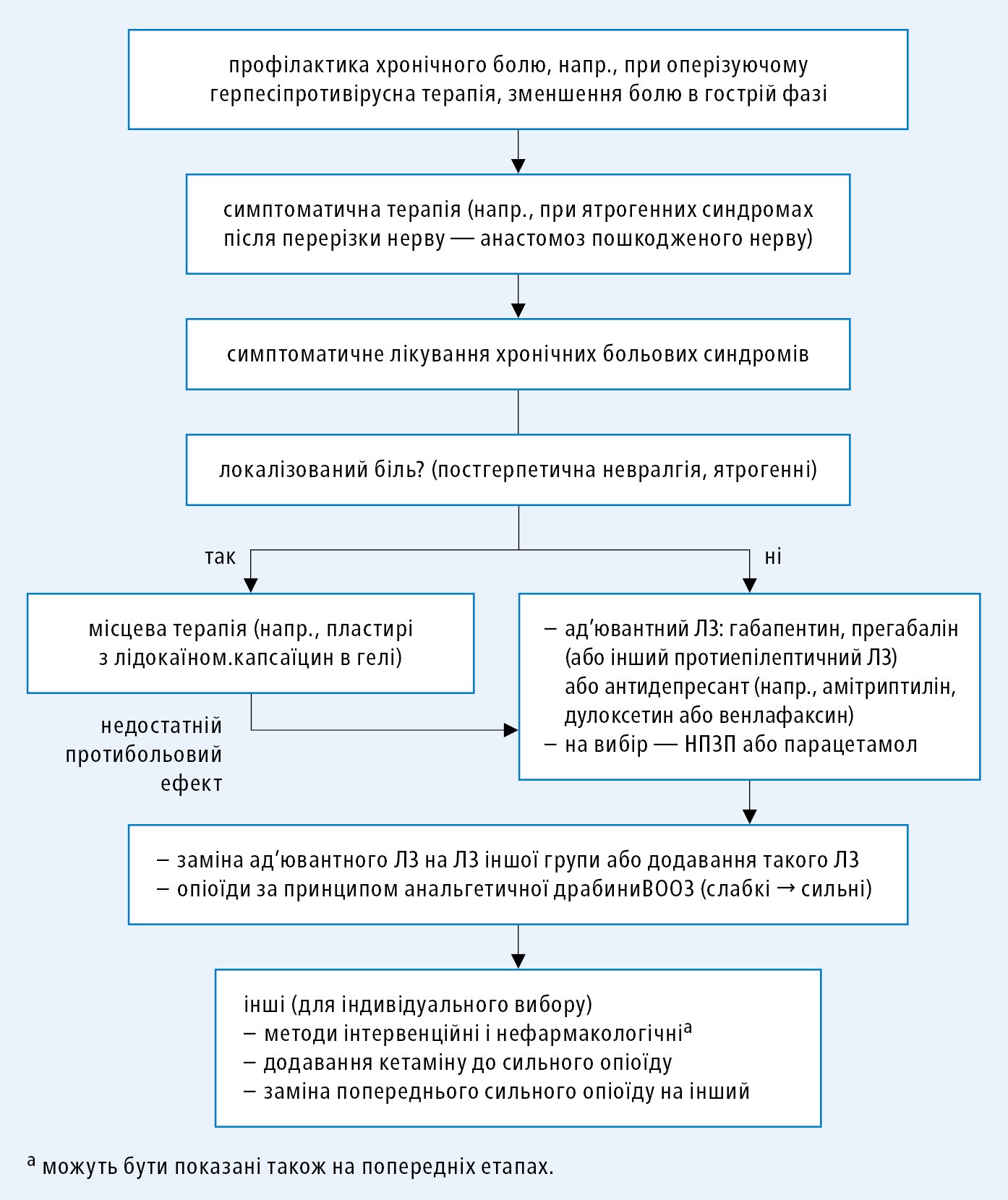
Рисунок 2. Aлгоритм лікування «чистого» невропатичного болю
2) «змішаний» невропатичний біль, спричинений пухлиною внаслідок складного патогенезу, лікування слід починати з анальгетиків згідно з анальгетичною драбиною, та додавати ад’ювантні ЛЗ — або одночасно, або тільки тоді, коли досягається найкращий з можливого, проте все ще недостатній ефект опіоїдного препарату →рис. 22.1-3.
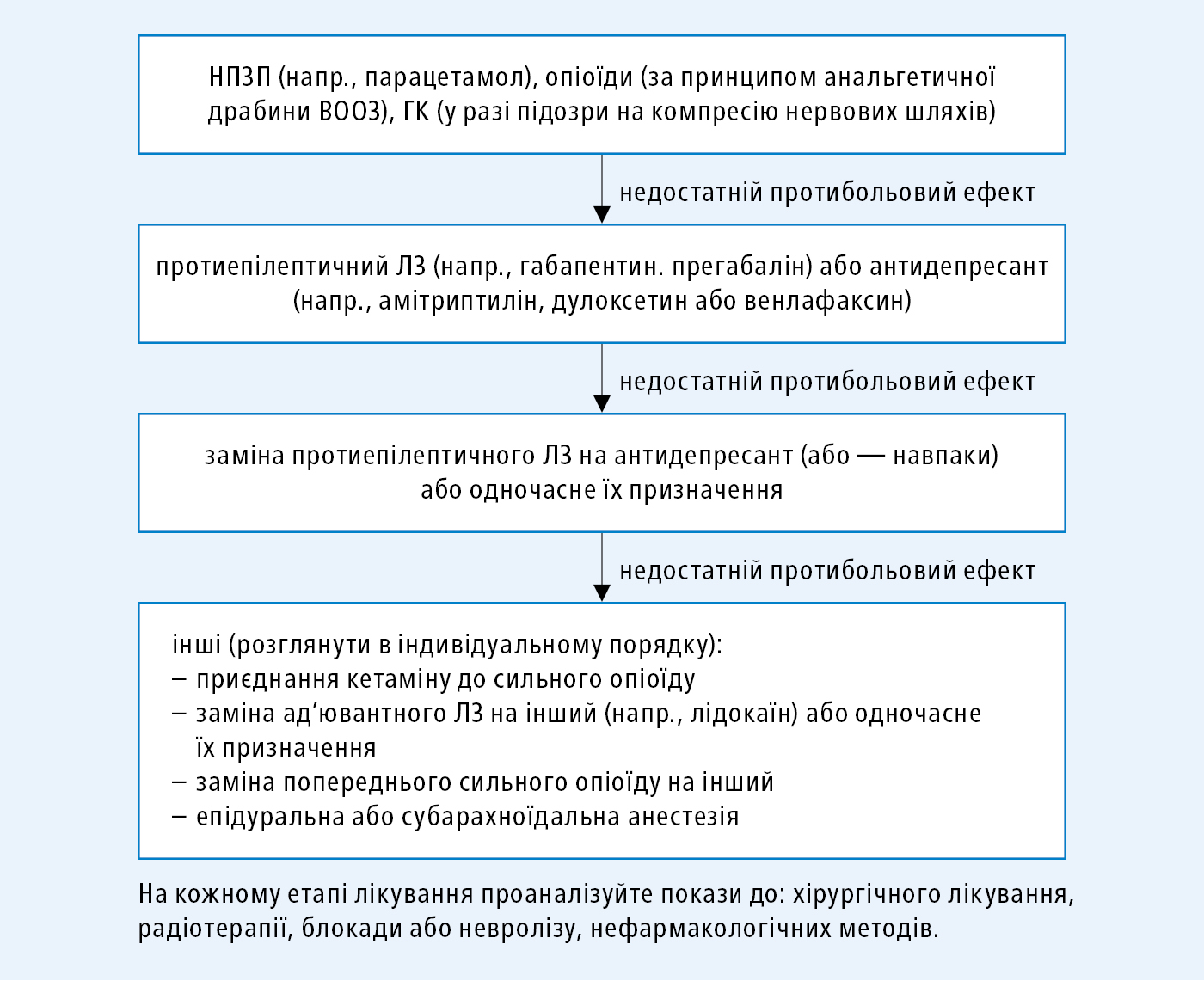
Рисунок 3. Лікування болю «змішаного» (з нейропатичним компонентом), що зумовлений пухлиною
Виникає, найчастіше, при метастазуванні пухлини у кістки (іноді не вдається виявити первинного вогнища), спочатку може бути тимчасовим, але, зазвичай, посилюється і стає постійним. Біль може бути спонтанним або спричинений рухом і масою тіла, часто виникають місцеві болі у кістках. Біль у кістках, спричинений метастазами раку, часто має, окрім ноцицептивного компоненту, також нейропатичний компонент (внаслідок патологічного росту нервових волокон навколо метастазу). Лікування →рис. 22.1-4.
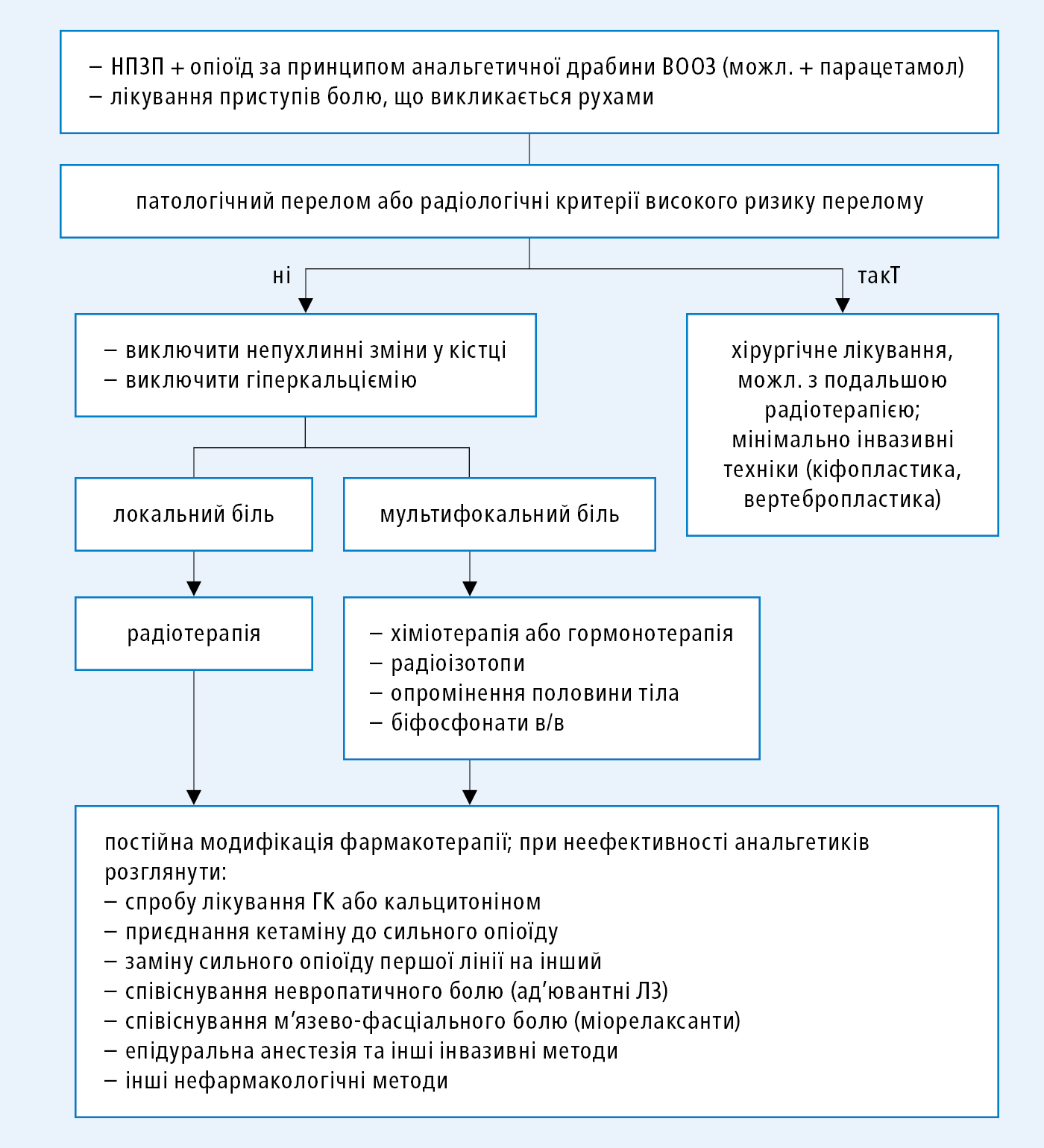
Рисунок 4. Алгоритм лікування болю кісток при пухлинах
Біль локалізується у м’язах або іррадіює, часто зустрічається у онкологічних пацієнтів на пізній стадії захворювання, особливо, у виснажених і знерухомлених хворих. Характеризується наявністю тригерних точок (ділянки м’язу, які не розслаблюються в результаті порушення функції кальцієвих каналів, і відчуваються при пальпації як болючі, тверді, веретеноподібні вузли чи валики). Тригерні точки можуть локалізуватися також у шкірі, підшкірній клітковині, зв’язках, післяопераційних рубцях. Натискування на тригерні точки викликає відчуття болю з іррадіацією чи без неї. Найбільш поширеним місцем локалізації є паравертебральна ділянка, головним чином, у поперековому, крижовому відділі, на сідницях, але можуть зустрічатись і у ділянці голови, шиї, передній частини тулуба і кінцівках. Усунення тригерних точок зменшує больові відчуття. Лікування: якщо стан пацієнта є задовільний, слід застосовувати фармакотерапію, якщо є потреба, лише протягом короткого часу, за допомогою фізіотерапії до відновлення нормальної довжини і сили м’язів, правильної постави і повного діапазону рухів у суглобах за допомогою вправ (регулярне розтягування м’язів), для лікування тригерних точок та контролю інших етіологічних факторів. При паліативній допомозі такий підхід часто є неможливим, тому ключовим стає симптоматичне лікування: блокада місцевим анестетиком тригерних точок (бупівакаїн) або ГК; місцеве охолодження м’язів і тригерних точок з одночасним пасивним розтягуванням; фізіотерапія (масаж, вправи); психотерапія (релаксація, медитація) і, за необхідності, НПЗП та міорелаксанти.
Раптове підсилення больових відчуттів, незважаючи на відповідну терапію хронічного болю. Проривний біль діагностують тільки при наявності обох критеріїв:
1) наявний стійкий чи тривалий біль, тобто тривалістю ≥12 год на добу, або такий біль був би присутній, якби пацієнт регулярно не приймав би анальгетики;
2) стійкий біль (чи тривалістю ≥12 год на добу) контролюється задовільно. Таким чином, умовою діагностики є впевненість, що терапія стійкого болю оптимальна. Розрізняйте ідіопатичний проривний біль (що не залежить від стимуляції) від спровокованого — викликаного визначеними відомими стимулами, напр., діагностичною чи лікувальною процедурою, передбачуваною ситуацією (рух) або складною до прогнозування (кашель). Намагайтеся встановити механізм проривного болю, та спробуйте вплинути конкретно на нього (напр., при нападоподібному невропатичному болю слід оптимізувати систематичне лікування через додання коанальгетиків, при наявності спровокованого болю, пов’язаного з метастазами у кістки, слід розглянути променеву терапію або оперативне лікування).
Медикаментозна терапія проривного болю заснована на призначенні «рятувальних доз» препарату, що вводиться при потребі з метою усунення проривного болю чи запобігання його виникненню. Зазвичай призначають препарат з негайним вивільненням і якомога швидшим початком дії. Іноді достатньо анальгіну, НПЗП або парацетамолу, проте частіше необхідно ввести опіоїди — зазвичай це пероральний препарат морфіну з негайним вивільненням. Величина рятувальної дози зазвичай знаходиться в проміжку 1/10–1/6 (або 10–20 %) добової дози опіоїду, що призначається систематично, з урахуванням еквівалентності доз (рятувальні дози опіоїдів титруйте індивідуально).
При прогнозованому спровокованому болю необхідно превентивно призначати анальгетик — напр., морфін п/о у формі препарату з негайним вивільненням за 30–60 хв до дії стимулу, що викликає біль. При ідіопатичному болю препарат призначайте тоді, коли виникає біль. Якщо проривний біль, особливо ідіопатичний, недостатньо усувається після прийому п/о морфіну у формі препарату з негайним вивільненням, розгляньте призначення фентанілу через слизову оболонку. Рятівні дози фентанілу не пов’язані з дозуванням опіоїда, що призначається систематично, тому їх слід титрувати окремо, починаючи з найменших дозувань.
Оптимальним методом терапії проривного болю (в частини хворих, зокрема в умовах стаціонару) може бути парентеральне введення опіоїдів. Проривний біль також може мати нейропатичний характер. У таких випадках оптимізація лікування хронічного нейропатичного болю або введення екстрених доз препарату, що використовується для лікування невропатичного болю (наприклад, пероральний або інтраназальний кетамін), може бути більш ефективним, ніж введення екстрених доз неопіоїдного або опіоїдного анальгетика.