DEFINICIÓN Y ETIOPATOGENIAArriba
La tuberculosis es una enfermedad infecciosa, causada por micobacterias ácido-alcohol resistentes del grupo Mycobacterium tuberculosis complex: Mycobacterium tuberculosis, Mycobacterium bovis y Mycobacterium africanum. Patogenia de la infección: inhalación de micobacterias → fagocitosis por macrófagos → proliferación dentro del macrófago → lisis del macrófago e infección de otras células → formación de granuloma tuberculoso (células epitelioides y células gigantes de Langhans) que rodea las células lisadas (focos de necrosis caseosa). Al mismo tiempo se desarrolla la respuesta inmunológica con participación de linfocitos Th1 CD4+, que activan los macrófagos (a través de IFN-γ). Las lesiones pueden remitir espontáneamente por fibrosis. En los pacientes con respuesta celular deficiente se produce fluidificación de la necrosis caseosa con intensa proliferación de bacilos pudiéndose formar cavitaciones. Antes de que se logre instaurar una respuesta inmunológica específica, los macrófagos que han fagocitado bacilos pueden pasar a la sangre periférica a través del sistema linfático y de esta forma causar una bacteriemia. A través de la sangre los bacilos alcanzan multitud de órganos, pero permanecerán activos solo en aquellas localizaciones con condiciones favorables para su crecimiento. Los bacilos pueden permanecer viables en el cuerpo humano durante mucho tiempo (infección latente por bacilo tuberculoso), y pasados muchos años de la primoinfección se pueden reactivar y dar lugar a una tuberculosis pulmonar o extrapulmonar.
Grupos de mayor riesgo de infección por bacilo tuberculoso o de contraer tuberculosis después de la infección: infectados por VIH, personas que han tenido un contacto reciente con enfermos bacilíferos, personas con lesiones pulmonares “mínimas” (visibles en radiografía de tórax), diabéticos, alcohólicos, drogadictos, indigentes, inmigrantes de áreas con alta prevalencia de tuberculosis, personas con déficit inmunológico (también a consecuencia de tratamientos inmunosupresores), uso de fármacos anti-TNF u otros fármacos biológicos con acción inmunosupresora, adultos >65 años de edad, fumadores de tabaco o personas con antecedentes del hábito tabáquico (aumento leve del riesgo de enfermedad), personas con IMC ≤20 kg/m2.
CUADRO CLÍNICO E HISTORIA NATURALArriba
Síntomas sistémicos (independientemente de la localización de la infección): fiebre, pérdida de apetito, pérdida de peso, sudoración nocturna, malestar general. Examen de sangre: generalmente los resultados son normales, en ocasiones se describe leucopenia o leucocitosis, anemia, VHS elevada, a veces hiponatremia e hipercalcemia.
Tuberculosis pulmonar
1. Síntomas: tos crónica (inicialmente seca, luego productiva con expectoración mucosa o purulenta), en ocasiones hemoptisis, disnea en algunas formas (en la neumonía caseosa, tuberculosis miliar o tuberculosis fibrocavitaria), que puede cursar con insuficiencia respiratoria.
2. Signos: en enfermos con alteraciones avanzadas pueden existir signos pulmonares de condensación, ocupación pleural, ruido de secreciones bronquiales, soplo cavitario o polipnea y dificultad respiratoria.
3. Exploraciones complementarias:
1) Radiografía de tórax: en la tuberculosis primaria sobre todo en niños (la enfermedad se produce poco después de la infección) aparecen condensaciones, con mayor frecuencia en los campos pulmonares medios e inferiores, con adenopatías hiliares y paratraqueales. En la tuberculosis posprimaria hay condensaciones especialmente en los segmentos apicales y posteriores de los lóbulos superiores y en los segmentos superiores de los lóbulos inferiores. Las condensaciones pueden ser de diferente densidad y en estadios avanzados pueden evolucionar a cavidades visibles como áreas radiolúcidas rodeadas de un halo de mayor densidad. En ocasiones, las lesiones infiltrantes adquieren forma de nódulos redondeados formados por masas caseosas (el denominado tuberculoma o caseoma). En los estados de inmunosupresión las lesiones pueden ser atípicas (condensaciones difusas en lóbulos inferiores, adenopatías mediastínicas o hiliares).
2) Pruebas bacteriológicas: se utilizan tinciones y cultivos específicos para detectar el bacilo en secreciones y tejidos, especialmente en la expectoración, que debe ser de buena calidad (mucopurulenta).
3) Prueba de la tuberculina: inyección intradérmica de tuberculina. Se comprueba el diámetro de la induración cutánea a las 48-72 h (en Chile a las 72 h). Un resultado positivo no diferencia la infección activa del contagio pasado. También puede ser positiva en personas que han recibido la vacuna BCG y en aquellas expuestas a micobacterias no tuberculosas. En Chile se considera positiva una induración ≥10 mm en sujetos inmunocompetentes.
4) Pruebas basadas en la producción de interferón γ por linfocitos T activados (IGRA, interferon-gamma release assay): tienen mayor especificidad (99 %) que la prueba de tuberculina. La vacunación BCG no afecta al resultado. Se utilizan el Quantiferon TB Gold Plus (por ELISA) con sensibilidad cercana a 95 % (punto de corte diagnóstico: ≥0,35 UI/ml) y el T-SPOT (Elispot) con sensibilidad hasta 90 % (punto de corte diagnóstico: ≥6).
4. Formas específicas de la tuberculosis pulmonar:
1) Tuberculosis miliar: es consecuencia de la diseminación hematógena de los bacilos. El curso clínico puede ser grave con fiebre alta y disnea intensa. La radiografía de tórax muestra imágenes micronodulares similares al grano de mijo (en los primeros 2-3 días de la diseminación la radiografía puede ser normal). Con frecuencia se acompaña de hepatomegalia y esplenomegalia, así como alteraciones en la médula ósea, el fondo de ojo (tubérculos coroideos) y el SNC debido a la siembra de bacilos con reacción tisular.
2) Neumonía tuberculosa (caseosa): predominan síntomas de toxemia con fiebre elevada héctica y disnea intensa. Es frecuente la hemoptisis. En el frotis de esputo se encuentran abundantes bacilos.
3) Tuberculosis fibrocavitaria: en casos de tuberculosis diagnosticada tardíamente o deficientemente tratada. Los enfermos suelen ser muy bacilíferos y con frecuencia albergan micobacterias resistentes a fármacos. En las cavernas curadas pueden desarrollarse infecciones bacterianas y fúngicas. Puede existir disnea.
Tuberculosis extrapulmonar
1. Pleuritis tuberculosa: habitualmente se desarrolla pocos meses después de la infección primaria. El paciente presenta fiebre, tos seca, a veces disnea y dolor torácico de carácter pleurítico. El derrame pleural es generalmente unilateral, con abundantes células (inicialmente predominan neutrófilos, luego linfocitos), elevada concentración de proteínas y actividad aumentada de adenosina-deaminasa (ADA). En ~30 % de los casos se pueden cultivar micobacterias a partir del líquido pleural.
2. Tuberculosis ganglionar: se presenta principalmente en niños y adultos jóvenes. Las adenopatías se localizan en regiones ganglionares anteriores y posteriores del cuello, supraclaviculares y rara vez en regiones axilares o inguinales. Los ganglios están aumentados de tamaño, son duros, indoloros y la piel permanece sin cambios. Con el tiempo se ablandan y se fistulizan. En ~50 % de los casos se asocia a focos pulmonares.
3. Tuberculosis genitourinaria: predominan síntomas locales (polaquiuria o disuria), a menudo discretos. En las mujeres la afectación del aparato genital puede manifestarse por dolor pélvico y trastornos de la menstruación. La enfermedad puede ocasionar esterilidad. En los hombres puede desarrollarse prostatitis o epididimitis.
4. Tuberculosis osteoarticular: en países con poca incidencia de tuberculosis aparece principalmente en personas mayores. Suele presentar un curso muy prolongado antes de comenzar las manifestaciones clínicas. Síntomas principales: dolor, edema y limitación funcional articular. Inicialmente se daña el disco vertebral (espondilodiscitis) y secundariamente el cuerpo vertebral produciendo fracturas. Se pueden formar colecciones de material caseoso en las zonas paravertebrales (“abscesos fríos”) en contacto con el músculo psoas, que se pueden extender hacia el canal espinal, produciendo compresión medular. Más frecuentemente afecta al segmento toracolumbar y sacro, pueden afectarse las grandes articulaciones. En articulaciones periféricas se presenta como monoartritis.
5. Tuberculosis del SNC: más frecuente en niños como meningitis tuberculosa o en forma de tuberculomas. La inflamación se localiza principalmente en la base encefálica y provoca lesiones de los nervios craneales (más característicos los nervios oculomotores) y obstaculiza la circulación del LCR ocasionando hidrocefalia. Síntomas: somnolencia, cefalea, náuseas, vómitos y rigidez de nuca, a menudo también paresias, así como síntomas piramidales y cerebelosos, alteración de la conciencia y convulsiones. Deja secuelas neurológicas.
6. Tuberculosis del tracto digestivo: se presenta con escasa frecuencia. La tuberculosis gástrica e intestinal se manifiesta con febrícula, adelgazamiento, diarrea, náuseas, dolor abdominal. A veces se presentan síntomas de apendicitis u obstrucción intestinal. Puede además ocasionar ascitis (tuberculosis peritoneal) y linfoadenopatias retroperitoneales y mesentéricas o desarrollar una lesión focal sugerente de neoplasia.
7. Otras formas de tuberculosis extrapulmonar: tuberculosis pericárdica, cutánea, esplénica, hepática, etc. Recordar que la tuberculosis puede afectar a todos los órganos.
DIAGNÓSTICOArriba
Procurar siempre obtener confirmación bacteriológica.
En los enfermos con sospecha de tuberculosis pulmonar se deben solicitar ≥2 muestras de esputo para tinción y cultivo sobre medios sólido o líquido (este último medio desarrolla el cultivo de la micobacteria más precozmente). La norma nacional de Chile actual recomienda 2 muestras inmediatas de expectoración simultáneas para enviar a estudio de pruebas moleculares con GenXpert MTB/RIF, con el fin de procesar la mejor muestra y disponer de muestra suficiente para realizar cultivo líquido mediante MGIT, y, eventualmente, realizar otra prueba molecular rápida con GenXpert XDR para estudio ampliado de detección para mutaciones en genes de resistencia a isoniazida, fluoroquinolonas e inyectables (en los servicios que disponen de esta tecnología). En caso de pacientes con VIH los laboratorios realizan además baciloscopias para tamizaje de micobacterias ambientales. En caso de que el paciente no logre expectorar una muestra adecuada → inducción de esputo con solución salina hipertónica de NaCl. Se pueden obtener muestras realizando lavado broncoalveolar mediante broncoscopia en casos de alta sospecha de enfermedad. Es útil solicitar un examen del esputo expectorado tras finalizar la broncoscopia. Considerar que la sensibilidad de la baciloscopia solo es cercana al 50 % debido a que requiere 5000-10000 bacilos/ml de expectoración para resultar positiva. En caso de un resultado negativo del examen bacteriológico de esputo se puede realizar un test de diagnóstico molecular llamado GenXpert MTB/RIF, que es un método automatizado basado en la amplificación del ADN de la micobacteria a través de la PCR, que permite detectar en 2 h la presencia de ADN de Mycobacterium tuberculosis. Realizar un estudio microbiológico para tuberculosis (incluidos examen molecular y cultivo) y un examen histológico de los tejidos obtenidos de todas las localizaciones en las que se sospeche infección por esta bacteria con el fin de buscar procesos inflamatorios crónicos con granulomas y necrosis caseosa. En enfermos graves con alta sospecha clínica de tuberculosis se podría iniciar el tratamiento antituberculoso independientemente del resultado de las pruebas listadas más arriba. Los resultados negativos no descartan una tuberculosis y no indican que se deba suspender el tratamiento.
Criterios diagnósticos de tuberculosis pulmonar sin confirmación bacteriológica:
1) resultados negativos de todas las pruebas bacteriológicas (debe obtenerse una muestra adecuada para el examen bacteriológico a través de cualquier método disponible: inducción del esputo, broncoscopia, aspiración de contenido gástrico)
2) alteraciones radiológicas sospechosas de tuberculosis (debe realizarse una TC de alta resolución donde pueden observarse típicos nódulos extralobulillares diseminados que indican tuberculosis miliar, y/o nódulos intralobulillares en forma de un árbol en brote, pequeñas cavidades)
3) falta de respuesta al tratamiento antibiótico de amplio espectro en pacientes con lesiones pulmonares sin evidencias de neoplasia (evitar fluoroquinolonas, ya que son activas frente a Mycobacterium tuberculosis y pueden producir una respuesta temporal en los enfermos con tuberculosis).
La tuberculosis debe tenerse en cuenta en el diagnóstico diferencial de todos los casos de alteración en la radiografía de tórax, incluso cuando dichas lesiones no son típicas de tuberculosis. Se debe sospechar tuberculosis en los casos de tos productiva purulenta que persiste 2 semanas, en casos de neumonía que no responde al tratamiento estándar, particularmente cuando se asocian a cavitación o derrame pleural. Las siguientes condiciones requieren descartar tuberculosis extrapulmonar: fiebre de etiología desconocida, adenopatías, piuria estéril, meningitis persistente con parálisis de pares craneales, enfermedades intestinales inflamatorias (sobre todo la enfermedad de Crohn), casos seleccionados de esterilidad en mujeres y procesos inflamatorios persistentes del sistema osteoarticular.
En la tuberculosis extrapulmonar realizar radiografía de tórax y, de ser posible, también cultivo del esputo. Las lesiones extrapulmonares contienen generalmente menos bacilos y el diagnóstico se basa con frecuencia en los hallazgos histopatológicos (nota: los granulomas tuberculoides pueden encontrarse en muchas enfermedades y no en todos los casos de tuberculosis se observa una necrosis caseosa). Puede resultar útil realizar cultivos de Koch de los tejidos obtenidos por biopsia y una PCR para Mycobacterium tuberculosis en tejidos (Xpert MTB/RIF).
En infectados por VIH las alteraciones pulmonares dependen del grado de inmunodeficiencia. Los cuadros clínicos clásicos son típicos de la fase temprana de la enfermedad. En etapas avanzadas la enfermedad se localiza en las regiones inferiores y medias del pulmón o tienen carácter diseminado. Las cavitaciones se presentan raramente. A menudo la prueba de tuberculina es negativa, el resultado de IGRA puede ser “indeterminado” y son menos frecuentes los resultados positivos del examen directo del esputo (la probabilidad aumenta junto con el número de las pruebas realizadas, sobre todo cuando el material proviene del esputo inducido o de la secreción obtenida mediante broncoscopia). En estos casos, además de los cultivos del esputo, se deben realizar hemocultivos y biopsia de ganglios linfáticos y de médula ósea. Es importante también solicitar pruebas de sensibilidad de los bacilos.
TRATAMIENTOArriba
Basado en las recomendaciones actuales de la OMS.
1. Reglas generales de tratamiento:
1) Los esquemas de tratamiento deben contener ≥3 fármacos en la fase intensiva y ≥2 fármacos en la fase de continuación a los cuales las micobacterias aisladas son probablemente sensibles.
2) A un esquema ineficaz no se debe añadir un único fármaco nuevo, ya que puede ocasionar el desarrollo de resistencia a este fármaco (amplificación del patrón de resistencia).
3) El tratamiento debe ser supervisado con el fin de evitar el incumplimiento del tratamiento por parte del enfermo, lo que puede ocasionar resistencia y fracaso o letalidad. Educar al paciente para identificar los efectos colaterales de los fármacos y garantizar la salud pública (p. ej. identificación oportuna de recidiva de la enfermedad para acortar el tiempo de contagio comunitario).
4) Al inicio del tratamiento se debe notificar cada caso a la autoridad sanitaria en forma diaria y obligatoria (en Chile a la Secretaría Regional Ministerial de Salud correspondiente) mediante un boletín electrónico (ENO). Además posteriormente cada servicio de salud envía sus casos a un registro nacional de tuberculosis en el Ministerio de Salud.
5) Antes de comenzar el tratamiento hay que analizar las enzimas hepáticas, bilirrubina, urea, creatinina, ácido úrico y plaquetas. En Chile se recomienda realizar exploración oftalmológica en caso de utilizar etambutol (ETB) en forma prolongada (>2 meses) o en pacientes con daño ocular previo, o que durante el curso de la terapia refieren problemas visuales (en la fase diaria de 2 meses con este fármaco a dosis de 25 mg/kg es infrecuente la aparición de neuritis óptica). Es necesario en todo caso de tuberculosis identificar la infección por el VIH y realizar en los cultivos positivos estudio de sensibilidad a todos los fármacos de primera línea en el laboratorio de referencia como parte de la vigilancia de resistencia a fármacos (en Chile es el Instituto de Salud Pública, ISP), independientemente de la realización de GenXpert realizada en el propio servicio de salud. La muestra directa de la expectoración contribuye a descartar la probabilidad de farmacorresistencia a rifampicina (detección de mutación de gen RpOB que confiere resistencia a rifampicina). Además, hay que valorar la capacidad de adhesión del paciente.
6) Vigilar la aparición de efectos adversos e interacciones medicamentosas.
Ocasionalmente en personas en estado grave por una enfermedad en la que existe alta sospecha de tuberculosis y en las personas con elevado riesgo de progresión para tuberculosis (infectadas por VIH, pacientes con tratamiento anti-TNF) con cuadros clínicos sugerentes de tuberculosis se puede iniciar inmediatamente un tratamiento estándar con 4 fármacos (sin esperar los resultados de las pruebas microbiológicas).
2. Fármacos tuberculostáticos:
1) fármacos básicos (de elección) →tabla 3.15-2
2) fármacos de segunda elección: rifabutina, rifapentina, etionamida (ETA), capreomicina (CAP), cicloserina (CS), ácido paraaminosalicílico (PAS), kanamicina (KM), amikacina, algunas fluoroquinolonas (levofloxacina, moxifloxacino, gatifloxacino), bedaquilina (BDQ), delamanid (DLM), linezolid, clofazimina (CFZ) y otros (en Chile la claritromicina y azitromicina es utilizada frecuentemente en el tratamiento de infecciones no tuberculosas).
3. Glucocorticoides: se utilizan en estados de riesgo vital. Tienen indicación absoluta en la insuficiencia suprarrenal en el curso de la tuberculosis de las glándulas suprarrenales. Considerar además que la RMP reduce los niveles de cortisol y puede ser necesario un aumento de la dosis de glucocorticoides en pacientes que reciben este fármaco. También son utilizados en los siguientes casos: pericarditis aguda (prednisona durante 6-12 semanas, inicialmente a dosis de 60 mg/d, disminuir gradualmente después de 2-3 semanas), meningitis y encefalitis en enfermos con alteraciones de conciencia y síntomas de hipertensión intracraneal (prednisona durante 6-8 semanas, inicialmente a dosis de 20-40 mg/d, disminuir gradualmente después de 2-3 semanas, o dexametasona a dosis de 8-12 mg/d), pleuritis y peritonitis exudativas de curso grave (prednisona a dosis de 20-40 mg/d durante 1-2 semanas), estenosis de las vías respiratorias con riesgo vital, tuberculosis ganglionar con síntomas de compresión de las estructuras adyacentes, reacciones severas por hipersensibilidad a los fármacos tuberculostáticos (en caso de no poder sustituirlos por otros fármacos), síndrome inflamatorio en el curso de reconstitución inmunológica en enfermos infectados por el VIH (→más adelante).
4. Tratamiento de nuevos casos de tuberculosis:
1) Fase inicial → rifampicina (RMP), isoniazida (INH), pirazinamida (PZA) y etambutol (ETB) durante 2 meses.
2) Fase de continuación → RMP e INH durante 4 meses a diario o 3 × semana.
Excepciones:
1) sospecha de infección por micobacterias resistentes a fármacos →más adelante
2) meningitis tuberculosa → se podría usar estreptomicina (SM) en lugar de ETB (indicación no contemplada en la norma de terapia nacional de Chile) y prolongar la fase de continuación hasta 7-10 meses; se deben utilizar además glucocorticoides
3) tuberculosis osteoarticular → prolongar la fase de continuación por 3 meses
4) en presencia de cavernas pulmonares y cultivo de esputo positivo al final de la fase intensiva → prolongar la fase de continuación por 3 meses más si hay sensibilidad a isoniazida (administrar durante 7 meses en fase trisemanal; en Chile se utiliza solo terapia diaria) con el fin de reducir las posibilidades de recaída
5) necesidad de usar otro esquema de tratamiento diferente al tratamiento estándar:
a) enfermos en los que no es posible usar PZA en la fase inicial del tratamiento (frecuentemente ocurre intolerancia en ancianos y en embarazadas o hepatitis por PZA) → usar INH, RMP y ETB durante los 2 primeros meses y luego INH y RMP durante los siguientes meses en forma diaria por 7 meses
b) enfermos con daño hepático o con trasplante de órganos (→más adelante)
6) enfermos con contraindicaciones para el tratamiento con ETB → puede discontinuarse este fármaco si el bacilo es sensible a los demás fármacos de primera línea.
En enfermos que exigen una prolongación de la fase de continuación usar fármacos tuberculostáticos diariamente. El enfermo debe tomar todas las dosis de la fase intensiva (56 dosis de cada fármaco) durante ≤3 meses. En la fase de continuación estándar cada fármaco se administra durante hasta 6 meses (126 dosis; en Chile 80 dosis, ya que no se administra ambulatoriamente los sábados y domingos). El tratamiento estándar completo (se supone que dura 6 meses) no puede durar más de 9 meses.
5. Vigilancia de los efectos adversos del tratamiento: pruebas de laboratorio y consulta oftalmológica en caso de sospecha. El efecto adverso más frecuente del esquema básico de tratamiento es la afectación hepática. Si se produce un aumento asintomático de la actividad de AST y ALT ≤5 × LIN y ≤3 × LSN, no se requiere interrumpir el tratamiento. En caso de superar estos límites → suspender temporalmente RMP, INH, ETB y PZA (la conducta habitual es suspender todos los fármacos para no ocasionar resistencia por usar esquemas débiles). En enfermos de alto riesgo de afectación hepática determinar las concentraciones de AST y ALT transcurridos 7 y 14 días desde el inicio del tratamiento y posteriormente cada mes hasta la finalización del tratamiento. En los demás casos, los niveles de AST y ALT pueden determinarse 1 × mes en todo momento ante la aparición de síntomas digestivos (náuseas, vómitos, dolor abdominal, ictericia). Se deben suspender los fármacos hepatotóxicos cuando la ALT/AST >5 × LIN aunque sea asintomático y cuando la ALT/AST >3 × LSN y se acompañan de síntomas digestivos (ictericia, náuseas, pérdida de apetito, flatulencia o dolor abdominal). Si la ALT y la AST disminuyen a <2 × LSN → reintroducir los fármacos suspendidos anteriormente, inicialmente la RMP y el ETB y luego progresivamente la INH (excepto PZA) y controlar periódicamente la actividad de AST y ALT. El tratamiento sin PZA debe durar 9 meses. A la espera de la disminución de los niveles de AST/ALT se debe interrumpir completamente el tratamiento antituberculoso o, si lo requiere la situación clínica, utilizar SM, ETB y alguna fluorquinolona (en Chile esta decisión requiere la evaluación del referente técnico del programa de control de la tuberculosis que se encuentra en los diferentes servicios de salud).
6. Vigilancia de la respuesta al tratamiento: realizar examen microbiológico de esputo al final de la fase intensiva. En caso de baciloscopia positiva al final del 3.er mes de tratamiento → solicitar cultivo y pruebas de farmacosensibilidad. Una baciloscopia positiva durante el 4.° mes significa fracaso del tratamiento si además el cultivo es positivo (consenso en Chile). En un paciente que retorna al tratamiento hay que realizar examen de baciloscopia, cultivo del esputo y farmacosensibilidad. En el caso de tuberculosis multirresistente (TB-MDR): durante todo el tratamiento realizar baciloscopia y cultivo del esputo cada mes; volver a realizar un examen de farmacosensibilidad extendida a fármacos de segunda línea en caso de cultivo positivo después de 4 meses de tratamiento. Los resultados del tratamiento para la tuberculosis extrapulmonar se valoran más frecuentemente mediante estudios clínicos. En Chile se realiza baciloscopia de esputo y cultivos líquidos (MGIT) mensualmente durante todo el tratamiento en los casos de tuberculosis pulmonar bacteriológicamente demostrados.
7. Enfermos tratados de tuberculosis con anterioridad: realizar una prueba molecular rápida y siempre antibiograma en medios sólidos (en Chile se realiza estudio de susceptibilidad a fármacos de TBC (RMP, IHN, fluoroquinolonas, inyectables) mediante pruebas moleculares rápidas.
8. Tratamiento de tuberculosis farmacorresistente: se distingue monorresistencia y multirresistencia (los bacilos son resistentes por lo menos a INH y RMP), pre-XDR (preextrarresistentes son bacilos resistentes a INH, RMP y fluoroquinolonas) y XDR (extrarresistentes, es decir, con resistencia extendida, son bacilos con multirresistencia que son resistentes adicionalmente a bedaquilina y/o linezolida, y a fluoroquinolonas:
1) Resistencia a INH → se puede utilizar RMP + ETB + PZA diariamente 6-9 meses excepto en casos con lesiones pulmonares extensas o pacientes bacilíferos, donde inicialmente es necesario agregar moxifloxacina, levofloxacina o amikacina diariamente durante todo el tratamiento (en Chile, esta decisión terapéutica debe ser autorizada por el referente técnico del programa de tuberculosis local).
2) Resistencia a RMP: tratar a los pacientes como TB-MDR. Para la TB-MDR y TB-XDR se utilizan fármacos de los grupos establecidos por la OMS 2019 (los más activos pertenecen a los grupos A y B):
a) grupo A — fluoroquinolonas: levofloxacina, moxifloxacino (no usar ofloxacino ni ciprofloxacino; el gatifloxacino ha dejado de usarse por sus efectos adversos sobre el nivel de la glucemia), bedaquilina, linezolid
b) grupo B — clofazimina, cicloserina, terizidona
c) grupo C — etambutol, delamanid, pirazinamida, imipenem/cilastatina, meropenem, amikacina, etionamida, protionamida, PAS.
Se deben utilizar ≥4 fármacos antituberculosos con probable eficacia. En todos los casos usar un fármaco del grupo A y uno del grupo B, escogidos sobre la base de una prueba de farmacosensibilidad, y adicionalmente ≥2 fármacos del grupo C. Si no es posible escoger el número recomendado de fármacos de los grupos A, B, C, se administran fármacos del grupo D. La fase intensiva del tratamiento con fármacos administrados por vía parenteral debe durar hasta que se negativicen las baciloscopias durante 2 meses consecutivos (≥4 meses de tratamiento parenteral).
En Chile se está aplicando la recomendación de terapia actual de la OMS de esquemas acortados para tuberculosis (excepto embarazadas y tuberculosis extrapulmonar) de 9-12 meses ya que muestran mejor eficacia (curación >80 %) que los esquemas convencionales prolongados de 18 meses (curación ~60-70 %). Durante 6 meses se utilizan: la asociación de bedaquilina (dosis de carga de 400 mg/d × 2 semanas seguido de 22 semanas de 200 mg cada 48 h), linezolida 600 mg/d, moxifloxacina 400 mg/d y clofazimina 100 mg/d durante 6 días de la semana, es decir, de lunes a sábado, seguido de 3 meses con moxifloxacina y clofazimina, si se ha presentado negativización de cultivos.
Nota: las normas locales son variables por los diferentes patrones de resistencia individuales y se deben rescatar los fármacos disponibles con sensibilidad probable según la historia de uso previo de fármacos ya que los test de sensibilidad fenotípicos habitualmente bien no son fiables, o bien no se produce una relación entre los resultados in vitro y la respuesta clínica. En Chile los esquemas de TB-MDR son evaluados y autorizados por un comité de terapia nacional en el Ministerio de Salud.
9. Tratamiento de tuberculosis durante la gestación y lactancia: utilizar tratamiento estándar (estreptomicina contraindicada). Las enfermas tratadas con INH deben recibir piridoxina (25-50 mg/d). La lactancia no constituye contraindicación para usar el esquema primario, y las mujeres en período de lactancia deben ser tratadas de forma estándar (para los niños que solamente tienen lactancia materna y cuyas madres están bajo tratamiento antituberculoso deben recibir piridoxina a dosis de 1-2 mg/kg/d). El embarazo no es una contraindicación para el tratamiento de la tuberculosis multirresistente. Si la situación clínica lo permite, el tratamiento puede iniciarse tras terminar el 1.er trimestre. Deben evitarse los fármacos administrados por vía parenteral (son ototóxicos para el feto) y la etionamida (por efecto teratógeno y riesgo aumentado de producir náuseas y vómitos).
10. En caso de insuficiencia renal: utilizar RMP e INH a dosis estándar (se excretan principalmente por vía biliar). Utilizar ETB y PZA 3 × semana a dosis de 15 mg/kg y 25 mg/kg respectivamente (se refiere a los enfermos con aclaramiento de creatinina <30 ml/min). En pacientes en hemodiálisis los fármacos se administran una vez terminada la sesión y pueden ser administrados a diario en la fase inicial del tratamiento.
11. En caso de insuficiencia hepática:
1) sin fármacos hepatotóxicos, opciones:
a) ETB y fluoroquinolona durante 18-24 meses (con SM durante los 2 primeros meses)
b) ETB, CS y un fármaco administrado por vía parenteral durante 18-24 meses
2) 1 fármaco hepatotóxico, opciones:
a) INH, ETB y SM durante 2 meses, posteriormente HIN y ETB durante 10 meses; en Chile se utiliza una fluoroquinolona (levofloxacina) en vez de SM y RMP en vez INH, asociada a ETB.
b) RMP, ETB, fluoroquinolona o CS y un fármaco administrado por vía parenteral durante 12-18 meses
3) 2 fármacos hepatotóxicos, opciones:
a) INH y RMP durante 9 meses y ETB administrado hasta conocer la sensibilidad a INH
b) INH, RMP, ETB y SM durante 2 meses y posteriormente HIN y RMP durante 6 meses
c) RMP, PZA, ETB (y eventualmente fluoroquinolona) durante ≥6 meses. Esta opción es la menos aconsejada y solo se podría utilizar si la hepatitis es leve y fue ocasionada por la INH.
12. Diabetes mellitus: normalmente se administrará un esquema estándar de tratamiento. En enfermos con nefropatía diabética los aminoglucósidos están contraindicados. ETB y PAS están contraindicados en caso de neuropatía diabética. Hay que tener en cuenta la posibilidad de interacciones de los derivados de sulfonilureas con RMP y la aparición de hipoglucemia provocada por ETA.
13. En enfermos con bajo nivel de conciencia que no pueden deglutir: utilizar INH y SM IM, y fluoroquinolona iv., algunos fármacos pueden utilizarse por sonda nasogástrica (RMP en jarabe o molido, INH, PZA y ETB molidos). A los enfermos alimentados por gastrostomía o sonda nasogástrica se les pueden administrar los fármacos antituberculosos orales triturados 2-3 h antes de la comida o después de comer. En Chile se dispone de rifampicina iv. (viales de 600 mg) y de INH iv. (viales de 300 mg).
14. En trasplantados de órgano sólido o de células hematopoyéticas: tener precaución con las interacciones de rifampicinas (RMP, rifabutina, rifapentina) con inhibidores de calcineurina (ciclosporina y tacrolimus) → incrementar la dosis del inmunosupresor en 3-5 veces y monitorizar la concentración en sangre) y con glucocorticoides (→ aumentar la dosis de esteroides en el 50 %).
15. En infectados por el VIH: en la fase intensiva INH, RMP, PZA y ETB. En la fase de continuación INH y RMP. Si la mejoría clínica o microbiológica se produce lentamente o existe inmunosupresión avanzada → prolongar el tratamiento por 9 meses o ≥4 meses tras obtener cultivos negativos de esputo. En todos los casos utilizar cotrimoxazol profilácticamente, según el nivel de CD4. Si el enfermo no ha recibido previamente tratamiento antirretroviral, el diagnóstico de tuberculosis es una indicación para iniciarlo (se debe empezar por el tratamiento antituberculoso y posteriormente, en la medida de lo posible antes de transcurridas 8 semanas —en enfermos con un número de linfocitos CD4+ <50/μl no antes de transcurridas 2 semanas— añadir el tratamiento antirretroviral →Infección por VIH y sida). En enfermos con meningitis tuberculosa el tratamiento antirretroviral se debe retrasar por el riesgo de producirse una respuesta paradójica potencialmente mortal. En los enfermos que reciben inhibidores de proteasa no se debe utilizar RMP, que disminuye la concentración de estos fármacos en la sangre. La introducción de los fármacos antirretrovirales puede producir el síndrome inflamatorio de reconstitución inmunológica (SIRI). Síntomas: fiebre, intensificación de los síntomas del tracto respiratorio o SNC y progresión de las alteraciones radiológicas. Antes de iniciar el tratamiento para el SIRI descartar otras infecciones oportunistas diferentes a la tuberculosis, o el fracaso del tratamiento antituberculoso. Tratamiento: AINE, con síntomas agravados agregar prednisona a dosis de 1,25 mg/kg/d (50-80 mg/d) durante 2-4 semanas, que posteriormente se irá reduciendo hasta la suspensión del fármaco (durante 6-12 semanas o más).
16. En caso de enfermos tratados con anti-TNF (factor de necrosis tumoral): si la tuberculosis se ha presentado durante el tratamiento con el fármaco anti-TNF → suspender el fármaco. Se puede reiniciar el tratamiento después de ≥1 mes del tratamiento antituberculoso adecuado y tras confirmar la sensibilidad de los bacilos a los fármacos utilizados.
COMPLICACIONESArriba
Neumotórax, empiema pleural, fibrosis pleural, hemorragia pulmonar, amiloidosis.
PREVENCIÓNArriba
1. Diagnóstico rápido y tratamiento de enfermos con tuberculosis.
2. Prevención de infecciones hospitalarias:
1) Hasta la exclusión de la tuberculosis pulmonar activa, y sobre todo hasta el cese de la capacidad de transmisión (baciloscopias repetidas negativas luego de ≥2 semanas de terapia diaria efectiva con esquema de primera línea) los enfermos deberían estar en aislamiento respiratorio.
2) Es necesario ventilar con frecuencia de forma natural o mediante un dispositivo automático adecuado las habitaciones de los enfermos (cambios de aire cada 6 h en habitaciones antiguas y cada 20 h en edificios nuevos). Procurar que la evacuación del aire al exterior del edificio se realice tras una filtración adecuada, manteniendo una presión negativa en los interiores, y usando radiación con lámparas UV.
3) En enfermos con sospecha de tuberculosis o con tuberculosis pulmonar activa, el personal sanitario y los visitantes a las zonas hospitalarias de mayor riesgo de infección (salas de aislamientos, pabellones de broncoscopia, procedimientos de inhaloterapia o esputo inducido, salas de autopsia y salas de espera de pacientes con tuberculosis) deberían portar máscaras (óptimamente con el filtro HEPA), pero bastaría mascarilla bien ajustada si la exposición es breve o máscaras N95 si es más prolongada. Además, el paciente debe llevar una mascarilla hasta que deje de ser contagioso.
4) Para limpiar no utilizar aspiradoras ni ventiladores para no promover aerosoles. Los espacios interiores deben limpiarse con agua, los suelos deben desinfectarse y las superficies tienen que limpiarse de acuerdo con las indicaciones de las unidades de control de infecciones.
3. Vacuna antituberculosa (BCG) —en Chile obligatoria solo en neonatos de peso ≥2000 g— una dosis intradérmica a las 24 h del nacimiento. Ya no se utilizan rutinariamente dosis de recuerdo. Contraindicaciones: alergia a componentes de la vacuna, fiebre, dermatitis generalizada, inmunodeficiencias congénitas, tratamientos inmunodepresores, neoplasias malignas, infección por el VIH (la vacunación de neonatos nacidos de mujeres infectadas por el VIH se debe realizar después de descartar la infección por el VIH en el neonato), y tuberculosis activa en tratamiento con fármacos tuberculostáticos.
4. Estudio de contactos: las personas que han tenido contacto con un enfermo con tuberculosis pulmonar bacteriológicamente demostrada deben someterse a pruebas con el fin de descartar la tuberculosis (observación de síntomas, radiografía de tórax, prueba de tuberculina o IGRA). En Chile vuelven a evaluarse los contactos a los 3 meses para detectar casos secundarios y virajes de la prueba de tuberculina. Recomendaciones relativas a exploraciones en los contactos →fig. 3.15-1.
5. Tratamiento preventivo (la dosis de los fármacos será idéntica a la del tratamiento de la tuberculosis activa): INH 1 comprimido de 300 mg (o 3 de 100 mg) al día durante 6 o 9 meses (es más prolongada en inmunosuprimidos y en VIH con niveles de CD4 normales), RMP 600 mg (4 cápsulas de 150 mg) 1 × d durante 4 meses. (600 mg de RMP con 300 mg de INH) 1 × d durante 3-4 meses, rifapentina con INH 1 × semana durante 3 meses). Control mensual durante el tratamiento, en caso de enfermedad hepática, consumo regular de alcohol, infectados por VIH, >35 años, embarazadas, puérperas con <3 meses desde el parto → control de la actividad de AST y ALT y concentración de bilirrubina sérica.
La quimioprofilaxis anti-TBC está indicada en:
1) Los contactos con el enfermo con tuberculosis: niños <5 años, personas gravemente inmunodeprimidas (indicación absoluta, con independencia del resultado de la prueba de tuberculina/IGRA), niños <16 años con prueba de tuberculina/IGRA positiva. En otras situaciones clínicas se debe considerar individualmente el resultado positivo de la prueba de tuberculina/IGRA. En Chile se recomienda tratar además los contactos adultos con infección tuberculosa latente. Se dispone de rifapentina (Rp) para uso asociado a isoniazida en esquema de 1 dosis semanal única durante 12 semanas (3 meses) para la terapia de infección tuberculosa latente en contactos. Puede usarse en personas infectadas por VIH que no reciben terapia con inhibidores de la proteasa ni de integrasa ni maraviroc. En caso de usar dolutegravir, no es necesario duplicar la dosis durante la terapia con Rp, pero sí con RMP. En personas con peso >50 kg, la dosis de isoniazida es de 900 mg y de rifapentina 900 mg (no se utiliza en embarazadas, <2 años, enfermos con daño hepático crónico o en personas con casos índices de resistencia a isoniazida o rifampicina).
2) Personas que se tratarán con anti-TNF u otros fármacos biológicos con acción antinflamatoria que aumentan el riesgo de tuberculosis, o potenciales receptores de órganos/células hematopoyéticas que:
a) presentan una prueba de la tuberculina/IGRA positiva (actual o por la anamnesis)
b) han tenido contacto con un enfermo con tuberculosis bacilífera o han presentado en el pasado tuberculosis (no tratada o tratada de manera inadecuada) sin demostración actual de actividad
c) tienen cambios postuberculosos en la radiografía de tórax (cambios fibróticos, calcificaciones pulmonares y de los ganglios linfáticos, engrosamientos pleuríticos), y no estaban tratados previamente de tuberculosis (las personas que han finalizado correctamente el tratamiento antituberculoso no requieren tratamiento profiláctico).
3) Personas infectadas por VIH con prueba positiva de tuberculina (≥5 mm) o del IGRA. Si se utiliza INH en enfermos con diabetes, insuficiencia renal, sida, desnutridos y alcohólicos, hay que administrar vitamina B6 a dosis de 10-20 mg/d, en Chile 50 mg/d para prevenir polineuropatía.
TABLAS Y FIGURAS
Dosificación de los fármacos tuberculostáticos de elección
|
Fármacos y preparados
|
Dosificación
|
|
fase inicial
|
fase de continuación
|
|
Isoniacida (INH)a
|
5 mg/kg/d, máx. 300 mg/d
|
5 mg/kg/d o 10 mg/kg 3 × semana, máx. 900 mg/d
|
|
Rifampicina (RMP)a
|
10 mg/kg/d, máx. 600 mg/d (450 mg/d en personas <45 kg)
|
10 mg/kg/d o 3 × semana a la misma dosis
|
|
Pirazinamida (PZA)
|
25 mg/kg/d, en general 1500-2000 mg/d
|
No se utiliza en la fase de continuación
|
|
Etambutol (ETB)
|
15 mg/kg/d, en general 1000-1250 mg/d
|
Como más arriba
|
|
a La isoniazida y la rifampicina suelen administrarse en un único preparado compuesto, que contiene 100 o 150 mg de INH y 150 o 300 mg de RMP.
Todos los fármacos básicos utilizados VO se administran 1 × d, de preferencia por la mañana (pero puede ser en otro momento del día), 30 min antes de la comida.
|
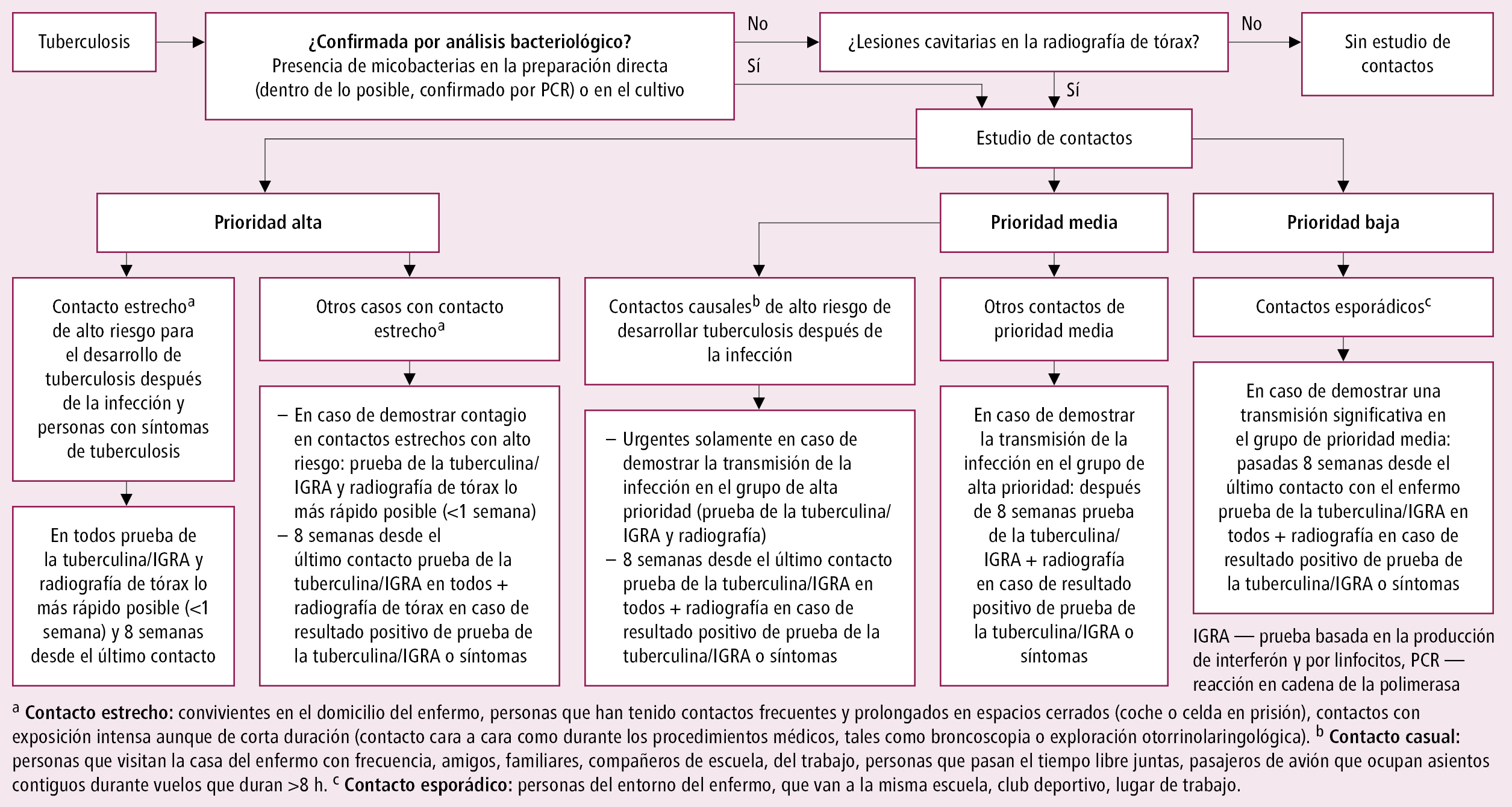
Fig. 3.15-1. Estudio de contactos: esquema de actuación (a partir del acuerdo del Consenso Europeo de 2010, modificado)
 Español
Español
 English
English
 українська
українська





