DEFINICIÓN Y ETIOPATOGENIAArriba
El adenocarcinoma de las células ductales pancreáticas es el más frecuente (80 %). Suele localizarse en la cabeza (65 %), pero también en el cuerpo y en la cola (25 %). En ~10 % de los casos es de carácter multifocal. Factores de riesgo: tabaquismo (el riesgo aumenta con el número de cigarrillos); obesidad (con un aumento de IMC de 5 kg/m2 el riesgo crece ~10 %); diabetes; pancreatitis crónica (principalmente hereditaria), consumo elevado de grasas saturadas, alimentos procesados, carne roja (el consumo elevado de fruta y verdura disminuye el riesgo); exposición a sustancias químicas (p. ej. disolventes hidrocarburos clorados, compuestos de níquel y de cromo, polvo de sílice, pesticidas); predisposición genética: cáncer pancreático familiar (en familias en las que los síndromes genéticos relacionados con el cáncer de páncreas no han sido confirmados, cuando el cáncer de páncreas se presenta en ≥2 familiares de 1.er grado); pancreatitis hereditaria (aumenta el riesgo hasta en 50-70 veces); síndromes hereditarios: síndrome de Peutz-Jeghers, síndrome de melanoma y lunares múltiples atípicos familiares [FAMMM], síndrome de Lynch, cáncer de mama u ovario hereditario, ataxia-telangiectasia, síndrome de Li-Fraumeni, poliposis adenomatosa familiar, antecedentes familiares de cáncer de páncreas (que no cumplen los criterios de cáncer pancreático familiar), infecciones (H. pylori, VHB, VHC; datos de baja calidad).
PERSPECTIVA LATINOAMERICANA
En Chile la incidencia anual de cáncer de páncreas es de 5,5/100 000 habitantes en hombres y 4,9/100 000 en mujeres. En Argentina la incidencia anual de CP es de 4,8/ 100 000 en hombres y de 3,4/100 000 en mujeres.
En 2020, en América Latina y el Caribe se presentaron 37 352 casos de cáncer de páncreas en total, y se reportaron 36 030 muertes.
CUADRO CLÍNICO E HISTORIA NATURALArriba
En las etapas iniciales los síntomas son poco característicos: molestia y distensión abdominal, falta de apetito, pérdida de peso (posteriormente anorexia y caquexia), diarrea, náuseas. Manifestaciones tardías más específicas: ictericia obstructiva (por compresión del colédoco por el cáncer a nivel de la cabeza pancreática o por adenopatías metastásicas a nivel del ligamento hepatoduodenal [p. ej. en casos avanzados de cáncer de cuerpo o cola]), prurito de la piel, dolor epigástrico, dorsal/de hombros, vómitos, signo de Courvoisier (vesícula biliar aumentada de tamaño y palpable asociada a ictericia; en <25 % de los casos), diabetes o tolerancia a la glucosa alterada (la aparición de diabetes, sobre todo después de los 50 años, requiere diferenciar con el cáncer de páncreas), pancreatitis aguda (precede al diagnóstico de cáncer de páncreas en un 13 % de los enfermos), trombosis venosa profunda, tromboflebitis superficial migratoria (signo de Trousseau); también pueden presentarse: hemorragia digestiva, esplenomegalia, obstrucción duodenal, ascitis, disminución del estado de ánimo / depresión, agotamiento.
Neoplasia de gran malignidad, caracterizada por un rápido crecimiento local y gran tendencia a infiltrar órganos y vasos vecinos; provoca metástasis peritoneales, en ganglios linfáticos, hígado y órganos a distancia.
DiagnósticoArriba
Exploraciones complementarias
1. Pruebas de laboratorio: inicialmente suelen ser normales. Posteriormente perfil colestásico: hiperbilirrubinemia conjugada, aumento de ALP y GGT (en ~50 % de los enfermos), anemia, hipoalbuminemia; elevación del antígeno CA 19-9 (escasa sensibilidad [sobre todo en caso de tumores de pequeño tamaño] y especificidad [elevación en casos de colestasis de cualquier origen; tiene interés principalmente en el diagnóstico de la recidiva tras la pancreatectomía]).
2. Pruebas de imagen. Ecografía: permite detectar solo tumores relativamente grandes (sólidos, hipoecogénicos respecto al parénquima pancreático circundante); no es útil para la detección del carcinoma ni para la estadificación de la enfermedad. Una ecografía normal no excluye el cáncer de páncreas. Es necesario profundizar el diagnóstico en caso de observar un tumor o la dilatación de colédoco. TC multicorte de abdomen y pelvis con contraste: es la técnica básica de diagnóstico por imagen. Está indicado realizarla con protocolo pancreático. Permite detectar el cáncer y evaluar el estadio (infiltración de grandes vasos, metástasis ganglionares y metástasis a distancia). Ecoendoscopia: recomendada para detectar lesiones pancreáticas focales, especialmente tumores pequeños (más sensible que la TC); permite realizar PAAF/biopsia con aguja cortante (lo que no se asocia a un riesgo significativo de diseminación), evaluar la extensión local y regional de la neoplasia y, en especial, la infiltración vascular y la previsión de resecabilidad. Resulta útil en casos no concluyentes mediante TC. RMN/CPRM: la RMN con contraste tiene una sensibilidad y especificidad semejante a la TC; valoración no invasiva de las vías biliares y conducto pancreático (también fuera del lugar de estenosis); evaluación de lesiones hepáticas difíciles de interpretar en la TC. CPRE: no indicada con fines diagnósticos, sino para procedimientos terapéuticos (p. ej. colocación endoscópica de prótesis en la estenosis del colédoco): en el cáncer de páncreas resecable, en caso de colangitis o de aplazamiento >2 semanas de una resección planificada). La identificación de eventuales metástasis pulmonares se realiza mediante radiografía o TC de tórax.
3. Estudio morfológico: con mayor frecuencia se observa un adenocarcinoma de células ductales pancreáticas.
Tamizaje en el grupo de alto riesgo de la enfermedad
La realización de ecoendoscopia o RMN con fines diagnósticos deben considerarse en los siguientes casos:
1) personas con ≥2 familiares de 1.er grado con cáncer de páncreas
2) personas con síndrome de Peutz-Jeghers o con FAMMM
3) portadores de mutaciones de los genes BRCA1, BRCA2 y PALB2
4) personas con síndrome de Lynch o portadores de la mutación del gen ATM con ≥1 familiar de 1.er o 2.º grado con cáncer de páncreas
5) personas con pancreatitis hereditaria autosómica dominante.
Los expertos de la ASGE sugieren realizar pruebas anuales a partir de los 50 años, o 10 años antes de la edad más temprana del diagnóstico del cáncer pancreático en un familiar. En caso de FAMMM las pruebas deben iniciarse a partir de los 40 años, o 10 años antes de la edad más temprana del diagnóstico del cáncer pancreático en un familiar, en la pancreatitis hereditaria asociada a la mutación del gen PRSS1 a partir de los 40 años, y en el síndrome de Peutz-Jeghers a partir de los 35 años, o 10 años antes de la edad más temprana del diagnóstico del cáncer pancreático en un familiar.
Criterios diagnósticos
Diagnóstico y valoración del estadio de la enfermedad: sobre la base de las pruebas de imagen (TC multicorte con protocolo pancreático [pero en caso de lesiones pequeñas su sensibilidad es menor que la de la ecoendoscopia], ecoendoscopia [eventualmente combinada con PAAF] y RMN/CPRM). En caso de tumor resecable, no se precisa un diagnóstico histológico antes de la cirugía. Antes de administrar terapia neoadyuvante, y en enfermos sin criterio quirúrgico, antes del inicio de quimioterapia paliativa es necesaria una confirmación del diagnóstico (p. ej. PAAF/biopsia con aguja cortante). La PAAF también permite diferenciar la pancreatitis crónica y autoinmune. Para la identificación de las eventuales metástasis pulmonares → radiografía o TC de tórax (estudio de preferencia). En caso de dudas diagnósticas → PET-TC.
Diagnóstico diferencial
Pancreatitis autoinmune, pancreatitis crónica, linfoma y otros tumores pancreáticos o metástasis pancreáticas (p. ej. del cáncer de pulmón, cáncer de riñón), cáncer de la papila de Vater, cáncer de las vías biliares.
TratamientoArriba
Por medio de las pruebas de imagen se diferencia el cáncer de páncreas resecable, el resecable limítrofe y el no resecable (demasiado avanzado locorregionalmente o con metástasis a distancia). La indicación terapéutica se establece teniendo en cuenta la resecabilidad y el estado general del paciente.
1. Tratamiento radical: la pancreatectomía es el único procedimiento curativo (viable solo en un 15-20 % de los casos); pancreatoduodenectomía radical según Kausch-Whipple (resección de la cabeza de páncreas, vesícula biliar, colédoco, duodeno y la parte pilórica del estómago) o según Traverso (con conservación del píloro), resección total del páncreas (p. ej. cuando el tumor es multifocal), o resección únicamente del cuerpo y cola junto a esplenectomía (pancreatectomía distal cuando el tumor se localiza en la parte izquierda del páncreas).
Durante las 8-12 semanas posteriores a la pancreatectomía se administra tratamiento adyuvante: se prefiere la quimioterapia según el esquema FOLFIRINOX modificado (en enfermos en buen estado general [ECOG 0-1 →tabla 16.13-12]) o gemcitabina en comparación con la capecitabina, eventualmente gemcitabina en monoterapia, o 5-fluorouracilo con folinato de calcio.
En caso de tumores resecables limítrofes, al haber realizado biopsia y haber confirmado el diagnóstico, se recurre al tratamiento neoadyuvante sistémico con el fin de disminuir el tamaño y la estadificación del tumor y aumentar la probabilidad de la resección radical. Tras reexaminar al paciente (TC o RMN de abdomen y pelvis y radiografía/TC de tórax) se considera la posibilidad de resección.
2. Tratamiento de los casos no resecables:
1) quimioterapia: en enfermos en buen estado general (ECOG 0/1) el esquema FOLFIRINOX o gemcitabina con nab-paclitaxel u otros fármacos; en enfermos en mal estado general gemcitabina en monoterapia, capecitabina, 5-fluorouracilo o tratamiento sintomático; quimiorradioterapia como alternativa, pero es más tóxica que la quimioterapia por sí sola
2) tratamiento analgésico: terapia farmacológica del dolor (de acuerdo con la escalera analgésica →fig. 24.1-1); en algunos enfermos neurólisis del plexo celíaco guiada por ecoendoscopia (preferiblemente) o percutánea
3) tratamiento de la ictericia obstructiva: prótesis biliar endoscópica
4) tratamiento de la insuficiencia pancreática exocrina →Pancreatitis crónica
5) profilaxis antitrombótica →Profilaxis primaria de la ETV.
PronósticoArriba
El pronóstico depende de la estadificación en el momento del diagnóstico, y del grado de diferenciación. La resección completa es posible solamente en <20 % de los enfermos. Tras una cirugía realizada en un centro especializado, un 10-25% de los enfermos sobrevive 5 años.
TABLAS Y FIGURAS
Escala de actividad según el Eastern Cooperative Oncology Group (ECOG)
|
Grado de actividad
|
Definición
|
|
0
|
Actividad normal, capacidad conservada de realizar todas las actividades sin restricción
|
|
1
|
Presencia de síntomas de la enfermedad, capacidad para andar y realizar trabajos ligeros
|
|
2
|
Capacidad de cuidarse, incapacidad de trabajar, necesidad de permanecer en cama durante ≤50 % del día
|
|
3
|
Capacidad limitada de cuidarse, necesidad de permanecer en cama durante >50 % del día
|
|
4
|
Necesidad de permanecer en cama todo el día y necesidad de ayuda continua
|
|
5
|
Muerte
|
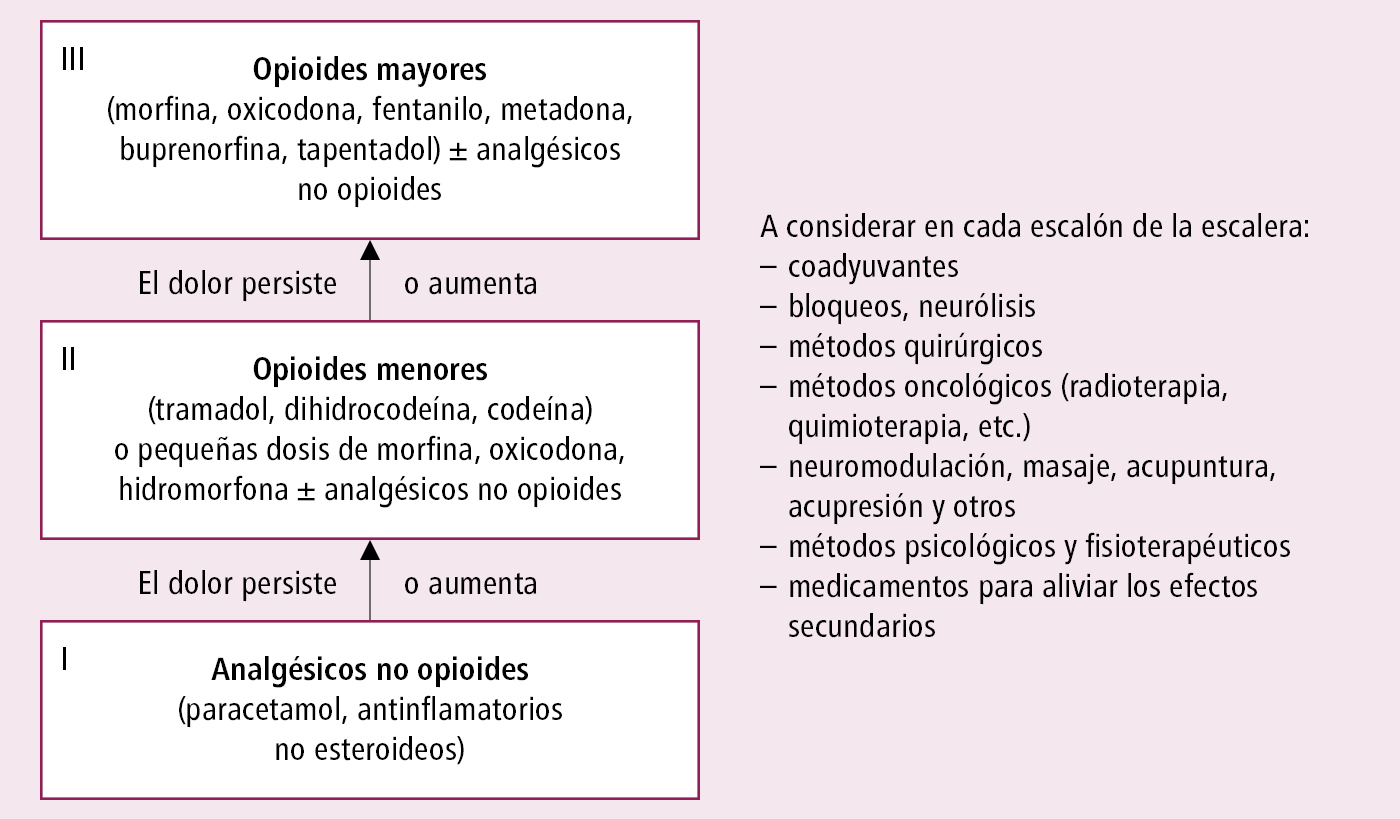
Fig. 24.1-1. Escalera analgésica de la OMS en combinación con otras técnicas de tratamiento del dolor
 Español
Español
 English
English
 українська
українська





