Anomalías detectadas en pruebas de imagen
Las lesiones observadas en las pruebas de imagen de control dependen, entre otras cosas, de la imagen radiológica inicial, que puede presentar distintas formas
1) curso asintomático: la imagen radiológica de los órganos torácicos es normal o las lesiones son pequeñas (fig. 1)
2) neumonía atípica sin insuficiencia respiratoria (fig. 2)
3) lesiones más graves, de distinto grado de complejidad, que conducen a insuficiencia respiratoria, con posible SDRA (fig. 3-5)
4) evolución complicada por EP (fig. 6).
La radiografía típica de neumonía secundaria a COVID-19 muestra opacidades bilaterales periféricas (fig. 2 y 3). La mayoría de personas hospitalizadas por COVID-19 presentan lesiones en la imagen de la tomografía computarizada (TC) pulmonar. En el perímetro del parénquima pulmonar se observan opacidades en vidrio deslustrado y consolidaciones (fig. 4B y C y fig. 5C-E) que, en función del período y el estadio de la enfermedad, pueden estar causadas en distintas proporciones por derrames, edemas, neumonía organizada, DAD o SDRA. Cabe recordar que las lesiones pulmonares en la COVID-19 también se pueden revelar (normalmente antes) mediante una ecografía, como trastornos periféricos de la ventilación del parénquima que desembocan en la formación de líneas B (fig. 1B).
Las lesiones observadas en las pruebas de imagen después de la COVID-19 pueden persistir durante mucho tiempo, sobre todo si la enfermedad fue grave. En un ensayo, el 94 % de las 90 personas con COVID-19 presentaron lesiones en la TC en el momento del alta hospitalaria (mediana de tiempo desde la aparición de los síntomas hasta el día de la prueba: 24 días). El tipo de lesión más observado fue la opacidad en vidrio deslustrado. Incluso en los casos de enfermedad leve, el 53 % de los sujetos presentaron lesiones pulmonares 3 semanas después del alta. Las anomalías pueden ser secuelas de la COVID-19, la EP (fig. 6) o la ventilación mecánica; también pueden ser síntomas de otra enfermedad potencialmente tratable (p. ej. neumonía organizada posinfecciosa; fig. 5).
En la observación posterior, por lo general las lesiones remiten de manera espontánea sin necesidad de ninguna intervención (fig. 4). Desgraciadamente, algunos pacientes desarrollan fibrosis pulmonar, que se asocia a una disminución de la función pulmonar. En un ensayo, aproximadamente 1/3 de los pacientes de COVID-19 con neumonía grave o SDRA presentaron lesiones fibróticas en la TC de control (fig. 5). La mayoría de estas lesiones persisten a los 6 meses (fig. 5). Se observan con bastante más frecuencia en las personas >50 años que han sufrido SDRA, han necesitado ventilación asistida y han presentado alteraciones radiológicas pulmonares más extensas de inicio. Como por el momento el período de observación ha sido corto, todavía no se sabe cómo se desarrollará la enfermedad más adelante en estos pacientes. En una observación anual de 83 enfermos hospitalizados en Wuhan (China), hasta el 24 % presentaron lesiones pulmonares en la TC de alta resolución (TCAR) 12 meses después del inicio de la enfermedad.
La TC es la mejor prueba de imagen para valorar las secuelas de la COVID-19. No obstante, conviene subrayar que ninguna asociación científica recomienda realizar TC rutinarias como pruebas de control. La prueba de imagen fundamental para evaluar a los pacientes que han sufrido COVID-19 es la radiografía de tórax (véase a continuación). La TC sirve para valorar con más precisión a los pacientes en los que se sospechen lesiones en el parénquima pulmonar o en los vasos pulmonares.
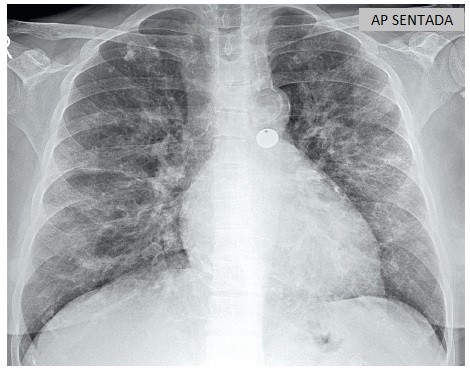
Fig. 1. Hombre de 56 años con COVID-19 asintomática confirmada tras un contacto con una persona contagiada de SARS-CoV-2.A. En la radiografía se observa una opacidad en el campo inferior del pulmón izquierdo que difumina el contorno del diafragma (flechas).
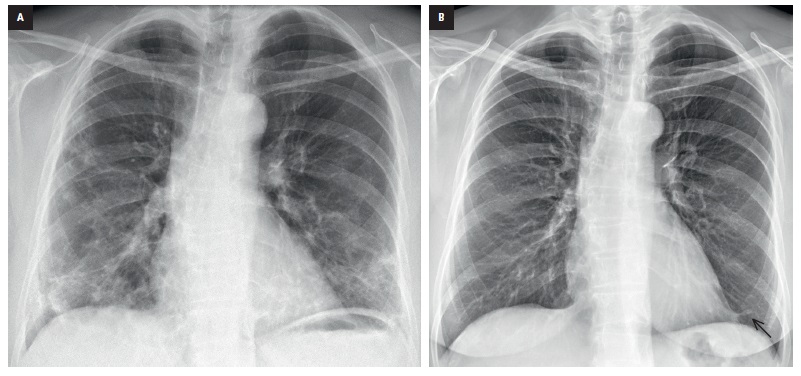
B. La ecografía permite evidenciar incluso lesiones tan leves. Fig. 2. Mujer de 65 años con COVID-19, debilidad, disnea, fiebre y tos.
A. La radiografía en proyección posteroanterior (PA) evidencia opacidades bilaterales en vidrio deslustrado que confluyen en opacidades más intensas en el perímetro del parénquima; las lesiones predominan en el pulmón derecho.
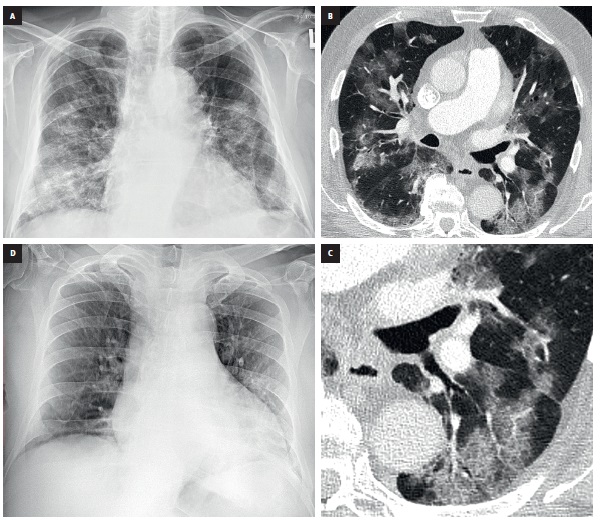
B. En la radiografía realizada 3 meses después se observa una ventilación pulmonar normal y una regresión de las inflamaciones; solo se detecta una adherencia pleural en la zona del ápice del corazón (flecha). Fig. 3. Mujer de 49 años con manifestaciones de COVID-19. La radiografía muestra una imagen típica: opacidades difusas bilaterales en los campos pulmonares, con lesiones más intensas en el perímetro del parénquima; campo superior del pulmón derecho parcialmente conservado. Fig. 4. Hombre de 62 años con COVID-19 e insuficiencia cardíaca, hospitalizado por insuficiencia respiratoria.
A. La radiografía realizada el 1.er día de hospitalización evidencia opacidades bilaterales en vidrio deslustrado que confluyen en consolidaciones en el perímetro del parénquima.
B. En la TC de capa fina se observan opacidades en vidrio deslustrado localizadas en múltiples áreas y un engrosamiento reticular de las líneas septales intralobulillares.
C. Las lesiones se superponen y se forma un signo de adoquín; la imagen indica el desarrollo de SDRA.
D. Radiografía realizada 7 meses después del alta hospitalaria: no se observan residuos de neumonía. Fig. 5. Hombre de 68 años con COVID-19 hospitalizado por insuficiencia respiratoria.
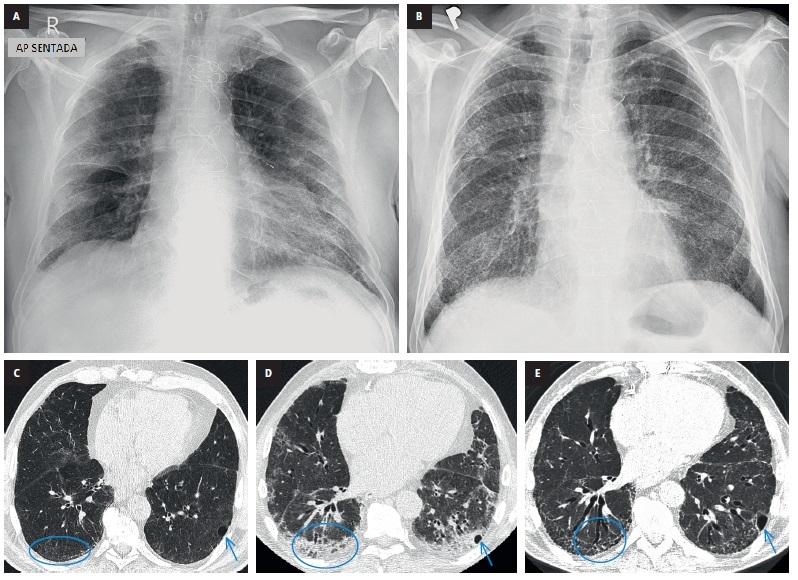
A. En la radiografía de ambos pulmones se observan opacidades, que son más intensas en las zonas periféricas.
B. 18 días después del ingreso, la insuficiencia respiratoria persistía (la RT-PCR ya era negativa); en la radiografía de control se observan opacidades discretas en vidrio deslustrado y pequeñas sombras reticulares.
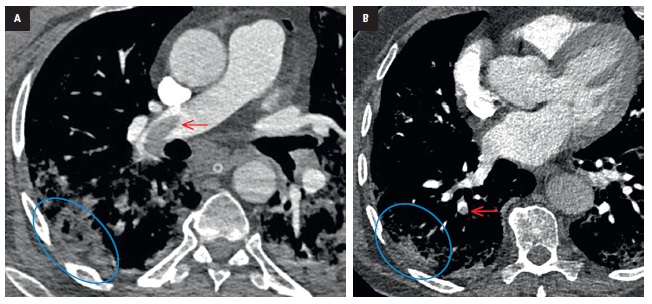
C. La TC evidencia consolidaciones difusas en vidrio deslustrado y un engrosamiento reticular de las líneas septales, principalmente en las zonas subpleurales (óvalo azul); las lesiones están acompañadas de un neumatocele (flecha azul).
D. En la TC realizada el día 39 después del ingreso, cuando la insuficiencia respiratoria empezó a empeorar progresivamente y la fiebre aparecía de forma transitoria, se observó una progresión de las lesiones: 1) opacidades en vidrio deslustrado más intensas y 2) consolidaciones subpleurales (óvalo azul). Se diagnosticó neumonía organizada, se implementó un tratamiento con prednisolona (1 mg/kg/d) y se consiguió mejorar el estado clínico.
E. En la TCAR realizada 9 meses después, se observa una regresión de las consolidaciones y opacidades en vidrio deslustrado; siguen observándose un engrosamiento reticular de las líneas septales (sección al nivel del neumatocele: flecha azul) y lesiones de carácter fibrótico, lo que señalan las bronquiectasias por tracción (óvalo azul). Fig. 6. Hombre de 59 años con COVID-19 e insuficiencia respiratoria.
A. En la angio-TC se observa una pérdida de contraste parcial de la arteria pulmonar izquierda (flecha roja), acompañada por una zona de consolidaciones subpleurales, probablemente un infarto pulmonar (óvalo azul).
B. En la angiografía de control realizada 5 meses después, se observa una pérdida parcial de contraste en la rama segmentaria X y un foco subpleural de infarto pulmonar sensiblemente menor (óvalo azul).
Bibliografía:
1. Yang X., Yu Y., Xu J. y cols., Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study, Lancet Respir. Med., 2020; 8: 475-481. doi: 10.1016/S2213-2600(20)30079-52. Grasselli G., Zangrillo A., Zanella A. y cols., Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy, JAMA, 2020; 323: 1574-1581. doi: 10.1001/jama.2020.5394
3. Mehta P., McAuley D.F., Brown M. y cols., COVID-19: consider cytokine storm syndromes and immunosuppression, Lancet, 2020; 395: 1033-1034. doi: 10.1016/ S0140-6736(20)30628-0
4. Guan W.J., Ni Z.Y., Hu Y. y cols., Clinical characteristics of coronavirus disease 2019 in China, N. Engl. J. Med., 2020; 382: 1708-1720. doi: 10.1056/NE JMoa2 002 032
5. Cheng V.C.C., Lau S.K.P., Woo P.C.Y., Yuen K.Y., Severe acute respiratory syndrome coronavirus as an agent of emerging and reemerging infection, Clin. Microbiol. Rev., 2007; 20: 660-694. doi: 10.1128/CMR.00 023-07
6. Chan-Yeung M., Xu R.-H., SARS: epidemiology, Respirology (Carlton, Vic.), 2003; 8 (suppl. 1): S9-S14. doi: 10.1046/j.1440-1843.2003.00 518.x
7. Ramadan N., Shaib H., Middle East respiratory syndrome coronavirus (MERS-CoV): a review, Germs, 2019; 9: 35-42. doi: 10.18683/germs.2019.1155
8. Ooi G.C., Khong P.L., Müller N.L. y cols., Severe acute respiratory syndrome: temporal lung changes at thin-section CT in 30 patients, Radiology, 2004; 230: 836-844. doi: 10.1148/radiol.2 303 030 853
9. Ketai L., Paul N.S., Wong K.T., Radiology of severe acute respiratory syndrome (SARS): the emerging pathologic-radiologic correlates of an emerging disease, J. Thorac. Imaging, 2006; 21: 276-283. doi: 10.1097/01.rti.0000213581.14225.f1
10. Chang Y.C., Yu C.J., Chang S.C. y cols., Pulmonary sequelae in convalescent patients after severe acute respiratory syndrome: evaluation with thin-section CT, Radiology, 2005; 236: 1067-75. doi: 10.1148/radiol.2 363 040 958
11. Hui D.S., Joynt G.M., Wong K.T. y cols., Impact of severe acute respiratory syndrome (SARS) on pulmonary function, functional capacity and quality of life in a cohort of survivors, Thorax, 2005; 60: 401-409. doi: 10.1136/thx.2004.030 205
12. Ngai J.C., Ko F.W., Ng S.S. y cols., The long-term impact of severe acute respiratory syndrome on pulmonary function, exercise capacity and health status, Respirology (Carlton, Vic.), 2010; 15: 543-550. doi: 10.1111/j.1440–1843.2010.01 720.x
13. Hui D.S., Wong K.T., Ko F.W. y cols., The 1-year impact of severe acute respiratory syndrome on pulmonary function, exercise capacity, and quality of life in a cohort of survivors, Chest, 2005; 128: 2247-2261. doi: 10.1378/chest.128.4.2247
14. Zhang P., Li J., Liu H. y cols., Correction: Long-term bone and lung consequences associated with hospital-acquired severe acute respiratory syndrome: a 15-year follow-up from a prospective cohort study, Bone Res., 2020; 8: 34. doi: 10.1038/s41413-020-00113-1
15. Chang Y.-C., Yu C.-J., Chang S.-C. y cols., Pulmonary sequelae in convalescent patients after severe acute respiratory syndrome: evaluation with thin-section CT, Radiology, 2005; 236: 1067-1075. doi: 10.1148/radiol.2363040958
16. Wu X., Dong D., Ma D., Thin-section computed tomography manifestations during convalescence and long-term follow-up of patients with severe acute respiratory syndrome (SARS), Med. Sci. Monit., 2016; 22: 2793-2799. doi: 10.12659/msm.896985
17. Das K.M., Lee E.Y., Singh R. i wsp.: Follow-up chest radiographic findings in patients with MERS-CoV after recovery. Indian J. Radiol. Imaging, 2017; 27: 342–349. doi: 10.4103/ ijri.IJRI_469_16
18. Wang Y., Dong C., Hu Y. y cols., Temporal changes of CT findings in 90 patients with COVID-19 pneumonia: a longitudinal study, Radiology, 2020; 296: E55-E64. doi: 10.1148/ radiol.2020200843
19. Mo X., Jian W., Su Z. y cols., Abnormal pulmonary function in COVID-19 patients at time of hospital discharge, Eur. Respir. J., 2020; 55: 2001217. doi: 10.1183/13993003.01217-2020
20. Livingston E., Bucher K., Coronavirus disease 2019 (COVID-19) in Italy, JAMA, 2020; 323: 1335. doi: 10.1001/jama.2020.4344
21. Torres-Castro R., Vasconcello-Castillo L., Alsina-Restoy X. y cols., Respiratory function in patients post-infection by COVID-19: a systematic review and meta-analysis, Pulmonology, 2020. doi: 10.1016/j.pulmoe.2020.10.013
22. Cheung O.Y., Chan J.W., Ng C.K., Koo C.K., The spectrum of pathological changes in severe acute respiratory syndrome (SARS), Histopathology, 2004; 45: 119-124. doi: 10.1111/j.1365–2559.2004.01926.x
23. Hamad G.A., Cheung W., Crooks M.G., Morice A.H., Eosinophils in COPD: how many swallows make a summer?, Eur. Respir. J., 2018; 51. doi: 10.1183/13993003.02177-2017
24. Zhao X., Nicholls J.M., Chen Y-G., Severe acute respiratory syndrome-associated coronavirus nucleocapsid protein interacts with smad3 and modulates transforming growth factor-β signaling, J. Biol. Chem., 2007; 283: 3272-3280. doi: 10.1074/jbc.m708033200
25. Zuo W., Zhao X., Chen Y.-G., SARS coronavirus and lung fibrosis. Molecular biology of the SARS-coronavirus, Berlin Heidelberg, Springer, 2009: 247-258
26. Chang C.-K., Hou M.-H., Chang C.-F. y cols., The SARS coronavirus nucleocapsid protein – forms and functions, Antiviral Res., 2014; 103: 39-50. doi: 10.1016/j.antiviral.2013.12.009
27. Zuo W., Zhao X., Chen Y.-G., SARS coronavirus and lung fibrosis. Molecular biology of the SARS-coronavirus, Berlin Heidelberg, Springer, 2009: 247-258. doi: 10.1007/978-3-642-03 683-5_15
28. Malik Y.A., Properties of coronavirus and SARS-CoV-2, Malays J. Pathol., 2020; 42: 3-11
29. George P.M., Barratt S.L., Condliffe R. y cols., Respiratory follow-up of patients with COVID-19 pneumonia, Thorax, 2020; 75: 1009-1016. doi: 10.1136/thoraxjnl-2020-215 314
30. Guo T., Fan Y., Chen M. y cols., Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19), JAMA Cardiol., 2020; 5: 811–818. doi: 10.1001/ jamacardio.2020.1017
31. Akhmerov A., Marbán E., COVID-19 and the heart, Circulation Res., 2020; 126: 1443-1455. doi: 10.1161/circresaha.120.317 055
32. Ai T., Yang Z., Hou H. y cols., Correlation of chest CT and RT-PCR testing in coronavirus disease 2019 (COVID-19) in China: a report of 1014 cases, Radiology, 2020; Feb 26: 200 642
33. Han X., Fan Y., Alwalid O. y cols., Six-month follow-up chest CT findings after severe COVID-19 pneumonia, Radiology, 2021; 299: E177-E186. doi.org/10.1148/radiol.2 021 203 153
34. Wu X., Liu X., Zhou Y., 3-month, 6-month, 9-month, and 12-month respiratory outcomes in patients following COVID-19-related hospitalisation: a prospective study, Lancet Respir. Med., 2021. doi: 10.1016/S2213-2600(21)00 174-0
 Español
Español
 English
English
 українська
українська