Tratamiento de 2.a línea
Para optimizar la eficacia del tratamiento, las terapias empíricas de 2.a línea y las terapias de rescate deben depender de la resistencia local de los fármacos, evaluada mediante pruebas de sensibilidad e índices de erradicación [D/MB].
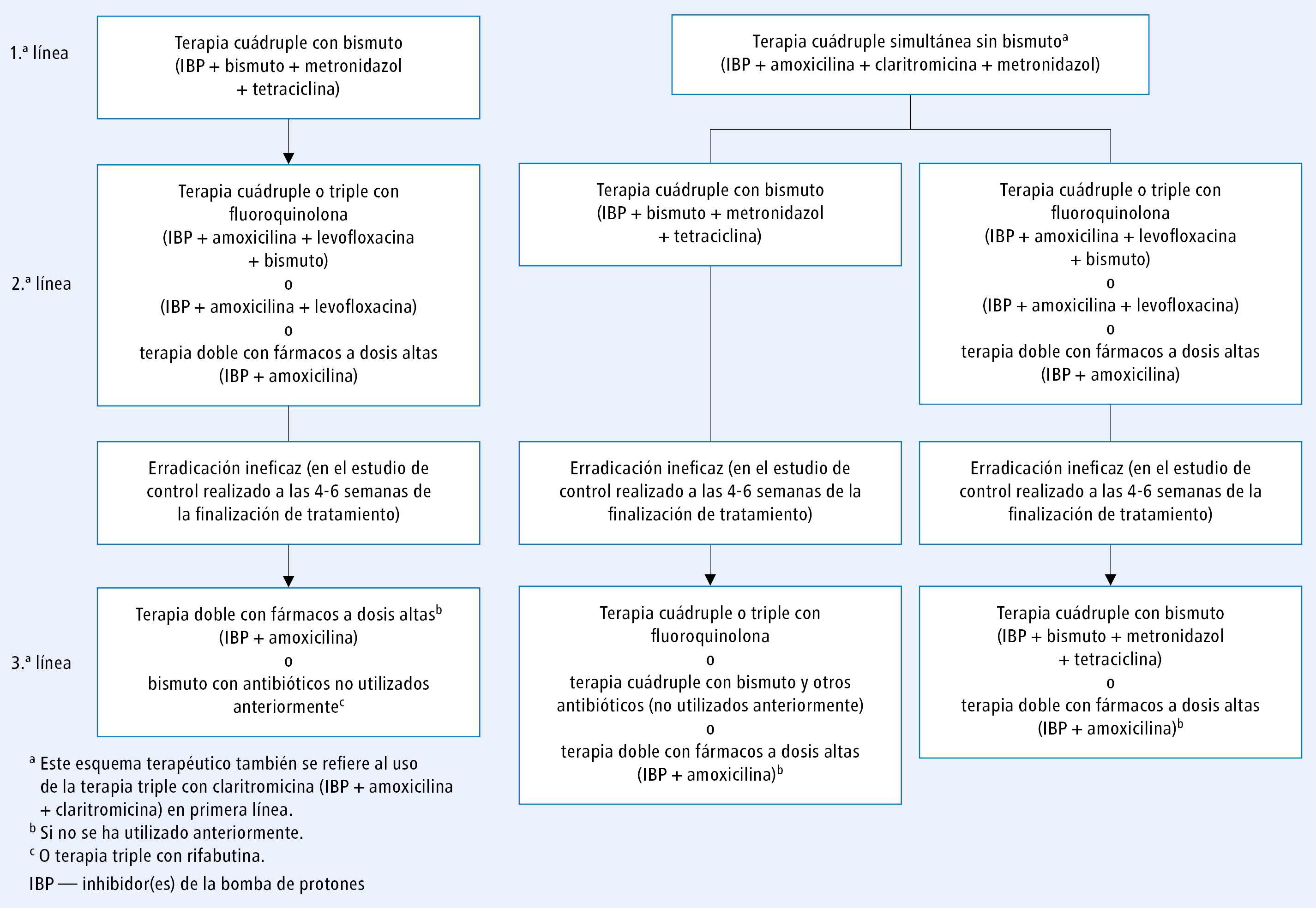
Si la terapia cuádruple con bismuto resulta ineficaz, se puede indicar la terapia cuádruple (o triple) con fluoroquinolona, o la terapia doble de IBP con amoxicilina a dosis altas. Si se observa una alta resistencia a fluoroquinolonas, se puede valorar la asociación de bismuto con otros antibióticos o con rifabutina (…) [D/B].
Si la terapia cuádruple sin bismuto resulta ineficaz, se recomienda la terapia cuádruple con bismuto o la terapia cuádruple (o triple) con fluoroquinolona. También se puede valorar la terapia doble de IBP con amoxicilina a dosis altas [D/B].
Debido a las últimas advertencias sobre los efectos adversos graves de fluoroquinolonas, estos fármacos deben utilizarse solo si los beneficios de su uso prevalecen sobre los riesgos; la misma situación sucede en caso de la terapia de erradicación. La eficacia del tratamiento con levofloxacina disminuye debido al aumento de la resistencia primaria de las bacterias a las fluoroquinolonas. El bismuto actúa sinérgicamente con los antibióticos, por lo que su asociación al tratamiento aumenta la eficacia terapéutica. La terapia cuádruple (IBP, amoxicilina, levofloxacina y bismuto) de 14 días resultó solo un poco más eficaz que la terapia triple (sin bismuto), pero en caso de las cepas resistentes a la levofloxacina los resultados fueron visiblemente mejores (71 vs. 37 % de los enfermos).
En el tratamiento de 2.a línea también se puede utilizar la combinación de amoxicilina e IBP a dosis altas. El metaanálisis demostró que la eficacia de este tratamiento en los enfermos tras ≥1 tratamiento de erradicación ineficaz llega al 80 %. La administración de IBP a dosis altas aumenta significativamente la eficacia de la erradicación.
Si en el tratamiento de 1.a línea se utilizó el esquema con claritromicina y este resultó ineficaz, en el tratamiento de 2.a línea se recomienda la terapia cuádruple con bismuto, la terapia cuádruple (o triple) con fluoroquinolona o la terapia doble con IBP y amoxicilina a dosis altas [D/B].
Los datos del registro Hp‑EuReg demuestran que, tras un fracaso de tratamiento con claritromicina, la eficacia óptima de la erradicación (≥90 %) se consigue con la terapia triple o cuádruple con fluoroquinolona de 14 días, o con la terapia cuádruple clásica (con tetraciclina) y después de la terapia cuádruple de 10 días con un preparado que contiene antibióticos y bismuto en 1 solo comprimido.22,23 Por esta razón, en la terapia de 2.a línea es esencial el esquema cuádruple con bismuto, especialmente en las regiones con alta resistencia a las fluoroquinolonas.
Tratamiento de 3.a línea
Si el tratamiento de erradicación fracasa 2 veces, es necesario emplear la terapia de 3.a línea, seleccionada según los esquemas previamente utilizados:
1) si en el tratamiento de 1.a línea se empleó la terapia cuádruple sin bismuto (o triple con claritromicina) y en la 2.a línea la terapia cuádruple con bismuto, se recomienda el esquema con fluoroquinolona, y en las regiones con alta resistencia a las fluoroquinolonas se debe considerar: la terapia cuádruple con bismuto y otros antibióticos (no utilizados previamente), la terapia con rifabutina (…), o la terapia doble con IBP y amoxicilina a dosis altas [D/M]
2) si en el tratamiento de 1.a línea se empleó la terapia cuádruple sin bismuto (o triple con claritromicina) y en la 2.a línea el esquema con fluoroquinolona, se recomienda la terapia cuádruple con bismuto, y si el bismuto no está disponible, se debe considerar la terapia doble con IBP y amoxicilina a dosis altas o la terapia con rifabutina (…) [D/M]
3) si en el tratamiento de 1.a línea se empleó la terapia cuádruple con bismuto (o triple con claritromicina) y en la 2.a línea el esquema con fluoroquinolona, la terapia triple o cuádruple con claritromicina está recomendada solo en las regiones de baja (<15 %) resistencia a la claritromicina; en las demás regiones se debe pautar la terapia terapia doble con IBP y amoxicilina a dosis altas, la terapia con rifabutina (…) o la combinación de bismuto con otros antibióticos (no utilizados previamente) [D/B].
Se puede aumentar la eficacia del esquema IBP + amoxicilina + levofloxacina después de 2 intentos fallidos de erradicación añadiendo la sal de bismuto, especialmente si la bacteria es resistente al levofloxacina. Debido al aumento de la resistencia de las bacterias a las fluoroquinolonas, se deben buscar nuevos esquemas terapéuticos, p. ej. con sitafloxacina (fluoroquinolona de IV generación) o vonoprazán.
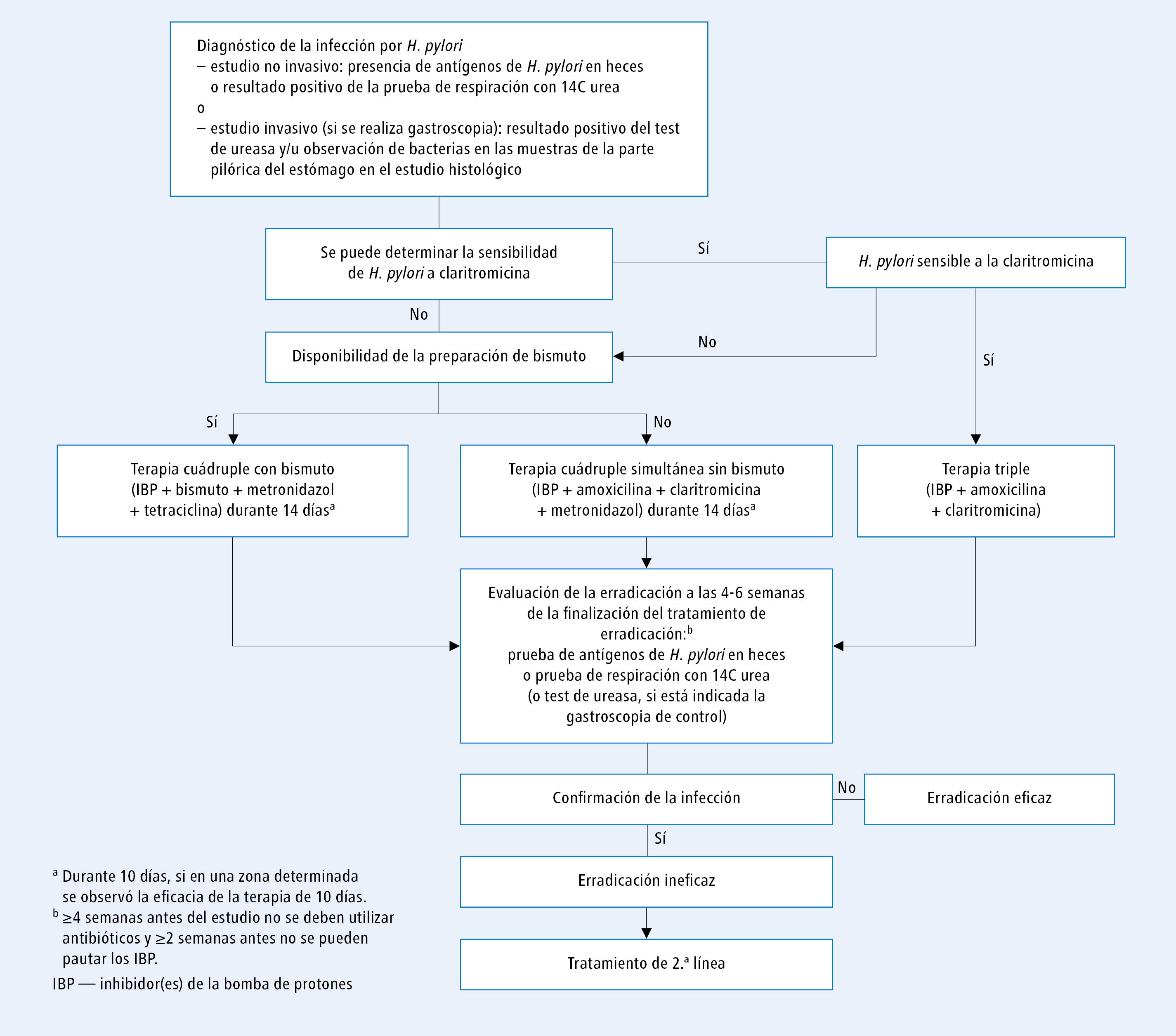
El esquema de tratamiento de la infección por H. pylori se presenta en las figuras 1 y 2.
Un 5‑10 % de los pacientes notifica alergia a la penicilina, lo que dificulta el tratamiento de erradicación si la terapia cuádruple con bismuto resulta ineficaz, ya que todos los demás esquemas de tratamiento incluyen la amoxicilina. No todas las personas que notifican esta alergia la tienen de verdad, por lo que vale la pena realizar pruebas de alergia para descartar la hipersensibilidad a este fármaco. Si no se confirma la presencia de esta alergia, el uso de los esquemas con amoxicilina es seguro. Si la alergia se confirma, se pueden valorar los esquemas con fluoroquinolona y metronidazol, la terapia cuádruple (IBP + claritromicina + metronidazol + bismuto […]), eventualmente se puede cambiar la amoxicilina por cefuroxima (tras descartar la alergia a la misma).
Papel de probióticos en el tratamiento de erradicación
Se ha demostrado que algunos probióticos son eficaces para disminuir los síntomas gastrointestinales que se presentan debido a los efectos adversos del tratamiento de erradicación [D/A]. Este efecto fue demostrado en algunas cepas de Lactobacillus (sobre todo si se utilizan <2 semanas) y Saccharomyces boulardii. También se evaluó el efecto de los probióticos en la eficacia de la erradicación. Aunque los metaanálisis y ensayos clínicos aleatorizados sugieren su eficacia, se ha demostrado que solo algunas cepas de Lactobacillus, Bifidobacterium y S. boulardii tienen efecto beneficioso, por lo que no es posible generalizar. Finalmente, 3 metaanálisis confirmaron el efecto beneficioso de S. boulardii en la eficacia de la erradicación. Parece que esta se debe más bien a la reducción de los efectos adversos de los antibióticos que al efecto directo sobre H. pylori, por lo que se considera que algunos probióticos pueden tener efecto beneficioso sobre el tratamiento de erradicación de H. pylori al minimizar los efectos adversos de los antibióticos [D/M].
Fig. 1. Manejo de la infección por H. pylori en las regiones de alta resistencia de H. pylori a la claritromicina, según el consenso de Maastricht IV/Florencia
Fig. 2. Las siguientes líneas de tratamiento de la infección por H. pylori en caso de ineficacia de la erradicación, según el esquema utilizado en la anterior línea de tratamiento, según el consenso de Maastricht IV/Florencia
Volver al artículo principal: Guías: efecto de Helicobacter pylori en el tracto gastrointestinal.
Bibliografía
- Malfertheiner P., Megraud F., Rokkas T. y cols., Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report, Gut, 2022; 71:1724‑1762
- Malfertheiner P., Megraud F., O’Morain C.A. y cols., Management of Helicobacter pylori infection – the Maastricht V/Florence. Consensus Report, Gut, 2017; 66: 6‑30
- Malfertheiner P., Megraud F., O’Morain C. y cols., Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report, Gut, 2007; 56: 772‑781
- Sugano K., Tack J., Kuipers E.J. y cols., Kyoto global consensus report on Helicobacter pylori gastritis, Gut, 2015; 64: 1353‑1367
- Marshall B.J., Armstrong J.A., McGechie D.B. y cols., Attempt to fulfil Koch’s postulates for pyloric Campylobacter, Med. J. Aust., 1985; 142: 436‑439
- Bisschops R., Areia M., Coron E. y cols., Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) quality improvement initiative, Endoscopy, 2016; 48: 843‑864
- Stanghellini V., Chan F.K., Hasler W.L. y cols., Gastroduodenal disorders, Gastroenterology, 2016; 150: 1380‑1392
- Black C.J., Paine P.A., Agrawal A. y cols., British Society of Gastroenterology guidelines on the management of functional dyspepsia, Gut, 2022; 71: 1697‑1723
- Moayyedi P., Lacy B.E., Andrews C.N. y cols., ACG and CAG Clinical Guideline: management of dyspepsia, Am. J. Gastroenterol., 2017; 112: 988‑1013
- Dyspepsia and Gastro‑Oesophageal Reflux Disease: Investigation and management of dyspepsia, symptoms suggestive of gastro‑oesophageal reflux disease, or both. London, National Institute for Health and Care Excellence (NICE), 2014
- Rugge M., Meggio A., Pennelli G. y cols., Gastritis staging in clinical practice: the OLGA staging system, Gut, 2007; 56: 631‑636
- Sugano K., Spechler S.J., El‑Omar E.M. y cols., Kyoto international consensus report on anatomy, pathophysiology and clinical significance of the gastro‑oesophageal junction, Gut, 2022; 71: 1488‑1514
- Chiang T.H., Chang W.J., Chen S.L. y cols., Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: a long‑term cohort study on Matsu Islands, Gut, 2021; 70: 243‑250
- Krajowy Rejestr Nowotworów. https://onkologia.org.pl/sites/default/files/%C5%BBo%C5%82%C4%85dek.pdf (acceso: 6.03.2023)
- Zucca E., Arcaini L., Buske C. y cols., ESMO Guidelines Committee: Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up, Ann. Oncol., 2020; 31: 17‑29
- Ko C.W., Siddique S.M., Patel A. y cols., AGA Clinical Practice Guidelines on the Gastrointestinal Evaluation of Iron Deficiency Anemia, Gastroenterology, 2020; 159: 1085‑1094
- World Gastroenterology Organisation: Global guidelines Helicobacter pylori. 2021. https://www.worldgastroenterology.org/UserFiles/file/guidelines/helicobacter-pylori-english-2021.pdf (acceso: 6.03.2023)
- Ding S.‑Z., Du Y.‑Q., Lui H. y cols., Chinese consensus report on family‑based helicobacter pylori infection control and management (2021 edition), Gut, 2022; 71: 238‑253
- Ferenc S., Gnus J., Kościelna M. y cols., High antibiotic resistance of Helicobacter pylori and its effect on tailored and empiric eradication of the organism in Lower Silesia, Poland, Helicobacter, 2017; doi: 10.1111/hel.12 365
- Bińkowska A., Biernat M.M., Łaczmański Ł., Gościniak G., Molecular patterns of resistance among Helicobacter pylori strains in South‑Western Poland, Front Microbiol., 2018; doi: 10.3389/fmicb.2018.03 154
- Wasielica‑Berger J., Gugnacki P., Mlynarczyk M. y cols., Comparative effectiveness of various eradication regimens for Helicobacter pylori infection in the Northeastern Region of Poland, Int. J. Environ. Res. Public Health, 2022; doi: 10.3390/ijerph19 116.921
- Nyssen O.P., Vajra D., Pérez Aísa A. y cols., Empirical second‑line therapy in 5000 patients of the European Registry on Helicobacter pylori Management (Hp‑EuReg), Clin. Gastroenterol. Hepatol., 2022; 20: 2243‑2257
- Nyssen O.P., Pérez Aísa A., Castro‑Fernandez M. y cols., European Registry on Helicobacter pylori management: single‑capsule bismuth quadruple therapy is effective in real‑world clinical practice, United European Gastroenterol. J., 2021; 9: 38‑46
- Pimentel‑Nunes P., Libânio D., Marcos‑Pinto R. y cols., Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019, Endoscopy, 2019; 51: 365‑388
 Español
Español
 English
English
 українська
українська