Definición y etiopatogeniaArriba
La endocarditis infecciosa (EI) es una enfermedad que se desarrolla a consecuencia de una infección localizada en el endocardio de las válvulas (lo más común), de los ventrículos y de las aurículas, en el endotelio de los grandes vasos del tórax (p. ej. en caso de coartación de aorta), de las comunicaciones vasculares, o en cuerpos extraños intracardíacos (p. ej. electrodos de marcapasos). En la EI se afectan con mayor frecuencia las válvulas aórtica o mitral, y menos frecuentemente la válvula tricúspide. En ~10 % de casos hay afectación de >1 válvula. La EI está precedida de una bacteriemia en un período de tiempo que oscila entre <2 semanas (en un 80 % de los casos) y 2-5 meses (en algunos pacientes con EI sobre prótesis valvular).
Agentes etiológicos: bacterias (>90 % de los casos), hongos (<1 %), muy raramente clamidias, rickettsias y micoplasmas. Entre las bacterias se encuentran: estafilococos (el agente etiológico cada vez más frecuente de EI; Staphylococcus aureus, epidermidis y otros coagulasa-negativos), estreptococos (Streptococcus viridans que hasta hace poco eran la causa más común de EI sobre válvula nativa), enterococos y bacterias gramnegativas, también del grupo HACEK, Corynebacterium diphtheriae no productoras de toxina. En personas adictas a drogas la etiología es a menudo mixta. En ~10 % de los casos no se consigue identificar el agente etiológico.
PERSPECTIVA COLOMBIANA
Según algunos estudios locales, el S. aureus es el germen mayormente rescatado en los cultivos microbiológicos, siendo el 87,5 % de los casos Staphylococcus aureus sensible a la meticilina (SAMS).
Agentes etiológicos de EI con hemocultivos negativos: Coxiella burnetii, Bartonella spp., Aspergillus spp., Mycoplasma pneumoniae, Brucella spp., Legionella pneumophila, Candida spp., Tropheryma whipplei.
Enfermedades y situaciones que predisponen a la EI sobre válvula nativa: aquellas enfermedades con indicación para profilaxis →más adelante. Además: antecedente de enfermedad reumática, prolapso mitral con insuficiencia, miocardiopatía hipertrófica, otras cardiopatías (especialmente valvulopatía aórtica, p. ej. válvula bicúspide, coartación de aorta), inmunodeficiencia (inmunosupresión, infección por VIH), colocación prolongada de catéteres venosos centrales, presencia de cuerpos extraños (p. ej. electrodos intracardíacos, parches vasculares), uso de drogas intravenosas en personas adictas (afectación predominante de las válvulas de la parte derecha del corazón). La EI sobre prótesis valvular (10-30 % de los casos de EI) se desarrolla con mayor frecuencia en la 5.ª o 6.ª semana de la cirugía. Siempre que se desarrolle dentro de los 12 primeros meses tras la intervención se considerará relacionada con la cirugía: S. epidermidis (con mayor frecuencia), especialmente cepas resistentes a meticilina, S. aureus y Candida spp. A partir del primer año de la cirugía, la etiología es similar a la de la EI sobre válvula nativa. En caso de TAVI, los agentes etiológicos más frecuentes son estreptococos, S. aureus y enterococos.
EI asociada a dispositivos cardíacos implantados: es más frecuentemente provocada por los estafilococos.
Cuadro clínicoArriba
Predominan síntomas y signos poco característicos: fiebre alta con escalofríos o febrícula prolongada acompañada de sudoración excesiva (la manifestación más frecuente, que puede estar ausente en ancianos y en casos con insuficiencia cardíaca y renal), malestar general, debilidad, artralgia, mialgia, falta de apetito, pérdida de peso, cefalea y náuseas. Además, los síntomas pueden estar relacionados con la afectación:
1) De la parte izquierda del corazón: soplos de insuficiencia de la válvula afectada (~80 % de los enfermos), en muy raros casos las grandes vegetaciones pueden provocar estenosis mitral funcional; síntomas de insuficiencia cardíaca; edema pulmonar en pacientes sin cardiopatía previa. Síntomas relacionados con embolismos (más a menudo en la EI por S. aureus): en el SNC (30-40 %; hemiparesia, afasia, cambios de comportamiento en caso de microembolia; raras veces hemorragia intracraneal por rotura de un aneurisma inflamatorio) de arterias renales, arteria esplénica o arterias mesentéricas que pueden cursar con manifestaciones de íleo paralítico → dolor abdominal o de espalda; embolia de las arterias coronarias (raro) → dolor torácico; de la arteria central de la retina → alteraciones de la visión, de la arteria de una extremidad → dolor; síntomas vasculares periféricos (petequias cutáneas y subungueales, nódulos de Osler [lesiones rojas, dolorosas, localizadas sobre todo en los dedos de las manos y de los pies], manchas de Roth [derrames en la retina con el centro pálido], lesión de Janeway [manchas hemorrágicas indoloras en las palmas de las manos y en las plantas de los pies]); hepatoesplenomegalia (a menudo en la EI de larga evolución).
2) De la parte derecha del corazón: manifestaciones de neumonía y embolismo pulmonar, como tos y dolor torácico de características pleuríticas (embolia pulmonar séptica); raramente hemoptisis y disnea; el soplo de insuficiencia de la válvula tricúspide o pulmonar no aparece o aparece tardíamente. Signos de insuficiencia ventricular derecha en la EI de larga evolución. En personas adictas a drogas, la EI de la parte derecha del corazón a menudo es recurrente.
El embolismo es una de las causas de retraso en el diagnóstico de EI, dado que los enfermos pueden ingresar en diferentes servicios especializados en función de las manifestaciones embólicas.
Atención: el embolismo acompañado de un estado febril siempre requiere exclusión de EI.
DiagnósticoArriba
Procedimiento diagnóstico
Las siguientes pruebas deben realizarse en todos los casos de sospecha de EI.
1. Hemocultivos (antes de empezar la antibioticoterapia): extraer ≥3 muestras de sangre (con intervalos de 30 min; cada muestra de 10 ml para una botella con caldo de cultivo para aerobios y otra para anaerobios; marcar la sospecha de EI en la solicitud de microbiología; en caso de Coxiella burnetii es suficiente 1 resultado positivo). Extraerlos independientemente de la temperatura corporal. No utilizar para su extracción los catéteres venosos introducidos previamente. Dentro de lo posible, extraer las muestras de sangre para cultivos ≥2 días después de suspender el antibiótico usado previamente. Después de una antibioticoterapia prolongada, los cultivos todavía pueden permanecer negativos durante una semana. En todos los enfermos sometidos a cirugía cardíaca, sobre todo si los resultados de los hemocultivos previos han sido negativos, cultivar muestras de todos los tejidos extraídos o de los materiales artificiales, realizar estudio microscópico y la reacción en cadena de la polimerasa (PCR) para identificar el agente etiológico.
2. Pruebas serológicas: ante la sospecha de infección por Bartonella, Brucella, Histoplasma capsulatum, Cryptococcus neoformans, Legionella, Chlamydia o Coxiella burnetii.
3. Ecocardiografía: revela vegetaciones (formaciones móviles ecogénicas fijadas al endocardio o material extraño en el corazón; no permite distinguir con seguridad entre vegetaciones ya curadas y vegetaciones con EI activa), lesión valvular (insuficiencia valvular debida a la vegetación, perforación del velo o rotura de la cuerda tendinosa; aneurisma de la válvula mitral) y complicaciones perivalvulares (abscesos, pseudoaneurismas, fístulas intracardíacas).
Se debe realizar una ecocardiografía transtorácica a todos los enfermos sin prótesis valvular con sospecha clínica de EI. Si la probabilidad clínica de EI es baja y el resultado del estudio transtorácico es negativo (con buena calidad de imágenes), es poco probable que se trate de EI → considerar otro diagnóstico. Si no se consiguen imágenes de buena calidad, proceder al estudio transesofágico. Realizar el estudio transesofágico también en los siguientes casos:
1) si la probabilidad clínica de EI es alta (p. ej. bacteriemia por estafilococos) y el resultado del estudio transtorácico es negativo
2) sospecha de EI en portador de prótesis valvular o de dispositivos intracardíacos, y ante la sospecha de afectación de la válvula aórtica
3) antes de una cirugía cardíaca en un enfermo con EI activa
4) si el resultado del estudio transtorácico indica EI (excepto EI sobre válvulas derechas nativas, si las imágenes del estudio transtorácico son inequívocas); si el resultado del estudio transesofágico es negativo y la sospecha clínica de EI está justificada, repetir el estudio a los 5-7 días.
En enfermos después de la TAVI, al igual que en aquellos después del reemplazo quirúrgico de la válvula aórtica, la ecocardiografía tiene menor importancia en el diagnóstico de EI.
4. Pruebas de laboratorio: VHS aumentada (un promedio de 50 mm después de 1 h en casi todos los enfermos); leucocitosis con predominio de neutrófilos (más a menudo en la EI de evolución aguda); anemia, habitualmente normocrómica y normocítica; elevación de fibrinógeno, proteína C-reactiva e inmunoglobulinas en sangre; hematuria microscópica y proteinuria leve (en >50 % de los enfermos).
5. ECG: cambios inespecíficos.
6. Radiografía de tórax: muestra el grado de insuficiencia cardíaca o la presencia de complicaciones pulmonares.
7. TC multicorte. Complemento esencial del estudio ecocardiográfico en la valoración de los cambios perivalvulares: abscesos, pseudoaneurismas y fístulas; también en portadores de prótesis valvulares; útil en la valoración de la anatomía de la válvula aórtica (p. ej. perforación de velo) y de la aorta, y en el diagnóstico del embolismo pulmonar en EI de la parte derecha de corazón; en la detección de los abscesos metastásicos (p. ej. en el bazo) y embolismo en el SNC (menos sensible que la RMN, pero con acceso más fácil).
8. RMN: más sensible que la TC para el diagnóstico de ACV (sobre todo clínicamente silente), del accidente isquémico transitorio y de encefalopatía.
9. Pruebas radioisotópicas: aumentan la probabilidad de detectar focos infecciosos y, por lo tanto, confirmar el diagnóstico de EI. Son especialmente útiles en el diagnóstico de EI tras implantar válvula protésica.
Criterios diagnósticos
El diagnóstico de EI puede establecerse, cuando en un enfermo con sepsis o infección generalizada se observan signos objetivos de afectación endocárdica.
1. EI definida →tabla 2.13-1.
2. EI posible →tabla 2.13-1.
3. EI activa:
1) resultados positivos de hemocultivos o de los cultivos del material extraído durante la cirugía
2) signos de la endocarditis observados durante la cirugía
3) no se ha finalizado la antibioticoterapia iniciada a raíz del diagnóstico de EI.
4. Recidiva de EI: EI provocada por el mismo microorganismo en <6 meses desde el diagnóstico del episodio previo. Reinfección: EI provocada por el mismo microorganismo en >6 meses desde el diagnóstico del episodio previo, o provocada por otro microorganismo.
5. EI asociada a dispositivos cardíacos implantados: es difícil de distinguir de la infección local del dispositivo. Se debe sospechar en caso de fiebre de causa no precisada en un enfermo con un dispositivo implantado. Las pruebas más importantes para su diagnóstico son la ecocardiografía (la transesofágica es más sensible y específica, pero primero hay que realizar la transtorácica) y los hemocultivos.
Diagnóstico diferencial
Otras causas de la fiebre →Fiebre de origen desconocido, enfermedades sistémicas del tejido conectivo, neoplasias, brote de fiebre reumática en pacientes con cardiopatía conocida previamente.
Causas de un resultado falso positivo en la ecocardiografía: trombos y tumores intracardíacos con forma polipoide no infectados; vegetaciones valvulares no infectadas (p. ej. en endocarditis de Libman-Sacks en el curso de LES, con menor frecuencia en la enfermedad de Behçet, NEN secretora de serotonina, fiebre reumática aguda).
TratamientoArriba
El diagnóstico de EI es una indicación de hospitalización, habitualmente durante 4-6 semanas. La EI en una prótesis valvular precisa tratamiento durante ≥6 semanas.
Tratamiento farmacológico
1. Antibioticoterapia iv.: en estado grave (p. ej. sepsis) el tratamiento será empírico →fig. 2.13-1; en los demás casos según el antibiograma: p. ej. la EI por estreptococos →fig. 2.13-2, por estafilococos →fig. 2.13-3, por otros microorganismos (incluidos los que son causa de EI con hemocultivos negativos →tabla 2.13-2).
2. Prevención antifúngica (no incluida en las guías de ESC): p. ej. fluconazol 50-100 mg/d, en casos no complicados por lo menos durante las 2 primeras semanas de antibioticoterapia.
3. Tratamiento anticoagulante: la EI por sí misma no constituye una indicación para empezarlo, pero se debe continuar si el paciente lo recibe por otras indicaciones. Si puede resultar necesaria una evaluación urgente de la indicación quirúrgica o si se observan considerables oscilaciones del INR, cambiar el anticoagulante previo por HNF. En caso de ACV hemorrágico → suspender todos los anticoagulantes y antiagregantes. En pacientes con prótesis valvular reiniciar el tratamiento anticoagulante (utilizando HNF) siempre y cuando sea seguro. En caso de complicaciones hemorrágicas graves, suspender el tratamiento antiagregante y consultar con un equipo de expertos en EI.
Tratamiento invasivo
La decisión terapéutica más difícil es establecer el momento adecuado para la cirugía. El estado hemodinámico puede requerir tratamiento quirúrgico incluso en caso de antibioticoterapia efectiva. Son indicaciones de cirugía inmediata (en las primeras 24 h): edema de pulmón o shock cardiogénico por insuficiencia o estenosis mitral o aórtica graves, o formación de comunicaciones intracardíacas o entre las cámaras cardíacas y el pericardio. Son indicaciones de cirugía urgente (en días) en la EI activa: insuficiencia cardíaca grave provocada por disfunción de válvula nativa o protésica; persistencia de infección después de 7-10 días de antibioticoterapia dirigida; afectación de estructuras perivalvulares (absceso, fístula o rotura de los velos valvulares, alteraciones en la conducción, miocarditis); infección por microorganismos que habitualmente no responden bien al tratamiento conservador (hongos, Brucella, Coxiella) o que pueden provocar una destrucción rápida de las estructuras cardíacas afectadas (p. ej. Staphylococcus lugdunensis); embolismo recidivante, vegetaciones >10 mm a pesar de una antibioticoterapia adecuada (sobre todo en las primeras 2 semanas de tratamiento); presencia de vegetaciones móviles de >10 mm y otros signos que empeoran el pronóstico: insuficiencia cardíaca, abscesos, tratamiento ineficaz (hay menos evidencias de la necesidad de cirugía urgente en pacientes con vegetaciones de >15 mm sin los signos enumerados con anterioridad).
Los enfermos con insuficiencia valvular sin signos de insuficiencia cardíaca deben operarse de manera programada.
Se admite el tratamiento quirúrgico después de una embolia al SNC si se descarta la hemorragia intracraneal, el paciente no está en coma, el ACV no ha provocado gran lesión cerebral, no hay comorbilidad que sea contraindicación para el tratamiento quirúrgico (en todo paciente con complicaciones neurológicas hay que realizar una TC o una RMN craneal) y el enfermo tiene insuficiencia cardíaca grave, sepsis no controlada, infección por microorganismo resistente a la antibioticoterapia, absceso o existe un riesgo elevado de nuevo episodio de embolismo. La cirugía con circulación extracorpórea dentro de los primeros 30 días después del ACV se relaciona con un riesgo adicional y elevado de complicaciones. El accidente isquémico transitorio y el embolismo asintomático al SNC también son indicaciones para el tratamiento quirúrgico. El riesgo de embolismo es mayor antes de empezar la antibioticoterapia y en los primeros días de tratamiento; después de 2 semanas de tratamiento el riesgo disminuye de manera significativa.
Tratamiento de la EI asociada a dispositivos cardíacos implantados: empezar la antibioticoterapia (inicialmente empírica; preferiblemente con un antibiótico eficaz contra los estafilococos; después según el antibiograma); contactar con el centro en el que se retiran los dispositivos implantados de manera percutánea (en caso de las vegetaciones >20 mm considerar la cirugía); analizar una vez más las indicaciones para la reimplantación del dispositivo. Si el estado del enfermo lo permite, posponer la reimplantación hasta que la EI esté curada. Si el paciente depende del estimulador, se debe implantar un electrodo temporal en el lado opuesto.
Tratamiento de EI en personas adictas a drogas: debido a la adicción, se observan recurrencias frecuentes de EI, por lo cual es relativamente raro que se indique el reemplazo valvular. Considerar el tratamiento quirúrgico en caso de bacteriemia mantenida >7 días a pesar de tratamiento antimicrobiano adecuado, en infecciones por hongos, en caso de insuficiencia cardíaca derecha resistente al tratamiento, y en caso de vegetaciones grandes y persistentes (>20 mm) tras embolismos pulmonares recurrentes. Es importante someter al enfermo al tratamiento de la adicción.
Combinar el tratamiento quirúrgico con la antibioticoterapia, cuya duración se calcula a partir del primer día de antibioticoterapia dirigida, y no desde el día de la cirugía. Si los resultados de los cultivos del tejido valvular son positivos y la cepa bacteriana aislada es resistente a los antibióticos utilizados, empezar un nuevo ciclo completo de tratamiento con antibióticos eficaces contra las bacterias aisladas.
VigilanciaArriba
Controlar: la temperatura corporal (en caso de evolución clínica no complicada la temperatura se normaliza a los 5-10 días), el nivel de la proteína C-reactiva (habitualmente baja bruscamente después de 7-14 días de tratamiento, puede estar elevado durante >4-6 semanas; la persistencia de niveles elevados de proteína C-reactiva es un signo de infección persistente), el recuento de leucocitos (normalización en la 1.ª o 2.ª semana del tratamiento), el recuento de plaquetas y de hematíes, la concentración de creatinina en el suero y la TFGe. Realizar hemocultivos de control a las 48-72 h para evaluar la eficacia del tratamiento. Observar las manifestaciones de posibles complicaciones cardíacas y extracardíacas, sobre todo de eventos embólicos. Si el paciente se ha tratado de forma conservadora, una vez terminado el tratamiento, evaluar el grado de la cardiopatía y las indicaciones de tratamiento quirúrgico. Repetir un estudio transtorácico de control al finalizar el tratamiento.
Planificar 4 visitas ambulatorias: a los 1, 3, 6 y 12 meses de la finalización del tratamiento hospitalario.
ComplicacionesArriba
Embolismo, focos metastásicos de infección, lesiones valvulares, insuficiencia cardíaca, alteraciones del ritmo y de la conducción, insuficiencia renal.
PrevenciónArriba
1. Métodos inespecíficos:
1) higiene de la boca y de la piel (controles odontológicos 2 × año en caso de personas con alto riesgo y 1 × año en los demás casos)
2) desinfección de heridas
3) erradicación o reducción del estado de portador crónico de bacterias en piel y en vías urinarias
4) uso de antibióticos en caso de cualquier foco de infección bacteriana
5) abstención del uso de antibióticos sin indicación médica
6) medidas estrictas de prevención de infecciones en todo caso de procedimiento de riesgo para EI
7) recomendar a los pacientes no aplicarse piercing ni tatuajes
8) limitación en lo posible del uso de catéteres intravenosos y de intervenciones invasivas; usar preferentemente accesos venosos periféricos (en lugar de centrales) y recambiarlos regularmente cada 3-4 días; seguimiento estricto de los cuidados al enfermo portador de catéter venoso central o periférico.
2. Indicaciones para la profilaxis antibiótica: la prevención de la EI se recomienda solamente antes de intervenciones odontológicas que requieran manipulaciones en las encías o en la zona de la raíz dental, o rotura de la continuidad de la mucosa (extracción dental, manipulaciones en el periodonto, endodoncia, eliminación del sarro dental, implante dental, biopsia en la cavidad oral), y solo en personas con:
1) prótesis valvulares incluidas las percutáneas (se recomienda en caso de colocación percutánea de prótesis valvular aórtica o del tronco pulmonar, se debe considerar tras la reparación percutánea de las válvulas mitral y tricúspide), o valvuloplastia previa con inserción de material de reparación
2) EI previa
3) cardiopatía congénita cianótica; corrección quirúrgica completa de cardiopatía sin defecto residual y sin colocación de prótesis valvular, hasta 6 meses tras la intervención; tratamiento quirúrgico o transcatéter previo con bypass paliativo, utilizando tubos u otras prótesis
4) dispositivo de asistencia ventricular.
Se puede considerar la profilaxis antibiótica en enfermos tras un trasplante cardíaco.
3. Se recomienda antibioticoterapia (1 dosis 30-60 min antes de la intervención):
1) personas sin alergia a la penicilina: amoxicilina (VO) o ampicilina (iv. o IM) 2 g en adultos y 50 mg/kg en niños; cefazolina o ceftriaxona IM o iv. 1 g en adultos y 50 mg/kg en niños
2) personas alérgicas a la penicilina: cefalexina VO 2 g en adultos y 50 mg/kg en niños; azitromicina o claritromicina VO 500 mg en adultos y 15 mg/kg en niños; doxiciclina VO 100 mg en personas >45 kg y 2,2 mg/kg en personas <45 kg; cefazolina o ceftriaxona IM o iv. 1 g en adultos y 50 mg/kg en niños.
No se debe utilizar cefalosporinas si hay antecedentes de anafilaxia, angioedema o urticaria tras utilizar penicilina o ampicilina.
PERSPECTIVA LATINOAMERICANA
La dalfopristina no está disponible en Chile ni en Colombia.
TABLAS Y FIGURAS
Diagnóstico de endocarditis infecciosa (EI): criterios de la Universidad de Duke, modificados por la ESC en 2023
|
Criterios mayores
|
|
1) Hemocultivos positivos
a) microorganismos compatibles con EI en 2 hemocultivos separados
– estreptococos orales, Streptococcus gallolyticus (Streptococcus bovis), grupo HACEK, Staphylococcus aureus, Enterococcus faecalis; o
b) microorganismos compatibles con EI en hemocultivos positivos persistentemente
– ≥2 hemocultivos positivos de muestras de sangre tomadas con >12 h de diferencia; o
– los 3 hemocultivos positivos, o una mayoría de ≥4 hemocultivos separados ≥1 h entre la primera y la última muestra; o
– cultivo único de sangre positivo para Coxiella burnetii, o un título de anticuerpos IgG contra Coxiella burnetii >1:800
2) Evidencia de EI en pruebas de imagen: cambios anatómicos o focos de metabolismo alterado localizados en la válvula, zona perivalvular o en material implantado, detectados mediante uno de los siguientes métodos
a) ecocardiografía (transtorácica o transesofágica)
b) TC cardíaca
c) 18F‑FDG PET/TC
d) SPECT/TC con leucocitos marcados.
|
|
Criterios menores
|
|
1) Factores predisponentes de EI (cardiopatía asociada con riesgo alto o intermedio de IC o uso de drogas por vía endovenosa)
2) Fiebre >38 °C
3) Fenómenos embólicos (incluidos los que se detectan solo por imagen): embolias sistémicas o pulmonares mayores, infartos o abscesos, complicaciones osteoarticulares sépticas hematógenas (espondilodiscitis), aneurisma infeccioso, focos de hemorragia o isquemia intracraneal, hemorragias conjuntivales, lesiones de Janeway
4) Fenómenos inmunológicos: glomerulonefritis, nódulos de Osler, manchas de Roth, factor reumatoide
5) Evidencia microbiológica: hemocultivo positivo que no cumple un criterio mayor o evidencia serológica de infección activa por un microorganismo compatible con EIa
|
|
Interpretación
|
|
EI definida:
1) 2 criterios mayores; o
2) 1 criterio mayor + ≥3 criterios menores; o
3) 5 criterios menores
EI posible:
1) 1 criterio mayor + 1-2 criterios menores; o
2) 3-4 criterios menores
EI descartada:
No se cumplen los criterios de EI definida o posible, con o sin diagnóstico alternativo firme.
|
|
a Nota de la editorial: en la actualidad, con cada vez mayor frecuencia se realiza la PCR del ARNr.
18F‑FDG PET/TC — tomografía por emisión de positrones con 18F-fluorodesoxiglucosa asociada a la tomografía computarizada, SPECT/TC — tomografía por emisión de fotón único con tomografía computarizada, TC — tomografía computarizada
A partir de los criterios de la ESC 2023, modificados
|
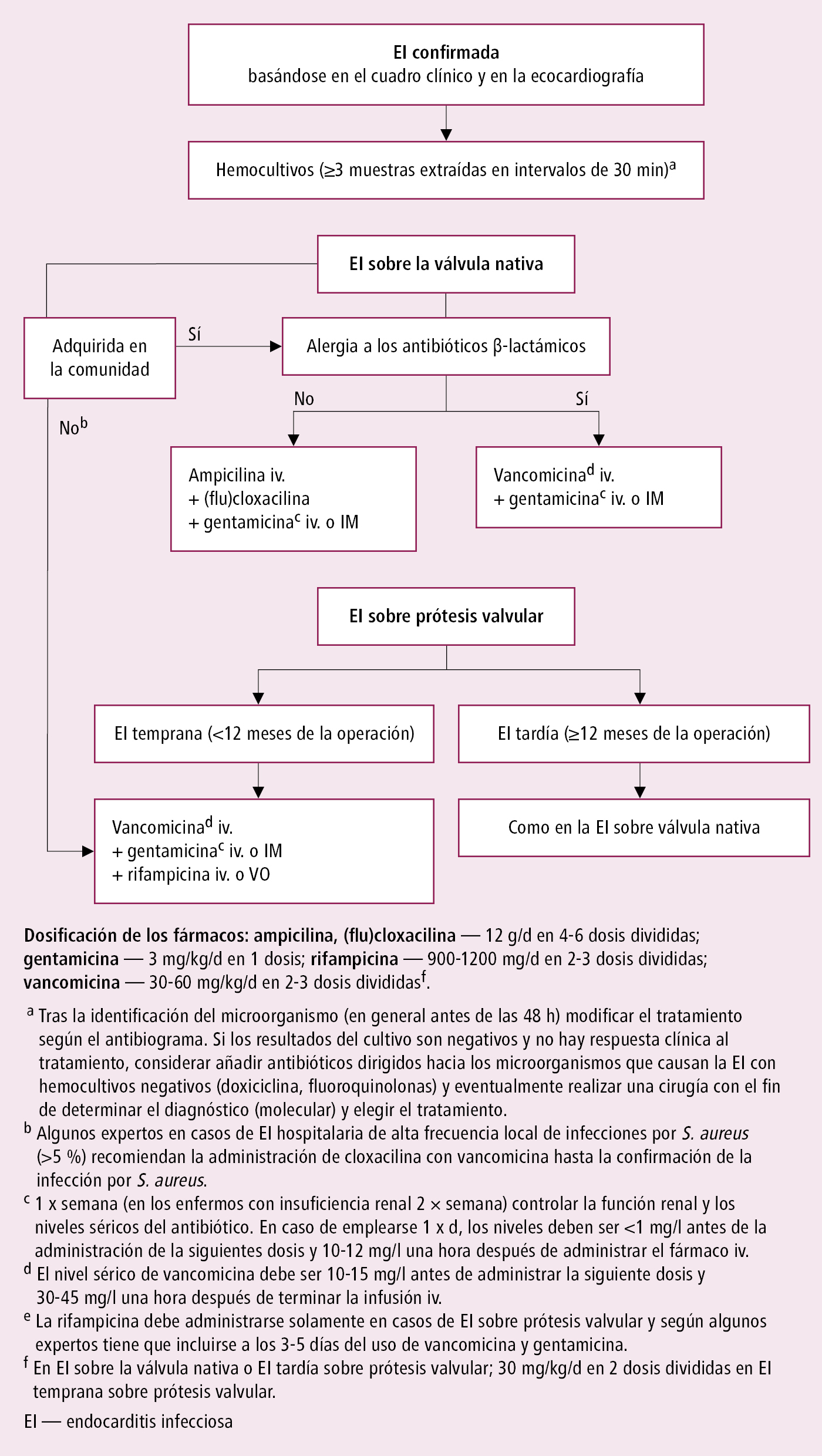
Fig. 2.13-1. Antibioticoterapia empírica de la endocarditis infecciosa (EI) antes del aislamiento o sin aislamiento de microorganismo (a partir de las guías de la ESC 2023, modificado)
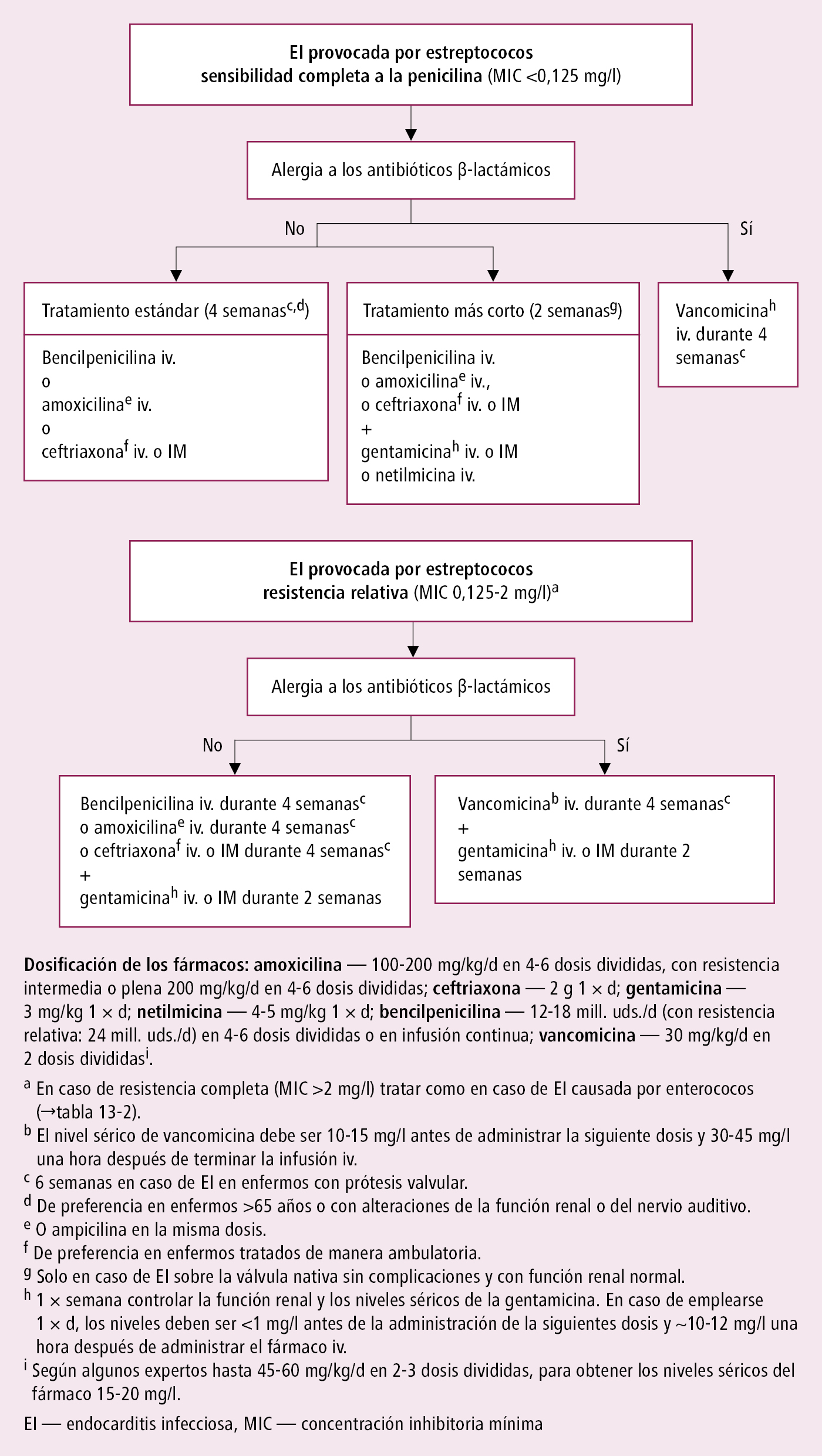
Fig. 2.13-2. Antibioticoterapia específica en la EI por estreptococos de la cavidad bucal o Streptococcus gallolyticus (a partir de las guías de la ESC 2023, modificado)

Fig. 2.13-3. Antibioticoterapia específica en la EI por estafilococos (a partir de las guías de la ESC 2023, modificado)
Antibioticoterapia de la endocarditis infecciosa causada por microorganismos distintos a estreptococos y estafilococos
|
Enterococos
|
|
Cepas resistentes a antibióticos β-lactámicos y gentamicina
– amoxicilina 200 mg/kg/d (o ampicilina 12 g/d) iv. repartida en 4-6 dosis durante 4-6 semanas + gentamicinaa 3 mg/kg/d iv. o IM en dosis única, durante 2 semanas o
– amoxicilina 200 mg/kg/d (o ampicilina 12 g/d) iv. repartida en 4-6 dosis durante 6 semanas + ceftriaxona 4 g/d iv. o IM repartida en 2 dosis, durante 6 semanas
Cepas resistentes a aminoglucósidos
Amoxicilina 200 mg/kg/d (o ampicilina 12 g/d) iv. repartida en 4-6 dosis durante 6 semanas + ceftriaxona 4 g/d iv. o IM repartida en 2 dosis, durante 6 semanasb
|
|
Cepas resistentes a antibióticos β-lactámicos (E. faecium)
– resistencia provocada por producción de β-lactamasa: utilizar ampicilina con sulbactam o amoxicilina con ácido clavulánico (en lugar de ampicilina o amoxicilina) en esquemas arriba presentados
– resistencia provocada por proteínas que se unen a penicilina: utilizar el esquema de tratamiento con vancomicina: vancomicina 30 mg/kg/d iv. repartida en 2 dosis durante 6 semanas + gentamicina 3 mg/kg/d iv. o IM en dosis única, durante 2 semanas
|
|
Cepas resistentes a vancomicina
Daptomicina 10-12 mg/kg/d iv. en dosis única + antibiótico β-lactámico (ampicilina 300 mg/kg/d iv. repartida en 4-6 dosis, ertapenemc 2 g/d iv. o IM en dosis única o ceftarolina 1800 mg/d iv. repartida en 3 dosis) o fosfomicina 12 g/d iv. repartida en 4 dosis
|
|
Cepas resistentes a varios antibióticos (aminoglucósidos, β-lactámicos y vancomicina)
– daptomicina 10 mg/kg/d iv. en dosis única + ampicilina 200 mg/kg/d iv. repartida en 4-6 dosis, ertapenemc 2 g/d iv. en dosis única o ceftarolina 600 mg/8 h iv. o fosfomicina 3 g/6 h iv. durante ≥8 semanasd, o
– linezolid 600 mg iv. o VO 2 × d durante ≥8 semanase, o
– quinupristina con dalfopristinaf a dosis de 7,5 mg/kg 3 × d durante ≥8 semanas
Nota. Dosis en niños (no deben ser mayores a las dosis de adultos): amoxicilina 100-200 mg/kg/d iv. repartida en 4-6 dosis, ampicilina 300 mg/kg/d iv. repartida en 4-6 dosis, gentamicina 3 mg/kg/d iv. o IM en dosis única o repartida en 3 dosis, o vancomicina 30 mg/kg/d iv. repartida en 2-3 dosis, ceftriaxona 100 mg/kg iv. o IM repartida en 2 dosis, daptomicina 10-12 mg/kg/d en dosis única (ajustada a la edad), ertapenemc 1 g/d iv. o IM en dosis única, ceftarolina 24-36 mg/kg/d iv. repartida en 3 dosis, fosfomicina 2-3 g/d iv. en dosis única
|
|
Grupo HACEK (Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella spp.)
|
|
Cefalosporina de III generación (p. ej. ceftriaxona 2 g/d iv. o IM durante 4 semanas en EVN y durante 6 semanas en EVP). Si no producen β-lactamasa: ampicilina 12 g/d iv. repartida en 4 o 6 dosis durante 4-6 semanas + gentamicina 3 mg/kg/d repartida en 2-3 dosis durante 2 semanas
|
|
Bacterias que causan EI con cultivo negativo (todas las abajo mencionadas)
|
|
Brucella spp.
|
|
Doxiciclina 200 mg/d + cotrimoxazol 960 mg 2 × d + rifampicina 300-600 mg/d durante ≥3-6 meses VO. Durante las primeras semanas se puede añadir estreptomicina 15 mg/kg/d repartida en 2 dosis
|
|
Coxiella burnetii
|
|
Doxiciclina 200 mg/d + hidroxicloroquina 200-600 mg/d VO (se prefiere sobre la doxiciclina en monoterapia) durante >18 meses
|
|
Bartonella spp.
|
|
Doxiciclina 100 mg VO 2 × d durante 4 semanas + gentamicina 3 mg/kg/d iv. durante 2 semanas
|
|
Legionella spp.
|
|
Levofloxacina 500 mg iv. o VO 2 × d durante ≥6 semanas o claritromicina 500 mg 2 × d iv. durante 2 semanas, a continuación VO durante 4 semanas + rifampicina 300-1200 mg/d
|
|
Mycoplasma spp.
|
|
Levofloxacina 500 mg iv. o VO 2 × d durante ≥6 meses
|
|
Tropheryma whippleig
|
|
Doxiciclina 200 mg/d + hidroxicloroquina 200-600 mg/d VO (se prefiere sobre la doxiciclina en monoterapia) durante ≥18 meses
|
|
a Dosis máxima: 240 mg/d 1 × semana monitorizar la función renal y el nivel sérico de gentamicina, que debe estar <1 mg/l antes de la administración de la siguiente dosis y 10-12 mg/l una hora después de la administración iv. de la dosis única diaria del medicamento.
b Fármacos recomendados en caso de resistencia a gentamicina. Si está preservada la sensibilidad a la estreptomicina, se puede sustituir la gentamicina (combinación de fármacos en caso de cepas sensibles a gentamicina →más arriba) por estreptomicina 15 mg/kg/d IM repartida en 2 dosis.
c El uso de fármaco a dosis altas se asocia a la presencia de convulsiones.
d Es imprescindible la colaboración con un especialista en medicina infecciosa.
e Monitorizar la toxicidad hematológica.
f No activas frente a E. faecalis.
g En caso de compromiso del SNC, a la doxiciclina se debe asociar sulfadiazina 1,5 g 4 × d VO. Tratamiento alternativo: ceftriaxona (2 g/d iv.) durante 2-4 semanas o bencilpenicilina (2 mill. uds. 6 × d) y estreptomicina (1 g/d) iv. durante 2-4 semanas, a continuación cotrimoxazol (800 mg 2 × d) VO. Trimetoprim no funciona en caso de infección por T. whipplei.
EVN — endocarditis infecciosa sobre válvula nativa, EVP — endocarditis infecciosa sobre válvula protésica
A partir de las guías de la ESC 2023, modificado
|
 Español
Español
 English
English
 українська
українська







