DEFINICIÓN Y ETIOPATOGENIAArriba
El cáncer colorrectal (en un 85 % adenocarcinoma) se desarrolla sobre adenomas en un 90 % de los casos. Se consideran estados precancerosos: adenomas, síndrome de poliposis familiar y enfermedades inflamatorias intestinales. Es raro antes de los 40 años de edad, a excepción de los síndromes de poliposis genéticamente condicionados (0,5-2 % de todos los casos de cáncer colorrectal) →más arriba, en los que se presenta más precozmente. Hasta el 5 % de los casos de cáncer colorrectal está representado por el síndrome de Lynch →Síndrome de Lynch.
PERSPECTIVA LATINOAMERICANA
En las Américas, dónde es el cuarto cáncer más común, se registran cada año unos 246 000 nuevos casos y aprox. 112 000 muertes debidas a esta enfermedad. La incidencia y la mortalidad en América Latina y el Caribe (ALC) es generalmente menor que en EE. UU. y Canadá, con la excepción Uruguay, Argentina, Barbados y Trinidad, cuyas tasas de incidencia son similares a las de los EE. UU. y Canadá.
En ALC, la incidencia de esta enfermedad ha ido creciendo, principalmente debido a los cambios demográficos como el incremento en la esperanza de vida, los cambios de estilo de vida y patrones alimentarios, entre otros.
Se pronostica que para el año 2030 la incidencia de CCR en las Américas crecerá un 60 % con un total de 396 000 nuevos casos/año. Este crecimiento se producirá en gran parte en ALC donde el incremento de nuevos casos doblará el de EE. UU. y Canadá. La mortalidad por CCR en varios países de ALC sigue aumentando.
CUADRO CLÍNICOArriba
Cáncer de la mitad derecha del colon → hemorragia digestiva oculta (anemia progresiva) y/o dolor abdominal. Cáncer de recto y de la mitad izquierda del colon → hemorragia digestiva baja manifiesta y alteraciones del hábito intestinal (diarrea con gran cantidad de moco o estreñimiento). Cáncer del recto inferior → con frecuencia tumoración palpable durante el tacto rectal. Las primeras manifestaciones pueden ser: tenesmo rectal persistente, dolor, heces en forma de lápiz, diarrea u obstrucción. En el cáncer de recto, el sangrado y la perforación intestinal son raros.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Pruebas de laboratorio
1) anemia ferropénica: frecuente sobre todo en el cáncer de ciego y de colon ascendente
2) elevación del CEA), y el cáncer colorrectal" name="160893">antígeno carcinoembrionario (CEA) sérico (sensibilidad y especificidad relativamente bajas: tiene valor en el control después del tratamiento y no en el diagnóstico de la enfermedad)
3) presencia de sangre oculta en heces.
2. Colonoscopia: es la prueba diagnóstica principal, permite detectar el tumor, tomar biopsias y explorar la totalidad del intestino para identificar lesiones sincrónicas (en un 1-3 % de los casos se identifican focos del cáncer en otros segmentos intestinales).
3. Pruebas de imagen. TC: detección de metástasis hepáticas, peritoneales, ganglionares y en los órganos torácicos. Ecografía abdominal: menor sensibilidad en la detección de metástasis. Ecoendoscopia (ecografía transrectal) y RMN: para descartar las metástasis hepáticas (método de referencia) y evaluar la profundidad de la infiltración tumoral en la pared rectal y afectación de los ganglios linfáticos regionales. PET: detección de recidivas (puede dar falsos negativos en el cáncer con componente mucocelular, y falsos positivos en casos de tratamiento con metformina [aumenta la absorción de la 18F-desoxiglucosa por las células intestinales]).
4. Prueba histológica: en un 85 % de los casos se trata de adenocarcinomas con diverso grado de diferenciación, de los cuales ~20 % son poco diferenciados o indiferenciados con un peor pronóstico.
Tamizaje
1. Objetivo: detección del cáncer en un estadio temprano y detección y resección de pólipos considerados precancerosos: adenomatosos (→Pólipos adenomatosos) y serrados →Pólipos serrados).
2. Métodos: alternativamente
1) examen endoscópico, la colonoscopia con mayor sensibilidad y especificidad en el diagnóstico de neoplasias colorrectales, también permite extirpar los pólipos; excepcionalmente sigmoidoscopia como técnica de segunda elección
2) examen de heces para la detección de sangre oculta (de preferencia prueba inmunoquímica fecal [FIT], o eventualmente con guayacol [gFOBT]).
3. Tamizaje en personas con un riesgo común de sufrir la enfermedad (como en la población general): iniciar a partir de los 50 años (en mujeres y hombres):
1) FIT, eventualmente gFOBT cada año, o
2) colonoscopia cada 10 años.
En caso de hallar sangre oculta en heces o pólipos en la sigmoidoscopia → siempre realizar la colonoscopia completa. No se recomienda el tacto rectal como tamizaje (baja sensibilidad), pero debe realizarse en la exploración física de rutina.
4. En personas con mayor riesgo de desarrollar la enfermedad
1) después de una polipectomía realizar colonoscopia con una frecuencia que dependerá del número y del tipo de pólipos →Pólipos adenomatosos y →fig. 1 en Pólipos adenomatosos
2) poliposis adenomatosa familiar →Poliposis adenomatosa familiar
3) familiares de enfermos con síndrome de Lynch que cumplen los criterios de Ámsterdam II →Síndrome de Lynch.
Criterios diagnósticos
El diagnóstico se realiza mediante el estudio histológico de las muestras de biopsia tomadas durante la colonoscopia y posteriormente de toda la pieza quirúrgica. Para precisar el tratamiento es indispensable determinar el estadio de la enfermedad →tabla 1.
Diagnóstico diferencial
Enfermedad diverticular del colon, adherencias, ulceración del intestino grueso causada por AINE, colitis infecciosa e inespecífica, otras neoplasias intestinales (linfoma, NEN), síndrome de la úlcera rectal solitaria, hemorroides.
TRATAMIENTO Y PRONÓSTICOArriba
Al planificar el tratamiento del cáncer colorrectal, es fundamental excluir la diseminación y la infiltración no resecable de órganos adyacentes. La mayoría de los enfermos son tratados quirúrgicamente (por laparotomía o laparoscopia) con linfadenectomía regional simultánea. También es posible la resección endoscópica (en casos de carcinomas que se limitan a un pólipo si se verifica microscópicamente la extirpación completa y no presenta rasgos clínicos de afectación de ganglios linfáticos regionales).
Tratamiento preoperatorio
Indicado en enfermos con
1) cáncer de recto: tumor cT3 o cN1-2, evaluado clínicamente como "móvil" → radioterapia; tumor T3 evaluado clínicamente como "inmóvil" o T4 → radioquimioterapia (con el fin de disminuir la masa tumoral y el riesgo de recidiva local)
2) cáncer colorrectal avanzado, antes de la resección de metástasis hepáticas o pulmonares → tratamiento sistémico.
Tratamiento quirúrgico
El tratamiento principal del cáncer de recto o colon es la resección clásica, laparoscópica o robótica, del segmento intestinal afectado, con linfadenectomía regional. En caso de tumores no avanzados (cN0), bien diferenciados (G1-2) y pequeños es posible la resección local con técnicas endoscópicas. En pacientes seleccionados con cáncer de recto, sobre todo con contraindicaciones médicas para la cirugía, la radioterapia radical o radioquimioterapia pueden ser una alternativa. El pronóstico posoperatorio depende del estadio de la enfermedad →tabla 1.
El tratamiento quirúrgico puede incluir también la extirpación de metástasis hepáticas o pulmonares.
Tratamiento complementario
1. Cáncer de colon: el tratamiento sistémico complementario (en enfermos en estado físico bueno o moderado) se utiliza en caso de metástasis ganglionares regionales (estadio III), y se puede considerar en el estadio II (pN0) y en otros pacientes que presenten factores de riesgo adicionales (pT4, grado G3, número insuficiente [es decir, <12] de ganglios linfáticos extirpados o estudiados), o si existe un mayor riesgo asociado a la cirugía (cirugía urgente, perforación tumoral, dehiscencia anastomótica, complicaciones infecciosas posoperatorias graves); con mayor frecuencia fluorouracilo (5-FU) con folinato de calcio, capecitabina y oxaliplatino (en distintos esquemas).
2. Cáncer de recto: en pacientes no sometidos a la radioterapia preoperatoria se considera la quimioterapia complementaria según las indicaciones similares a aquellas que se aplican en el cáncer de colon.
Tratamiento sistémico del cáncer avanzado metastásico
1. Cáncer colorrectal avanzado con metástasis a distancia: quimioterapia (en enfermos en buen estado general). Se suele comenzar con esquemas que contienen 5-FU e irinotecán u oxaliplatino, hasta la estabilización de la enfermedad (generalmente en 4-6 meses). También se emplean (sobre todo como segunda y siguientes líneas de tratamiento): aflibercept, bevacizumab (antagonista de VEGF), cetuximab y panitumumab (antagonistas de EGFR; para usarlos es necesario, entre otros, demostrar ausencia de mutaciones activadoras de genes KRAS, NRAS o BRAF). Antes de iniciar el tratamiento sistémico debe evaluarse el estado de exones seleccionados de genes KRAS y NRAS, así como la mutación V600 del gen BRAF, ya que el perfil molecular es un requisito para añadir el fármaco biológico al esquema terapéutico, y puede proporcionar información acerca del pronóstico (la mutación V600 del gen BRAF se asocia a un pronóstico desfavorable).
2. Estenosis: permeabilización paliativa mediante la colocación de una prótesis a nivel de la estenosis, eliminación de tejido neoplásico mediante coagulación con argón; sin embargo, en la actualidad se prefiere realizar un estoma (si el paciente es apto para anestesia general y resección).
3. Metástasis hepáticas: resección o tratamiento local mediante procedimientos percutáneos de termoablación o inyección de alcohol (u otras sustancias) al tumor. En caso de infiltración vascular, radioterapia con haz concentrado (radiocirugía). La quimio- y radioembolización a través de las ramas de la arteria hepática a veces se utilizan como tratamiento que permite la resección hepática.
VIGILANCIAArriba
Después de una cirugía radical realizar revisión clínica y determinación del CEA cada 3-6 meses durante los primeros 3 años, a continuación cada 6-12 meses hasta los 5 años después de la intervención. La ESMO recomienda la TC de tórax, abdomen y pelvis cada 6-12 meses durante los 3 años iniciales, y a continuación cada 12 meses, hasta los 5 años posteriores a la intervención. Colonoscopia completa antes de la cirugía o hasta los 6 meses posteriores a la cirugía, al año después de la cirugía, 3 años más tarde (4 años desde la intervención) y 5 años más tarde (9 años desde la intervención). En intervalos más cortos en caso de detectar lesiones que requieran vigilancia. La vigilancia colonoscópica debe acabar cuando el paciente alcance los 80 años o antes, si las comorbilidades acortan la esperanza de vida.
Situaciones especialesArriba
Cáncer colorrectal familiar
En un 30 % de los enfermos con cáncer colorrectal presenta ≥1 caso en su familia. El riesgo de desarrollar cáncer colorrectal aumenta de manera significativa en caso del cáncer colorrectal en ≥2 familiares de 1.er grado, independientemente de la edad del diagnóstico, o de ≥1 familiar de 1.er grado con enfermedad <50 años. En tales casos se recomienda vigilancia colonoscópica cada 5 años a partir de los 40 años. En caso de detectar pólipos, se aplican las recomendaciones generales, salvo la colonoscopia de control después de extirpar lesiones que no requieren vigilancia, que también tiene que realizarse a los 5 años.
PrevenciónArriba
El ácido acetilsalicílico ~300 mg/d disminuye en un 40-50 % la morbilidad y la mortalidad por cáncer colorrectal, pero no se recomienda rutinariamente debido al incierto balance de beneficios (prevención del cáncer colorrectal) y de riesgos (efectos adversos digestivos). Se ha comprobado que los beneficios son superiores a los riesgos en el subgrupo de personas de 50-60 años con mayor riesgo de eventos cardiovasculares. El aumento del consumo de fibra y productos lácteos, así como de la actividad física también reducen el riesgo de desarrollar cáncer colorrectal.
TABLAS Y FIGURAS
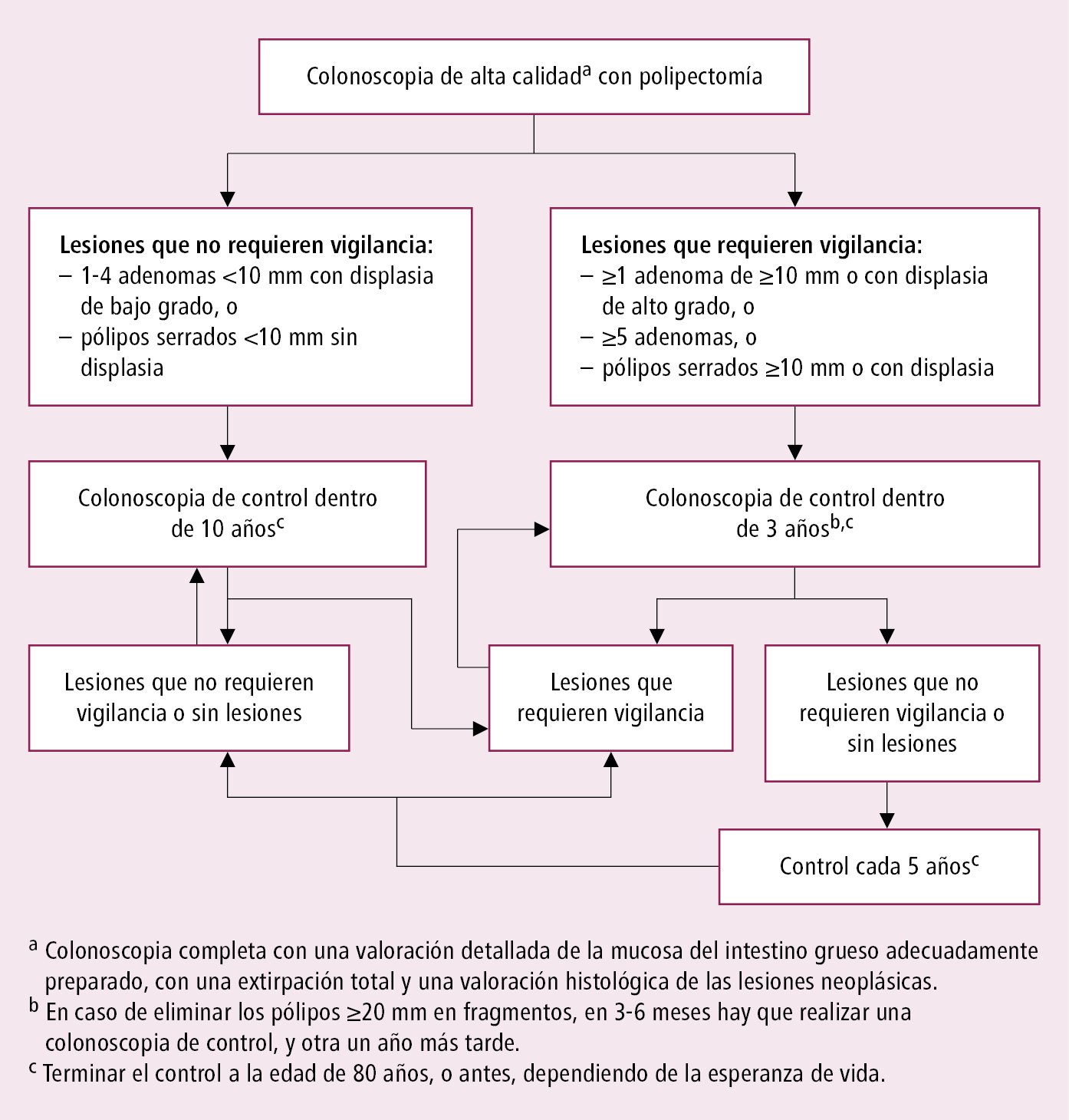
Fig. 4.23-1. Control endoscópico tras la polipectomía según las guías de la ESGE 2020 (no aplicable en enfermos diagnosticados de cáncer)
Evaluación simplificada del estadio clínico del cáncer de colon y recto, y tasa de supervivencia a los 5 años
|
Grado
|
Clasificación de Dukesa/Astler-Coller
|
Clasificación TNM
|
Descripción
|
Supervivencia a los 5 años
|
|
0
|
–
|
Tis, N0, M0
|
Cáncer limitado a la mucosa
|
100 %
|
|
I
|
A / A y B1
|
T1-T2, N0, M0
|
Tumor que no sobrepasa la muscular
|
85-100 %
|
|
II
|
B / B2 y B3
|
T3-T4, N0, M0
|
Tumor que sobrepasa la pared intestinal
|
50-80 %
|
|
III
|
C / C1, C2 y C3
|
T1-T4, N1-N2, M0
|
Metástasis ganglionares
|
30-60 %
|
|
IV
|
D
|
T1-T4, N0-N2, M1
|
Metástasis a distancia
|
Hasta varios %
|
|
a Con la modificación de Turnbull.
|
 Español
Español
 English
English
 українська
українська





