PERSPECTIVA LATINOAMERICANA
Una revisión sistemática y un metanálisis reciente concluyeron que la prevalencia de MASLD (esteatosis hepática metabólica) en América Latina es de un 24 % entre la población general. Si analizamos el continente en su globalidad, es una de las más altas del mundo, del 35,7 %, con uno de los cambios de prevalencia anual más rápidos a nivel mundial, del 2,7%. Esta tendencia ascendente en la prevalencia de MASLD se correlaciona con el incremento en la prevalencia de diabetes tipo 2, que es particularmente alta en Chile y México (8,6 % y 13,5 %, respectivamente), sobrepeso y obesidad.
La disfunción metabólica puede interactuar con el alcohol (MetALD), aumentando el riesgo de MASLD a largo plazo. Se requieren más investigaciones en América Latina para establecer la historia natural de los pacientes pertenecientes a este subgrupo, así como definir los umbrales de consumo de alcohol asociados con daño hepático en individuos con disfunción metabólica.
Los datos han sugerido que la gravedad del MASLD puede ser mayor en latinoamericanos, pero se necesitan más datos para respaldar esta observación.
Definición y etiopatogeniaArriba
La enfermedad hepática grasa no alcohólica (NAFLD) se define como una esteatosis de gota gruesa de ≥5 % de los hepatocitos, sin otras causas de esteatosis (como p. ej. ayuno, fármacos, enfermedades monogénicas) en una persona que no toma alcohol o lo consume en pequeñas cantidades (es decir, <20 g/d de etanol en caso de mujeres y <30 g/d en caso de hombres). La NAFLD abarca la esteatosis hepática no alcohólica (NAFL; esteatosis simple o con una leve inflamación lobular, sin causas de esteatosis secundaria →tabla 7.11-1, mínimo riesgo de progresar a cirrosis) y la esteatohepatitis no alcohólica, que deriva de esta (NASH; esteatosis hepática con hepatitis crónica progresiva, balonamiento de los hepatocitos, con o sin fibrosis hepática; la NASH sin tratamiento evoluciona a fibrosis además de hepatocarcinoma).
El ACG introdujo el término "NAFLD magra" (lean NAFLD) para referirse a las personas con NAFLD sin sobrepeso u obesidad (IMC <23 kg/m2 en enfermos de origen asiático y <25 kg/m2 en los demás).
Con mayor frecuencia, la NAFLD se desarrolla en personas con obesidad (con trastornos del metabolismo lipídico, diabetes tipo 2 y/o hipertensión arterial), por lo que en 2020 se propuso cambiar el nombre de la enfermedad de NAFLD a MAFLD —enfermedad hepática grasa asociada a la disfunción metabólica— y simplificar los criterios diagnósticos, obviando el consumo de alcohol.
En 2023, los expertos mundiales bajo el auspicio de la AASLD y EASL acordaron una nueva nomenclatura: enfermedad hepática grasa asociada a disfunción metabólica (MASLD), que reemplaza el término NAFLD; para establecer el diagnóstico, además de cumplir los criterios (→Criterios diagnósticos), es necesario tomar en cuenta el consumo de alcohol. Si este es de 140-350 g/semana en mujeres y 210-420 g/semana en hombres, se debe diagnosticar MetALD (este diagnóstico considera el papel tanto de los trastornos metabólicos como de alcohol en el desarrollo de la esteatosis). En enfermos sin factores de riesgo de MAFLD ni otras causas conocidas de esteatosis (como enfermedad hepática alcohólica, esteatosis inducida por medicamentos, enfermedades monogénicas) se debe establecer el diagnóstico de enfermedad hepática grasa criptogénica (cryptogenic steatotic liver disease, cryptogenic SLD). La esteatohepatitis asociada a disfunción metabólica (metabolic dysfunction-associated steatohepatitis, MASH) reemplaza la NASH.
Para el desarrollo de la NAFLD son importantes:
1) los factores ambientales: dieta inapropiada (dieta hipercalórica, consumo excesivo de azúcares [fructosa, sacarosa y glucosa: provocan la aparición de grasa en el hígado mediante el proceso de lipogénesis] y de ácidos grasos saturados) y baja actividad física, así como
2) los factores genéticos: variantes de los genes PNPLA3, TM6SF2, E167K, MBOAT7, GCKR, HSD17B13. La insulinorresistencia, alteraciones en la regulación de la adiponectina y el estrés oxidativo desempeñan el papel principal en su patogenia; también es significativa la influencia de factores genéticos.
Los principales factores de riesgo de la NAFLD son: obesidad (sobre todo visceral), diabetes mellitus tipo 2, dislipidemia, síndrome del ovario poliquístico. Entre los factores de riesgo se enumeran también: hipotiroidismo, hipopituitarismo, hipogonadismo, apnea obstructiva del sueño, estado tras pancreatoduodenectomía y psoriasis.
CUADRO CLÍNICO E HISTORIA NATURALArriba
Síntomas: generalmente ausentes. Algunos pacientes refieren cansancio, debilidad, malestar general o sensación de incomodidad en el cuadrante superior derecho del abdomen. La enfermedad se diagnostica con frecuencia de forma accidental al realizar una ecografía prescrita por otras causas, o después de identificar una actividad irregular de enzimas hepáticas (ALT, AST) en el suero.
Signos: generalmente obesidad, hepatomegalia (<75 % de los enfermos) o esplenomegalia (<25 %) u otros rasgos de hipertensión portal (raramente).
La fibrosis suele progresar lentamente (en un promedio de 1 grado en 14 años en la NAFL y 7 años en la NASH), pero en un ~20 % de los enfermos la fibrosis es de progresión rápida. En los enfermos con NASH el riesgo de fibrosis hepática y carcinoma hepatocelular está aumentado, pero la causa principal de muerte son las enfermedades cardiovasculares.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Pruebas de laboratorio: generalmente existe un aumento leve o moderado de la actividad de ALT y AST (los valores elevados de ALT son >30 U/l; cociente de De Ritis <1; la actividad de las transaminasas en los enfermos con hepatopatía avanzada en el curso de NASH es en general normal) y de GGT (~50 % de los casos), hiperbilirrubinemia (de forma excepcional), dislipidemia (25-75 % de los enfermos), hiperglucemia o tolerancia a la glucosa alterada (con frecuencia), hipoalbuminemia y prolongación del TP (en la hepatopatía avanzada), niveles elevados de hierro y de ferritina (con bastante frecuencia).
2. Pruebas de imagen. Ecografía: aumento de la ecogenicidad hepática (esteatosis), con menor frecuencia hepatomegalia. En caso de cirrosis, presencia de signos de hipertensión portal. Exploración difícil en caso de obesidad, no detecta esteatosis leve (<20 % del peso del hígado) y no distingue la NAFL de la NASH. TC: buena valoración del hígado y de otros órganos (no se recomienda su uso rutinario por la radiación ionizante). RMN: valoración precisa de esteatosis leve (5-10 % de los hepatocitos), pero disponibilidad limitada; 1H-ERM es el único método verificado de medición cuantitativa de contenido de grasa hepática.
3. Valoración no invasiva de la fibrosis: a fin de seleccionar enfermos con fibrosis avanzada o cirrosis (F3-F4). Métodos:
1) escalas basadas en parámetros bioquímicos: NAFLD Fibrosis Score (NFS, http://nafldscore.com), FIB-4 (http://gihep.com/calculators/hepatology/fibrosis-4-score/), Enhanced Liver Fibrosis (ELF), FibroTest
2) elastografía ecográfica (se recomienda la elastografía impulsional [FibroScan]) o por RMN.
4. Examen histológico de biopsia hepática: patrón de oro para el diagnóstico (necesario para distinguir con certeza la NAFL de la NASH), pero comporta un riesgo de complicaciones. Indicaciones:
1) sospecha de NASH, especialmente en caso de que las pruebas no invasivas indiquen fibrosis significativa (≥F2)
2) dudas diagnósticas, p. ej. otras causas de esteatosis, alta concentración de hierro sérico, presencia de autoanticuerpos (AAN, SMA, AMA), abuso de fármacos
3) coexistencia de la NAFLD con otras enfermedades hepáticas crónicas.
Procedimiento diagnóstico
Algoritmo de actuación →fig. 7.11-1.
Evaluación del enfermo con sospecha de NAFLD:
1) determinación del consumo de alcohol (descartar un consumo de ≥30 g/d por un hombre y de ≥20 g/d por una mujer)
2) anamnesis orientada a la toma de fármacos que puedan causar esteatosis
3) antecedentes personales y familiares de diabetes, hipertensión arterial y enfermedades cardiovasculares
4) cálculo del IMC, medición del perímetro abdominal, anamnesis para determinar los posibles cambios de peso
5) medición de la presión arterial
6) pruebas de laboratorio: AST, ALT, GGT, glucemia en ayunas, HbA1c, PTGO (eventualmente insulina en ayunas y prueba HOMA-IR), colesterol total, HDL, triglicéridos, ácido úrico, hemograma
7) estudios serológicos para VHB y VHC
8) ecografía abdominal.
Diagnóstico ampliado, en función de la valoración inicial de la probabilidad o de los resultados de las pruebas:
1) saturación de transferrina y niveles de ferritina
2) pruebas de detección de enfermedad celíaca, enfermedades de la glándula tiroides y síndrome del ovario poliquístico
3) pruebas de detección de enfermedades hepáticas raras: enfermedad de Wilson, enfermedades autoinmunes, déficit de α1-antitripsina.
Criterios diagnósticos
1. NAFLD: esteatosis hepática en la prueba de imagen o en el estudio histológico y exclusión de otras causas de la acumulación de grasa en el hígado (→tabla 7.11-1).
2. NAFL: NAFLD sin balonamiento de los hepatocitos.
3. NASH: NAFLD con esteatosis de ≥5 % de los hepatocitos, inflamación lobular y portal y balonamiento de los hepatocitos.
4. MASLD: esteatosis hepática (en el estudio histológico de una muestra hepática o en la prueba de imagen) y ≥1 de los siguientes criterios:
1) IMC ≥25 kg/m2 o perímetro abdominal ≥94 cm en hombres y ≥80 cm en mujeres (o por encima de la norma según el origen étnico)
2) presión arterial ≥130/85 mm Hg o tratamiento de la hipertensión arterial
3) nivel sérico de triglicéridos ≥1,7 mmol/l (150 mg/dl) o tratamiento de la hipertrigliceridemia
4) concentración de colesterol HDL en suero ≤1,0 mmol/l (<40 mg/dl) en hombres y ≤1,3 mmol/l (<50 mg/dl) en mujeres o tratamiento de la hipercolesterolemia
5) concentración de glucosa en ayunas ≥5,6 mmol/l (100 mg/l) o ≥7,8 mmol/l (140 mg/dl) a las 2 h de la sobrecarga con glucosa, o HbA1c ≥5,7 % (39 mmol/mol), o diabetes tipo 2 con o sin tratamiento.
Diagnóstico diferencial
Como en la hepatitis B crónica →Hepatitis B crónica.
TRATAMIENTOArriba
1. Modificación del estilo de vida: es esencial y abarca la reducción del aporte calórico, así como el aumento de la actividad física con el fin de reducir el peso corporal →tabla 7.11-2. En enfermos con NASH una reducción del peso corporal de ≥5 % puede reducir la esteatosis hepática, de ≥7 %: causar remisión de la esteatohepatitis, mientras que de ≥10 %: regresión o estabilización de la fibrosis. En personas con el IMC ≥25 kg/m2, el objetivo es reducir el peso corporal en ≥10 % (con pérdida de ~0,5-1 kg/semana), y en personas con normopeso: una reducción en un 3-5 % del peso corporal inicial. Con el fin de obtener una reducción significativa del peso corporal, es necesario reducir el aporte calórico en la dieta en 500-1000 kcal/d en comparación con el peso inicial, o hasta 1200 kcal/d en mujeres y 1400-1500 kcal/d en hombres. Se recomienda seguir una dieta mediterránea u otra similar, reducir la ingesta de ácidos grasos saturados (sobre todo de carne roja y carne procesada), y de productos edulcorados con fructosa, así como evitar el consumo de alcohol (en caso de observar una fibrosis ≥F2 está indicada la abstinencia total). El café puede resultar beneficioso para el curso de la NAFLD (con o sin cafeína; ≥ 3 tazas diarias).
El ejercicio físico refuerza el efecto de la dieta pobre en calorías. La actividad física, independientemente de la reducción de peso, puede disminuir el contenido de grasa hepática. Se recomiendan 150-300 min/semana de actividad física de intensidad moderada (3-6 MET) o de 75-150 min/semana de intensidad alta (>6 MET), idealmente en forma de ejercicios aeróbicos (caminatas, ciclismo). La disminución de la cantidad de grasa en el hígado es proporcional al aumento de la actividad física, por lo que se debe animar a los enfermos a que hagan la mayor cantidad de ejercicio posible (según sus posibilidades; pude ser beneficioso elaborar un plan de entrenamiento profesional e individual). Los cuidados multidisciplinares con la participación de médicos de especialidades pertinentes (según las comorbilidades), un dietista y un psicólogo aumentan la probabilidad de introducir cambios permanentes en el estilo de vida.
En enfermos con NASH y obesidad mórbida en los que no se ha conseguido la reducción de peso, los efectos beneficiosos (incluida la mejoría de cambios histopatológicos en el hígado) pueden obtenerse con la cirugía bariátrica.
En enfermos con cirrosis hepática en el curso de NAFLD, con frecuencia se presenta la obesidad sarcopénica, por lo que requieren un asesoramiento profesional dietético y relacionado con ejercicios físicos.
2. Farmacoterapia: en enfermos con NASH confirmada histológicamente puede utilizarse la vitamina E 800 UI/d durante ≤1 año (contraindicada en casos de diabetes y cirrosis hepática; interrumpir si no se reduce la actividad de ALT y AST después de 6 meses de tratamiento). Se recomienda utilizar pioglitazona a dosis de 30 mg/d o antagonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) en enfermos con diabetes y NASH (confirmada mediante el estudio histológico de una muestra de hígado).
Para el tratamiento de la NAFLD o la NASH no se recomiendan, entre otros: metformina, ácidos grasos n-3, estatinas (a no ser que estén indicadas por alteraciones metabólicas concomitantes), ácido ursodesoxicólico ni hepatoprotectores, porque no se ha confirmado la eficacia de tales tratamientos.
La terapia de la hiperlipidemia con estatinas es segura y beneficiosa (también a nivel hepático; únicamente está contraindicada en cirrosis hepática descompensada), al igual que los ácidos grasos n-3 (éster etílico de ácido icosapentaenoico) o fibratos en la hipertrigliceridemia asociada a NAFLD.
3. Tratamiento sintomático de las complicaciones de cirrosis hepática →Cirrosis hepática.
4. Trasplante hepático: en caso de cirrosis terminal o hepatocarcinoma.
VIGILANCIAArriba
En todos los enfermos con NAFLD diagnosticada, se debe determinar la estadificación de la cirrosis hepática →fig. 7.11-1. Controlar la actividad de ALT y AST cada 2-3 meses. No existen recomendaciones inequívocas en cuanto a la realización de ecografías de forma regular o a la determinación de α-fetoproteína en NAFLD, mientras que en NASH se recomienda realizar una ecografía cada 6 meses. Vigilancia de los enfermos con cirrosis hepática →Cirrosis hepática.
TABLAS Y FIGURAS
Causas de esteatosis hepática
|
Alcohol
|
|
Sustancias hepatotóxicas
– fármacos: antibióticos (tetraciclina, bleomicina, puromicina), citostáticos (metotrexato, L‑asparaginasa, 5-fluorouracilo, irinotecán), vitaminas (vitamina A a dosis altas), y otros (amiodarona, estrógenos, glucocorticoides, salicilatos, valproato sódico, warfarina, tamoxífeno)
– sustancias químicas: clorohidrocarburos, tetracloruro de carbono, disulfuro de carbono, fósforo, sales de bario, hidrazina
– toxinas de hongos (α‑amanitina)
|
|
Trastornos metabólicos y factores nutricionales
– sobrealimentación y obesidad, ayuno prolongado, desnutrición proteica (kwashiorkor)
– diabetes mellitus
– síndrome de Cushing
– déficit de zinc
– nutrición parenteral total a largo plazo (déficit de colina y carnitina)
– hiperlipidemias
|
|
Trastornos de digestión y absorción
– enfermedades del páncreas
– resección del intestino
– anastomosis intestinal (p. ej. anastomosis yeyunoileal)
– síndrome de absorción deficiente
– enfermedad celíaca
– enfermedad inflamatoria intestinal (colitis ulcerosa, enfermedad de Crohn)
|
|
Alteraciones congénitas del metabolismo
– abetalipoproteinemia
– enfermedades de almacenamiento: ésteres de colesterol (enfermedad de Wolman), esfingomielina (enfermedad de Niemann‑Pick), gangliósidos (enfermedad de Tay‑Sachs), glucocerebrósidos (enfermedad de Gaucher), cobre (enfermedad de Wilson), hierro (hemocromatosis hereditaria), glucógeno (glucogenosis), galactosa, fructosa, tirosina, homocisteína, ácido fitánico (síndrome de Refsum)
– trastornos congénitos del ciclo de la urea
|
|
Enfermedades infecciosas
– hepatitis C (sobre todo en caso de infección por el genotipo 3 del VHC)
– hepatitis D fulminante
– endotoxemia
|
|
Otras
– síndrome de Reye
– síndrome del ovario poliquístico
– complicaciones del embarazo: esteatosis hepática aguda de embarazo, eclampsia, síndrome HELLP (hemólisis, aumento de la actividad de enzimas hepáticas y trombocitopenia)
|
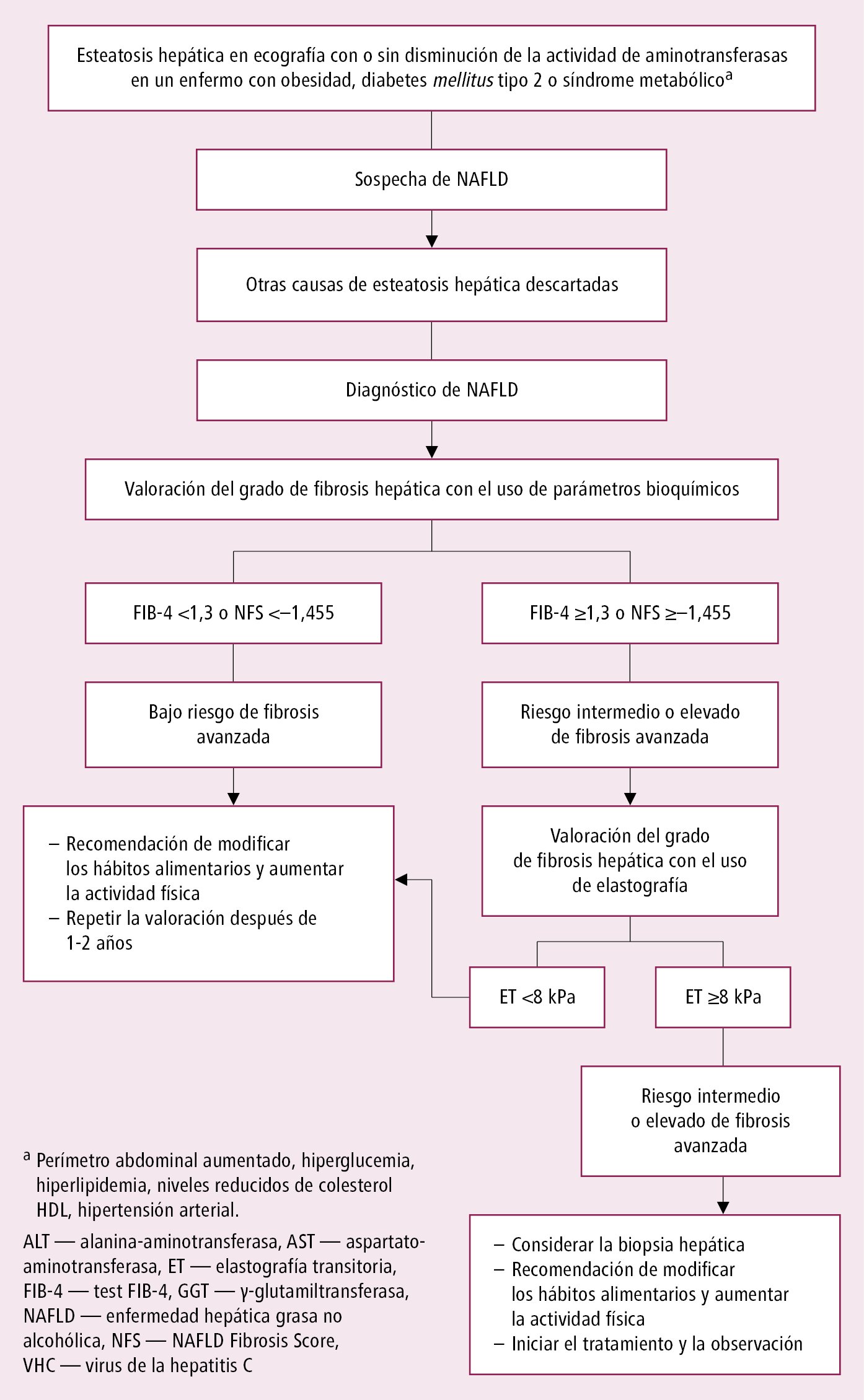
Fig. 7.11-1. Estrategia de diagnosticar y tratar la NAFLD
Cambio de estilo de vida en el tratamiento de la enfermedad hepática grasa no alcohólica (NAFLD)
|
Reducción del aporte calórico
|
– Reducir el aporte calórico en 500-1000 kcal a fin de reducir el peso corporal en 0,5-1 kg/semana
– Objetivo: reducción del peso corporal en ≥10 %
– Aplicar a largo plazo, junto con un aumento de actividad física y terapia cognitivo-conductual
|
|
Composición de la dieta
|
– Baja o moderada ingesta de grasas y moderada o alta ingesta de carbohidratos
– Dietas ricas en proteínas o cetogénicas bajas en carbohidratos
|
|
Consumo de fructosa
|
Evitar bebidas y comidas ricas en fructosa
|
|
Consumo de alcohol
|
Categóricamente mantener el consumo de alcohol debajo del nivel de riesgo (es decir, 2 uds. de alcohol diarios en hombres y 1 ud. en mujeres)
|
|
Consumo de café
|
No hay limitaciones relacionadas con el hígado
|
|
Entrenamiento y actividad física
|
– 150-300 min/semana de ejercicios aeróbicos de intensidad moderada en 3-5 sesiones (p. ej. caminar rápido, bicicleta fija)
– el entrenamiento de resistencia también es eficaz, mejora el funcionamiento del sistema locomotor, ejerce influencia positiva en los factores de riesgo metabólicos
– un alto nivel de cansancio, por culpa del cual se limita la actividad y se produce somnolencia durante el día, dificulta la realización de los ejercicios recomendados
|
 Español
Español
 English
English
 українська
українська





