Definición y etiopatogeniaArriba
1. Agente etiológico. Protozoos del género Plasmodium: P. falciparum, P. vivax, P. ovale, P. malariae y P. knowlesi. La mayor parte de los casos mundiales se deben a P. falciparum y vivax. Pueden existir coinfecciones. Se han observado ocasionalmente infecciones en humanos por especies que habitualmente infectan primates no humanos como P. cynomolgi en Malasia, Camboya y Tailandia, P. brasilianum en Venezuela y P. simium en Brasil. Estas, junto a la causada por P. knowlesi, constituyen antropozoonosis.
En el ciclo de vida de Plasmodium sp. participan 2 hospedadores. Al picar al ser humano, los mosquitos infectados inoculan esporozoítos alojados en sus glándulas salivales. En el humano se produce la reproducción asexuada (ciclo esquizogónico): los esporozoítos migran al hígado donde maduran a esquizontes y —exclusivamente en el caso de P. vivax y ovale— pueden generarse también formas latentes llamadas hipnozoítos. Una vez transcurridas 1-2 semanas (P. malariae hasta 4 semanas) de los esquizontes maduros se liberan múltiples merozoítos (~10 000), los cuales infectan a los eritrocitos y se inicia la esquizogonia eritrocítica. Los trofozoítos formados de los merozoítos, que inicialmente se presentan en estadio de anillos (→fig. 19.4-1) se transforman en esquizontes eritrocitarios que provocan la lisis de eritrocitos y la posterior liberación de merozoítos. Tal ciclo se repite cada ~48 h (P. falciparum, P. ovale y P. vivax) hasta ~72 h (P. malariae) y en el caso de P. knowlesi cada ~24 h. Algunos merozoítos se convierten en formas sexuales, es decir, gametocitos (→fig. 19.4-2), que pasan al mosquito durante la succión de la sangre de una persona infectada e inician la fase sexual (ciclo esporogónico) de su ciclo vital.
2. Patogenia: la liberación de merozoítos desde los eritrocitos desencadena episodios de fiebre y otros síntomas y signos de la enfermedad. La gravedad de la malaria depende de la especie implicada, la carga parasitaria y el estado inmunitario del paciente. En caso de P. falciparum el porcentaje de los eritrocitos invadidos puede alcanzar niveles más elevados que con otras especies, lo que condiciona mayor gravedad del cuadro clínico. Los parásitos inducen la producción de citoquinas proinflamatorias por las células inmunitarias del huésped (la denominada tormenta de citoquinas) y, en el caso de P. falciparum, desencadenan eventos de adhesión endotelial de los eritrocitos que generan disminución del flujo de sangre con la consecuente hipoxia de órganos y coagulopatía. Esta reacción puede originar un daño grave y rápidamente progresivo del SNC, fracaso multiorgánico e incluso la muerte. En los últimos años se reportan, con cada vez mayor frecuencia, cuadros de malaria grave en infecciones por P. vivax. En caso de invasiones por P. ovale y P. vivax la aparición de la enfermedad o la recurrencia puede producirse después de varios meses (e incluso años) a través de la liberación de los hipnozoítos presentes en el hígado.
3. Reservorio y vías de transmisión: el reservorio de los plasmodios son los seres humanos (para P. falciparum, vivax, ovale y malariae) o los macacos (P. knowlesi). La enfermedad se transmite por la picadura de mosquitos Anopheles. Otras vías de transmisión potencial son la transfusional, vertical y accidentes con riesgo biológico.
4. Factores de riesgo de infección grave: estancia en una región endémica de Plasmodium spp., actividades que favorecen la exposición a picaduras de vectores. El mayor riesgo de malaria de curso grave se presenta en niños menores a 5 años y embarazadas que habitan zonas endémicas para P. falciparum, así como en las personas no inmunes que visitan tales áreas.
5. Período de incubación y transmisibilidad: habitualmente la aparición de síntomas varía de 7 a 30 días desde el momento de la infección, en el caso de P. malariae puede ser mayor. En el caso de P. vivax y ovale puede haber recaídas meses o incluso años después de la infección inicial. Los antimaláricos tomados adecuadamente por viajeros a modo de profilaxis generalmente previenen la ocurrencia de malaria, sin embargo, en malaria por P. vivax y P. ovale puede presentarse recaída por hipnozoítos, independientemente de haber realizado la profilaxis. Si la profilaxis no se realiza adecuadamente, los síntomas pueden retrasarse y generar confusión al momento del diagnóstico.
EpidemiologíaArriba
La malaria es endémica en 85 países del mundo, presentándose en zonas de clima tropical y subtropical (→fig. 19.4-3). Según datos de la OPS/OMS, cerca del 95 % de los casos y de las muertes por malaria se producen en el continente africano. En 2020 se estimaron 241 millones de casos mundiales y 627 000 muertes, lo que constituye un aumento de 14 millones de casos y del 12 % de las muertes con respecto al 2019.
En la región de las Américas, Venezuela (con un incremento en más de 1000 % de los casos entre el 2000 y el 2019), Brasil y Colombia llevan actualmente más del 77 % de la carga de enfermedad. Argentina, El Salvador y Paraguay se han certificado como países libres de malaria en 2019, 2021 y 2018 respectivamente.
Durante 2019, en los países de la UE/Espacio Económico Europeo, se confirmaron 8638 casos de malaria, la mayoría importados en viajeros.
Cuadro clínico e historia naturalArriba
Los síntomas no son específicos, siendo el principal la fiebre que menudo es la única manifestación en el inicio de la enfermedad. En su descripción clásica la fiebre es alta (puede superar los 40 °C), se acompaña de escalofríos y el enfermo está ansioso y/o agitado. Después de varias horas la fiebre cede, el paciente suda profusamente y se duerme. Los episodios de fiebre se repiten cada ~48 h (P. ovale y P. vivax) hasta ~72 h (P. malariae), y en el caso de invasión por P. knowlesi cada 24 h. Sin embargo, esta periodicidad no siempre se ve, y en las infecciones por todos los géneros del Plasmodium la fiebre puede ser diaria o tener patrón irregular.
La fiebre puede ir acompañada de: debilidad, diarrea, cefalea, mialgias, artralgias tos, ictericia, náuseas y vómitos. Se puede hallar palidez cutáneo-mucosa y hepatoesplenomegalia. Manifestaciones y criterios diagnósticos de la malaria grave (con mayor frecuencia en el curso de infección por P. falciparum) →tabla 19.4-1. En las infecciones por P. falciparum, la progresión hasta un estado grave con disfunción multiorgánica y una respuesta inflamatoria sistémica intensa con características de tormenta de citoquinas puede ocurrir de manera repentina e impredecible.
En adultos que habitan durante muchos años en regiones de alta endemicidad se observa a menudo un desarrollo asintomático u oligosintomático de la infección.
DiagnósticoArriba
La enfermedad debe sospecharse en personas que viven o han visitado zonas endémicas de malaria y presentan fiebre o antecedentes de fiebre sin otra causa aparente. Es necesario realizar siempre un diagnóstico parasitológico el cual debe estar disponible rápidamente (idealmente en menos de 2 h desde la admisión).
Exploraciones complementarias
1. Identificación del agente etiológico:
1) Estudio parasitológico en frotis de sangre periférica (extendido y gota gruesa) teñidos por el método de Giemsa. Permiten la identificación de especie y cuantificar la parasitemia. Es el método básico del diagnóstico de malaria recomendado por la OMS y los CDC. En casi todos los casos de malaria sintomática las láminas de gota gruesa y de extendido fino realizados por servicios de microscopía competentes confirma la infección por plasmodios.
2) Las pruebas rápidas inmunocromatográficas que detectan el antígeno del parásito permiten diferenciar una invasión por P. falciparum de otras especies. La OMS recomienda el uso de un test de antígenos rápido cuando no están fácilmente disponibles las pruebas microscópicas de calidad asegurada.
3) Los métodos moleculares que se caracterizan por su gran sensibilidad (PCR) se realizan en pocos laboratorios y no permiten evaluar el nivel de parasitemia. La OMS no recomienda utilizar los métodos moleculares en la práctica clínica (especialmente en entornos con recursos limitados). Los CDC recomiendan las pruebas PCR para confirmar las especies del parásito que causan malaria y para detectar infecciones mixtas en viajeros con malaria importada de zonas endémicas.
4) Amplificación isotérmica de ADN mediada por bucle (LAMP), introducida en algunas regiones del mundo para la detección de infecciones de bajo nivel de parásitos que causan malaria en condiciones de campo, a modo de herramienta en los programas de control y eliminación de malaria.
5) Estudios serológicos que detectan anticuerpos específicos (no son de utilidad para decidir tratamiento en pacientes individuales, se utilizan para estudios epidemiológicos).
2. Otras: pueden observarse anemia, trombocitopenia, aumento de ALT y AST, hiperbilirrubinemia. Datos de laboratorio de infección grave por P. falciparum →tabla 19.4-1.
Diagnóstico diferencial
Arbovirosis (como dengue, zika, chikungunya, fiebre amarilla, entre otras) gripe, meningitis, neumonía, endocarditis infecciosa, sepsis, fiebre tifoidea y fiebres paratifoideas, leptospirosis, rickettsiosis, tripanosomiasis africana, babesiosis.
TratamientoArriba
El tratamiento de malaria no puede retrasarse, la OMS recomienda realizarlo en lo posible dentro de las 24-48 h desde el inicio de síntomas. La malaria grave constituye una emergencia médica y debe tratarse como tal. En los casos de alta sospecha en los que las pruebas parasitológicas no estén disponibles debe iniciarse tratamiento empírico precoz.
Tratamiento causal
1. Infección por P. falciparum de curso no complicado, en las regiones endémicas y en viajeros adultos: la OMS recomienda un tratamiento combinado de 3 días, basado en los derivados de artemisina (TCA).
2. Malaria grave, independientemente de la especie del plasmodio (más frecuentemente infección por P. falciparum): el fármaco de elección es artesunato iv. o IM. Si el artesunato no está disponible, se puede utilizar el arteméter o quinina. Los enfermos que recibieron una terapia parenteral durante ≥24 h pueden continuar el tratamiento con fármacos orales (TCA), siempre y cuando sean capaces de recibir medicamentos en esta forma.
3. Malaria no complicada causada por plasmodios distintos a P. falciparum: administrar cloroquina y, en caso de resistencia, TCA. En infecciones por P. vivax y P. ovale debe asociarse tratamiento de erradicación de hipnozoítos con primaquina. Antes de administrar estos fármacos excluir deficiencia de G6PD, en función de la disponibilidad de la determinación.
4. Malaria importada a un país libre de transmisión de la enfermedad: la prioridad es una instauración precoz del tratamiento antimalárico con los fármacos disponibles en el área. En viajeros adultos con malaria no complicada (P. falciparum) la OMS recomienda los fármacos del grupo de TCA, es admisible la administración de atovacuona con proguanil.
5. Caso de malaria en un viajero a una región endémica. Considerar el autotratamiento con fármacos antimaláricos (stand-by emergency treatment, SBET) en las siguientes situaciones:
1) falta de acceso a la asistencia médica durante 24 h
2) personas que planean unas estancias frecuentes y breves en las regiones con riesgo de malaria (p. ej. viajes profesionales del personal de las líneas aéreas)
3) viajes a regiones de riesgo muy bajo de infección por cepas multirresistentes de P. falciparum (p. ej. a algunas regiones del Sudeste Asiático y a la Amazonia), donde el riesgo de efectos adversos de la quimioprofilaxis supera el riesgo de contraer malaria.
Para el SBET recomendar los fármacos del grupo de TCA de acuerdo con las recomendaciones locales. Los viajeros que planifican usar este método tienen que ser educados minuciosamente sobre los síntomas, signos e historia natural de malaria, así como sobre los principios de tratamiento, y se les debe recomendar una consulta médica lo más urgentemente posible, una vez iniciado el autotratamiento.
6. Dosificación de los fármacos antimaláricos →tabla 19.4-2. Debido a la escasa disponibilidad de los fármacos, el tratamiento se realiza habitualmente en centros especializados en medicina tropical y en algunos servicios de enfermedades infecciosas.
Tratamiento sintomático
En malaria de curso grave suele ser necesario un manejo de soporte multidireccional que abarque, p. ej., transfusiones de hemoderivados, hemodiálisis en caso de insuficiencia renal aguda, soporte respiratorio, corrección de los trastornos hidroelectrolíticos e hipoglucemia, fármacos antiepilépticos y antipiréticos, antibioticoterapia si coexiste una infección bacteriana.
PERSPECTIVA LATINOAMERICANA
En América Latina, en contexto de la Alianza RBM (Roll Back Malaria) para Poner Fin a la Malaria de las Naciones Unidas, se desarrollan planes estratégicos de detección, tratamiento y control tanto en países endémicos como en aquellos libres de malaria. Aún con aplicación heterogénea entre países y regiones, esta iniciativa permite que exista disponibilidad de diagnóstico y tratamiento en los sistemas públicos de salud.
Situaciones especialesArriba
Embarazo
La infección por P. falciparum durante el embarazo se asocia a un riesgo elevado de curso grave de malaria y de la muerte de la madre, de aborto espontáneo o parto prematuro, de la muerte fetal intrauterina, de bajo peso al nacer y de la muerte del neonato en el período perinatal. El fármaco de elección en el tratamiento causal de malaria grave en embarazadas es el artesunato iv. o IM. En el tratamiento de malaria no complicada en el 1.er trimestre la OMS recomienda arteméter con lumefantrina como fármaco de elección. Si el fármaco de elección no está disponible, se admiten otras combinaciones de fármacos del grupo del TCA (con excepción de la sulfadoxina con pirimetamina y de la pironaridina). La OMS recomienda quinina con clindamicina VO (dosificación →tabla 19.4-2) solo si el TCA no está disponible. En el 2.o y 3.er trimestre se recomienda TCA.
En las regiones de alta transmisión de P. falciparum la OMS recomienda que las embarazadas se sometan al denominado tratamiento preventivo intermitente (intermittent preventive treatment in pregnancy, IPTp) que consiste en la administración intermitente de sulfadoxina pirimetamina desde el 2.o trimestre del embarazo.
Debido al riesgo asociado a la malaria durante el embarazo, se debe desaconsejar firmemente los viajes de embarazadas no inmunes que viven en las regiones libres de malaria a las zonas endémicas de P. falciparum. Quimioprofilaxis de malaria en embarazadas →más adelante.
PronósticoArriba
En invasiones de curso grave la letalidad en enfermos tratados adecuadamente llega al 20 %. Las secuelas orgánicas permanentes de la malaria con mayor frecuencia son las neuropsiquiátricas (alteraciones de la memoria, trastornos del estado de ánimo, psicosis, entre otras) y aparecen en <5 % de los adultos invadidos por P. falciparum. Ocasionalmente también pueden ocurrir complicaciones de la invasión por los demás géneros de plasmodios que amenacen la vida, p. ej. rotura del bazo en el curso de la invasión por P. vivax. La malaria es la principal causa de muerte en el contexto del síndrome febril del viajero.
PrevenciónArriba
Métodos específicos
1. Vacuna preventiva: la OMS recomienda la vacuna RTS,S/AS01 para la prevención de malaria provocada por P. falciparum en niños desde 5 meses de vida que viven en África Subsahariana y otras regiones de transmisión moderada o alta de este género del plasmodio.
2. Prevención en viajeros a áreas endémicas: aplicar la estrategia ABCDE de la prevención según las recomendaciones de la OMS →tabla 19.4-3.
Reglas generales de quimioprofilaxis de malaria en viajeros. La necesidad de quimioprofilaxis, así como la elección del fármaco a utilizar, depende de múltiples aspectos: incidencia de casos en la zona visitada, especies de plasmodios circulantes, resistencias a antimaláricos, tiempo de estancia, época del año, temperatura, altitud, actividades que realizará el viajero, estado de salud, tolerancia a fármacos antimaláricos empleados previamente, accesibilidad a servicios de salud y nivel de alerta del viajero.
El objetivo principal es la disminución del riesgo de malaria causada por P. falciparum y una minimización del riesgo de curso grave y de muerte. La eficacia de una profilaxis farmacológica bien ajustada y empleada adecuadamente es alta, pero no protege al 100 % de la infección. Es importante recordar que la mayoría de los fármacos utilizados como quimioprofilaxis no protege de las recaídas causadas por hipnozoítos de P. vivax y P. ovale. Únicamente la primaquina y la tafenoquina actúan contra estas formas de desarrollo. La tafenoquina está registrada para la profilaxis antimalárica en EE. UU. y recomendada por los CDC (pero no por la OMS).
El esquema de quimioprofilaxis debe aplicarse según el fármaco a utilizar. Se inicia 1 a 7 días antes de la llegada a la zona endémica de malaria, depende el fármaco, debe continuarse durante toda la estancia y hasta 1 a 4 semanas posteriores a la salida de la zona endémica (→tabla 19.4-4). En situaciones especiales, en viajeros a regiones endémicas se recomienda portar autotratamiento de emergencia con fármacos antimaláricos (SBET) en vez de quimioprofilaxis.
Quimioprofilaxis en viajes prolongados: el riesgo de malaria aumenta con el tiempo de estancia en la zona endémica. La mayor parte de los efectos adversos de los fármacos utilizados en la quimioprofilaxis se manifiestan en las primeras semanas del uso. El empleo de quimioprofilaxis prolongada en lugares de riesgo elevado de infección por P. falciparum depende de la evaluación individualizada de los beneficios y riesgos. Merece la pena recomendarla por lo menos en el período inicial de estancia en el trópico. En este tiempo el viajero ganará experiencia en la prevención de picaduras y se informará sobre el acceso a la asistencia médica local. No se ha establecido la duración de uso de cada fármaco utilizado en la profilaxis antimalárica. La OMS admite administrar atovacuona con proguanil, doxiciclina e incluso la mefloquina, durante varios meses, siempre que el viajero tenga buena tolerancia al fármaco. Después de 5 años de usar cloroquina a dosis profiláctica aumenta el riesgo de retinopatía (es necesaria una evaluación oftalmológica sistemática). La farmacorresistencia universal ha reducido el empleo de cloroquina como profilaxis en viajeros.
En algunas situaciones —en determinadas estaciones del año o en regiones seleccionadas durante el viaje— se puede considerar SBET (→más arriba). Esto debe ir precedido de un detallado análisis de variabilidad estacional e intensidad de transmisión de malaria en los países de destino.
Profilaxis antimalárica en viajeras embarazadas: considerando el riesgo para la madre y para el feto relacionado con la ocurrencia de malaria durante el embarazo, se desaconsejan firmemente los viajes de embarazadas a las zonas endémicas de malaria. Si tal viaje es imprescindible hay que cumplir rigurosamente las reglas de prevención de la malaria y consultarse con un especialista en medicina del viajero. Las posibilidades de quimioprofilaxis en este grupo de viajeros están, sin embargo, limitadas. La doxiciclina está contraindicada en el embarazo (categoría D). La atovacuona con proguanil no es recomendable por falta de datos sobre su seguridad para el feto. La cloroquina puede utilizarse durante la gestación, pero su utilidad se encuentra limitada a áreas con transmisión exclusiva de P. vivax o bien P. falciparum sensibles a cloroquina. La mefloquina es una opción para quimioprofilaxis en embarazo, pero su alta proporción de efectos adversos dificulta su efectividad. En todos los casos es aconsejable la consulta con un experto.
Métodos no específicos
1. En regiones endémicas: eliminación de los lugares de cría de los mosquitos y promoción de medidas de protección colectiva contra las picaduras (p. ej. fumigación de las viviendas con insecticidas).
2. En viajeros: →tabla 19.4-3.
Notificación obligatoria
En cada caso de sospecha.
TABLAS Y FIGURAS
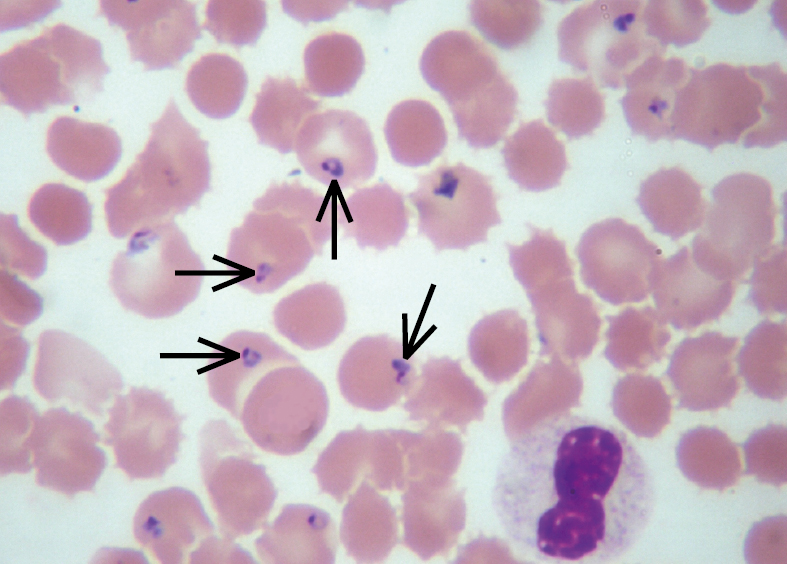
Fig. 19.4-1. Frotis de sangre capilar de un enfermo con malaria, realizado con tinción de Giemsa. Se observa una invasión masiva de los eritrocitos por Plasmodium falciparum. Protozoos en estadio de anillo (flechas) (foto: Dra. Danuta Cielecka)
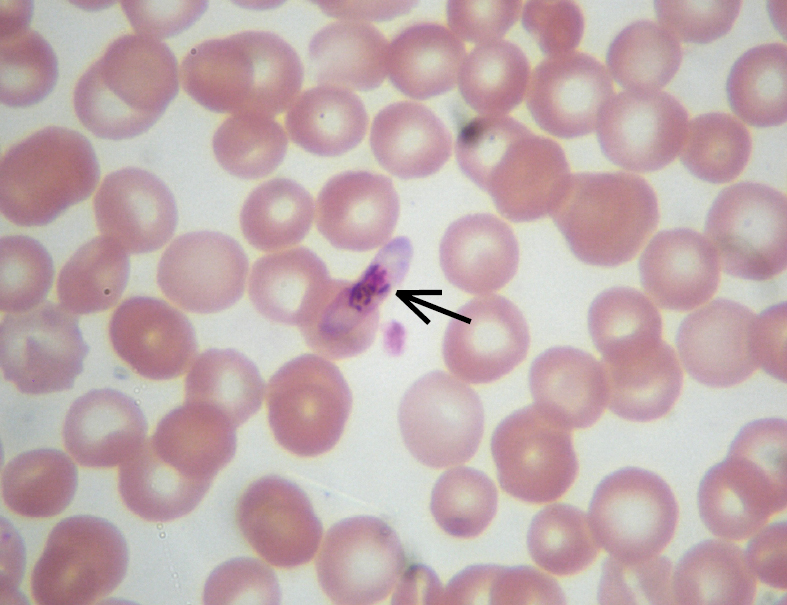
Fig. 19.4-2. Frotis de sangre capilar de un enfermo con malaria, realizado con tinción de Giemsa. Se observa un gametocito de Plasmodium falciparum (flecha) (foto: Dra. Danuta Cielecka)
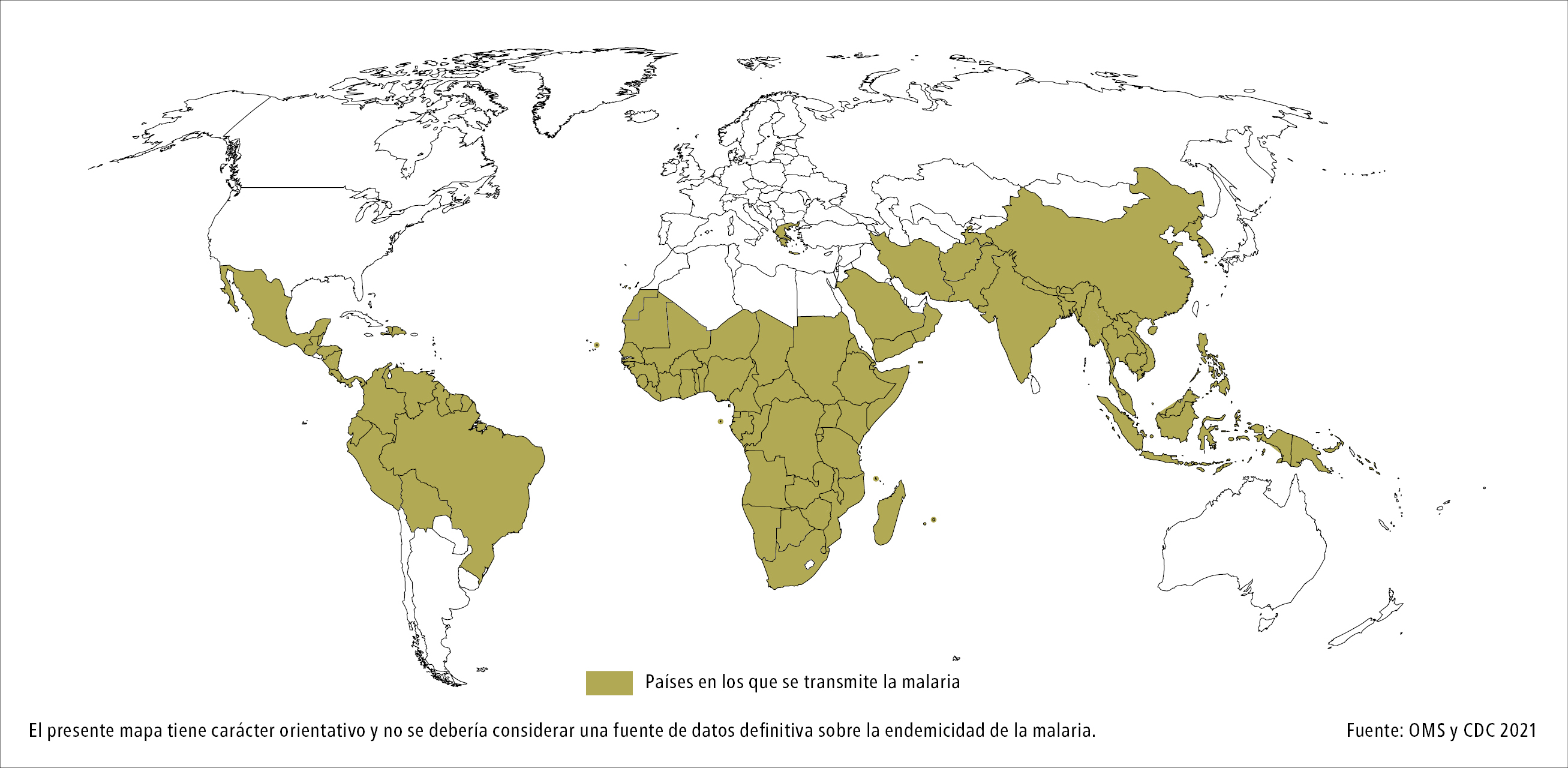
Fig. 19.4-3. Distribución geográfica de los plasmodios de la malaria
Criterios de laboratorio y clínicos de la malaria grave por P. falciparuma según la OMS (2023)
|
Síntomas, signos o síndromes
|
Definición
|
|
Alteraciones de la conciencia
|
En adultos: <11 ptos. en la escala de coma de Glasgow
En niños: <3 en la escala de coma de Blantyre
|
|
Postración
|
Debilidad generalizada (el enfermo no consigue permanecer sentado, de pie ni caminar sin ayuda)
|
|
Convulsiones
|
>2 episodios en 24 h
|
|
Acidosis
|
Déficit de bases >8 mEq/l o concentración sérica de HCO3– <15 mmol/l o ácido láctico venoso > o igual a 5 mmol/l. Se manifiesta como distrés respiratorio (taquipnea, respiración dificultosa).
|
|
Hipoglucemia
|
Concentración sérica de glucosa <40 mg/dl (2,2 mmol/l)
|
|
Anemia intensa
|
Hematocrito <20 % o una concentración de hemoglobina <7 g/dl y hematocrito <20 % en adultos (≤5 g/dl y 15 % respectivamente en niños menores de 12 años) con parasitemia >10 000/μl
|
|
Daño renal
|
Concentración sérica de creatinina >3 mg/dl (265 μmol/l) o urea plasmática >20 mmol/l
|
|
Ictericia
|
Concentración sérica de bilirrubina >3 mg/dl (>50 μmol/l), con parasitemia >100 000/μl
|
|
Edema pulmonar
|
Edema pulmonar confirmado por pruebas radiológicas o saturación de oxígeno <92 % con frecuencia respiratoria >30/min, generalmente con tiraje y rales crepitantes en la auscultación
|
|
Sangrado significativo
|
Sangrado recurrente o prolongado de encías, nariz o zonas de venopunción; hematemesis o melena
|
|
Shock
|
Compensado: tiempo de llenado capilar ≥3 s o gradiente de temperatura en la pierna (extremidad media a proximal), pero sin hipotensión
Descompensado: presión arterial sistólica <80 mm Hg (<70 mm Hg en niños) con evidencias de mala perfusión (enfriamiento distal o llenado capilar prolongado)
|
|
Hiperparasitemia
|
Parasitemia por P. falciparum >10 %
|
|
a Malaria grave por P. vivax: iguales criterios, pero sin parámetro de parasitemia.
Malaria grave por P. knowlesi: criterios como más arriba, a diferencia de:
– hiperparasitemia: parasitemia >100 000/µl
– ictericia con densidad parasitaria >20 000/µl.
A partir de las guías de la OMS (2023)
|
Tratamiento de malaria en adultos según la OMS (2023)
|
Indicación
|
Fármaco
|
Dosificación
|
|
Malaria complicada, grave (con mayor frecuencia por P. falciparum). El tratamiento por vía parenteral debe continuarse durante ≥24 h y hasta que se puedan administrar los fármacos VO, entonces rotar a TCA VO y cumplir tratamiento de 3 días
|
Artesunato (fármaco de elección)
|
iv. o IM 2,4 mg/kg 3 dosis diarias: 0, 12, 24 h, luego 1 × d
|
|
Arteméter
|
IM 3,2 mg/kg dosis inicial, luego 1,6 mg/kg 1 × d
|
|
Dihidroclorhidrato de quinina (sal)a
|
iv. 20 mg/kg diluida en 500 ml de solución lenta de glucosa al 5 % o NaCl al 0,9 % en infusión durante 4 h; repetir 10 mg/kg cada 8 h
|
|
Malaria no complicada causada por P. falciparum (tratamiento combinado con artemisinina, TCA)
|
Arteméter + lumefantrina
|
En personas de ≥35 kg: VO 80 mg + 480 mg 2 × d durante 3 días, las primeras 2 dosis deben administrarse a un intervalo de 8 h
|
|
Artesunato + amodiaquina
|
En personas de ≥36 kg: VO 200 mg + 540 mg 1 × d durante 3 días
|
|
Artesunato + mefloquina
|
En personas de ≥30 kg: VO 200 mg + 440 mg 1 × d durante 3 días
|
|
Dihidroartemisinina + piperazina
|
En personas de ≥36 kg y <60 kg: VO 120 mg + 960 mg 1 × d durante 3 días; en personas de ≥60 kg y <80 kg: VO 160 mg + 1280 mg 1 × d durante 3 días; en personas de ≥80 kg: VO 200 mg + 1600 mg 1 × d durante 3 días
|
|
Artesunato + sulfadoxina con pirimetamina (SP)
|
En personas de ≥50 kg VO 200 mg de artesunato 1 × d durante 3 días + 1500 mg/75 mg SP en dosis única el 1.er día del tratamiento
|
|
Artesunato + pironaridina
|
En personas de ≥45 kg y <65 kg: VO 180 mg + 540 mg 1 × d durante 3 días; en personas de ≥65 kg: VO 240 mg + 720 mg 1 × d durante 3 días
|
|
Reducción de la transmisión de malaria por P. falciparum en regiones endémicas en las cuales hay una intensidad de trasmisión baja. Dosis gametocida
|
Primaquinab
|
0,25 mg/kg VO en dosis única. Se administra junto con el tratamiento básico
La determinación de G6PD no es requerida
|
|
Malaria no complicada causada por P. vivax, P. ovale, P. malariae, P. knowlesi
|
TCA
|
→más arriba
|
|
Cloroquina
|
VO 10 mg base/kg 1 × d durante 2 días, 5 mg/kg el 3.er día del tratamiento
|
|
Malaria no complicada en el 1.er trimestre del embarazo
|
Arteméter + lumefantrina
|
→más arriba
|
|
|
TCA (con excepción de fármacos que contienen SP o piranoridina)
|
→más arriba
|
|
|
Quinina (sal) + clindamicina
|
VO 650 mg 3 × d + 100 mg/kg 2 × d durante 7 días
|
|
Prevención de las recaídas por P. vivax y P. ovale después del tratamiento de una invasión aguda
|
Primaquinab
|
VO 0,25-0,5 mg/kg 1 × d durante 14 días
Debe determinarse G6PD
|
|
a En Latinoamérica cuando no hay disponibilidad de los otros 3 fármacos (es decir, artesunato, arteméter o diclorhidrato de quinina), la OPS recomienda gluconato de quinidina 10 mg de sal/kg en infusión iv. durante 1-2 h, seguido de 0,02 mg sal/kg/min en infusión continua durante ≥24 h con clindamicina o doxiciclina.
b No administrar en embarazadas, niños <6 meses ni en mujeres que amamantan a bebés <6 meses.
|
Principios generales de prevención de la malaria y sus consecuencias en viajeros según la OMS
|
|
Reglas de prevención
|
Información detallada
|
|
A
|
Conciencia del viajero (Awareness)
|
Informar al paciente sobre la exposición al riesgo de malaria en la zona de destino y sobre las manifestaciones de la enfermedad
|
|
B
|
Prevención de picaduras de mosquitos (Bites of mosquitoes)
|
Recomendar las medidas de protección contra las picaduras de mosquitos →Métodos inespecíficos de protección contra los vectores
|
|
C
|
Quimioprofilaxis (Chemoprophylaxis)
|
Las recomendaciones detalladas se proporcionan en el capítulo
|
|
D
|
Diagnóstico y tratamiento oportunos (Diagnosis)
|
Informar al paciente sobre la necesidad de diagnóstico y tratamiento urgente en caso de presentarse fiebre durante el viaje, a ≥7 días desde la llegada a una zona endémica de malaria o después de volver del viaje, especialmente en los primeros 3 meses desde el regreso
|
|
E
|
Evitar actividades en entornos que favorecen la exposición (Environments)
|
Recomendar al paciente que evite actividades al aire libre en entornos que son lugares idóneos para la cría de mosquitos, tales como pantanos o zonas pantanosas, especialmente en los atardeceres y por la noche
|
Fármacos recomendados por la OMS para la quimioprofilaxis de la malaria
|
Fármaco
|
Dosificación y esquema de profilaxis
|
Observaciones
|
|
Atovacuona con proguanil
|
VO; adultos: 250 mg/100 mg/d; niños: peso 11-20 kg, 62,5 mg/25 mg/d (1 tableta pediátrica/d); peso 21-30 kg, 125 mg/50 mg/d (2 tabletas pediátricas/d); peso 31-40 kg, 187,5 mg/75 mg/d; peso >40 kg, 250 mg/100 mg/d. Iniciar 1-2 días antes de llegar a una zona endémica de malaria, continuar durante toda la estancia y hasta los 7 días posteriores a la partida
|
Es eficaz en la profilaxis de la malaria en la mayoría de las regiones endémicas del mundo, también en áreas de multirresistencia en el Sudeste Asiático. El mecanismo de acción del fármaco permite una suspensión rápida de la quimioprofilaxis después del regreso del viaje
|
|
Cloroquina
|
VO 5 mg base/kg 1 x semana (300 mg de fármaco base o 500 mg de fosfato de cloroquina para un adulto promedio)
Iniciar profilaxis ≥1 semana antes de llegar a una zona endémica de malaria, continuar durante toda la estancia y por 4 semanas posteriores a la partida
|
Debido a la resistencia frecuente de P. falciparum, hoy en día la cloroquina se considera un fármaco ineficaz como profilaxis en la mayoría de las regiones, incluida África. Su uso se limita a Centroamérica y países seleccionados. No debe usarse en personas con antecedentes de epilepsia. Puede exacerbar psoriasis y miastenia grave. El uso prolongado (>5 años) conlleva riesgo de retinopatía (se deben hacer controles cada 6-12 meses)
|
|
Doxiciclina
|
VO 100 mg/d. Iniciar profilaxis 1-2 días antes de la llegada a una región endémica de malaria, continuar durante toda la estancia y por 4 semanas posteriores a la partida. Tomar con abundante líquido y no acostarse inmediatamente. No puede usarse en <8 años
|
Es eficaz en la profilaxis de malaria en la mayoría de las regiones endémicas, incluidas las zonas de multirresistencia en el Sudeste Asiático. Precauciones: intolerancia digestiva, candidiasis vaginal secundaria, esofagitis. Debido al riesgo de reacción fototóxica durante la toma de doxiciclina evitar la exposición excesiva a la luz solar y emplear protectores solares contra la radiación ultravioleta
|
|
Mefloquina
|
VO 5 mg/kg/semana (en un adulto promedio 1 compr. 250 mg/semana). Iniciar profilaxis ≥1 semana antes de llegar a una zona endémica de malaria, continuar durante toda la estancia y por 4 semanas posteriores a la partida
|
No debe utilizarse en personas con antecedentes de trastornos neuropsiquiátricos y en aquellos con trastornos de la conducción cardíaca
Puede usarse en embarazadas con cuidado
|
 Español
Español
 English
English
 українська
українська







