DEFINICIONES Y ETIOPATOGENIAArriba
1. Hemorragia digestiva alta, por encima del ángulo de Treitz: se diagnostica en ~80 % de los pacientes hospitalizados por hemorragia digestiva. Causas. Frecuentes: úlcera gástrica o duodenal, gastropatía aguda hemorrágica (erosiva), varices esofágicas o gástricas, ulceraciones esofágicas por enfermedad por reflujo, síndrome de Mallory-Weiss. Más raras: cáncer esofágico o gástrico, alteraciones vasculares del tracto digestivo (angiodisplasias, telangiectasias, lesión de Dieulafoy, estómago en sandía [GAVE], síndrome de Bean), gastropatía portal, traumatismo esofágico, aneurismas (de aorta, de arteria esplénica, de arteria pancreaticoduodenal). Los trastornos de la hemostasia (incluida la trombocitopenia y el uso de anticoagulantes) son factores de riesgo de sangrado. La úlcera gastroduodenal y la gastropatía hemorrágica son la causa de ~60 % de hemorragias. Pueden producirse de forma aguda en casos de shock, sepsis, traumatismos multiorgánicos, insuficiencia respiratoria aguda, insuficiencia multiorgánica, quemaduras graves y otras enfermedades agudas graves.
2. Hemorragia digestiva baja, por debajo del ángulo de Treitz: se diagnostica en ~20 % de los pacientes hospitalizados por hemorragia digestiva. Causas. Frecuentes: hemorroides, lesiones por AINE o preparados orales de potasio, enfermedades infecciosas intestinales (Salmonella, Shigella, Campylobacter jejuni, Entamoeba histolytica), divertículos del intestino grueso, enfermedades inflamatorias intestinales, isquemia y colitis isquémica, neoplasias y malformaciones vasculares. Menos frecuentes: varices del ano, pólipos del intestino grueso, divertículo de Meckel, endometriosis, fístula aortoentérica tras cirugía de derivación aortobifemoral, enteritis por radiación (tras radioterapia del cáncer de próstata y del aparato reproductor femenino), vasculitis. Los trastornos de la hemostasia (incluida la trombocitopenia y el uso de anticoagulantes) son factores de riesgo de sangrado.
CUADRO CLÍNICOArriba
1. Hemorragia digestiva aguda:
1) alta: hematemesis de sangre fresca o en posos de café, melena o heces mezcladas con sangre (en sangrados masivos); a veces dolor epigástrico (posible también dolor retroesternal, imitando un episodio coronario); manifestaciones de hipovolemia: palidez, debilitamiento, vértigo, sudoración profusa, hipotensión, aumento de la frecuencia cardíaca, hasta un cuadro completo de shock →Shock hemorrágico
2) baja: heces sanguinolentas (excepcionalmente melenas; el grado de mezcla de sangre con las heces es mayor cuanto más proximal es la localización del sangrado), o contenido sanguinolento rojo brillante a través del ano (la hemorragia se origina en el canal anal o en la parte distal del recto); manifestaciones de hipovolemia →más arriba.
2. Hemorragia crónica: periódicamente presencia de una pequeña cantidad de sangre en las heces, anemia, sangre oculta en las heces.
DIAGNÓSTICOArriba
La fuente del sangrado puede detectarse durante la anamnesis. El tacto rectal es necesario en todos los casos de hemorragia digestiva (sangre o melenas visible en el dedo; puede diagnosticarse enfermedad hemorroidal, aunque es preferible la anoscopia; pueden coexistir varias causas, p. ej. hemorroides y cáncer colorrectal). El diagnóstico definitivo se establece mediante endoscopia (esofagogastroduodenoscopia, realizada a las 24 h del comienzo de las manifestaciones, tras estabilizar hemodinámicamente al paciente, y colonoscopia después de una adecuada preparación).
Exploraciones complementarias
1. Pruebas de laboratorio:
1) hemograma de sangre periférica: recordar que el descenso del hematocrito, hemoglobina y del recuento de eritrocitos puede no apreciarse hasta que se diluya la sangre al pasar el líquido extracelular al espacio vascular o por la reposición de líquidos que no contengan eritrocitos (p. ej. NaCl al 0,9 %)
2) INR y otras pruebas de coagulación: son especialmente importantes en enfermos anticoagulados con antagonistas de la vitamina K (AVK), sobre todo porque puede no ser posible obtener esta información sobre este tratamiento en enfermos con bajo nivel de conciencia; la coagulopatía puede también indicar alteraciones de la función hepática o consumo de factores de la coagulación
3) prueba de sangre oculta en heces: test inmunoquímico, más sensible (FIT), o test de guayaco (gFOBT), que requiere una dieta especial. Un resultado negativo no descarta el sangrado, por lo que no puede reemplazar la endoscopia en caso de sospecha de pérdida de sangre a través del tracto digestivo. Por esta razón, en caso de sospechar un sangrado digestivo oculto (p. ej. en un paciente con anemia por déficit de hierro), no se recomienda una prueba de sangre oculta en heces, sino directamente realizar pruebas endoscópicas del tracto digestivo.
2. Endoscopia digestiva alta o baja: son las técnicas diagnósticas básicas. Generalmente identifican el punto sangrante, permite valorar la intensidad e iniciar el tratamiento. Clasificación de la intensidad del sagrado de una úlcera según Forrest y cols., tipos:
I — sangrado activo en chorro (Ia) o en napa (Ib)
IIa — vaso visible no sangrante
IIb — coágulo adherido en el lecho
IIc — lesión con mancha pigmentada
III — úlcera sin signos de sangrado.
3. Otras exploraciones que ayudan a determinar el lugar de sangrado, sobre todo en caso de hemorragia crónica o recurrente localizada en el tracto digestivo bajo: angio-TC, angiografía mesentérica, gammagrafía con eritrocitos marcados con tecnecio, capsuloendoscopia o enteroscopia, anoscopia (→fig. 4.29-1).
TratamientoArriba
Algoritmo de actuación en sangrados digestivos altos de origen no varicoso →fig. 4.29-2.
Algoritmo de actuación en hemorragias por varices esofágicas →fig. 4.29-3.
Algoritmo de actuación en enfermos con manifestaciones de hemorragia digestiva baja aguda →fig. 4.29-4.
1. Iniciar el tratamiento inmediatamente tras el ingreso hospitalario (en el servicio de urgencias o sala de admisiones) y continuar en una unidad hospitalaria que facilite un diagnóstico y tratamiento posteriores adecuados, en función de la intensidad del sangrado y del estado general del enfermo. En la hemorragia digestiva alta con una pérdida considerable de sangre y con alteración de la conciencia, mantener la permeabilidad de las vías respiratorias →Paro cardíaco súbito; en caso de necesidad intubar (no posponer la intubación por el alto riesgo de aspiración).
2. Monitorizar la presión arterial; si es normal → repetir la medición en bipedestación. Revisar la presencia de signos de hipoperfusión, p. ej. retraso en el tiempo de llenado capilar y otros signos de shock. En estos casos iniciar inmediatamente un procedimiento anti-shock →Shock.
3. Reanimación con fluidos: el objetivo principal es corregir la hipovolemia y facilitar una perfusión tisular adecuada. Para reponer el volumen de sangre perdida, se debe asegurar el acceso venoso, introduciendo 2 catéteres de gran diámetro (≥1,8 mm [≤16 G]) en las venas periféricas o una vía venosa central, y perfundir enérgicamente soluciones cristaloides (3-5 ml por 1 ml de sangre perdida; se prefieren las soluciones equilibradas; en el sangrado de varices esofágicas hay que tener cuidado a la hora de perfundir cristaloides para no aumentar excesivamente el volumen intravascular, causando la elevación de la presión portal y el aumento del riesgo de sangrado), o coloides (1-1,5 ml por 1 ml de sangre perdida). Si la pérdida de sangre se estima en >1/3 (>1500 ml en un adulto) → transfundir también concentrados de hematíes o sangre entera conservada →Transfusión de sangre, sus componentes y derivados. Valoración del volumen de sangre perdida →Herida y hemorragia postraumática. En enfermos hemodinámicamente estables considerar la transfusión cuando la concentración de Hb es ≤7 g/dl, para mantener una Hb 7-9 g/dl (o mayor, en función de la edad, las enfermedades cardiovasculares, el estado hemodinámico y la persistencia del sangrado). En enfermos con comorbilidades graves (→Concentrados de hematíes) considerar la transfusión con Hb ≤8 g/dl, con un objetivo de Hb 9-10 g/dl.
En caso de sangrado de varices esofágicas no se recomienda realizar transfusiones rutinarias de plaquetas: si no se logra controlar el sangrado, la decisión sobre la transfusión de plaquetas debe tomarse de manera individual. En el manejo inicial no se recomienda transfundir plasma fresco congelado ni factor VIIa recombinante.
4. En la hemorragia digestiva alta, estimar el pronóstico con la escala GBS (Glasgow-Blatchford Bleeding Score; una puntuación ≤1 indica riesgo muy bajo de recidiva, de muerte a los 30 días, y de requerir intervención hospitalaria [transfusión de concentrados de hematíes, o tratamiento endoscópico o quirúrgico], por lo que no se requiere hospitalización) o la escala de Rockall.
5. Tratamiento farmacológico
En la hemorragia digestiva alta aguda de origen no varicoso, antes de realizar la endoscopia, administrar un inhibidor de la bomba de protones (IBP; reduce la actividad de sangrado y la necesidad de intervención endoscópica, la administración del IBP no debe retrasar la realización de endoscopia) iv. (esomeprazol, omeprazol o pantoprazol) en inyección 80 mg (2 amp.), a continuación durante 3 días en infusión continua 8 mg/h o en inyecciones 40-80 mg 2 × d (también después de controlar el sangrado por endoscopia). Los IBP VO a dosis altas tienen una eficacia similar (puede considerarse la administración 40-80 mg 2 × d VO). A continuación, IBP VO (preparados →Enfermedad ulcerosa gástrica y duodenal) 20-40 mg 1 × d durante 8-12 semanas en caso de úlcera gástrica, y 4-8 semanas en caso de úlcera duodenal (si la identificación de H. pylori es positiva, se debe realizar tratamiento de erradicación →Enfermedad ulcerosa gástrica y duodenal; realizar control de la erradicación ≥4 semanas desde su finalización). Es necesario un control endoscópico de la curación de la úlcera gástrica ~4 semanas después de la primera exploración.
En caso de sospecha de sangrado de varices esofágicas o gástricas, desde el ingreso hospitalario se debe administrar iv. un fármaco que disminuye la presión portal (en caso de confirmar el sangrado de varices utilizar hasta 5 días [en algunos enfermos puede discontinuarse el tratamiento después de 24-48 h, tras conseguir la hemostasia endoscópica]):
1) Terlipresina: inyecciones de 1-2 mg iv. cada 4 h durante 48 h, a continuación 1 mg iv. cada 4 h durante 2-5 días para prevenir la recurrencia (vigilar el sodio por el alto riesgo de hiponatremia; contraindicada durante el embarazo).
2) Somatostatina: inyección 250 µg, a continuación infusión continua de 250 µg/h durante 5 días (controlar la glucemia cada 4-6 h; administrar con precaución en enfermos con diabetes tipo 1, ya que puede agravar la intensidad y la duración de hipoglucemia).
3) Octreotida: inyección inicial de 50 µg seguida de infusión continua de 50 µg/h durante 5 días.
En pacientes con sangrado de varices esofágicas o gástricas y cirrosis hepática se debe utilizar también un antibiótico (ceftriaxona 1 g/d iv. durante ≤7 días u otro antibiótico según el antibiograma local o la eventual alergia del enfermo a antibióticos) y lactulosa (VO 25 mg cada 12 h hasta conseguir 2-3 deposiciones blandas al día, posteriormente ajustar la dosificación para mantener este número de evacuaciones) para prevenir la encefalopatía.
En enfermos que reciben anticoagulantes:
1) En sangrado digestivo durante el tratamiento antiagregante en:
a) pacientes que reciben AAS → se sugiere discontinuar AAS de manera permanente si se utilizó en monoterapia para la prevención primaria de enfermedades cardiovasculares; no discontinuar AAS de rutina si se utiliza como prevención secundaria (y si se ha discontinuado → reiniciar inmediatamente tras lograr la hemostasia o controlar las manifestaciones de sangrado)
b) pacientes en terapia antiplaquetaria doble (TAD) tras la colocación de stents coronarios → continuar la TAD; en caso de sangrado masivo se recomienda continuar la administración de AAS, y si se ha discontinuado temporalmente el inhibidor de la P2Y12, este debe reinstaurarse en el plazo de 5 días.
2) En sangrado digestivo durante el tratamiento anticoagulante → discontinuar el anticoagulante (antagonista de la vitamina K [AVK] o anticoagulante oral de acción directa [ACOD]) y corregir los trastornos de la coagulación en función de la gravedad de sangrado y del riesgo trombótico (la corrección de la coagulopatía no debe retrasar la endoscopia ni la intervención radiológica). En caso de inestabilidad hemodinámica en un enfermo que recibe:
a) AVK → administrar vitamina K iv. y considerar la administración de concentrado de factores del complejo de protrombina (CCP) o de plasma fresco congelado, si el CCP no está disponible
b) ACOD → puede considerarse el uso de un fármaco que revierte su acción: idarucizumab (5 mg [2 × 2,5 g] iv. en bolo o en 2 infusiones de 5-10 min) en los pacientes tratados con dabigatrán, y andexanet α o transfusión de CCP en los pacientes tratados con un inhibidor del factor Xa (rivaroxabán, apixabán).
Para la prevención secundaria de enfermedades cardiovasculares, se debe reintroducir el AAS a la mayor brevedad después de controlar el sangrado (preferiblemente a los 3-5 días de conseguir hemostasia). Si se usaba otro antiplaquetario en monoterapia (clopidogrel, prasugrel, ticagrelor), considerar cambiarlo temporalmente por AAS. En enfermos que toman AAS a dosis baja como prevención primaria, evaluar el equilibrio entre beneficio y riesgo sobre continuar con el fármaco y sobre esta base decidir si continuar o no la administración del AAS. En enfermos con indicación de terapia antiplaquetaria doble (TAD), reiniciar el fármaco retirado a la mayor brevedad, de preferencia a los 5 días. Además, derivar al enfermo a una consulta cardiológica. Recomendar tratamiento crónico con IBP a los enfermos que toman solo AAS y a los que requieren continuar TAD.
En enfermos que requieren tratamiento antiplaquetario y AVK, la actuación posterior a la hemorragia depende del riesgo de complicaciones tromboembólicas y de recidiva de sangrado. En enfermos hemodinámicamente estables, con alto riesgo de complicaciones tromboembólicas →tabla 2.34-4, y bajo riesgo de recidiva de hemorragia, se puede considerar volver a administrar un AVK el mismo día que se consigue una hemostasia eficaz. En caso de alto riesgo de recidiva del sangrado, se recomienda reintroducir el AVK en 7 días, y eventualmente considerar la administración de heparina hasta que se reintroduzca el AVK. Si el enfermo tomaba ACOD, se debe reintroducir pasadas 48-72 h desde la hemostasia. En estos enfermos se sugiere administración crónica de IBP.
6. Realizar endoscopia digestiva alta con intento de detener el sangrado en 24 h, y en caso de sospecha de sangrado de varices esofágicas en menos de 12 h. Se emplean inyecciones de sustancias vasoconstrictoras u obliterantes de vasos (escleroterapia), electrocoagulación o coagulación con argón plasma, clips hemostáticos (vasculares u OTSC) o ligadura con bandas, polvo hemostático. En caso de sangrado digestivo bajo, preparar al paciente para la colonoscopia. En caso de sangrado digestivo bajo masivo con un índice de shock (frecuencia cardíaca dividida por la presión arterial sistólica) >1, considerar la angiografía visceral y endoscopia digestiva alta urgentes.
7. Si el intento de detener un sangrado por varices esofágicas mediante endoscopia fracasa, se puede colocar en el esófago un stent autoexpandible Danis SX-ELLA (retirar en 7 días), o bien en el esófago y estómago una sonda de Sengstaken-Blakemore (→fig. 4.29-5), u otro tipo de sonda con balón para producir compresión sobre las varices (p. ej. de Linton-Nachlas, en caso de varices del fondo gástrico). Se mantienen por un máximo de 24 h. Alternativamente se puede considerar un shunt portosistémico intrahepático transyugular (TIPS; consistente en la colocación de un catéter por la vena yugular, vena cava superior e inferior en las venas hepáticas, y creando una comunicación con la vena porta, en la que se coloca un stent).
8. Si todos los procedimientos endoscópicos y farmacológicos fracasan, considerar la angiografía visceral y embolización selectiva del vaso sangrante.
9. Debido a la eventualidad de requerir intervención urgente → contactar con cirujano desde la etapa inicial del procedimiento. Indicaciones para el tratamiento quirúrgico: sangrado masivo no detenido (es decir, causante de una inestabilidad hemodinámica), también después de un intento fracasado del tratamiento endoscópico, y sangrado recurrente (tras 2 intentos endoscópicos). Actuación quirúrgica:
1) sangrado de una úlcera péptica →Enfermedad ulcerosa gástrica y duodenal
2) sangrado digestivo bajo → después de localizar el punto sangrante, extirpación segmentaria, y —en casos excepcionales— subtotal del intestino grueso.
VIGILANCIAArriba
No se recomienda la gastroscopia de control de rutina ≤24 h en todos los enfermos tratados por endoscopia. Puede considerarse en caso de alto riesgo de recurrencia de sangrado, de evaluación incompleta de mucosa debido a la sangre residual, en hemorragia de origen desconocido o en caso de dudas sobre la eficacia de la hemostasia. Si el origen del sangrado fue una úlcera gástrica, realizar una gastroscopia de control con toma de muestras para el estudio histológico a las ≥4 semanas de la primera exploración.
TABLAS Y FIGURAS
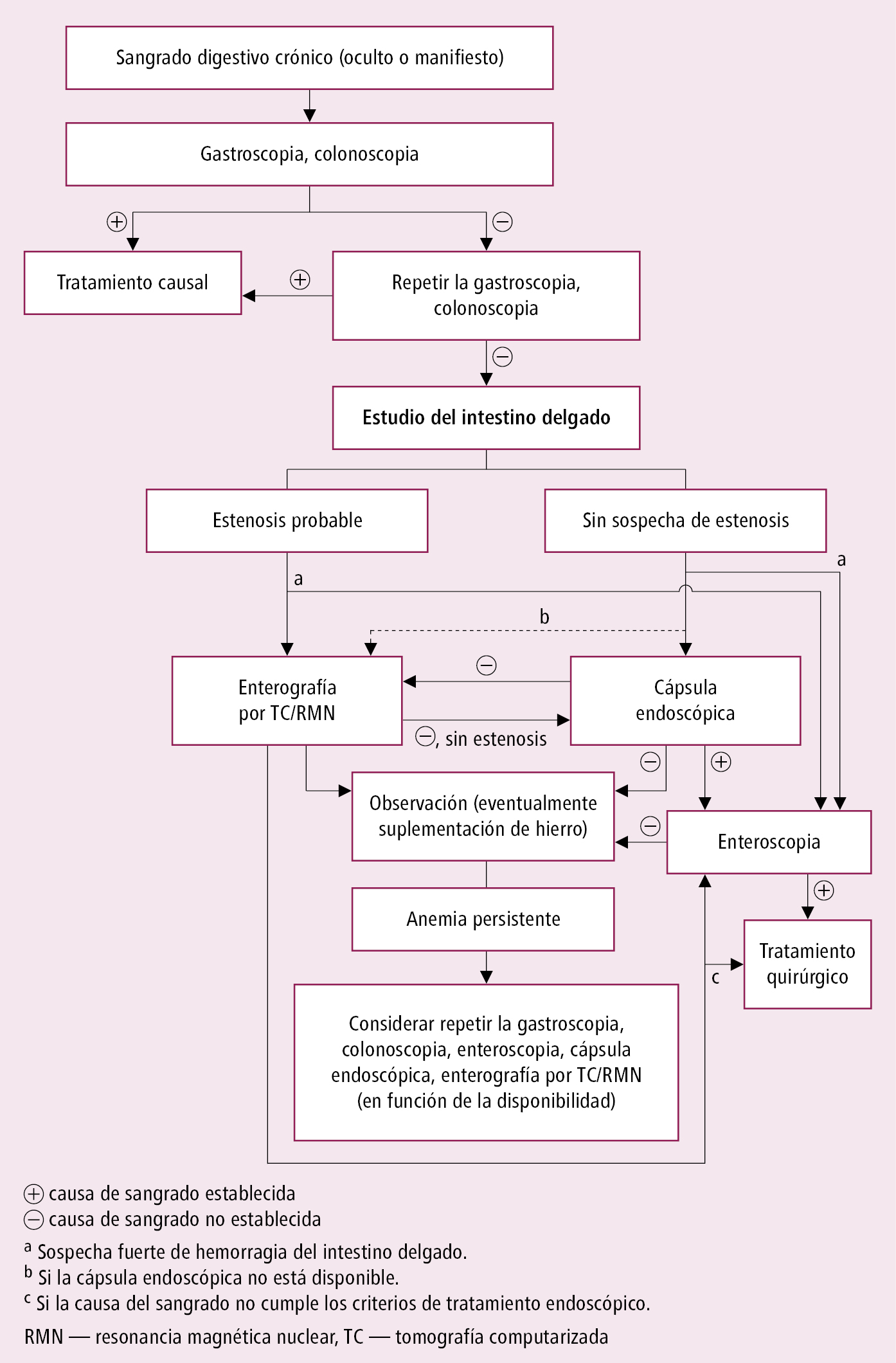
Fig. 4.29-1. Algoritmo diagnóstico en enfermos con sangrado digestivo crónico (a partir de las guías del ACG 2016, modificado)
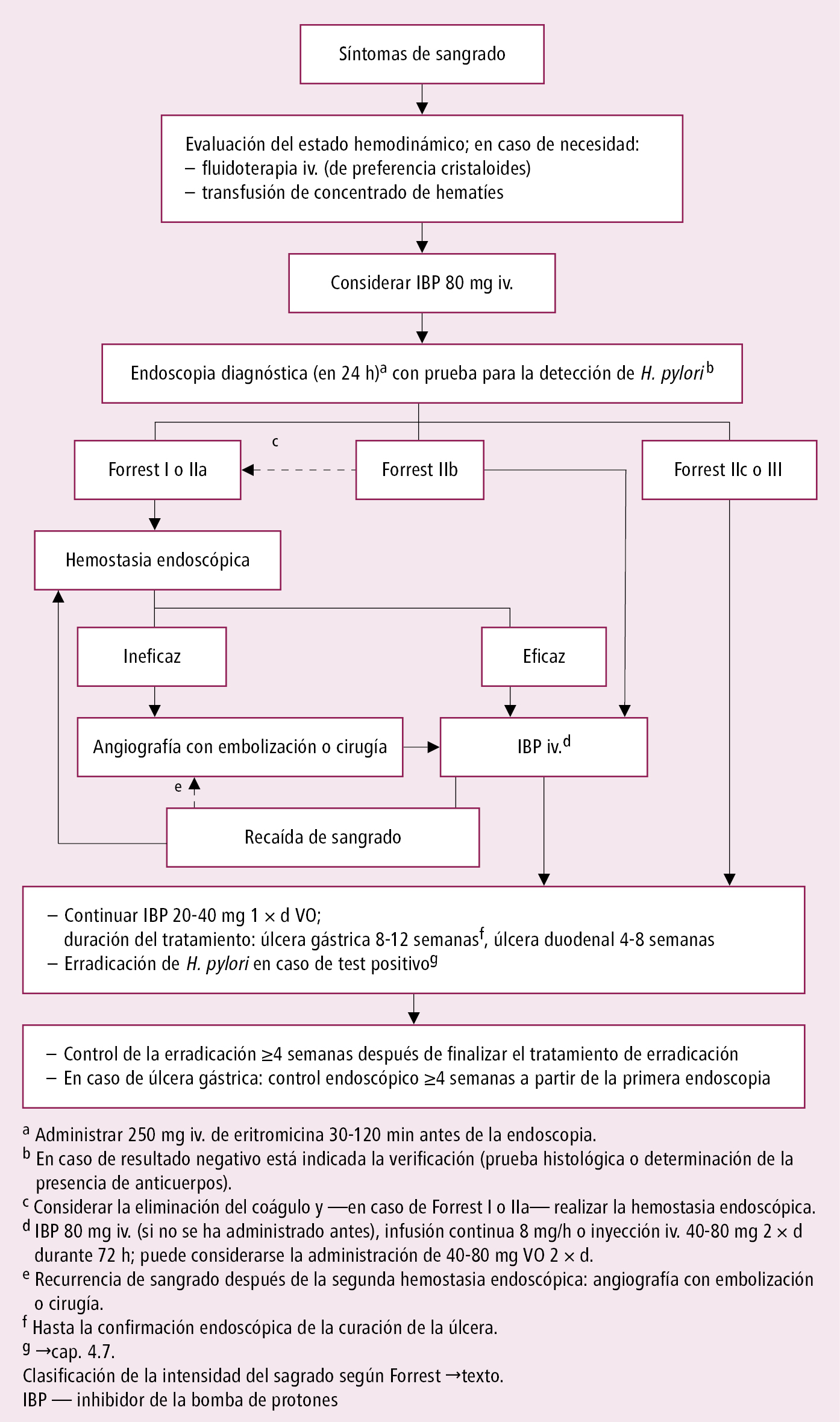
Fig. 4.29-2. Algoritmo de actuación en caso de sangrado digestivo alto de origen no varicoso (a partir de las guías de la ESGE 2021)
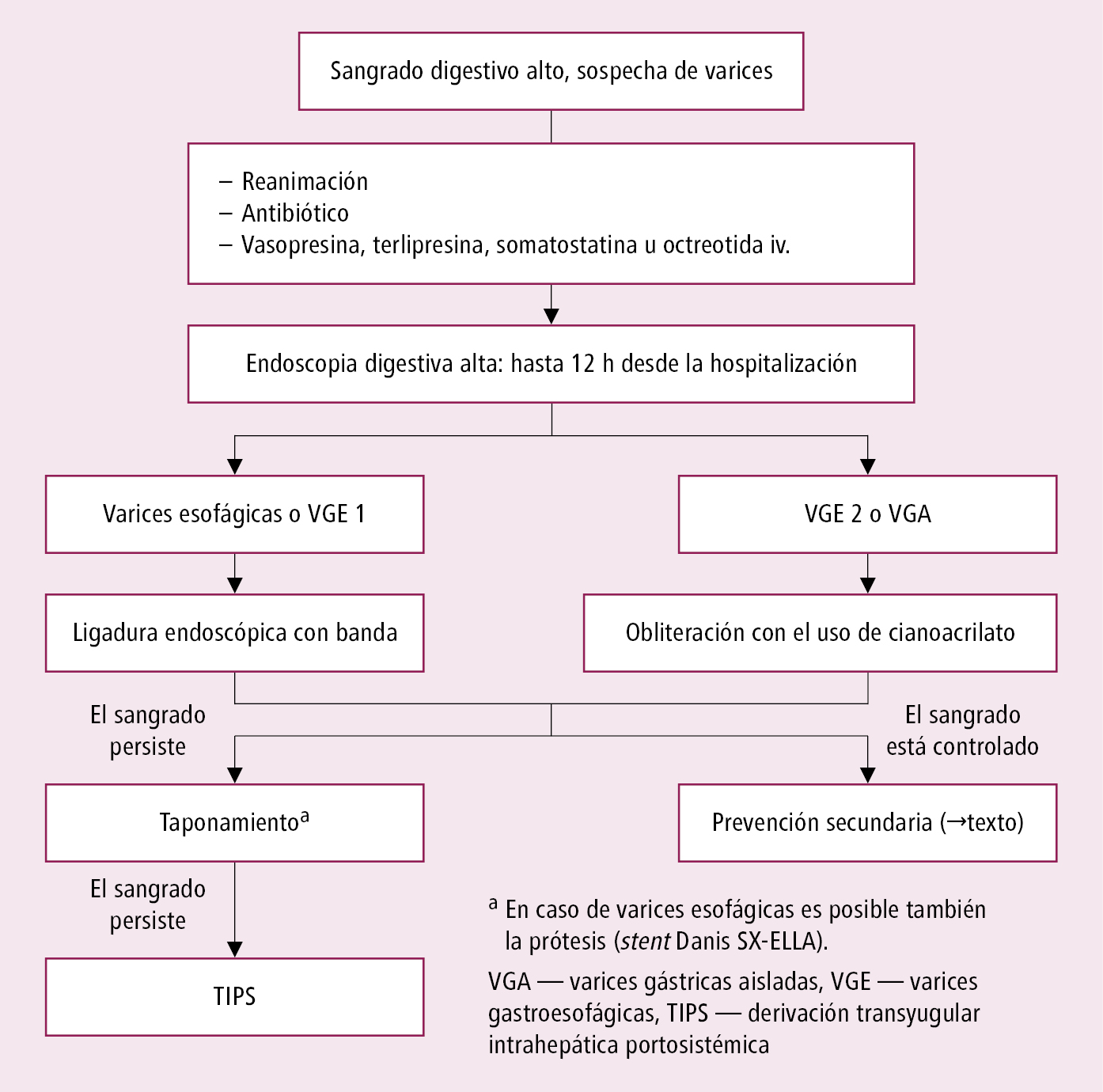
Fig. 4.29-3. Algoritmo de actuación en la hemorragia por varices esofágicas
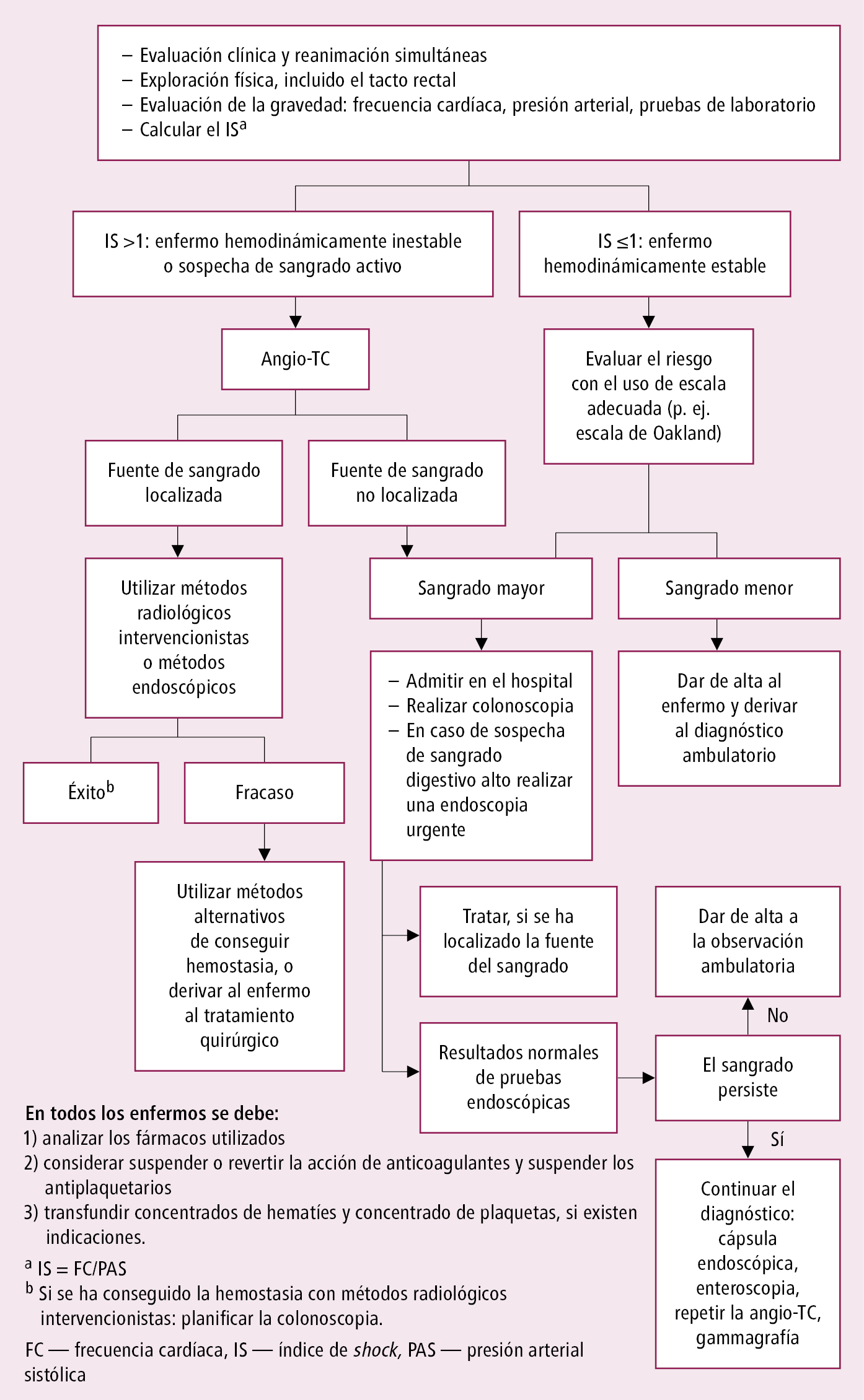
Fig. 4.29-4. Algoritmo de actuación en enfermos con manifestaciones de la hemorragia digestiva baja aguda (a partir de las guías de la BSG 2019, modificado)
Estratificación del riesgo de complicaciones tromboembólicas venosas o arteriales en enfermos en tratamiento crónico con AVK
|
Indicaciones para el tratamiento con AVK
|
Riesgo estimado de un episodio tromboembólico
|
|
Bajo
|
Intermedio
|
Alto
|
|
Prótesis valvular cardíaca mecánica
|
Prótesis aórtica mecánica bicúspide sin factores accesorios de riesgo de ACV
|
Prótesis aórtica mecánica bicúspide y uno de los siguientes factores de riesgo: fibrilación auricular, antecedente de ACV o de AIT, hipertensión arterial, diabetes mellitus, insuficiencia cardíaca congestiva, edad >75 años
|
– prótesis mitral mecánica
– prótesis aórtica mecánica antigua (tipo jaula-bola, de disco pivotante)
– ACV o AIT en los últimos 6 meses
|
|
Fibrilación auricular
|
1-4 ptos. en la escala CHA2DS2‑VASca sin antecedentes de ACV, AIT y episodio de embolismo periférico
|
5-6 ptos. en la escala CHA2DS2‑VASca o antecedentes de ACV, AIT o episodio de embolismo periférico en >3 meses anteriores
|
7-9 ptos. en la escala CHA2DS2‑VASca
– antecedente del ACV, AIT o episodio de embolismo periférico en los últimos 3 meses
– enfermedad cardíaca reumática
|
|
ETV
|
Antecedente de ETV en >12 meses anteriores, actualmente sin otros factores de riesgo de la ETV
|
– antecedente de un episodio hace 3-12 meses o ETV recurrente
– formas más leves de trombofilia (p.ej. heterocigoto para la mutación G20210A del gen de protrombina o factor V Leiden)
|
– antecedente de un episodio en los últimos 3 meses
– trombofilia grave (p.ej. déficit de antitrombina, de proteína C o de la proteína S, síndrome antifosfolipídico o coexistencia de varias alteraciones)
– neoplasia maligna (tratamiento en los últimos 6 meses o en estadio de tratamiento paliativo)
|
|
a Criterios →tabla 3 en Fibrilación auricular (FA).
AIT — accidente isquémico transitorio, ETV — enfermedad tromboembólica venosa
|
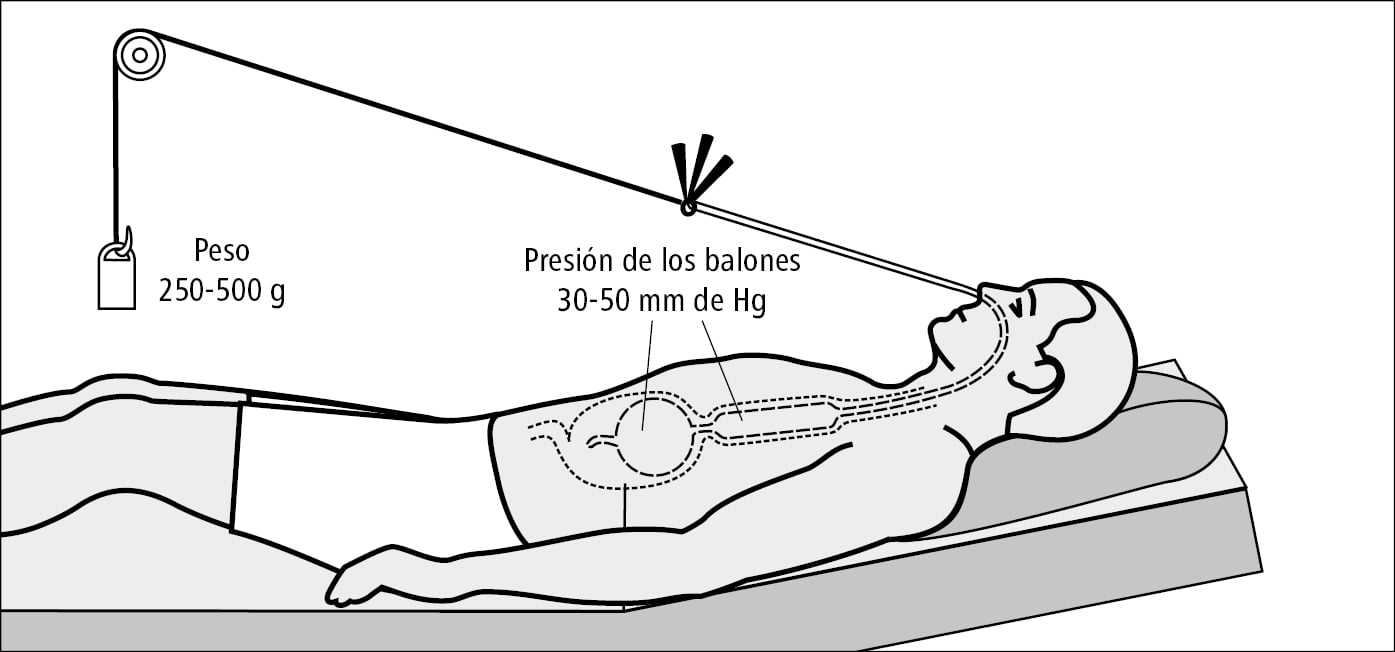
Fig. 4.29-5. Esquema de la correcta colocación de la sonda de Sengstaken-Blakemore
 Español
Español
 English
English
 українська
українська









