Definiciones y etiopatogeniaArriba
Nódulo tiroideo: crecimiento de tejido tiroideo que genera un aumento de volumen focal en la glándula, distinto al parénquima que lo rodea. Se debe a hiperplasia (con mayor frecuencia), degeneración, fibrosis o a neoplasias malignas (5-15 % de los casos). Se desarrolla a consecuencia de una deficiencia de yodo (inicialmente como bocio simple), predisposición genética, efecto de sustancias bociógenas, exposición a radiaciones ionizantes y antecedentes de tiroiditis, entre otros. Su prevalencia depende de la edad, del sexo y de la forma en que es diagnosticado. Es más frecuente en adultos mayores, en el sexo femenino y si el estudio se realiza mediante ecografía vs. palpación. Puede ser único o múltiple.
Bocio: aumento de volumen tiroideo (en ecografía >20 ml en mujeres y >25 ml en hombres). Bocio simple: aumento de volumen tiroideo sin alteraciones de la ecoestructura, que en la mayoría de los casos se desarrolla como consecuencia de una deficiencia de yodo en niños y en jóvenes. Constituye un factor de riesgo para el desarrollo de bocio multinodular en adultos. Bocio multinodular: crecimiento de la glándula tiroides debido a la presencia de múltiples nódulos. Puede evolucionar hacia crecimiento nodular y/o aumento de producción de hormonas tiroideas (bocio multinodular tóxico) →Bocio multinodular tóxico. Bocio retroesternal: aumento de volumen tiroideo en el que >1/3 de la glándula se encuentra por debajo de la escotadura esternal. Puede pasar desapercibido durante mucho tiempo, hasta la aparición de síntomas compresivos.
Cuadro clínico e historia naturalArriba
El nódulo tiroideo se desarrolla lentamente y con mucha frecuencia de forma inadvertida durante años. Con alta frecuencia no se acompaña de síntomas de disfunción tiroidea. La glándula tiroides aumentada de tamaño y con nódulos desarrollados puede llamar la atención debido al aumento del perímetro y a la asimetría cervical. Raramente los síntomas iniciales incluyen disnea, tos o disfagia, debidos a la compresión de los tejidos adyacentes por un nódulo de gran tamaño o de localización retroesternal. La presencia de un nódulo duro, adherido a planos profundos, en presencia de ronquera, así como con el antecedente de exposición del cuello a radiaciones ionizantes son criterios clínicos sugestivos de malignidad.
DiagnósticoArriba
Exploraciones complementarias
1. Pruebas de laboratorio: la medición de tirotropina (TSH) en el suero es el estudio de laboratorio inicial para valorar la función tiroidea en pacientes con sospecha de nódulo tiroideo o con un nódulo tiroideo detectado en una prueba de imagen:
1) TSH elevada o normal: en caso de un paciente con TSH elevada (hipotiroidismo) o normal (eutiroidismo), se debe proceder a realizar un ultrasonido avanzado de cuello para evaluar las características ecográficas y determinar su riesgo de malignidad.
2) TSH suprimida: en caso de un paciente con una TSH suprimida, previo a realizar estudios adicionales para su abordaje diagnóstico se debe realizar una gammagrafía para determinar la etiología de la tirotoxicosis.
PERSPECTIVA COLOMBIANA
En caso de encontrar a un paciente con TSH suprimida, para su abordaje diagnóstico puede realizarse una gammagrafía con tecnecio (el uso de 123I se indica solo en el tratamiento de cáncer).
2. Pruebas de imagen:
Ecografía de tiroides: se utiliza para evaluar y vigilar el volumen tiroideo, el cual se estudia por separado para cada lóbulo, utilizando la fórmula elipsoide simplificada (la mitad del producto de las tres dimensiones del lóbulo: V [ml] = a [cm] × b [cm] × c [cm] × 0,5). Los resultados obtenidos se suman. El volumen tiroideo normal es de ≤18 ml en mujeres y ≤25 ml en hombres. La ecografía también es útil para evaluar y vigilar las lesiones focales. Se examina su:
1) localización (ubicación de la lesión focal en la glándula tiroides)
2) tamaño (3 dimensiones)
3) forma (las lesiones ovales no aumentan el riesgo); los focos cuya dimensión anteroposterior (altura de la sección transversal) es mayor a la transversal (anchura de la sección transversal) son los más sospechosos, lo que recibe la denominación de la "forma más alta que ancha"
4) ecogenicidad (nódulos sólidos iso-, hiper- o hipoecogénicos; lesiones quísticas anecogénicas)
5) estructura interna (nódulos homogéneos, sólidos o llenos de líquido, o heterogéneos):
a) lesiones sólidas, con <10 % de contenido líquido
b) lesiones mixtas, principalmente sólidas (sólido-líquidas), con un 10-50 % de contenido líquido
c) lesiones principalmente líquidas (líquido-sólidas), con un 50-90 % de contenido líquido
d) lesiones llenas de líquido (quistes), con >90 % de contenido líquido
e) lesiones focales de aspecto espongiforme, que contienen espacios quísticos diminutos separados por membranas finas
6) límites (nítidos y lisos o mal delimitados e irregulares)
7) calcificaciones (micro- o macrocalcificaciones)
8) vascularización de todo el parénquima y lesiones focales (exploración con Doppler color o Doppler de potencia: las lesiones focales pueden no sufrir un aumento de vascularización [tipo I], tener vascularización periférica evidente [tipo II] o presentar vascularización intranodular aumentada [tipo III], más frecuente en caso de lesiones malignas), así como
9) rigidez (elasticidad) de las lesiones focales mediante elastografía (prueba que utiliza ultrasonidos para medir la deformación de lesiones focales en el tiroides). El tejido neoplásico suele tener menor elasticidad que el tejido adyacente (esto concierne a cánceres: papilar, medular y anaplásico); las lesiones con el índice de elasticidad alto suelen ser benignas (con excepción del cáncer folicular), lo que hace la prueba útil para seleccionar focos para una PAAF, y —en caso del carácter mixto de la lesión— para elegir la localización exacta dentro de la lesión para la PAAF. Las alteraciones focales identificadas mediante ecografías deben ser valoradas mediante palpación. La ecografía no permite diferenciar inequívocamente las lesiones benignas de las malignas, pero puede aportar información sobre el riesgo de malignidad →más adelante. En la ecografía también deben evaluarse los ganglios linfáticos cervicales para detectar la presencia de los factores de riesgo de metástasis (→más adelante).
Sistema de clasificación ecográfica de nódulos tiroideos según el riesgo de malignidad (TI-RADS), modificado por la ACR (ACR TI-RADS) y por la ETA (EU-TIRADS) →tabla 9.4-1). El riesgo de malignidad aumenta con la cantidad de factores de riesgo detectados en la ecografía, en cuyo caso es aún más necesaria la PAAF guiada por ecografía con la evaluación citológica de la lesión observada.
Gammagrafía tiroidea: indicada en casos de sospecha de bocio retroesternal o con niveles de TSH sérica cercanos al límite inferior del rango de referencia o más bajos (especialmente con un aumento simultáneo de los niveles de FT4, lo que sugiere un bocio multinodular tóxico; en estos casos, la identificación de nódulos autónomos confiere un riesgo de malignidad muy bajo). Además, la utilidad de la gammagrafía es muy limitada en los casos de bocio multinodular no tóxico, por lo que no está indicada en estos casos.
3. Punción aspirativa con aguja fina (PAAF) del nódulo tiroideo: examen citológico. Para diferenciar las lesiones benignas de las malignas o de las de alto riesgo de malignidad (criterios para seleccionar el nódulo para la PAAF →más adelante). Tiene importancia a la hora de tomar una decisión sobre la indicación del tratamiento quirúrgico →más adelante, u observar la evolución de los nódulos. El patólogo debe clasificar el resultado de examen citológico del tiroides en una de las 6 categorías diagnósticas →tabla 9.4-2. La PAAF (idealmente guiada por ecografía) permite diagnosticar con alta precisión el carcinoma papilar tiroideo, no obstante, no indica de manera definitiva el diagnóstico de cáncer folicular, debido a que no permite diferenciar inequívocamente entre el nódulo benigno (nódulo hiperplásico, tiroiditis o adenoma folicular, que es una neoplasia benigna) y el carcinoma folicular tiroideo. Para ello es decisivo el examen histológico posoperatorio. Por este motivo se ha introducido el diagnóstico citológico de "sospecha de neoplasia folicular" en lugar de "tumor folicular" y, en su caso, "sospecha de carcinoma de células de Hürthle" (en lugar de "variante oxifílica"). Las células oxifílicas son células tiroideas que contienen gran número de mitocondrias y están presentes tanto en el carcinoma papilar como en el folicular. No obstante, la sola detección de metaplasia oncocítica (oxifílica) no es indicativa de sospecha de neoplasia maligna, a no ser que en el preparado predominen los oncocitos (>75 % de las células). La metaplasia oxifílica es frecuente en las tiroiditis crónicas y en el bocio multinodular. El diagnóstico de nódulo hiperplásico es sinónimo de bocio multinodular. Durante la PAAF de tiroides con relativa frecuencia se obtienen frotis no satisfactorios (5-10 % de las biopsias), en cuyo caso se recomienda repetir la prueba transcurridos ≥3 meses.
PERSPECTIVA LATINOAMERICANA
En Chile y en Colombia la citología categorizada como Bethesda V o VI no requiere la confirmación diagnóstica por otro patólogo.
Procedimiento diagnóstico
En todos los casos de nódulo tiroideo es necesario realizar controles regulares y valorar la necesidad de la PAAF de las lesiones focales observadas en tiroides, teniendo en cuenta los factores de riesgo de malignidad clínicos y ecográficos.
Características clínicas de riesgo de malignidad de un nódulo tiroideo o de una lesión focal detectada en la ecografía de tiroides:
1) aumento del volumen de los ganglios linfáticos yugulares
2) metástasis linfáticas o metástasis a distancia de origen desconocido
3) agrandamiento de la lesión focal:
a) durante el seguimiento ecográfico, ≥20 % en cualquier dimensión en un año se considera importante (este criterio no se aplica a lesiones <1 cm y no prejuzga la malignidad)
b) un aumento de tamaño brusco (en unas semanas) y detectable clínicamente requiere una evaluación endocrinológica u oncológica inmediata con el objetivo de descartar un cáncer anaplásico de tiroides
4) presencia del nódulo duro, adherido a planos profundos en la exploración física
5) tamaño del nódulo >4 cm
6) ronquera causada por la parálisis del nervio laríngeo recurrente
7) antecedentes de exposición del cuello a radiaciones ionizantes
8) historia familiar de carcinoma medular de tiroides
9) edad <20 años o >60 años (en caso de aparición de nuevos nódulos).
Características ecográficas de riesgo de malignidad de un nódulo tiroideo o de una lesión focal detectada en la ecografía de tiroides:
1) presencia de microcalcificaciones en la lesión focal (<1-2 mm sin sombra acústica)
2) lesión focal sólida e hipoecogénica
3) forma de la lesión "más alta que ancha" (en la sección transversal)
4) límites irregulares de la lesión (difusos, lobulares)
5) signos de flujo aumentado (caótico) dentro de la lesión
6) signos de metástasis linfáticas yugulares
7) signos de infiltración de la cápsula o de órganos adyacentes al cuello.
Las lesiones focales de este tipo requieren una PAAF independientemente de su tamaño (a excepción de los focos <10 mm sin signos clínicos de riesgo elevado).
Las indicaciones para la PAAF de una lesión focal tiroidea (idealmente guiada por ecografía) según las recomendaciones de la ETA (2017; clasificación EU-TIRADS →tabla 9.4-1) se asocian al riesgo de malignidad definido en función de la presencia de características clínicas y ecográficas de riesgo (→más arriba).
Indicaciones para la PAAF:
1) Nódulo palpable o lesión focal detectada mediante la ecografía, si al menos una de sus dimensiones ≥1 cm y las demás ≥5 mm (en ausencia de otros focos de mayor riesgo de malignidad que requieran realizar PAAF en primer lugar). En caso de lesiones múltiples realizar PAAF en aquellas que presenten mayor riesgo de malignidad (→más arriba). En la práctica, se descarta cáncer en 3-4 focos de mayor riesgo, lo que en general requiere 2 sesiones de PAAF. En ausencia de factores clínicos de riesgo importantes, las guías de la ETA (2017) indican que la evaluación debe basarse en la presencia de factores ecográficos de riesgo de malignidad y no en el tamaño de la lesión →tabla 9.4-1.
2) Lesión focal de tiroides independientemente de su tamaño, en caso de factores clínicos y/o ecográficos de riesgo de malignidad (normalmente ≥5 mm en cada dimensión, si técnicamente es posible realizar una biopsia fiable). Si las características ecográficas de malignidad se refieren a una lesión de dimensiones <1 cm y el riesgo clínico no es alto, esta puede observarse mediante seguimiento ecográfico cada 3-6 meses, y será apta para la PAAF cuando al menos una dimensión de la lesión ≥1 cm o aparezcan nuevos factores de riesgo.
3) Cualquier lesión focal de tiroides, independientemente del tamaño, en todos los casos confirmados de metástasis ganglionar o a distancia, en presencia de un aumento en la concentración de calcitonina sérica, o en pacientes portadores de la mutación germinal del gen RET, que aumenta la predisposición al cáncer medular de tiroides, así como en caso de detectar un foco en el que la captación de glucosa está incrementada en el 18F-FDG PET, si técnicamente es posible realizar una biopsia fiable.
PERSPECTIVA LATINOAMERICANA
En América Latina para la indicación de PAAF de los nódulos tiroideos deben considerarse las características ecográficas en forma más relevante que solo el tamaño nodular ≥1 cm (según el Consenso de la Sociedad Chilena de Endocrinología y Diabetes [SOCHED] y la práctica clínica de varios países).
Debido al bajo riesgo de malignidad, no hay indicaciones para la PAAF en los siguientes casos:
1) lesión focal tiroidea ≤5 mm en todas sus dimensiones: en las guías de la ATA (2015) y la ETA (2017) existe una recomendación fuerte de no realizar biopsia en caso de lesiones focales de pequeño tamaño (≤10 mm) que no se acompañan de otros síntomas; estas lesiones deben vigilarse
2) quiste simple según criterios ecográficos
3) lesión de aspecto espongiforme en la ecografía en ≥50 % de su volumen
4) nódulo autónomo (nódulo caliente) en gammagrafía de tiroides, siempre y cuando no existan factores clínicos ni ecográficos de riesgo de malignidad.
Características ecográficas de riesgo sugerentes de metástasis ganglionares indicativas de PAAF: forma redondeada, pérdida del hilio graso, microcalcificaciones, heterogeneidad, estructura sólida y quística (degeneración quística), dimensión transversal >5 mm, vascularización periférica o caótica.
Preparación para la PAAF en pacientes bajo tratamiento anticoagulante: retirar el tratamiento anticoagulante antes de la PAAF:
1) HBPM 8 h antes
2) dabigatrán ≥12 h antes
3) rivaroxabán ≥24 h antes. La administración de acenocumarol o de warfarina no es una contraindicación absoluta para la PAAF, especialmente si se utiliza una aguja de diámetro 0,4 mm (27G) con un INR 2,5-3. Se permite la PAAF de tiroides en un enfermo que recibe clopidogrel, si la discontinuación del fármaco no es posible y las indicaciones para la biopsia son absolutas. No es necesario interrumpir el AAS administrado a dosis ≤300 mg/d.
Criterios diagnósticos de bocio multinodular no tóxico
1) >1 nódulo tiroideo detectable en la exploración física o que puede evidenciarse en la ecografía (independientemente del volumen de todo el tiroides), o una glándula tiroidea aumentada de tamaño en la ecografía: >20 ml en mujeres y >25 ml en hombres, con alteraciones focales de la ecoestructura de >1 cm de diámetro.
2) Nivel sérico de TSH normal.
3) Exclusión de neoplasia maligna mediante PAAF.
Pruebas de control para la exclusión del cáncer tiroideo
Considerar la PAAF en todo caso de nódulo tiroideo. Criterios de selección de lesiones focales para la PAAF →más arriba. En caso de presentar múltiples lesiones focales → excluir el cáncer en todos los focos con indicación de PAAF o como mínimo en ≥4 focos de mayor riesgo. Si las lesiones son múltiples, pero ecográficamente similares, sin características ecográficas de alto riesgo, se acepta realizar PAAF solo de la lesión de mayor tamaño.
1. Si en la primera PAAF no se han detectado signos de malignidad de los nódulos examinados (lesión benigna →tabla 9.4-2) y la citología es fiable, no se requiere una nueva PAAF. Bastan ecografías tiroideas de control. En caso de dudas se puede repetir la PAAF a los 6-12 meses, especialmente en casos de nódulos con rasgos ecográficos de malignidad. Es indispensable repetir la PAAF en caso de un aumento significativo del tamaño nodular, de aparición en la ecografía de nuevos signos de riesgo y si la PAAF no ha incluido el número suficiente de lesiones focales.
2. Si el resultado de la primera PAAF indica "lesión folicular de significado incierto", repetir la PAAF a los 3-12 meses, dependiendo de la sospecha clínica de malignidad.
3. Antes de proceder al tratamiento quirúrgico de una neoplasia folicular (también oxifílica), es conveniente que un segundo patólogo confirme el diagnóstico. Los enfermos que no reciben tratamiento quirúrgico requieren una observación cuidadosa.
PERSPECTIVA LATINOAMERICANA
En los últimos años se han utilizado estudios de expresión de algunos marcadores moleculares en nódulos tiroideos que pueden mejorar la capacidad diagnóstica en los nódulos con diagnóstico citológico indeterminado (Bethesda III y IV). Actualmente en varios países de Latinoamérica se encuentra disponible el estudio ThyroidPrint®, que ha mostrado un alto valor predictivo negativo para excluir la presencia de una neoplasia maligna.
TratamientoArriba
Ventajas y desventajas de varios métodos →tabla 9.4-3.
Tratamiento quirúrgico
Indicaciones:
1) Diagnóstico citológico de "neoplasia maligna" o "sospecha de malignidad" (→tabla 9.4-2), lo que implica la sospecha de cáncer tiroideo →Cáncer de tiroides o la imposibilidad de excluirla (indicación absoluta). La "sospecha de carcinoma de células de Hürthle" se relaciona con un riesgo de cáncer de un 15-25 % y constituye una importante indicación para el tratamiento quirúrgico. Se debe considerar de forma detenida en caso de nódulos >1 cm. El nódulo pequeño con el diagnóstico citológico de "sospecha de neoplasia folicular" constituye una indicación quirúrgica relativa. La decisión debe ser individualizada en función del tamaño del nódulo y de la presencia de características de riesgo de malignidad.
2) Bocio de gran tamaño (normalmente >60 ml) con compresión sobre la vía aérea que puede afectar su permeabilidad.
3) Bocio retroesternal (independientemente de la compresión de la vía aérea).
4) Nódulo >4 cm o, en caso de nódulos de menor tamaño, presencia de características de alto riesgo de malignidad.
Extensión de la cirugía: si se sospecha cáncer tiroideo en tumores ≥1 cm → tiroidectomía total (→Cáncer de tiroides). En los demás casos puede plantearse una tiroidectomía subtotal o lobectomía total del lóbulo con el tumor de alto riesgo de malignidad con istmectomía y lobectomía subtotal del otro lóbulo, en el caso de que en la ecografía se aprecien lesiones focales (indicado en caso de sospecha de neoplasia folicular, especialmente carcinoma de células de Hürthle). La biopsia intraoperatoria no es determinante en la decisión de si se trata de cáncer folicular o de neoplasia no maligna. Decide el examen histopatológico posoperatorio. Complicaciones →Hipertiroidismo.
Tratamiento no quirúrgico
Es de elección en caso de que ni el examen clínico ni la PAAF sugieran malignidad, y por tanto no existe indicación de tratamiento quirúrgico. El resultado negativo de una PAAF realizada en un centro que cumple con los estándares de calidad de las pruebas y con el algoritmo de punción de los focos de riesgo mayor constituye una base suficiente para excluir la neoplasia maligna. Solo en caso de lesiones con características ecográficas de riesgo, aún con diagnósticos citológicos de benignidad, debe repetirse la PAAF a los 3-12 meses (la urgencia de prueba depende de la intensidad de las características de riesgo).
1. Observación: en el primer período (1-2 años) examinar al enfermo cada 6 meses y realizar ecografía cada 6-12 meses (dependiendo del riesgo). Repetir la PAAF en caso de aumento significativo del tamaño de la lesión, empeoramiento de las características clínicas de riesgo de malignidad, o de aparición de nuevas características de riesgo clínicas o ecográficas. Si la observación no sugiere sospecha de malignidad y la lesión focal no aumenta de tamaño de manera significativa, los controles subsiguientes pueden realizarse con menor frecuencia, si bien no se deben abandonar. En pacientes con diagnóstico citológico de "lesión folicular de significado incierto" o "sospecha de neoplasia folicular" el riesgo de malignidad es bajo si en la gammagrafía se ha detectado un nódulo autónomo (controlar la TSH). Se puede recomendar observación de estos nódulos incluso si son pequeños (<1-2 cm) y no presentan signos clínicos ni ecográficos de alto riesgo.
2. Tratamiento con L-T4: actualmente no se recomienda la administración de L-T4 en enfermos con nódulo tiroideo, debido a que el mantenimiento de la concentración de TSH cerca del límite inferior de la normalidad se asocia a un riesgo mayor de osteoporosis en mujeres posmenopáusicas, así como también aumenta el riesgo de fibrilación auricular, en especial en enfermos >60 años. Considerar en situaciones muy excepcionales, únicamente en personas jóvenes, especialmente con leve aumento de la glándula tiroidea y nódulos de <3-4 cm de diámetro, y procurar mantener la concentración de TSH en el rango de 0,1-0,4 mUI/l. Si a lo largo de 6-12 meses el nódulo o el volumen del bocio no disminuyen → finalizar el tratamiento.
3. Inyección percutánea de etanol: produce una necrosis de la lesión, pudiendo disminuir significativamente el volumen de los nódulos solitarios. Ofrece buenos resultados en quistes y lesiones solido-quísticas. En estos casos, la frecuencia de recidiva tras un procedimiento eficaz es baja, si bien puede ser necesario repetir el procedimiento varias veces, en cuyo caso se requiere excluir el diagnóstico de cáncer con extrema meticulosidad. La inyección percutánea debe realizarse por un profesional experimentado y está justificada únicamente en los nódulos solitarios, incluidos los "pretóxicos" (autónomos en la gammagrafía, todavía sin elevación de FT4), y en caso de nódulos quísticos sintomáticos que recidivan tras su vaciamiento. No se justifica realizarla en nódulos tóxicos con hipertiroidismo clínico, ya que la frecuencia de las recidivas a largo plazo es alta.
4. Tratamiento con 131I. Indicaciones: edad >40-60 años, bocio grande >60 ml con contraindicaciones para la cirugía, tras excluir con meticulosidad el cáncer de tiroides y el riesgo de estenosis significativa de la vía aérea (considerar una administración preventiva de glucocorticoides). En general, se logra una disminución de volumen tiroideo en ~40 %, no obstante ~20 % de los enfermos no responde al tratamiento.
5. Técnicas de ablación percutánea: pueden ser una alternativa para la cirugía en caso de enfermos con nódulos tiroideos crecientes, grandes, sólidos, sin calcificaciones, que requieren tratamiento debido a los síntomas locales (compresión) y que no pueden someterse a una cirugía tradicional. Antes de usar estos métodos, es necesario excluir cáncer tiroideo.
1) Termoablación por ultrasonido focalizado de alta intensidad (HIFU): procedimiento que aplica un haz de ultrasonido de alta frecuencia, cuya energía produce calentamiento de tejidos nodulares hasta 85 ºC y desnaturalización de proteínas, realizado bajo control estricto ecográfico y con el uso de sistema especial de enfriamiento de la piel.
2) Ablación por radiofrecuencia: procedimiento con el que se aplican altas temperaturas al nódulo por medio de una punción, lo cual genera necrosis por coagulación del tejido nodular.
3) Ablación con láser: procedimiento que utiliza energía lumínica, en el que sobre el nódulo se posicionan fibras ópticas bajo control ecográfico. Provoca cambios en el tejido inducidos por un aumento local de la temperatura y, en consecuencia, una destrucción de una parte considerable del nódulo.
PronósticoArriba
Con una buena planificación junto con la PAAF, la posibilidad de que no se advierta la presencia de un nódulo maligno en un bocio multinodular es ≤5-10 %. Un nódulo benigno también puede aumentar de tamaño y causar síntomas de compresión. Además, existe un leve riesgo desarrollar hipertiroidismo →Hipertiroidismo y →fig. 9.2-1.
TABLAS Y FIGURAS
Clasificación EU-TIRADS para la evaluación ecográfica de lesiones focales de tiroides e indicaciones para biopsia a partir de la ETA (2017)
|
Clase
|
Tipo/carácter de lesiones
|
Riesgo de malignidad (%)
|
Indicaciones para biopsiaa
|
|
EU-TIRADS 1
|
Sin lesiones focales
|
0
|
No se recomienda
|
|
EU-TIRADS 2
|
– Focos anecoicos
– Focos sólido-líquidos de estructura espongiforme
|
Cerca de 0
|
No se recomienda (o únicamente con fines terapéuticos, p. ej. vaciamiento de quiste)
|
|
EU-TIRADS 3
|
– Iso- o hiperecogénicas
– Forma ovalada
– Márgenes lisos
– Sin signos ecográficos de riesgo de malignidad elevado
|
2-4
|
Lesión focal >20 mm
|
|
EU-TIRADS 4
|
– Hipoecogenicidad ligera
– Las demás características como en la clase 3
|
6-17
|
Lesión focal >15 mm
|
|
EU-TIRADS 5
|
Presencia de ≥1 de los siguientes factores de alto riesgo:
– lesión sólida con hipoecogenicidad marcada
– forma irregular, no ovalada (también "más alta que ancha")
– márgenes irregulares
– microcalcificaciones (<1 mm)
|
26-87
|
Lesión focal >10 mm (la presencia de ≥1 factor de riesgo es una indicación para PAAF)
|
|
a La decisión de realizar PAAF siempre debe tomarse de manera individual, teniendo en cuenta el contexto clínico (datos de la anamnesis y la exploración física, resultados de las exploraciones complementarias) y respetando la decisión del paciente. Se puede renunciar a la PAAF en caso de nódulos "calientes" en la gammagrafía sin factores clínicos de riesgo de malignidad.
PAAF — punción aspirativa con aguja fina
|
Categorías diagnósticas del examen citológico tiroideo según la clasificación de Bethesdaa
|
Categoría diagnóstica
|
Riesgo de cáncer de tiroides
|
Diagnósticos histopatológicos más frecuentes
|
Indicaciones para la siguiente PAAF
|
Manejo más recomendado
|
|
I — biopsia no diagnóstica o no satisfactoria
|
5-10 %b
|
Puede corresponder a cualquier categoría diagnóstica
|
Es necesario repetir la PAAF, normalmente a los 3-12 meses, dependiendo del riesgo. En caso de sospecha clínica de cáncer poco diferenciado es imprescindible continuar el procedimiento diagnóstico inmediatamente
|
Las indicaciones para la cirugía dependen del riesgo clínico de malignidad. La biopsia no diagnóstica es frecuente en quistes y tiroiditis
|
|
II — lesión benigna
|
<1 %b
(0-3 %)
|
– Bocio multinodular, incluidos los nódulos hiperplásicos y los nódulos coloideos
– Tiroiditis
|
Sí, solo cuando desde el principio en la ecografía se observan rasgos de riesgo de malignidad, cuando el aumento del tamaño del nódulo es de importancia clínica o cuando en la ecografía aparecen nuevos factores de riesgo
|
Conservador
|
|
III — lesión folicular indeterminada (FLUS) o atipias de significado incierto (AUS)
|
2,4-5,2 %
(6-18 %)b
|
Categoría usada solamente cuando no es posible obtener un diagnóstico citológico preciso
|
Sí
(a los 3-6 meses, dependiendo del riesgo)
|
Este diagnóstico por sí mismo constituye una indicación para considerar el tratamiento quirúrgico en caso de presencia de factores de riesgo importantes en la ecografía
|
|
IV — neoplasia folicular o sospecha de neoplasia folicularc
|
8,2-19 %
(10-40 %)b
|
Puede corresponder tanto a una lesión que no es neoplásica (en ≥25 % de los casos se trata de nódulos hiperplásicos o de tiroiditis) como a una neoplasia benigna que no se puede diferenciar de una neoplasia maligna en el examen citológico
|
No, pero si se planea una cirugía se necesita una confirmación diagnóstica por otro patólogo. En nódulos que requieren observación la siguiente PAAF se realiza a los 3-6 meses, dependiendo del riesgo
|
En los nódulos <1 cm de diámetro, si no presentan características de riesgo, se acepta el tratamiento conservador (bajo el control clínico y ecográfico estricto); en los nódulos más grandes y en caso de presencia de características de riesgo en general se necesita cirugía
|
|
V — sospecha de malignidad
|
75 % (45-60 %)b
|
Sospecha de carcinoma papilar tiroideo, carcinoma medular, metástasis en tiroides, linfoma, cáncer anaplásico o angiosarcoma
|
No, pero se necesita confirmación diagnóstica por otro patólogo
|
Tratamiento quirúrgico
|
|
VI — neoplasia maligna
|
≥95-100 % (94-96 %)b
|
Carcinoma papilar, carcinoma medular, linfoma, metástasis en tiroides, cáncer anaplásico, angiosarcoma u otro tipo de neoplasia maligna
|
No, pero se necesita confirmación diagnóstica por otro patólogo
|
Tratamiento quirúrgico
|
|
a A partir de: Cibas E.S., Ali S.Z., The Bethesda system for reporting thyroid cytopathology, Thyroid, 2017, 27: 1341-1346.
b Riesgo neoplásico que excluye casos de diagnóstico posoperatorio de neoplasia folicular de tiroides no invasiva con núcleos que se asemejan al carcinoma papilar, considerado actualmente como benigno según Cibas E.S., Ali S.Z., The Bethesda system for reporting thyroid cytopathology, Thyroid, 2017, 27: 1341-1346.
c En el diagnóstico "sospecha de neoplasia folicular" se incluye también la "sospecha de carcinoma de células de Hürthle" (antes "neoplasia oxifílica"), con mayor riesgo de malignidad (15-25%) y que más frecuentemente constituye una indicación inequívoca para la cirugía.
|
Tratamiento del nódulo tiroideo: ventajas y desventajas de las distintas opciones terapéuticas
|
Opción terapéutica
|
Desventajas
|
Ventajas
|
|
Cirugía (sospecha de malignidad, compresión de la tráquea)
|
Complicaciones de la cirugía (parálisis de cuerdas vocales, hipoparatiroidismo, hipotiroidismo) y necesidad de hospitalización
|
Resección del nódulo; remisión total de los síntomas; diagnóstico histológico
|
|
Tratamiento supresivo con levotiroxina
|
En la actualidad se utiliza raramente, ya que es ineficaz en la mayoría de los enfermos; larga duración; aumento del tamaño tras retirar la L-T4; riesgo de hipertiroidismo yatrogénico
|
Posible enlentecimiento del aumento del nódulo o posible prevención de la aparición de nuevos nódulos, principalmente <30 años
|
|
Inyección percutánea de etanol (nódulos subtóxicos, quistes simples)
|
Dificultad de evaluación citológica ulterior; necesidad de repetir las inyecciones; ineficaz en caso de nódulos grandes; intervención dolorosa; disfonía transitoria (1-2 %)
|
No conduce al hipotiroidismo; disminuye la recidiva de nódulos quísticos
|
|
Radioyodo (uso excepcional, casos de bocio multinodular no tóxico >60 ml, edad >40-60 años y contraindicaciones para la cirugía)
|
Disminución lenta del volumen del bocio; hipotiroidismo (un 10 % a los 5 años); tiroiditis posterior a la radiación (1-2 %); necesidad de prevenir el embarazo
|
Efectos secundarios leves; disminución del volumen del bocio en un 40 % a los 2 años
|
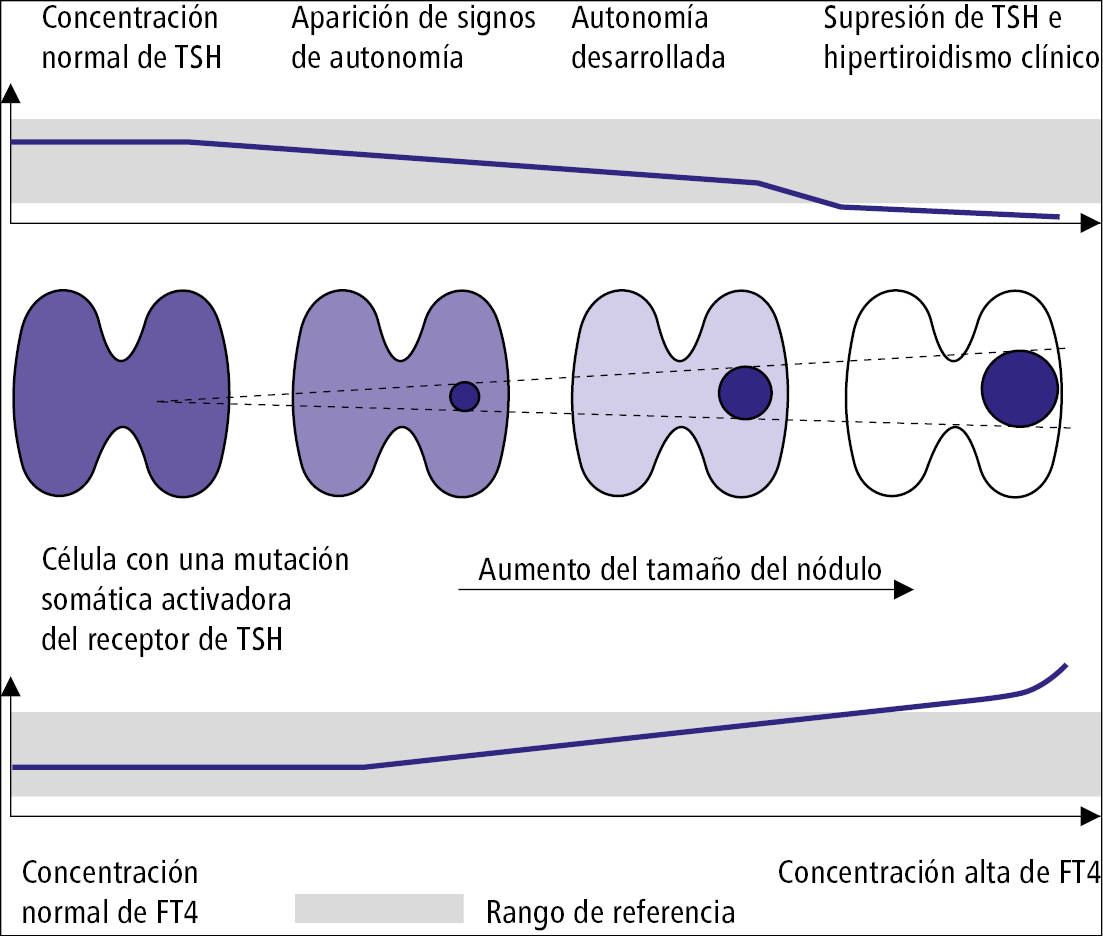
Fig. 9.2-1. Desarrollo del nódulo tiroideo autónomo
 Español
Español
 English
English
 українська
українська





