Definiciones y etiopatogeniaArriba
Cáncer de tiroides: neoplasia maligna que se origina principalmente en las células foliculares tiroideas o, mucho más raramente (~5 %) en las células C (parafoliculares, productoras de calcitonina).
Clasificación de cáncer de tiroides según la OMS (2022):
1) Neoplasias malignas derivadas de células foliculares:
a) carcinoma folicular de tiroides
b) carcinoma papilar, variante folicular encapsulada invasiva
c) carcinoma papilar de tiroides (13 subtipos), el más frecuente
d) carcinoma oncocítico de tiroides
e) carcinomas de células foliculares de alto grado de malignidad:
– carcinoma de tiroides diferenciado de alto grado de malignidad (papilar, folicular, oncocítico)
– carcinoma de tiroides pobremente diferenciado
f) carcinoma de células foliculares anaplásico (carcinoma escamoso tiroideo: considerado un subtipo de carcinoma anaplásico)
2) Carcinoma tiroideo derivado de células C (parafoliculares): carcinoma medular tiroideo
3) Carcinomas mixtos derivados de células foliculares y medular.
Además, la clasificación de la OMS distingue tumores benignos (adenomas) y neoplasias de bajo riesgo de células foliculares, que son tumores benignos o pueden progresar hacia el carcinoma de tiroides:
1) neoplasia tiroidea folicular no invasiva con núcleos de tipo papilar (NIFTP), que no requiere tratamiento, pero sí un control minucioso
2) tumor tiroideo bien diferenciado de potencial maligno incierto (WDT-UMP)
3) tumor folicular de potencial maligno incierto (FT-UMP).
En la clasificación de tumores tiroideos de la OMS (2022), las neoplasias de células oncocíticas derivadas de células foliculares (oncocitos y células oxifílicas; anteriormente células de Hürthle) pueden tener diverso grado de malignidad. Se distinguen: tumores benignos, es decir, el adenoma oncocítico de tiroides, y malignos, como carcinoma oncocítico de tiroides y carcinoma oncocítico de tiroides de alto grado de malignidad.
La clasificación de la OMS (2022) no considera microcarcinoma un subtipo de cáncer de tiroides, pero su diagnóstico tiene utilidad clínica. El término microcarcinoma se refiere únicamente a un cáncer papilar diagnosticado en un examen posoperatorio, cuando el foco de tumor ≤1 cm de diámetro y no se acompaña de metástasis ganglionares o a distancia.
Factores de riesgo de cáncer de tiroides: exposición a radiación ionizante, que es el único factor de riesgo comprobado de cáncer de tiroides (carcinoma papilar), especialmente si la exposición tuvo lugar en la infancia (p. ej. radioterapia para el tratamiento del linfoma de Hodgkin); déficit de yodo en el medio ambiente (en zonas con deficiencia de yodo aumenta la prevalencia del cáncer folicular); factores hereditarios (en ~25 % de los casos el cáncer medular tiroideo es hereditario, causado por una mutación germinal activadora del gen RET →Síndrome de neoplasia endocrina múltiple tipo 2 (MEN2)); oncogenes, p. ej. mutación activadora del gen BRAF (es la mutación somática más frecuente en el cáncer papilar de tiroides, en cuyo caso el pronóstico es un poco peor). Asimismo, pueden presentarse mutaciones somáticas del gen RET (en cáncer medular de tiroides), mutaciones del gen RAS (más frecuentes en el cáncer folicular).
El aumento de la incidencia de cáncer de tiroides puede deberse al creciente papel del diagnóstico ecográfico, el cual permite que cada vez más a menudo se detecten pequeñas alteraciones ecoestructurales asintomáticas. Existen dudas si estos casos de cáncer de tiroides son una verdadera amenaza para la vida del enfermo y si el diagnóstico de los mismos no resulta en un tratamiento innecesario. Por esta razón, la ATA y la ETA recomiendan no realizar biopsias de estos focos hasta que alcancen un diámetro de >10 mm →Nódulo tiroideo.
Cuadro clínico e historia naturalArriba
No es característico. Los nódulos malignos en la fase de desarrollo no se diferencian de los benignos, por lo que para el diagnóstico precoz debe realizarse una eco-PAAF, aunque este método no siempre permita distinguir las lesiones benignas de las malignas. La historia natural depende del tipo histológico. El crecimiento de los tumores diferenciados suele ser lento. Rara vez se detecta un rápido crecimiento de los nódulos, un aumento de la consistencia, adherencia a los tejidos subyacentes o ronquera (síntoma de infiltración del nervio laríngeo recurrente). Un aumento de tamaño brusco y visible del nódulo en la exploración física, con una infiltración extensa de las estructuras adyacentes, es uno de los signos más característicos de cáncer anaplásico (no diferenciado) de tiroides → el paciente debe derivarse inmediatamente al oncólogo. A veces la primera manifestación es la aparición de adenopatías yugulares metastásicas. Rara vez se diagnostica a partir de metástasis a distancia. La presencia de metástasis que no captan yodo es particularmente desfavorable. El dolor y la disnea son los primeros síntomas solo del cáncer no diferenciado. En el cáncer medular el síntoma característico, aunque infrecuente, es la diarrea (causada por una secreción excesiva de calcitonina y otras sustancias biológicamente activas). El desarrollo de los carcinomas medulares de tiroides no tratados es desfavorable, la enfermedad se disemina y por lo general los pacientes mueren en unos años. La presencia de cáncer anaplásico es particularmente grave, puesto que crece rápidamente, infiltra de manera extensa las estructuras adyacentes y conduce a la muerte en ≤6-12 meses.
DiagnósticoArriba
El diagnóstico definitivo del cáncer de tiroides se basa en exámenes posoperatorios: anatomopatológico e histológico (el diagnóstico establecido basándose en la eco-PAAF es preliminar). El diagnóstico del cáncer diferenciado se confirma también en la gammagrafía de cuerpo entero por la presencia de metástasis a distancia captadoras de yodo. No es posible diagnosticar el cáncer folicular basándose en un examen citológico, a no ser que el nódulo vaya acompañado de metástasis. El cáncer anaplásico (ATC) se origina a partir del cáncer de tiroides diferenciado o pobremente diferenciado, por lo que ambos a menudo coexisten en un solo tumor, y el ATC conserva las mismas mutaciones que el tumor primario, aunque sin características morfológicas de las células foliculares (por lo que en la descripción histológica se denomina como "cáncer no diferenciado"). El cáncer medular puede diagnosticarse con una alta probabilidad basándose en una elevada concentración sérica de calcitonina, que acompaña a un nódulo tiroideo.
Exploraciones complementarias
1. Pruebas de laboratorio:
1) Niveles séricos de TSH: con el fin de descartar las alteraciones de la función tiroidea y vigilar el tratamiento con L-T4 tras una tiroidectomía →más adelante.
2) Concentración sérica de Tg: un aumento después de una tiroidectomía total en el contexto de un cáncer indica persistencia de células tiroideas en el organismo (no tiene relevancia antes de la cirugía, pues la hipertiroglobulinemia a menudo acompaña a otras enfermedades tiroideas no neoplásicas). Es un marcador de la enfermedad persistente y de progresión de los carcinomas de tiroides diferenciados tras un tratamiento radical. Para interpretar el resultado es necesario determinar simultáneamente los anticuerpos anti-Tg utilizando el mismo método.
3) Anticuerpos anti-Tg: su presencia causa una falsa disminución de la concentración sérica de Tg en las pruebas de laboratorio inmunométricas o radioinmunométricas típicas, por lo que pueden producirse falsos negativos (más raramente falsos positivos). La presencia de anti-Tg es el problema más grave que limita la utilidad clínica de la determinación de Tg en la vigilancia de los enfermos con cáncer de tiroides. Tras un tratamiento compuesto de la tiroidectomía y la ablación con 131I, el tejido tiroideo residual anti-Tg normalmente desaparece en 3 años en pacientes sin enfermedad persistente. Una tendencia estable o decreciente de los niveles séricos de anti-Tg a lo largo del tiempo guarda relación con la remisión de la enfermedad, pero hasta que se consigan los valores de anti-Tg considerados negativos, no es posible clasificar al paciente en el grupo con respuesta excelente al tratamiento (→más adelante). El creciente aumento de anti-Tg sin lesiones sospechosas en las pruebas de imagen requiere que el enfermo se incluya en el grupo de pacientes con respuesta bioquímica incompleta, mientras que los niveles estables o decrecientes de anti-Tg en observación, sin lesiones sospechosas en las pruebas de imagen permite clasificar al paciente en el grupo de respuesta indeterminada al tratamiento.
4) Niveles séricos de calcitonina: muy elevados (>100 pg/ml) en un enfermo con un nódulo tiroideo confirman el diagnóstico del carcinoma medular; determinar en caso de sospecha de cáncer medular tiroideo (→Nódulo tiroideo). Otras posibles causas de niveles elevados de calcitonina: insuficiencia renal crónica, hiperparatiroidismo, tiroiditis autoinmune, leucemia, síndrome mieloproliferativo, síndrome de Zollinger-Ellison, carcinoma pulmonar microcítico.
5) Niveles séricos de calcio y de PTH: en caso de necesidad de diferenciar una lesión tiroidea focal hipoecogénica de localización periférica con un adenoma paratiroideo (la PAAF de la lesión y la medición de la PTH en el lavado de aguja tienen un alto valor diagnóstico).
2. Pruebas de imagen: ecografía de cuello (tiroides y ganglios linfáticos): las características ecográficas de un nódulo tiroideo no son patognomónicas de cáncer, pero algunas aumentan la sospecha de malignidad (indicaciones de eco-PAAF →Nódulo tiroideo); las adenopatías patológicas también se clasifican para la eco-PAAF o (más raramente) para la biopsia quirúrgica.
PERSPECTIVA LATINOAMERICANA
La ecografía de estadificación preoperatoria es fundamental en la estadificación del cáncer de tiroides y debe realizarse siempre antes de la cirugía o de la vigilancia activa, ya que permite modificar la conducta quirúrgica en un porcentaje significativo de casos.
Gammagrafía con 131I:
1) Tiroidea: es útil para el diagnóstico diferencial del nódulo tóxico o de la tiroiditis subaguda. La probabilidad de cáncer en caso de un nódulo no funcionante es la misma que en otros tipos de nódulo, mientras que en caso de nódulo autónomo solitario la probabilidad es menor (2 %).
2) De cuerpo entero: tiene gran importancia en la evaluación posoperatoria del estadio del cáncer diferenciado de tiroides. La identificación de focos de captación a nivel del esqueleto o de los pulmones casi siempre equivale a diagnosticar metástasis (se detectan incluso micrometástasis, no identificables con otros métodos radiológicos). Radiografía de tórax: puede evidenciar metástasis pulmonares. TC del cuello y de mediastino superior: indicada en enfermedad localmente avanzada con el fin de evaluar la idoneidad del tratamiento quirúrgico, así como en caso de sospecha de metástasis. En el cáncer diferenciado, antes de un tratamiento planificado con radioyodo, la administración de medios de contraste yodados está contraindicada, ya que puede reducir la captación de yodo por metástasis del cáncer de tiroides y reducir la eficacia del tratamiento isotópico.
3. Exámenes morfológicos: examen citológico →Nódulo tiroideo y →tabla 9.4-3. Un rasgo característico de los cánceres diferenciados es la expresión de Tg en células (en la inmunohistoquímica). Para el diagnóstico del cáncer medular y del linfoma se necesitan datos clínicos y exploraciones inmunohistoquímicas adicionales, que no se incluyen en los exámenes rutinarios. Examen intraoperatorio: permite diagnosticar el bocio no neoplásico, cáncer papilar, cáncer medular y cáncer no diferenciado. El riesgo de deformación mecánica de la lesión antes de ser fijada constituye una limitación importante. No permite distinguir inequívocamente entre adenoma y carcinoma folicular, por lo que no se recomienda en caso de diagnóstico citológico de "sospecha de neoplasia folicular". Examen histológico: en el resultado deben indicarse con precisión el tipo y variedad del cáncer tiroideo, así como los datos relativos al tamaño del tumor y su clasificación según TNM. Es la prueba más importante en el diagnóstico de cáncer de tiroides e influye en el tratamiento empleado. Sobre la base de sus resultados y teniendo en cuenta tales factores, como el grado de resección del tumor, cantidad de focos neoplásicos, extensión extratiroidea, angioinvasión, número y tamaño de los ganglios linfáticos afectados, concentración sérica de Tg después de la cirugía y la presencia de metástasis a distancia, se estima el riesgo de recidiva (→más adelante y →tabla 9.5-1).
4. Otras pruebas diagnósticas:
1) exploración laringológica (antes y después de la cirugía): evaluación de la movilidad de las cuerdas vocales
2) niveles séricos de calcio: evaluación de la función de las glándulas paratiroides tras una tiroidectomía total.
TratamientoArriba
Las diferencias en el tratamiento de los cánceres diferenciados, cáncer medular y cáncer no diferenciado se deben a la distinta biología de cada una de estas neoplasias, y se refieren principalmente al manejo posoperatorio. Respecto al cáncer papilar o folicular de tiroides, la clasificación de la ATA (2015) del cáncer diferenciado de tiroides, basada en el riesgo estimado de recurrencias, distingue cáncer de riesgo bajo, moderado y alto (→tabla 9.5-1). Se actualiza la estadificación del cáncer en las siguientes etapas de diagnóstico y tratamiento, lo que permite acomodar hasta cierto punto la intensidad del tratamiento empleado al riesgo de recurrencia en cada enfermo. Clasificación de la respuesta al tratamiento de carcinoma papilar o folicular de tiroides en los enfermos tras una tiroidectomía total y un tratamiento posoperatorio con 131I (o sin este tratamiento) según la ATA (2015) y las guías de las Sociedades Científicas Polacas y la Estrategia Oncológica Nacional (PTN-NSO 2022) →tabla 9.5-2.
Tratamiento del cáncer papilar y folicular
Tratamiento quirúrgico
1. Cáncer diagnosticado antes de la cirugía (independientemente del tamaño del foco neoplásico). Está indicada la tiroidectomía total extracapsular realizada en un centro especializado, en ocasiones junto a linfadenectomía de las cadenas ganglionares centrales, y en caso de metástasis yugulares laterales, también lateral del cuello.
Las guías de las PTN-NSO (2022) admiten excepciones en cuanto a la tiroidectomía total en caso de cánceres de bajo riesgo de recurrencia:
1) Lobectomía de un lóbulo con el istmo en carcinoma papilar limitado a la tiroides y diámetro de ≤1 cm en cT1a (microcarcinoma) y de ≤2 cm en grado cN0M0 (sin metástasis ganglionares y a distancia), cuando no hay indicaciones evidentes de tiroidectomía total, y el equipo que trata al paciente obtuvo su consentimiento para proceder de esta manera (si la lesión es solitaria y se cumplen los siguientes criterios: ausencia de antecedentes de exposición a radiación ionizante, localización favorable del foco, ausencia de sospecha de infiltración de los tejidos adyacentes en la ecografía, falta de antecedentes familiares de cáncer de tiroides, y exclusión de la presencia de metástasis ganglionares). En casos seleccionados de cáncer de tiroides primario (carcinoma papilar ≤1 cm, cT1aN0M0), de recidivas estructurales locales y/o ganglionares y de metástasis a distancia solitarios puede considerarse el uso de técnicas de termoablación mínimamente invasivas en centros especializados.
2) Renuncia al tratamiento quirúrgico y vigilancia activa en casos seleccionados de diagnóstico preoperatorio de cáncer papilar en grado cT1aN0M0 ante una lesión solitaria de bajo riesgo (de ≤1 cm de diámetro, foco único, bien delimitado, lesión rodeada de un margen de ≥2 mm de tejido tiroideo sano, sin signos de invasión extratiroidea, sin metástasis ganglionares y a distancia), tras conseguir el consentimiento del paciente. El protocolo de vigilancia activa incluye la realización de ecografía cada 6 meses durante los primeros 2 años, y luego 1 × año. Si se observa progresión (aumento de tamaño del tumor ≥3 mm o metástasis ganglionares), es necesario derivar al paciente para el tratamiento quirúrgico.
2. Cáncer diagnosticado después de la cirugía: en general está indicada la tiroidectomía total secundaria de la parte restante de tiroides; la intervención debe realizarse a los pocos días de la cirugía, o transcurridos 2-3 meses, tras la cicatrización de los tejidos. Asimismo, está indicado realizar una linfadenectomía de las cadenas ganglionares centrales y, en caso de metástasis yugulares laterales, también de las cadenas ganglionares laterales.
En la actualidad se intenta limitar la frecuencia de la tiroidectomía secundaria en caso de observar un pequeño foco solitario de cáncer diferenciado de tiroides a partir del material obtenido durante una cirugía realizada por indicaciones distintas a las oncológicas, cuando una reintervención no proporcionará beneficios importantes para el enfermo y no cambiará el pronóstico. Es posible renunciar a la cirugía en los siguientes casos:
1) microcarcinoma o carcinoma de bajo riesgo: carcinoma papilar monofocal de ≤2 cm de diámetro (pT1), tras descartar metástasis ganglionares y a distancia
2) carcinoma papilar de >2 cm, pero ≤4 cm de diámetro, limitado a la tiroides (pT2), cuando los residuos posoperatorios de ambos lóbulos, evaluados mediante ecografía, tienen un volumen ≤1 ml en cada uno de sus lados, y los datos disponibles indican la radicalidad completa de la cirugía y el bajo riesgo asociado al cáncer
3) carcinoma papilar de mayor grado, si la cirugía radical no es posible o no será beneficiosa para el enfermo (sobre todo en cánceres pobremente diferenciados y no diferenciados)
4) carcinoma folicular mínimamente invasivo de ≤1 cm de diámetro (pT1a), clasificado de manera individual por un equipo multidisciplinar tras acordarlo con el paciente, diagnosticado tras una lobectomía total o una tiroidectomía subtotal, sin metástasis a distancia y ganglionares.
La decisión quirúrgica debe estar tomada por un equipo multidisciplinar formado en cada unidad especializada en el tratamiento de cáncer de tiroides. Este equipo tiene que presentar su decisión al paciente, teniendo en cuenta la voluntad del mismo y asegurar la adecuada vigilancia.
Tratamiento con yodo radioactivo (radioyodo; 131I)
El tratamiento se administra óptimamente en el período desde >4 semanas hasta en general ≤3 meses tras la tiroidectomía (cuando se inicia a los 9-12 meses desde la cirugía se trata de una terapia retardada) usando, como procedimiento de elección, la tirotropina recombinante (rhTSH administrada en 2 inyecciones IM en un intervalo de 24 h) para la estimulación exógena de TSH. Si no es posible, antes de administrar el radioyodo interrumpir el tratamiento con L-T4 durante 4-6 semanas (estimulación endógena de TSH) hasta alcanzar niveles de TSH>30 mUI/l. Antes del tratamiento con radioyodo se deben evitar la administración de preparados con yodo y las exploraciones con contrastes yodados. Medidas de precaución →Hipertiroidismo. Según las recomendaciones de la ATA, el tratamiento con radioyodo debe estar limitado a los casos de cáncer de alto riesgo de recidiva. También las PTN-NSO (2022) permiten desistir del tratamiento rutinario con radioisótopos en enfermos del grupo de bajo riesgo después de la cirugía radical, si su respuesta al tratamiento es excelente.
PERSPECTIVA CHILENA
En Chile en el manejo del cáncer diferenciado de tiroides se utiliza el Protocolo Clínico. Cáncer Diferenciado de Tiroides. Programa de Cáncer del Adulto 2020.
La decisión sobre el tratamiento con radioyodo debe realizarse en un comité ad-hoc. Se utiliza excepcionalmente en los pacientes de bajo riesgo, debe considerarse caso a caso en los de riesgo moderado y debe realizarse siempre en los de alto riesgo de recidiva.
El uso de la rhTSH en Chile es limitado debido a su alto costo.
Tipos de tratamiento en función de la estadificación de la enfermedad:
1) Adyuvante: indicado tras la tiroidectomía total en pacientes con carcinoma papilar o folicular sin metástasis a distancia. El objetivo del tratamiento es la eliminación del tejido tiroideo residual después de la cirugía (ablación tiroidea), así como la destrucción de las células neoplásicas residuales clínicamente indetectables (en el lecho tiroideo, en los ganglios linfáticos y no visibles a distancia). La aplicación de la terapia con radioyodo en cáncer de tiroides de bajo riesgo es controvertida.
2) Radical: tras la tiroidectomía total por cáncer diferenciado si se encuentran metástasis a distancia captadoras de yodo, p. ej. pulmonares.
3) Paliativo: en caso de tumor primario no resecable, recurrencia local no resecable, o en presencia de metástasis a distancia que acumulan yodo de manera insuficiente para que la dosis de energía absorbida ocasione la eliminación completa. El objetivo del tratamiento es disminuir el tamaño y frenar el crecimiento del cáncer, aliviando los síntomas, p. ej. el dolor en caso de metástasis óseas.
Tratamiento con L-T4 del cáncer diferenciado de tiroides
En pacientes con cáncer de tiroides, el tratamiento con L-T4 por un lado suplementa las deficiencias hormonales (tratamiento de reemplazo), y por otro disminuye el riesgo de recidivas (tratamiento supresivo). Utilizar dosis de L-T4 que permitan la disminución de los niveles de TSH sérica y los mantengan en un rango deseado. Es necesario tomar en cuenta el riesgo de complicaciones de tratamiento supresivo crónico (efecto perjudicial de exceso de tiroxina sobre el corazón y los huesos). En los últimos años las indicaciones de tratamiento supresivo se han atenuado significativamente: se debe utilizar solo en enfermos del grupo de alto riesgo o en aquellos sin respuesta excelente al tratamiento (→fig. 9.5-1). Se debe recomendar la supresión completa de TSH (niveles de TSH <0,1 mUI/l) a los enfermos con alto riesgo de recidiva, con síntomas clínicos y persistentes de la enfermedad neoplásica, o en enfermos sin características de la enfermedad clínica, pero con respuesta bioquímica incompleta (→tabla 9.5-2), si no hay contraindicaciones de este tratamiento.
Si se ha conseguido una remisión completa después del tratamiento primario (sin signos de enfermedad en pruebas de imagen y concentración de Tg <1 µg/l tras la estimulación con TSH), en los enfermos de alto riesgo deben recomendarse las dosis un poco más bajas de L-T4 que permitan mantener la TSH dentro del rango 0,1-0,5 mUI/l (supresión de TSH incompleta).
Se debe considerar renunciar a la supresión de TSH e iniciar el tratamiento de reemplazo, si después de finalizar la terapia el riesgo de recidiva de cáncer es muy bajo (en enfermos con una respuesta excelente al tratamiento: con niveles bajos de tiroglobulina en la prueba de estimulación y ausencia de anticuerpos anti-Tg, con una remisión de ≥5 años →fig. 9.5-1), y también en enfermos del grupo de riesgo más bajo (pT1a N0M0).
Se debe evitar el aumento de la concentración de TSH >2 mUI/l en todos los pacientes después de un tratamiento de cáncer de tiroides, con excepción de períodos cortos cuando la estimulación de TSH es necesaria para realizar pruebas de control.
En cáncer de tiroides pobremente diferenciado es suficiente una suplementación normal de la deficiencia hormonal. Igualmente, los enfermos con cáncer medular de tiroides tras la tiroidectomía total requieren solamente una dosis de sustitución de L-T4 hasta alcanzar la concentración objetivo de TSH entre 0,4-2,0 mUI/l.
La variabilidad en las dosis de L-T4 es muy alta y depende de la masa corporal magra. Empezar con una dosis de 1,5-2 µg/kg y continuar modificándola cada 6-8 semanas, basándose en la concentración de TSH determinada en ayunas antes de ingerir la siguiente dosis de fármaco. Una vez establecida la dosis correcta, las ulteriores modificaciones de la dosis suelen ser pequeñas (de 10-15 µg/d) y los controles de niveles de TSH se realizan con menor frecuencia (cada 3-6 meses).
Tratamiento del cáncer de tiroides resistente a la terapia con radioyodo
Sin contar los casos de cáncer no diferenciado, las metástasis a distancia afectan a <10 % de los enfermos con cáncer de tiroides. Entre ellos, un 60-70 % (es decir, <5 % de todos los enfermos) son casos refractarios al tratamiento con radioyodo. A este grupo pertenecen con más frecuencia los cánceres poco diferenciados. También algunos cánceres diferenciados y carcinomas oncocítico de tiroides (anteriormente de células de Hürthle) durante la progresión de la enfermedad pierden la capacidad de captar yodo y, en algunos casos, incluso la capacidad de producir Tg (los denominados cánceres indiferenciados de tiroides), lo que es un factor de mal pronóstico. Tras agotar las posibilidades de tratamiento con radioyodo, se emplean (sobre todo en el ámbito de ensayos clínicos o programas de tratamiento farmacológico) los inhibidores de la tirosina-cinasa de acción antiangiogénica. Al planificar el tratamiento, se toman en consideración los síntomas y signos generales, grado de compresión de la tráquea o del esófago, intensidad de los síntomas provocados por metástasis óseas, pulmonares y/o cerebrales, así como la influencia de la enfermedad en la vida cotidiana del enfermo. La 18FDG PET-TC permite valorar la biología de la neoplasia: una captación alta de glucosa en los focos neoplásicos es un factor de mal pronóstico. En el tratamiento en primer lugar se considera la posibilidad de emplear técnicas locorregionales (radioterapia externa, metastasectomía, ablación térmica percutánea o ablación con etanol, cementoplastia de metástasis óseas). La terapia sistémica con inhibidores de la tirosina-cinasa no se aplica hasta detectar la enfermedad metastásica progresiva.
Tratamiento del cáncer medular
La tiroidectomía total con linfadenectomía es fundamental, a pesar de lo cual, en el ~50 % de los casos no se llega a la normalización de niveles séricos de calcitonina por la existencia de micrometástasis en otros ganglios linfáticos o a distancia, como en el hígado. Tras la tiroidectomía total no se necesita un tratamiento supresivo, bastan dosis de L-T4 de restitución hasta alcanzar niveles de TSH entre 0,4-2,0 mUI/l. En la terapia del cáncer medular de tiroides agresivo, sintomático, no resecable, localmente avanzado o metastático se pueden emplear inhibidores de la tirosina-cinasa, como vandetanib o cabozantinib. Los nuevos inhibidores selectivos de la cinasa RET (selpercatinib y pralsetinib) abren nuevas posibilidades de tratamiento. Debido a una alta probabilidad de enfermedad hereditaria (→Síndrome de neoplasia endocrina múltiple tipo 2 (MEN2)), siempre se debe evaluar la presencia de la mutación germinal del protooncogén RET en el ADN aislado de los linfocitos de sangre periférica. Antes de la resección tiroidea también debe excluirse la coexistencia de feocromocitoma suprarrenal. Si se demuestra que un familiar de 1.er grado es portador de la mutación, está indicada la tiroidectomía profiláctica debido al alto riesgo de aparición de cáncer medular.
Tratamiento del cáncer no diferenciado (anaplásico)
El progreso de la enfermedad es tan rápido que en la mayoría de los casos el diagnóstico se establece en un estadio no resecable. No es posible el tratamiento con 131I (las células del tumor no captan yodo). Se recurre a la radioterapia externa o quimioterapia, aunque se trata también de medidas poco eficaces. En la terapia sistémica de los enfermos con cáncer anaplásico y mutación V600E del gen BRAF se sugiere administrar dabrafenib con trametinib. En enfermos sin mutación del gen BRAF confirmada, el tratamiento de elección es la quimioterapia con taxanos y doxorrubicina. Tras la tiroidectomía por cáncer anaplásico no se aplica un tratamiento supresivo, siendo suficiente una suplementación normal de la deficiencia hormonal.
VigilanciaArriba
La clasificación del riesgo de recidiva de carcinoma papilar y folicular de tiroides incluye la valoración macroscópica del tumor en el material posoperatorio, la presencia y el tipo de metástasis, el tipo histológico de cáncer y los resultados de la gammagrafía, lo que permite determinar si el riesgo es bajo, moderado o alto →tabla 9.5-1. Tras el tratamiento primario del cáncer de tiroides diferenciado se realiza una constante estratificación del riesgo (durante cada visita). Se toman en consideración la edad y el sexo del enfermo, el resultado del examen histológico, la extensión de la cirugía y la evaluación de la respuesta al tratamiento (→tabla 9.5-2). Esta última determina la frecuencia y la extensión de las pruebas de control y la necesidad de tratamiento ulterior (→fig. 9.5-1).
En el caso de pacientes que han sido sometidos a una lobectomía de un lóbulo con el istmo, la interpretación de los niveles séricos de Tg y de anti-Tg no es fácil → se debe evaluar sobre todo la dinámica de los cambios en los niveles de Tg en el tiempo. El marcador de la remisión clínica propuesto para este grupo de enfermos es una tendencia estable o decreciente de la concentración sérica de Tg durante la remisión clínica de la enfermedad. También se ha propuesto el punto de corte de los niveles de Tg para determinar la respuesta excelente al tratamiento de <30 ng/ml (→tabla 9.5-2). Por su parte, la elevación persistente de los niveles de Tg requiere pruebas diagnósticas más específicas para descartar la recurrencia de cáncer.
PronósticoArriba
El cáncer papilar en estadio de microcarcinoma es totalmente curable. En los tumores <4 cm, la supervivencia a 10 años es de un 90-95 % de los casos; mientras que en el cáncer con infiltraciones extensas de los tejidos adyacentes es de solo ~60 %. En un 5 % de los enfermos el diagnóstico se establece tardíamente y a pesar del tratamiento, solo la mitad de los casos alcanza una supervivencia de 10 años. En los casos de metástasis pulmonares captadoras de yodo se puede conseguir la remisión completa. Si todavía no son visibles en pruebas radiológicas, la probabilidad de curación puede alcanzar el 80 %. En caso de metástasis óseas, el pronóstico es considerablemente peor, incluso si captan yodo. En el cáncer folicular, la tasa de supervivencia a los 10 años suele ser ~10 % más baja. El tiempo medio de supervivencia en los cánceres indiferenciados se reduce hasta 3-5 años. El pronóstico en los cánceres diferenciados de tiroides es significativamente mejor en enfermos jóvenes (<55 años en el momento del diagnóstico de cáncer). El riesgo de recurrencia es mayor en los primeros 5 años, si bien hay que tenerlo en cuenta durante toda la vida. Por este motivo los enfermos requieren un seguimiento constante en los centros donde se ha realizado el tratamiento. Con el tiempo, los controles pueden ser menos frecuentes (cada 5-10 años). Actualmente se utiliza una constante estratificación del riesgo, basada en la respuesta al tratamiento administrado. No hay datos que confirmen el aumento en la supervivencia en enfermos tratados con inhibidores de tirosina-cinasa, sin embargo se prolonga de manera significativa el tiempo hasta la progresión de la enfermedad. El desarrollo del cáncer tiroideo no diferenciado (anaplásico) constituye una amenaza grave, ya que el tumor crece rápidamente y puede provocar una muerte repentina por asfixia. La mayoría de los enfermos que reciben tratamiento agresivo muere por metástasis a distancia (en los pulmones, huesos y/o cerebro) a los 1-2 años desde el diagnóstico.
TABLAS Y FIGURAS
Tratamiento del nódulo tiroideo: ventajas y desventajas de las distintas opciones terapéuticas
|
Opción terapéutica
|
Desventajas
|
Ventajas
|
|
Cirugía (sospecha de malignidad, compresión de la tráquea)
|
Complicaciones de la cirugía (parálisis de cuerdas vocales, hipoparatiroidismo, hipotiroidismo) y necesidad de hospitalización
|
Resección del nódulo; remisión total de los síntomas; diagnóstico histológico
|
|
Tratamiento supresivo con levotiroxina
|
En la actualidad se utiliza raramente, ya que es ineficaz en la mayoría de los enfermos; larga duración; aumento del tamaño tras retirar la L-T4; riesgo de hipertiroidismo yatrogénico
|
Posible enlentecimiento del aumento del nódulo o posible prevención de la aparición de nuevos nódulos, principalmente <30 años
|
|
Inyección percutánea de etanol (nódulos subtóxicos, quistes simples)
|
Dificultad de evaluación citológica ulterior; necesidad de repetir las inyecciones; ineficaz en caso de nódulos grandes; intervención dolorosa; disfonía transitoria (1-2 %)
|
No conduce al hipotiroidismo; disminuye la recidiva de nódulos quísticos
|
|
Radioyodo (uso excepcional, casos de bocio multinodular no tóxico >60 ml, edad >40-60 años y contraindicaciones para la cirugía)
|
Disminución lenta del volumen del bocio; hipotiroidismo (un 10 % a los 5 años); tiroiditis posterior a la radiación (1-2 %); necesidad de prevenir el embarazo
|
Efectos secundarios leves; disminución del volumen del bocio en un 40 % a los 2 años
|
Clasificación de riesgo de recurrencia de cáncer papilar o folicular de tiroides a partir de la ATA (2015) y las guías polacas de las PTN-NSO (2022)
|
Cáncer de bajo riesgo
|
Cáncer papilar con todas las siguientes características:
– ausencia de metástasis locales y a distancia
– tumor totalmente extirpado en la evaluación macroscópica
– ausencia de infiltraciones extratiroideas
– el tipo histológico del cáncer no es agresivo (como p. ej. de células altas, de células columnares, de células en tachuela)
– ausencia de acumulación de 131I fuera del lecho tiroideo en la gammagrafía posterapéutica tras el primer tratamiento (si se aplicó)
– ausencia de invasión vascular
– ganglios linfáticos: clínicamente N0 o ≤5 micrometástasis ganglionares (<0,2 cm en su dimensión máxima)
Carcinoma folicular bien diferenciado de tiroides con invasión de la cápsula: sin invasión vascular o <4 focos de invasión vascular
Microcarcinoma papilar de tiroides, uni- o multifocal, también con la presencia de la mutación BRAF
|
|
Cáncer de riesgo moderado
|
Infiltración extratiroidea microscópica
Acumulación de 131I en el cuello fuera del lecho tiroideo en la gammagrafía posterapéutica tras el primer tratamiento
Subtipo histológico agresivo
Cáncer papilar con invasión vascular
Clínicamente N1 o >5 ganglios invadidos (0,2-3 cm)
Cáncer papilar multifocal con infiltración extratiroidea y presencia de mutación BRAF
|
|
Cáncer de alto riesgo
|
Extensa infiltración extratiroidea
Resección incompleta del tumor
Metástasis a distancia
Alta concentración posoperatoria de Tg, sugerente de metástasis a distancia
Presencia de adenopatías metastásicas >3 cm en su dimensión máxima
Cáncer folicular con una extensa invasión vascular (>4 focos de invasión vascular)
|
|
PTN-NSO — Sociedades Científicas Polacas y Estrategia Nacional de Oncología
|
Clasificación de la respuesta al tratamiento de carcinoma papilar o folicular de tiroides en los enfermos tras una tiroidectomía total y un tratamiento posoperatorio con 131I (o sin este tratamiento) a partir de la ATA (2015) y las guías polacas de las PTN-NSO (2022)
|
Respuesta excelente
|
– resultados normales de las pruebas de imagen
y
– Tg (supresión) <0,2 µg/l
o
– Tg (estimulación) <1 µg/l (<2 µg/l en caso de enfermos no tratados con 131I)
y
– niveles indetectables de anti-Tg
|
|
Respuesta bioquímica incompleta
|
– resultados normales de las pruebas de imagen
y
– Tg (supresión) >1 µg/l (>5 µg/l en caso de enfermos no tratados con 131I)
o
– Tg (estimulación) >10 µg/l (en caso de enfermos no tratados con 131I, niveles crecientes de Tg durante la observación, con niveles comparables de TSH)
o
– niveles crecientes de anticuerpos anti-Tg
|
|
Respuesta estructural incompleta
|
– presencia de la enfermedad persistente identificada en las pruebas de imagen
– independientemente de los niveles de Tg y de anti-Tg
|
|
Respuesta indefinida
|
– resultados no concluyentes de las pruebas de imagen
o
– pequeña captación de 131I en el lecho tiroideo
o
– Tg sin estimulación 0,2-1 µg/l (0,2-5 µg/l en caso de enfermos no tratados con 131I)
o
– Tg tras estimulación 1-10 µg/l (2-10 µg/l en caso de enfermos no tratados con 131I)
o
– concentración de anticuerpos anti-Tg estable o decreciente sin objetivar focos en las pruebas de imagen
|
|
anti-Tg — anticuerpos antitiroglobulina, 131I — radioyodo, PTN-NSO — Sociedades Científicas Polacas y Estrategia Nacional de Oncología, Tg — tiroglobulina, TSH — tirotropina
A partir de las recomendaciones de las PTN-NSO (2022); la clasificación de la respuesta al tratamiento en pacientes con cáncer de tiroides diferenciado tras una lobectomía y no tratados con 131I se presenta por separado →tabla 3 en Cáncer de tiroides.
|
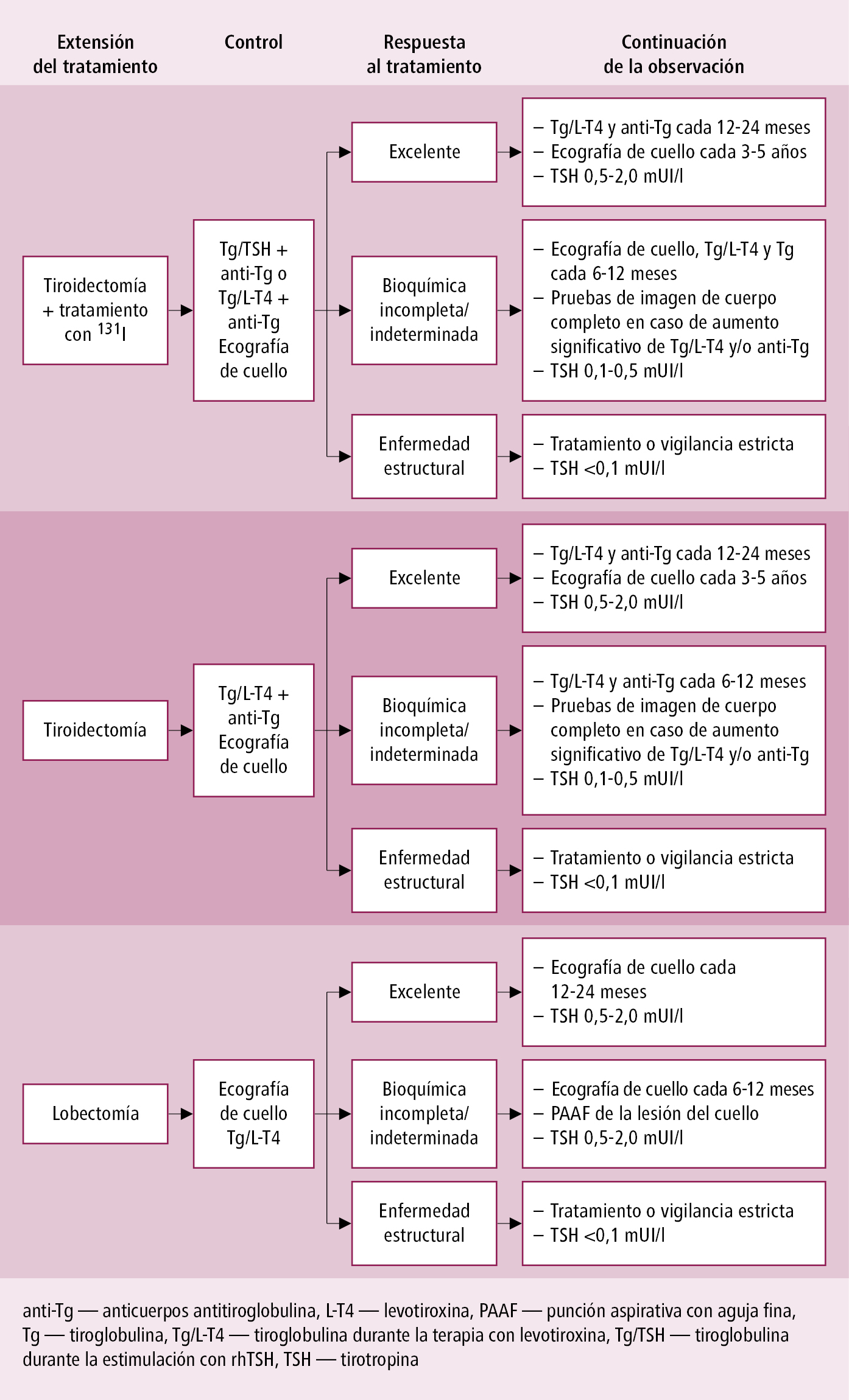
Fig. 9.5-1. Principios de vigilancia de cáncer de tiroides diferenciado de bajo riesgo y niveles objetivo de TSH sérica, en función de la respuesta al tratamiento obtenida (a partir de: European Journal of Endocrinology 182, 5; 10.1530/EJE-19-0960, modificado)
 Español
Español
 English
English
 українська
українська





