DEFINICIÓN Y ETIOPATOGENIAArriba
La pancreatitis aguda es un proceso inflamatorio agudo debido a la activación precoz de proenzimas pancreáticas (principalmente tripsina), que puede comprometer con una gravedad variable tanto a tejidos regionales como a órganos a distancia. Causas: principalmente colelitiasis y consumo de alcohol (en conjunto responsables de ~80 % de los casos), idiopáticas (~10 %), yatrogénicas (colangiopancreatografía retrógrada endoscópica [CPRE]), hipertrigliceridemia (la causa más probable en caso de triglicéridos plasmáticos >1000 mg/dl [11,3 mmol/l]), hiperparatiroidismo, fármacos (glucocorticoides, tiacidas, azatioprina), defectos congénitos (páncreas divisum), traumatismo abdominal, posquirúrgicas; muy raramente infecciones virales (Coxsackie, parotiditis, CMV, VIH), parásitos (ascariasis), factores genéticos (p. ej. mutaciones del gen SPINK1 codificador de inhibidor propio de tripsina, fibrosis quística), enfermedades autoinmunes sistémicas (LES, síndrome de Sjögren). Se diferencian 2 tipos de pancreatitis aguda:
1) pancreatitis edematosa-intersticial: en un 80-90 % de los enfermos; sin necrosis del parénquima pancreático ni de tejidos peripancreáticos; se evidencia un aumento difuso (raramente localizado) del volumen pancreático, difuminación de los bordes del páncreas y/o de los tejidos peripancreáticos; pueden presentarse colecciones líquidas agudas peripancreáticas
2) pancreatitis necrotizante: necrosis del parénquima pancreático y/o de los tejidos peripancreáticos.
PERSPECTIVA LATINOAMERICANA
En Argentina y Colombia la etiología biliar es la causa más frecuente de PA, seguida del consumo de alcohol. En Colombia, el 5,1 % de los casos se debe a los traumatismos y el 1,3 % a la ascariasis; tras descartar estas causas, en las primeras horas deben tenerse en cuenta la hipercalcemia y la hipertrigliceridemia.
CUADRO CLÍNICO E HISTORIA NATURALArriba
1. Síntomas y signos: dolor abdominal (el síntoma más importante, aparece de forma súbita, es intenso, se localiza en epigastrio o hipocondrio izquierdo, a veces irradiado al dorso), náuseas y vómitos que no alivian los síntomas, fiebre (frecuente; la cronología de su aparición es importante para determinar su causa y significado clínico: durante la 1.a semana es resultado de un SRIS y remite con la reducción de la reacción inflamatoria, en las semanas 2.a y 3.a suele deberse a infección de tejidos necróticos), disminución o ausencia de ruidos intestinales (íleo paralítico), distensión abdominal, dolor a la palpación epigástrica, resistencia abdominal dolorosa a la palpación profunda (en algunos casos de pancreatitis aguda grave; debida a la extensión de la necrosis y a los infiltrados peripancreáticos), alteración del nivel de conciencia (manifestación de shock en desarrollo, hipoxemia y endotoxemia; el conjunto de manifestaciones con trastornos de desorientación y ansiedad puede ser expresión de una encefalopatía pancreática), taquicardia (frecuente), hipotensión (suele deberse a hipovolemia), a veces shock (10 %), ictericia (en un 20-30 % de los enfermos, sobre todo en casos de enfermedad biliar obstructiva), con menos frecuencia manifestaciones cutáneas (enrojecimiento o cianosis facial y de extremidades, equimosis periumbilical [signo de Cullen], o a nivel lumbar [signo de Grey Turner], que en la pancreatitis aguda grave cursa con shock), derrame pleural (~40 % de los casos; de predominio izquierdo).
2. Historia natural: la fase aguda suele durar 1 semana, pudiendo prolongarse hasta 2 semanas. Se considera fase tardía de la pancreatitis aguda al período comprendido entre varias semanas a varios meses desde el comienzo, con similares manifestaciones a una pancreatitis aguda moderada o grave.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Pruebas de laboratorio:
1) alteraciones típicas: elevación de las enzimas pancreáticas (normalmente >3 × LSN):
a) lipasa en suero (mayor sensibilidad y especificidad en el diagnóstico de pancreatitis aguda)
b) amilasa en suero y orina: después de 48-72 h la actividad en sangre suele normalizarse a pesar de persistir la enfermedad; se mantiene elevada la actividad de la amilasa total en orina, y la isoenzima pancreática en sangre
2) indicadores de gravedad y de aparición de complicaciones: leucocitosis con desviación izquierda, elevación de la proteína C-reactiva (se correlaciona bien con la gravedad, sobre todo en las primeras 48-72 h), elevación de procalcitonina (PCT; se relaciona bien con la gravedad y con el riesgo de desarrollar fallo orgánico e infección de los tejidos necróticos), elevación sérica de nitrógeno ureico (BUN) o de creatinina (puede indicar una insuficiente reposición hídrica en la fase precoz o empeoramiento de la función renal, y es un factor independiente de mortalidad), marcadores bioquímicos de daño hepático (hiperbilirrubinemia, elevación de ALT, AST, ALP y GGT, que sugieren una etiología biliar), elevación de LDH, hipoalbuminemia, poliglobulia (por deshidratación [vómitos] y exudado [tercer espacio]) o anemia (por sangrado), hipoxemia, hiperglucemia, hipertrigliceridemia, hipocalcemia.
2. Pruebas de imagen. Ecografía abdominal: prueba de elección, aunque a menudo no se consigue visualizar el páncreas (gas intestinal, obesidad). En pancreatitis aguda, aumento del volumen pancreático con bordes mal definidos y ecogenicidad del parénquima disminuida e irregular; pueden encontrarse cálculos biliares y complicaciones de la pancreatitis (p. ej. colecciones). La ecografía con refuerzo de contraste intravenoso permite visualizar necrosis del parénquima pancreático. La TC con contraste permite evaluar lesiones en la cavidad abdominal (grados A-D), sobre todo la presencia y la extensión de la necrosis pancreática: índice tomográfico de gravedad (índice CTSI de la clasificación de Balthazar →tabla 5.1-1). No realizar de manera rutinaria en pacientes con un diagnóstico obvio, en los que la enfermedad cursa de forma benigna y sin complicaciones. Realizar la TC si el estado del paciente no mejora en 48-72 h (p. ej. por persistencia del dolor, fiebre, náuseas e imposibilidad de nutrición enteral), para detectar complicaciones locales, tales como necrosis pancreática. La TC, realizada los días 5.º-7.º del comienzo, permite la valoración óptima de la extensión de la necrosis. La prueba se realiza de forma inmediata en enfermos en estado crítico o en los que requieren una intervención quirúrgica urgente. Repetir el examen en caso de empeoramiento, insuficiencia orgánica progresiva, o manifestaciones de sepsis, entre la 2.a y la 4.a semana del comienzo de la enfermedad para identificar las complicaciones peripancreáticas locales. Transcurridas 4 semanas, se debe realizar la TC abdominal, si no mejora el estado del enfermo. En este caso, es útil para determinar la indicación y tipo de intervención quirúrgica. La RMN se realiza en caso de contraindicaciones para la TC y para diferenciar las colecciones abdominales (se aconseja realizarla transcurridas 4 semanas desde el inicio de la enfermedad, antes del tratamiento quirúrgico en enfermos con pancreatitis aguda necrótica y colecciones sintomáticas y persistentes). Radiografía de tórax: puede presentar atelectasia basal, derrame pleural (sobre todo izquierdo), SDRA. Radiografía de abdomen: puede presentar niveles hidroaéreos o dilatación de asas intestinales (signos del íleo paralítico →Íleo paralítico). CPRM: empleada en casos dudosos en la fase aguda de la enfermedad; principalmente para el diagnóstico de colelitiasis y valoración del conducto pancreático en presencia de colecciones/quistes y fístulas en la fase tardía de la enfermedad.
3. Ecoendoscopia: prueba de preferencia para identificar el agente etiológico en personas con antecedentes de pancreatitis aguda o con formas recurrentes idiopáticas, si los exámenes realizados hasta el momento no han podido confirmarla. Permite diagnosticar microlitiasis biliar (cálculos <5 mm), tumores en la cabeza de páncreas y anomalías en el conducto pancreático.
Criterios diagnósticos
Cumplimiento de 2 de 3 criterios:
1) cuadro clínico típico (dolor epigástrico de comienzo brusco, a menudo con irradiación hacia el dorso)
2) enzimas pancreáticas séricas >3 × LSN
3) resultados de las pruebas de imagen (ecografía abdominal, TC con contraste o eventualmente RMN) típicos de pancreatitis aguda.
Algoritmo diagnóstico →fig. 5.1-1.
Valoración de la gravedad y pronóstico
1. Clasificación clínica de Atlanta (2012):
1) pancreatitis aguda leve: ausencia de fracaso orgánico y de complicaciones locales y sistémicas
2) pancreatitis aguda moderada: insuficiencia orgánica transitoria (<48 h), complicaciones locales (colección líquida peripancreática aguda, pseudoquiste, necrosis, colección necrótica aguda, necrosis pancreática encapsulada) o sistémicas (p. ej. exacerbación de la cardiopatía isquémica o de la enfermedad pulmonar crónica) sin fallo orgánico persistente
3) pancreatitis aguda grave: se caracteriza por la presencia de insuficiencia orgánica persistente (>48 h) y generalmente por la aparición de ≥1 complicación local. Definiciones de insuficiencia orgánica (escala de Marshall modificada) →tabla 5.1-2. Cuando la insuficiencia orgánica aparece en las primeras 24 h tras la hospitalización y no se puede valorar si va a ser transitorio o persistente, hay que clasificar y tratar al paciente inicialmente como en pancreatitis aguda grave. Repetir la valoración de la gravedad a las 24 h, 48 h y 7 días del ingreso.
2. Marcadores clínicos de riesgo de desarrollo de pancreatitis aguda grave en el momento del ingreso:
1) edad >55 años
2) obesidad (IMC >30 kg/m2)
3) alteraciones de la conciencia
4) etiología alcohólica
5) comorbilidades
6) SRIS →tabla 19.9-1
7) alteraciones de laboratorio:
a) BUN >20 mg/dl (urea 7,14 mmol/l [42,86 mg/dl]) o elevación
b) Hto >44 % o elevación
c) elevación de creatinina sérica
8) anomalías detectadas en las pruebas de imagen:
a) derrame pleural
b) infiltrados pulmonares
c) colecciones múltiples o extensas.
3. Otros. Escala BISAP: ≥3 ptos. (presencia en las primeras 24 h de: BUN >25 mg/dl [8,93 mmol/l], alteraciones de la conciencia, SRIS, edad >60 años y derrame pleural; 1 pto. por cada característica) indica la presencia de pancreatitis aguda; índice CTSI →tabla 5.1-1, escala APACHE II. La magnitud de la elevación de las enzimas pancreáticas en sangre y orina no tiene valor pronóstico.
Diagnóstico diferencial
Perforación digestiva (úlcera gástrica o duodenal, perforación intestinal), apendicitis aguda, isquemia intestinal aguda, aneurisma aórtico disecante, embarazo ectópico, infarto agudo de miocardio (sobre todo de cara inferior).
TRATAMIENTOArriba
En la fase aguda comprende sobre todo una hidratación intravenosa intensiva, control del dolor y soporte nutricional (tras una interrupción inicial de la vía enteral). Otras intervenciones dependen de la gravedad y de la aparición de complicaciones.
Algoritmo de tratamiento de la pancreatitis aguda →fig. 5.1-2.
Tratamiento conservador
1. Procedimiento inicial:
1) En las primeras 12-24 h, en todos los casos sin enfermedad cardiovascular ni renal concomitante, hidratación intensiva iv. → infusión de solución de electrólitos isotónica (p. ej. solución Ringer lactato; se prefieren soluciones equilibradas →Fluidoterapia intravenosa) 250-350 ml/h, controlando mediante parámetros clínicos y bioquímicos el estado hemodinámico con un objetivo de diuresis >0,5-1 ml/kg/h, presión arterial media (MAP) 65-85 mm Hg, frecuencia cardíaca <120/min; nitrógeno ureico (BUN) <20 mg/dl (si es mayor, reducir en ≥5 mg/dl dentro de las primeras 24 h), Hto 35-44 %. Monitorizar los requerimientos de fluidos dentro de las primeras 6 h desde el ingreso y durante las siguientes 24-48 h. En enfermos con hipovolemia grave (hipotensión, taquicardia) puede ser necesaria una hidratación más acelerada (en bolo). En fase temprana de pancreatitis aguda se sugiere implementar la estrategia de hidratación moderada (infusión de líquidos iv. 1,5 ml/kg/h, precedida por un bolo iv. 10 ml/kg solo en enfermos con hipovolemia), puesto que una hidratación intensiva iv. no controlada conlleva el riesgo de hiperhidratación y puede afectar los resultados terapéuticos.
2) Corregir inmediatamente los posibles trastornos electrolíticos, sobre todo hipopotasemia.
3) Hematocrito <25 % → transfundir concentrados de hematíes para lograr valores del 30-35 %.
4) Hiperglucemia >13,9 mmol/l (250 mg/dl) → utilizar insulina.
2. Manejo del dolor: usar metamizol iv. 1,0 g en caso de emergencia; en caso de un dolor más intenso emplear opioides, p. ej. tramadol VSc. o iv. 50 mg cada 6-8 h o buprenorfina iv. 0,2-0,6 mg cada 6 h. Un método recomendado por su buen efecto analgésico y mejoría del flujo sanguíneo visceral es la analgesia epidural continua a nivel Th4-L1 con bupivacaína (10 ml del preparado al 0,25 %, posteriormente infusión 5 ml/h).
3. Tratamiento nutricional: en caso de la pancreatitis aguda leve no está recomendado, si no hay datos de desnutrición. Tras ceder el dolor, se puede iniciar la ingesta oral de alimentos pobres en grasa. En los enfermos hemodinámicamente estables con pancreatitis aguda moderada o grave se recomienda iniciar de forma precoz la alimentación oral (dentro de las primeras 24 h desde el diagnóstico; posibles causas para retrasar el inicio de la nutrición: dolor abdominal persistente, vómitos u obstrucción); en caso de intolerancia administrar nutrición enteral. En los enfermos hemodinámicamente inestables con pancreatitis aguda grave emplear nutrición enteral después de 24-48 h, si es posible, y en caso de necesidad complementar con nutrición parenteral.
1) Nutrición enteral completa por sonda nasoyeyunal (en los enfermos hemodinámicamente inestables, con grandes colecciones peripancreáticas que comprimen el estómago y el duodeno, con hipertensión intraabdominal >15 mm Hg, con antecedentes de trastornos motores o de cirugía reconstructiva del tracto digestivo superior, y en casos de intolerancia a la nutrición intragástrica), o por sonda nasogástrica; emplear dietas elementales, semielementales y poliméricas; infusión continua (durante 24 h o con descanso nocturno de 4 h), inicialmente 10-20 ml/h, progresivamente (2-4 días) aumentar la dosis hasta 500-2000 ml/d (máx. 100 ml/h). Complicaciones: raras y leves (movilización u obstrucción de la sonda, diarrea, náuseas y distensión abdominal provocada por una administración del preparado demasiado rápida).
2) Nutrición parenteral completa: usar solo cuando no se puede iniciar la nutrición enteral. Comenzar después de 24-48 h, tras la estabilización del estado hemodinámico. Es necesaria la observación y corrección de los trastornos metabólicos (hipo- e hiperglucemia, hipocalcemia, hipo- e hiperpotasemia, hipofosfatemia, hipomagnesemia y trastornos del equilibrio ácido-base). Suspender inmediatamente, si es posible la nutrición enteral.
4. Antibioticoterapia: no utilizar prevención antibiótica de rutina en la pancreatitis aguda grave, ni antibioticoterapia en enfermos con necrosis pancreática estéril para prevenir su infección. Los antibióticos están indicados para el tratamiento de la necrosis pancreática infectada (→Complicaciones) y de infecciones extrapancreáticas: colangitis, infección de catéter, bacteriemia, infecciones de tracto urinario, neumonías. No utilizar de rutina antifúngicos asociados con antibióticos.
Tratamiento invasivo
1. CPRE con esfinterotomía: indicada en las primeras 24 h en la colangitis obstructiva aguda. En caso de obstrucción persistente de la vía biliar realizar la CPRE en las primeras 72 h de hospitalización (para eliminar los cálculos biliares; prevención de la pancreatitis aguda pos-CPRE: diclofenaco en supositorio y una correcta hidratación durante el período perioperatorio). Innecesaria en la mayoría de los pacientes con pancreatitis aguda biliar sin datos de laboratorio o clínicos de obstrucción biliar persistente. En ausencia de datos de colangitis y/o ictericia, pero con sospecha fundada de cálculos de conducto biliar, realizar el diagnóstico mediante ecoendoscopia o CPRM.
2. Colecistectomía: si no hay contraindicaciones se debe realizar en casos de pancreatitis aguda biliar leve antes del alta hospitalaria. En los casos de pancreatitis aguda biliar grave se realiza la colecistectomía tras la remisión de la inflamación activa y reabsorción o estabilización de las colecciones (normalmente después de 6-8 semanas).
3. Tratamiento de la pancreatitis necrótica: el tratamiento invasivo está indicado en caso de infección confirmada de la necrosis pancreática y/o de los tejidos peripancreáticos. También debe considerarse en las siguientes situaciones:
1) sospecha clínica de infección de la necrosis con insuficiencia orgánica persistente, o con insuficiencia orgánica que se desarrolla varias semanas después del inicio de la pancreatitis aguda a pesar de un tratamiento conservador óptimo
2) necrosis estéril con compresión de órganos regionales (estómago, intestino, vía biliar) que causen obstrucción, o con dolor persistente (tener en cuenta el elevado riesgo de infección secundaria).
El tratamiento quirúrgico debe realizarse pasadas >4-6 semanas desde el inicio de la pancreatitis aguda, cuando la necrosis está ya bien delimitada. En primer lugar, drenaje de la necrosis encapsulada endoscópico (guiado por ecoendoscopia) o percutáneo, si su localización lo permite. En ausencia de mejoría, dependiendo de la localización de la necrosis → necrosectomía endoscópica o intervención quirúrgica mínimamente invasiva (mejor que la clásica extirpación quirúrgica de los tejidos necróticos).
VIGILANCIAArriba
En casos de pancreatitis aguda grave es necesaria una vigilancia estrecha:
1) control horario de la presión arterial, el pulso y el balance hídrico
2) gasometría arterial y electrólitos cada 6 h
3) exploración física cada 12 h
4) control de las enzimas pancreáticas, hemograma, TP, TTPa, función renal, proteína C-reactiva, proteínas totales, albúmina, y si fuera necesario, perfil glucémico de 24 h diariamente
5) valoración de la disfunción orgánica según la escala de Marshall diariamente durante los primeros 7 días
6) ecografía o TC: periódicamente
7) PAAF de los tejidos necróticos guiada por TC, valoración de los niveles de procalcitonina en sangre: si se sospecha de infección.
En los casos de pancreatitis aguda grave con necrosis, evaluar la función pancreática exocrina y endocrina cada 6 meses durante los 18 meses siguientes a la recuperación.
COMPLICACIONESArriba
1. Colección líquida aguda peripancreática (acute peripancreatic fluid collection, APFC): aparece precozmente, a menudo en las primeras 24-48 h de la pancreatitis aguda intersticial-edematosa. Carece de pared propia bien definida en ecografía o TC. Su contenido es exclusivamente líquido. Se desarrolla por rotura de los conductos pancreáticos o por acumulación de exudado inflamatorio. Suele reabsorberse en las primeras 4 semanas y raramente se convierte en pseudoquiste.
2. Pseudoquiste: APFC que no se ha reabsorbido en 4 semanas. La pared del pseudoquiste suele estar formada por una cápsula de tejido conjuntivo tapizado de tejido granular, y puede estar delimitada por órganos contiguos: estómago, intestino, páncreas. Al igual que el APFC, su contenido es material líquido.
3. Colección necrótica aguda (acute necrotic collection, ANC): se desarrolla en la fase temprana de la pancreatitis aguda necrótica, puede reabsorberse por completo (cuando la necrosis engloba <30 % de la glándula), o resolverse gradualmente formando una cápsula. Contenido variable de material sólido (restos de tejido necrosado): rasgo diferencial entre ANC y APFC y pseudoquistes. Puede infectarse. La RMN, ecoendoscopia y ecografía abdominal son las pruebas más útiles para el diagnóstico diferencial.
4. Necrosis encapsulada (walled-off necrosis, WON): ANC persistente y madura, con una cantidad variable de contenido líquido y mezclas de material sólido, rodeada de una pared gruesa que disminuye la probabilidad de resorción espontánea. Suele desarrollarse ≥4 semanas desde el comienzo de la pancreatitis aguda necrotizante. Puede ser asintomática o producir dolor abdominal, obstrucción mecánica del duodeno y/o de la vía biliar.
5. Infección de la necrosis pancreática y de los tejidos peripancreáticos: suele aparecer en la 3.ª semana, la mortalidad alcanza el 50 %. Sospechar infección en enfermos con necrosis pancreática o de los tejidos peripancreáticos que empeoran o no mejoran en 7-10 días de hospitalización. Diagnóstico: imagen característica en la TC, pero la PAAF percutánea guiada por TC es el mejor método (tinción de Gram del aspirado y cultivo con antibiograma). Está permitida también la antibioticoterapia empírica (sin realizar biopsia) iv.: carbapenem (doripenem, ertapenem, imipenem con cilastatina 1 g cada 8 h o meropenem 1 g cada 8 h) o quinolona (ciprofloxacina 200 mg cada 12 h, moxifloxacina, levofloxacina 500 mg cada 24 h iv., o pefloxacina con metronidazol 500 mg cada 8 h. Suele ser necesario el tratamiento quirúrgico →más arriba; en algunos enfermos estables se puede prorrogar el tratamiento invasivo o no realizarlo, siempre y cuando estén estrictamente vigilados.
6. Fístulas y síndrome del ducto pancreático desconectado (SDPD): las fístulas se producen por la rotura del conducto pancreático, que provoca salida del jugo pancreático al exterior de los conductos pancreáticos, y la formación de colecciones agudas y, si la fuga persiste, la creación del pseudoquiste. La degradación de su pared puede provocar comunicaciones con cavidades corporales (es decir, fístula pleural [y en su consecuencia derrame pleural] o peritoneal [con ascitis pancreática]), o con el tracto digestivo (p. ej. estómago, duodeno, intestino grueso). Las manifestaciones dependen del tamaño de la fístula, su localización y el lugar con el que está conectada. Puede ser asintomática o causar dolor abdominal, náuseas, vómitos, aumento del perímetro abdominal, y en caso de fístula pleural tos, disnea y dolor torácico. Una complicación rara es una desconexión completa del ducto pancreático, es decir, el síndrome del ducto pancreático desconectado, que se presenta en el curso de necrosis pancreática, en el que todo el jugo pancreático creado distalmente al lugar de desconexión fuga a la cavidad abdominal. Diagnóstico: la CPRM es el mejor método para evaluar la anatomía del conducto pancreático. Tratamiento: en la etapa temprana terapia coadyuvante, para limitar la respuesta inflamatoria generalizada y la disfunción orgánica, la nutrición enteral y las técnicas endoscópicas (drenaje de colecciones); las fístulas pueden cerrarse espontáneamente. En caso del fracaso del tratamiento endoscópico del SDPD, puede ser necesaria la resección de la parte del páncreas desconectada, con autotrasplante de islotes.
7. Complicaciones vasculares:
1) Hipertensión portal prehepática, producida por la compresión u obstrucción de la vena esplénica o mesentérica superior.
2) Sangrado o aparición del pseudoaneurisma por erosión directa de las arterias y venas pancreáticas o peripancreáticas. La rotura del pseudoaneurisma es causa de hemorragia masiva, con sangrado hacia la luz del pseudoquiste, peritoneo, espacio retroperitoneal o hacia el tubo digestivo. En caso de la comunicación del pseudoaneurisma con el conducto pancreático puede producirse un sangrado duodenal a través de la ampolla de Vater.
3) Trombosis de la vena o arteria esplénica o vena porta →Trombosis de la vena porta.
Diagnóstico: TC, RMN, ecografía Doppler, angiografía selectiva del tronco celíaco (permite detener el sangrado activo o cierre del pseudoaneurisma). Dependiendo de la localización, puede ser necesario el tratamiento quirúrgico.
8. Complicaciones orgánicas: tempranas por el SRIS (→Sepsis y shock séptico):
1) Shock →Shock.
2) SDRA →Insuficiencia respiratoria aguda.
3) LRA →Lesión renal aguda.
4) CID →Coagulación intravascular diseminada.
5) Sepsis →Sepsis y shock séptico.
6) Síndrome compartimental abdominal: hipertensión intraabdominal persistente >20 mm Hg asociada a disfunción/fracaso de órgano de nueva aparición. Causas: edema pancreático y visceral, ascitis, íleo paralítico y perfusión de un gran volumen de líquidos. Síntomas: astenia, dolor y distensión abdominal, disnea, vértigo (los enfermos suelen estar en un estado clínico tan grave que no consiguen comunicar los síntomas). Signos: normalmente aumento del perímetro abdominal con abdomen a tensión, edemas periféricos, hipotensión, taquicardia, disnea, distensión de venas yugulares, oliguria progresiva, manifestaciones de hipoperfusión (piel fría, ansiedad, confusión). Pruebas de laboratorio: rasgos de insuficiencia respiratoria aguda y acidosis láctica. Diagnóstico: medir la presión intraabdominal mediante un catéter intravesical especial. Tratamiento: analgésicos y sedación, descompresión del tracto digestivo (colocando sonda nasogástrica y/o rectal), balance hídrico neutro o negativo; suspensión o limitación de la nutrición enteral, drenaje percutáneo de la ascitis y otras colecciones; en enfermos en ventilación mecánica eventualmente administrar miorrelajantes; en caso de ineficacia se procede a la descompresión quirúrgica.
TABLAS Y FIGURAS
Grados de la pancreatitis aguda e índice tomográfico de gravedad (CTSI)
|
Grado en TC
|
|
Puntuación
|
|
A
|
Imagen normal
|
0
|
|
B
|
Cambios inflamatorios limitados al páncreas
|
1
|
|
C
|
Cambios inflamatorios en páncreas y en tejidos peripancreáticos
|
2
|
|
D
|
Cambios inflamatorios más acentuados que abarcan tejidos peripancreáticos y 1 colección líquida peripancreática mal delimitada
|
3
|
|
E
|
Múltiples y extensas colecciones líquidas extrapancreáticas o una colección líquida infectada
|
4
|
|
Necrosis: no existe — 0 ptos., 1/3 del parénquima pancreático — 2 ptos., 1/2 — 4 ptos., >1/2 — 6 ptos.
CTSI (0-10 ptos.) = puntuación TC + puntuación necrosis; un resultado ≥7 ptos. pronostica evolución grave y elevado riesgo de muerte.
|
Escala de Marshall modificada
|
Sistema
|
Puntuación
|
|
0
|
1
|
2
|
3
|
4
|
|
Respiratorio (PaO2/FiO2)
|
>400
|
301-400
|
201-300
|
101-200
|
<101
|
|
Renal (creatinina sérica, µmol/l)a
|
<134
|
134-169
|
170-310
|
311-439
|
>439
|
|
Cardiovascular (presión arterial sistólica, mm Hg)b
|
>90
|
<90
respuesta a la reposición hídrica
|
<90
falta de respuesta a la reposición hídrica
|
<90,
pH <7,3
|
<90,
pH <7,2
|
|
Resultado ≥2 para cualquier sistema supone insuficiencia orgánica.
a La puntuación en enfermos con insuficiencia renal crónica existente depende del grado de empeoramiento de la función renal basal; no se dispone de métodos para calcular la concentración de creatinina de partida ≥134 µmol/l (1,4 mg/dl).
b Sin asistencia inotrópica.
A partir de: Gut, 2013, 62: 102-111
|

Fig. 5.1-3. Actuación en caso de sospecha de infección de la necrosis pancreática (a partir de las guías del ACG, modificado)
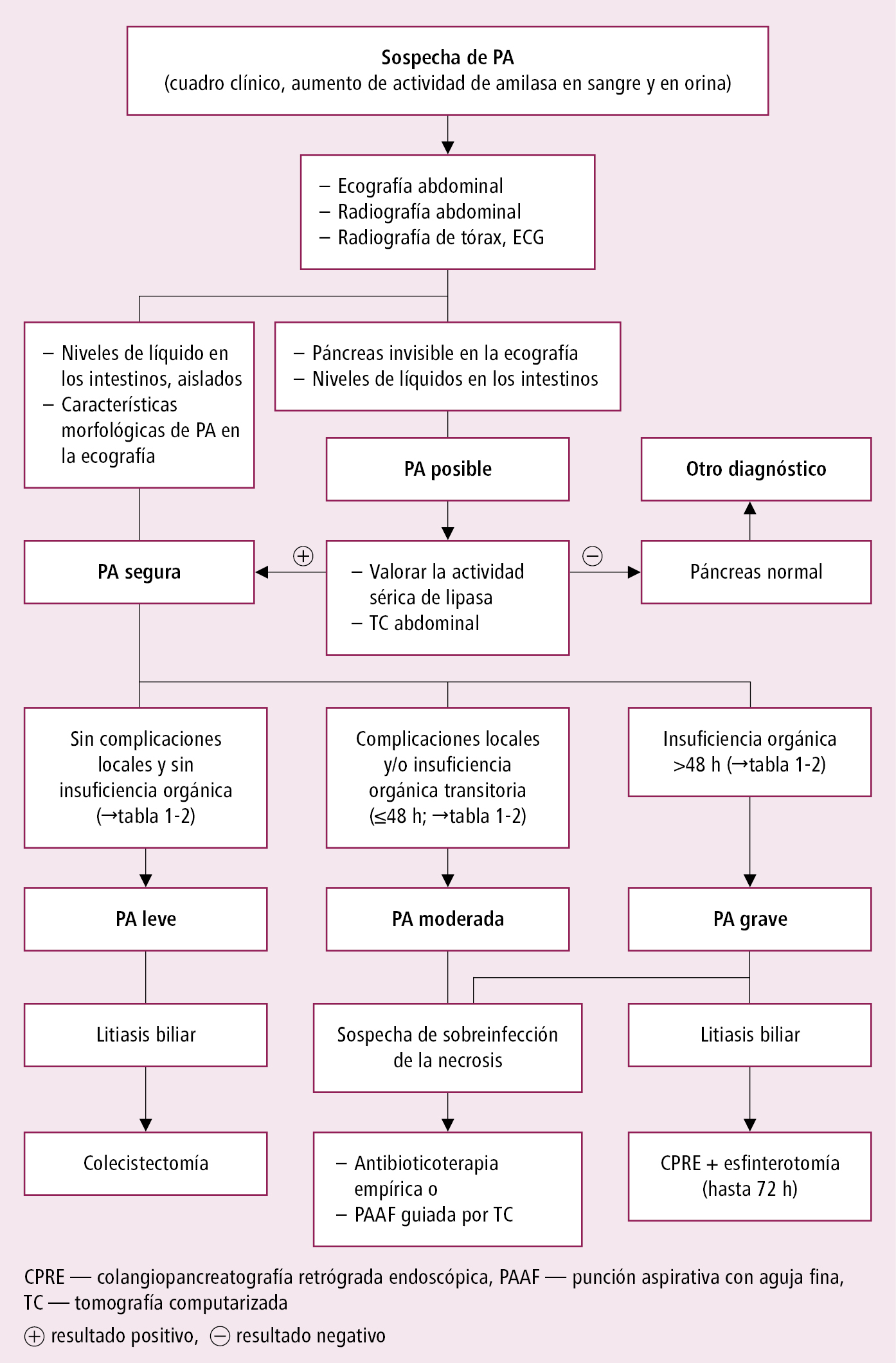
Fig. 5.1-1. Algoritmo diagnóstico de la pancreatitis aguda (PA)
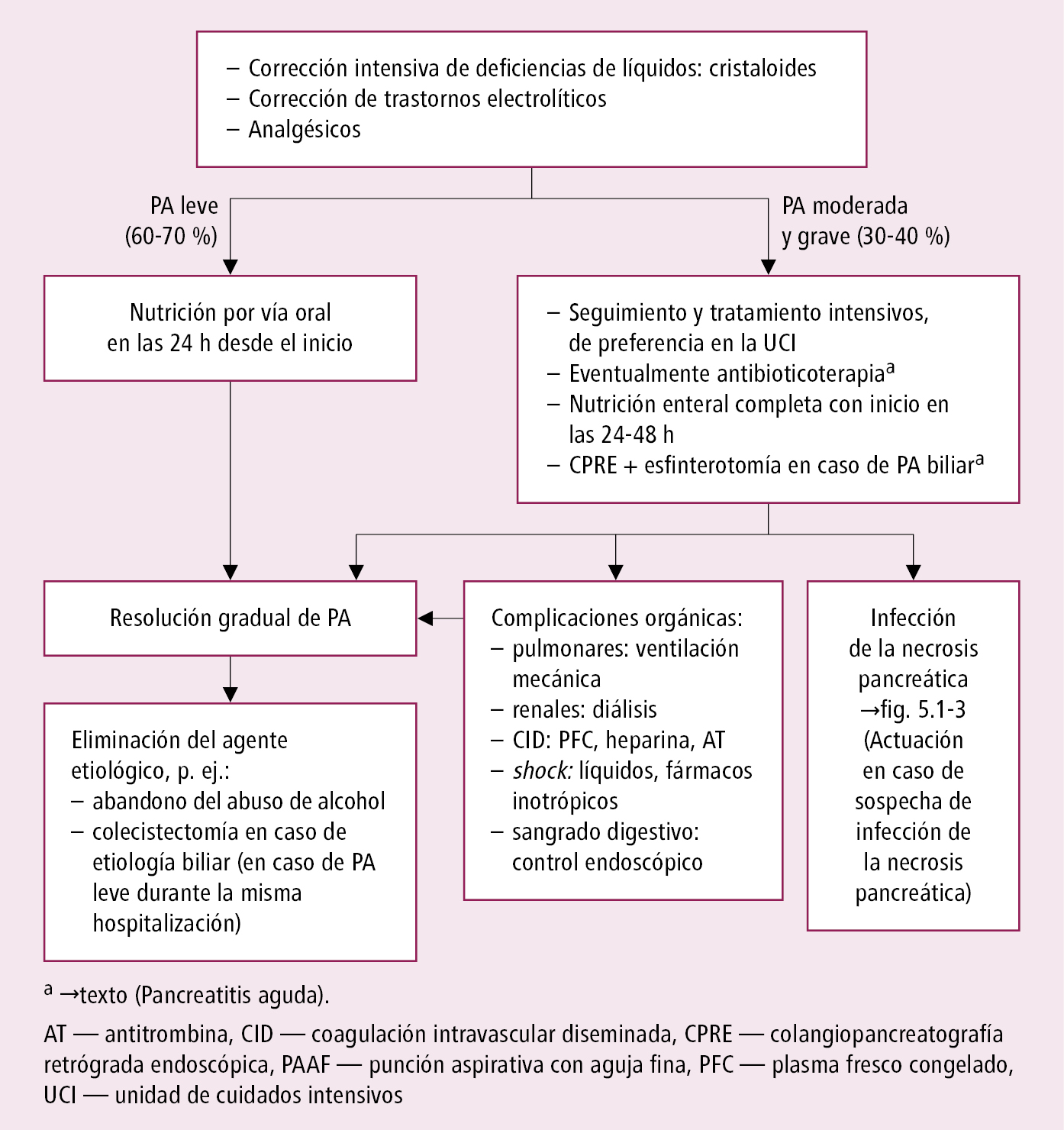
Fig. 5.1-2. Algoritmo de tratamiento de la pancreatitis aguda (PA)
Definiciones y criterios diagnósticos de sepsis y shock séptico
|
Definiciones y criterios
|
Anteriores (1991, 2001)
|
Actuales (2016)
|
|
Sepsis
|
SRIS secundario a una infección
|
Disfunción orgánica potencialmente mortal causada por una respuesta anómala del sistema a la infección. Dicha respuesta origina un daño tisular y orgánico (corresponde al concepto anterior de “sepsis grave”)
|
|
Sepsis grave
|
Sepsis causante de insuficiencia o disfunción grave de órganos (o de sistemas →más adelante); corresponde a la “sepsis” en la nueva nomenclatura
|
Su equivalente es “sepsis” según se define más arriba
|
|
Criterios diagnósticos de alteraciones de la función sistémica u orgánica
|
Utilizados para el diagnóstico de sepsis grave (→tabla 2)
|
Utilizados para el diagnóstico de sepsis: aumento súbito del resultado en la escala SOFA en ≥2 ptos. (→tabla 3)a, en presencia o sospecha de infección
|
|
Shock séptico
|
Forma grave de sepsis con insuficiencia circulatoria aguda, que se caracteriza por hipotensión persistente (presión arterial sistólica <90 mm Hg, presión media <65 mm Hg o reducción de la presión sistólica en >40 mm Hg), a pesar de una apropiada reposición con fluidos y que por lo tanto requiere la administración de fármacos vasoconstrictores
|
Sepsis, en la que los trastornos de los sistemas cardiovascular, metabólico y a nivel celular son tan profundos que aumenta de manera significativa la mortalidad.
Se diagnostica si, a pesar de una reposición con fluidos adecuada, se mantiene:
1) una hipotensión que requiera la administración de fármacos vasoconstrictores con el fin de conseguir una presión arterial media de ≥65 mm Hg y
2) una concentración de lactato sérico >2 mmol/l (18 mg/dl)
|
|
Escala propuesta para la identificación temprana de enfermos con riesgo de muerteb
|
No se ha precisado. Se han utilizado tanto los criterios SRIS como de las alteraciones de la función orgánica y los criterios ampliados de diagnóstico de sepsis que abarcan dichas alteraciones (→tabla 4)
|
Resultado en la escala QuickSOFA (qSOFA): ≥2 de los siguientes síntomas y signos
1) alteraciones de la concienciac
2) presión sistólica ≤100 mm Hg
3) frecuencia respiratoria ≥22/min
|
|
Estimación de la intensidad de la reacción inflamatoria
|
Usada en la definición de sepsis — SRIS, es decir, ≥2 de los siguientes:
1) temperatura corporal >38 ºC o <36 ºC
2) frecuencia cardíaca >90/mind
3) frecuencia respiratoria >20/min o PaCO2<32 mm Hg
4) leucocitosis >12 000/μl o <4000 /μl o >10 % de formas inmaduras de neutrófilos
|
No se menciona (se asume que la reacción inflamatoria es solo uno, y no el más importante de los aspectos de la reacción sistémica a la infección; se subrayan las alteraciones de la función orgánica, con la suposición de que de manera significativa aumentan la mortalidad)
|
|
a En enfermos sin alteraciones agudas de la función orgánica la puntuación de SOFA suele ser 0.
b No utilizar los criterios SRIS, la escala qSOFA ni otras escalas pronósticas como las únicas herramientas de evaluación.
c Resultado de la valoración de la escala de coma de Glasgow (→tabla 2 en Conciencia, alteraciones) <15 ptos.
d Puede no aparecer en enfermos que reciben β-bloqueantes.
PaCO2 — presión parcial de dióxido de carbono, SRIS — síndrome de respuesta inflamatoria sistémica
A partir de: Intensive Care Med., 2003; 29: 530-538 y JAMA 2016; 315: 801-810. doi: 10.1001/jama.2016.0287
|
 Español
Español
 English
English
 українська
українська







