Definiciones y etiopatogeniaArriba
En 2016 se publicó una nueva definición de sepsis y shock séptico. Debido al hecho de que muchos datos epidemiológicos, de pronóstico, y de tratamiento hacen referencia (sobre todo) a los cuadros diagnosticados sobre la base de las definiciones utilizadas hasta la fecha, y también al hecho de que lo que anteriormente se denominaba "sepsis grave" en la nueva nomenclatura se denomina "sepsis", en esta edición del manual se utilizarán dichas definiciones de manera paralela (→tabla 19.9-1, →tabla 19.9-2, →tabla 19.9-3). En las nuevas definiciones no se incluyó el término “infección”, por lo que en el texto se usará su definición tradicional.
Infección: respuesta inflamatoria a la presencia de microorganismos en los tejidos, fluidos o cavidades corporales que normalmente son estériles.
Infección confirmada microbiológicamente: aislamiento de microorganismos patógenos (o detección de sus antígenos o de su material genético) en fluidos corporales o tejidos que normalmente son estériles.
Sospecha clínica de infección: estado clínico que de manera clara sugiere una infección, p. ej. presencia de leucocitos en fluidos corporales fisiológicamente estériles (con excepción de la sangre), perforación de órganos internos, imagen de neumonía en la radiografía de tórax junto con expectoración en las vías respiratorias, herida infectada, etc.
Síndrome de disfunción multiorgánica (SDMO): trastornos graves del funcionamiento de los órganos en el curso de una enfermedad aguda, que indican la imposibilidad de mantener una homeostasis sistémica sin intervención terapéutica.
Bacteriemia: presencia de bacterias vivas en la sangre. Viremia: presencia de virus capaces de replicar en la sangre. Fungemia: presencia de hongos vivos en la sangre (candidemia: hongos vivos del género Candida en la sangre).
Causas
El tipo de microorganismo no determina el curso de la sepsis. Los microorganismos no tienen que estar presentes en la sangre. La mayoría de los pacientes no presenta trastornos previos de la inmunidad, si bien dichas alteraciones son el factor de riesgo de sepsis.
Las infecciones y estados inflamatorios que causan la sepsis pueden afectar a diferentes órganos: la cavidad abdominal (p. ej. peritonitis, colangitis, pancreatitis aguda), el aparato urinario (pielonefritis), el aparato respiratorio (neumonía), el SNC (neuroinfecciones), el endocardio, los huesos y articulaciones, la piel y el tejido subcutáneo (heridas debidas a traumas, lesiones por presión y heridas posoperatorias), el aparato reproductor (infección durante el embarazo anembriónico, entre otros). Con frecuencia el foco de la infección puede permanecer oculto y localizarse en dientes y tejidos periodontales, senos paranasales, amígdalas, vesícula biliar, aparato reproductor, abscesos de órganos internos.
Factores de riesgo yatrogénicos: cánulas y catéteres intravasculares, sonda vesical, catéteres de drenaje, prótesis y dispositivos implantados, ventilación mecánica, nutrición parenteral, transfusión de líquidos y hemoderivados contaminados, heridas y lesiones por presión, alteraciones inmunitarias debidas a farmacoterapia y radioterapia, entre otros.
Factores de riesgo de sepsis meningocócica: edad (mayor prevalencia en niños >5 años y en personas 15-24 años), inmunodeficiencias (deficiencia de componentes del complemento y de properdina), asplenia (funcional y anatómica), permanencia en un ambiente cerrado, contacto con un enfermo (los casos de enfermedad en el entorno más cercano aumenta el riesgo de infección varias centenas de veces), estilo de vida (estancia en lugares concurridos, p. ej. discotecas), viaje a regiones de distribución endémica (África subsahariana, Oriente Próximo). La asplenia también constituye un factor de riesgo de sepsis provocada por otras bacterias encapsuladas (especialmente neumococos).
Mecanismo patogénico
La sepsis es una reacción del organismo a la infección, con participación de componentes del microorganismo y sus endotoxinas, así como mediadores de la respuesta inflamatoria generados por el huésped (citoquinas, quimiocinas, icosanoides y los demás responsables del SRIS), y otras sustancias que producen daño celular (p. ej. radicales libres de oxigeno).
El shock séptico (hipotensión e hipoperfusión tisular) es consecuencia de los mediadores de la respuesta inflamatoria: llenado insuficiente del lecho vascular por hipovolemia relativa (vasodilatación y disminución de la resistencia vascular sistémica) o absoluta (aumento de la permeabilidad capilar), con menor frecuencia por disminución de la contractilidad miocárdica (en el shock séptico el gasto cardíaco habitualmente se encuentra aumentado siempre que el llenado del lecho vascular sea adecuado). La hipotensión e hipoperfusión provocan una disminución del aporte de oxígeno a los tejidos y la consiguiente hipoxia tisular. La disminución final del suministro y consumo de oxígeno potencia el metabolismo anaeróbico en las células y lleva a la aparición de la acidosis láctica. Otros elementos del shock séptico: síndrome de distrés respiratorio agudo (SDRA), insuficiencia renal aguda, alteración de la conciencia debida a la isquemia del SNC y actuación de los mediadores de la respuesta inflamatoria, trastornos en el funcionamiento del tracto digestivo como íleo paralítico por la isquemia y daño en la membrana mucosa que provoca la translocación de las bacterias desde el tubo digestivo a la sangre, y también hemorragias (gastropatía hemorrágica aguda y úlceras agudas por estrés →Gastropatía aguda hemorrágica (erosiva), colitis isquémica →Colitis isquémica), insuficiencia hepática aguda →Insuficiencia hepática aguda, disminución de la reserva suprarrenal (insuficiencia suprarrenal relativa).
Cuadro clínico e historia naturalArriba
Síntomas de sepsis →Definiciones y etiopatogenia, →tabla 19.9-4. Otros síntomas dependen de los órganos afectados. La erupción hemorrágica en las partes distales de miembros →fig. 19.9-1 y tronco, así como las petequias en conjuntivas y mucosa oral pueden indicar la presencia de sepsis meningocócica o (más raramente) neumocócica. Los trombos y émbolos en las arterias pueden causar necrosis de los dedos →fig. 19.9-2. Si no se controla la infección en las fases iniciales de la sepsis, aparecerán las manifestaciones de disfunción multiorgánica: del aparato respiratorio (síndrome de distrés respiratorio agudo, SDRA →Insuficiencia respiratoria aguda), aparato circulatorio (hipotensión, shock) y riñones (lesión renal aguda, inicialmente prerrenal →Lesión renal aguda) y trastornos de hemostasia (generalmente en primer lugar la trombocitopenia; CID →Coagulación intravascular diseminada; la frecuencia de la púrpura fulminante en enfermos con sepsis meningocócica es de ~25 %) y trastornos metabólicos (acidosis láctica). En ausencia de un tratamiento eficaz se agravan las manifestaciones del shock y de la disfunción multiorgánica y sobreviene la muerte.
DiagnósticoArriba
Exploraciones complementarias
1. Pruebas de laboratorio: para evaluar la disfunción de los órganos (gasometría arterial y venosa, niveles séricos de lactato [determinar idealmente en la primera hora desde la aparición de la sepsis o de su sospecha], pruebas de la hemostasia, parámetros de la función renal y hepática) y la gravedad de la respuesta inflamatoria (hemograma completo, proteína C-reactiva o procalcitonina [PCT], IL-6, en la actualidad más raramente VHS; se sugiere que los resultados de la determinación de PCT complementaria al estudio clínico no determinen la decisión de iniciar la antibioticoterapia, y que es necesario guiarse por la valoración clínica; la disminución de la PCT puede llevar a reducir el tiempo de tratamiento con antibióticos en enfermos con una infección diagnosticada, y el resultado negativo de la determinación de PCT puede apoyar la decisión sobre discontinuar la antibioticoterapia empírica en los enfermos con sospecha de sepsis no confirmada en las pruebas).
2. Pruebas microbiológicas:
1) Sangre: ≥2 muestras, entre ellas ≥1 muestra extraída de una vena y una muestra de cada uno de los catéteres vasculares insertados por un período >48 h. Deben realizarse hemocultivos de todas las muestras de sangre en condiciones aerobias y anaerobias.
2) Otras. Según el foco de sospecha: de las vías respiratorias, orina, otros fluidos corporales (p. ej. líquido cefalorraquídeo, líquido pleural), frotis o exudados de heridas.
3. Pruebas de imagen: radiografía (principalmente de tórax), ecografía y TC (principalmente de abdomen).
Criterios diagnósticos
→Definición y etiopatogenia, →tabla 19.9-1. Criterios de diagnóstico ampliados →tabla 19.9-4. Es preciso explorar rutinariamente a los enfermos graves (p. ej. tratados en la UCI), focalizándose en una posible sepsis a fin de poder iniciar lo antes posible el tratamiento correspondiente.
TratamientoArriba
Es necesario aplicar simultáneamente un tratamiento causal y sintomático. El pronóstico depende sobre todo de la rapidez con la que se inicia la administración de antibióticos y líquidos. Manejo precoz (el denominado paquete de medidas) →tabla 19.9-5. Los enfermos que requieren cuidados intensivos deben ser admitidos en la UCI cuanto antes (según la Campaña para sobrevivir a la sepsis [SSC] en 6 h), idealmente en 1-2 h, y el tratamiento intensivo debe instaurarse de inmediato, ya antes de la admisión en la UCI.
Tratamiento causal
1. Tratamiento antimicrobiano: el tratamiento inicial (empírico) debe comenzar lo antes posible, es decir, en un plazo inferior a 1 h en enfermos con shock séptico o alta probabilidad de sepsis (cada hora de retraso aumenta la mortalidad). Antes de iniciar el tratamiento se deben extraer las muestras microbiológicas para cultivos (→Diagnóstico), siempre y cuando esto sea posible y no suponga un retraso del tratamiento en >45 min. En los demás enfermos (sin shock) con sospecha de sepsis se sugiere profundizar el diagnóstico e iniciar la antibioticoterapia en 3 h, si se ha confirmado la infección o persiste una sospecha fundada. Asociar ≥1 antibiótico de amplio espectro iv.; incluir la actividad contra los agentes etiológicos más probables (bacterias, hongos, virus), así como la penetración en el foco de infección y la sensibilidad local de los microorganismos al fármaco. En enfermos con alta probabilidad de infección por SARM utilizar un fármaco activo frente a este microorganismo →Infecciones estafilocócicas y →tabla 19.2-2. En caso de alto riesgo de infección por microorganismos multirresistentes, en el tratamiento empírico utilizar 2 antibióticos dirigidos contra bacterias gramnegativas (en el tratamiento dirigido se sugiere utilizar 1 antibiótico). En enfermos con alto riesgo de infección fúngica utilizar de manera empírica un antifúngico. Todos los días hay que valorar, según la evolución del paciente, la posibilidad de cambio a un tratamiento antibiótico de espectro más estrecho o a monoterapia. En el shock séptico tal modificación se recomienda en unos días, en función de la mejoría clínica y la aparición de rasgos del cese de la infección. Esto concierne al tratamiento combinado (dirigido hacia el mismo patógeno), tanto empírico como dirigido. Lo más rápidamente posible administrar un tratamiento dirigido (en la mayoría de los casos monoterapia), sobre la base de los resultados del antibiograma. En la dosificación hay que tener en cuenta los rasgos farmacocinéticos y farmacodinámicos de los medicamentos, p. ej.:
1) administración de altas dosis de carga iniciales: p. ej. vancomicina
2) ajuste de dosis de algunos fármacos al peso corporal o a los resultados de concentración sérica: aminoglucósidos y vancomicina
3) uso de infusiones continuas o prolongadas iv. de fármacos de acción dependiente del momento en el que su concentración es mayor a la CIM: sobre todo antibióticos β-lactámicos (tras verificar la duración de la estabilidad del fármaco en la solución)
4) administración 1 × d de fármacos de actividad dependiente de su concentración máxima y de un efecto posantibiótico considerable: aminoglucósidos
5) características de los fármacos en enfermos con sepsis y shock séptico, p. ej. en caso del aumento del volumen de distribución de antibióticos hidrófilos y de la filtración glomerular (aclaramiento renal), que se presentan sobre todo en enfermos sometidos a reanimación con fluidos, se debe optar por la administración de dosis mayores.
Duración del tratamiento: generalmente 7-10 días (más, si la respuesta al tratamiento es lenta, no se consigue eliminar definitivamente el foco de infección, se presenta neutropenia →Neutropenia febril u otra inmunodeficiencia, algunos microorganismos, bacteriemia por S. aureus). En personas con el foco infeccioso bien controlado se sugiere preferir una antibioticoterapia más corta (6-8 días) a un esquema más largo (10-14 días) y además —al tomar la decisión sobre la finalización de la antibioticoterapia— complementar la evaluación clínica con la determinación de PCT →más arriba.
2. Eliminación del foco de infección: eliminación de los tejidos u órganos infectados (p. ej. vesícula biliar, segmentos necróticos del intestino), retirada de catéteres (el catéter intravascular que puede ser fuente de infección debe retirarse inmediatamente después de obtener un acceso vascular nuevo), prótesis y dispositivos implantados, realizar drenaje de abscesos, empiemas y otros focos infectados. Se prefiere el procedimiento eficaz menos invasivo (p. ej. si es posible, realizar drenaje percutáneo de abscesos en lugar de cirugía). En casos de necrosis pancreática infectada optar más bien por aplazar la intervención quirúrgica.
Tratamiento sintomático
Indispensable en la sepsis (sepsis grave según la denominación anterior) y el shock séptico.
1. Procedimiento inicial anti-shock: inicio temprano, sobre todo de la infusión de fluidos iv. →más adelante, así como una vigilancia frecuente de la eficacia son por lo menos tan importantes como la actuación de acuerdo con los algoritmos específicos y la obtención de parámetros objetivo fijados al inicio. Además de una mejoría del estado clínico general (y parámetros simples, tales como la frecuencia cardíaca, la presión arterial, la saturación de oxígeno arterial, la frecuencia respiratoria, la temperatura corporal, la diuresis) se considera de mayor importancia la reducción (regreso a valores normales) de los niveles de lactato en enfermos con hipoperfusión, así como la obtención de una presión arterial media 65 mm Hg en el shock séptico (cuando se administran fármacos vasoconstrictores →más adelante; la presión elevada en personas con hipertensión arterial puede asociarse a menor riesgo de lesión renal aguda). La normalización del tiempo de llenado capilar puede ser un parámetro complementario. Los resultados de la determinación de lactato deben interpretarse en el contexto del estado clínico, teniendo en cuenta otras causas de su aumento, distintas a la hipoperfusión. No obstante, se recomienda continuar la evaluación hemodinámica (como evaluación de la función cardíaca, p. ej. mediante ecocardiografía), en caso de dudas en cuanto al tipo de shock (p. ej. junto con el shock séptico puede presentarse el shock cardiogénico), así como se prefiere utilizar parámetros hemodinámicos dinámicos (y no estáticos) para prever la respuesta a la perfusión de líquidos →Shock. Algunos de estos estudios requieren equipo especializado, pero se trata también de los cambios en la presión central venosa y en el tiempo de llenado capilar.
Si, una vez alcanzado el nivel deseado de presión arterial media (tras la infusión de líquidos y la administración de vasoconstrictores), no se obtiene el objetivo de la reducción de lactato (o el objetivo de la saturación de la sangre venosa) en las primeras horas, hay que considerar, dependiendo de las circunstancias (frecuencia cardíaca, función del ventrículo izquierdo, respuesta anterior a los líquidos, concentración de hemoglobina) ≥1 de las siguientes medidas: continuación de la infusión de fluidos, transfusión de concentrados de hematíes hasta alcanzar un hematocrito >30 %, tratamiento que aumenta la contractilidad miocárdica (→más adelante).
2. Tratamiento de la disfunción del sistema cardiovascular:
1) Recuperación adecuada de la volemia con líquidos. En enfermos con hipoperfusión tisular y sospecha de hipovolemia empezar por la perfusión de cristaloides a una cantidad sugerida de ≥30 ml/kg en las primeras 3 h, con observación dirigida hacia signos de hipervolemia (este volumen es orientativo y puede modificarse según la respuesta al tratamiento). Algunos enfermos pueden requerir una administración rápida (o posterior) de dosis adicionales de líquidos. Dosis mayores de líquidos (p. ej. >30 ml/kg) deben perfundirse en forma de dosis individuales (p. ej. de 200-500 ml una), y después de la administración de cada una de ellas hay que valorar la respuesta al tratamiento (→Shock). Se prefieren las soluciones equilibradas, sobre todo en caso de necesidad de perfundir grandes cantidades iv. (→Fluidoterapia intravenosa). Se desaconseja fuertemente la administración de soluciones de hidroxietilalmidón (HES). Se sugiere también no utilizar las soluciones de gelatina ni dextranos. La administración de las soluciones de albúmina no es un procedimiento rutinario durante la fluidoterapia inicial intensiva, sin embargo, se sugiere su infusión como complemento en la perfusión de cristaloides durante el manejo inicial y la continuación de la fluidoterapia en enfermos que requieran una transfusión de grandes cantidades de cristaloides. En enfermos con COVID-19 y en enfermos con SDRA se sugiere utilizar la fluidoterapia restrictiva, es decir, administrar dosis menores de líquidos (lo que en la práctica significa administración más temprana de vasoconstrictores →más adelante).
2) Vasoconstrictores: noradrenalina (de preferencia, si no está disponible se puede administrar adrenalina o vasopresina; dosificación →Shock), si resulta ineficaz agregar vasopresina (o adrenalina, si no está disponible); se sugiere no utilizar la terlipresina. La vasopresina también puede utilizarse para reducir la dosis de noradrenalina (o para evitar que continúe su aumento); la asociación de vasopresina a una dosis moderada de noradrenalina puede resultar más beneficiosa que el aumento de la dosis de noradrenalina (p. ej. empezar la administración de vasopresina si la dosis de noradrenalina es 0,25-0,5 µg/kg/min). Asociar la adrenalina si el tratamiento combinado con noradrenalina y vasopresina no es eficaz. Indicaciones: hipotensión persistente a pesar de la perfusión de un volumen adecuado de líquidos. Si el posible, administrar los vasoconstrictores a través de un catéter situado en la vena cava y vigilar la presión arterial de forma invasiva (colocar el catéter en la arteria). No obstante, no posponer la administración de vasoconstrictores hasta la colocación de catéter en la vena cava; administrar el fármaco a través de una vía venosa periférica en la fosa cubital o más proximal. No se recomienda el uso de dopamina (excepto en casos con bradicardia y gasto cardíaco disminuido, y bajo riesgo de arritmias).
3) Tratamiento para aumentar la contractilidad miocárdica: en enfermos con disfunción miocárdica e hipoperfusión persistente a pesar de la perfusión adecuada de líquidos y presión arterial normal, considerar la asociación de dobutamina a la noradrenalina o el cambio de noradrenalina por adrenalina (más bien no utilizar levosimendán). La dosificación (→Shock) debe tener en cuenta que el objetivo es el cese de la hipoperfusión. Dejar de administrar dobutamina en caso de disminución de la presión arterial y/o presentación de arritmias.
3. Tratamiento de insuficiencia respiratoria →Insuficiencia respiratoria aguda. Las guías de la SSC (2021) sugieren preferir la oxigenoterapia nasal de alto flujo a la ventilación pulmonar mecánica no invasiva. A menudo es necesaria la ventilación mecánica invasiva. Tratamiento de la neumonía →Neumonía adquirida en la comunidad.
4. Tratamiento de la insuficiencia renal: la estabilización funcional del sistema cardiovascular (normalización de la presión arterial) es primordial. En caso de necesidad iniciar tratamiento renal sustitutivo, si bien no se ha comprobado el beneficio de su uso precoz, aunque no se suele recomendar que la oliguria o el aumento de la creatininemia sean las únicas indicaciones para el tratamiento renal sustitutivo.
5. Tratamiento de la acidosis: dirigido a la eliminación de la causa. Se sugiere no utilizar NaHCO3 de manera rutinaria en todos los enfermos con shock séptico y acidosis láctica para mejorar los parámetros hemodinámicos y disminuir el requerimiento de vasopresores. Las guías de la SSC (2021) sugieren administrar NaHCO3 a los enfermos con sepsis acompañada de acidosis con pH de sangre arterial ≤7,2 y de LRA (grado 2 o 3 →tabla 15.1-1).
6. Corticoterapia: si la hipotensión persiste a pesar de una hidratación adecuada y el uso de vasopresores → hidrocortisona iv. 50 mg cada 6 h o en infusión continua 200 mg/d (normalmente hasta que el shock se resuelva), iniciar ≥4 h después de administrar un vasoconstrictor, cuando la dosis de noradrenalina o adrenalina ≥0,25 (>0,1 según algunos expertos) µg/kg/min.
7. Control glucémico: en caso de hiperglucemia (>10 mmol/l [180 mg/dl] en 2 mediciones consecutivas) causada por sepsis, administrar insulina (habitualmente infusión iv.). El objetivo suele ser glucemia 8-10 mmol/l (144-180 mg/dl). Al comienzo de la insulinoterapia es necesario verificar la glucemia cada 1-2 h y, una vez estabilizada, cada 4-6 h. Evitar la hipoglucemia. Las mediciones de la sangre capilar pueden presentar resultados erróneos. En enfermos con catéter arterial se sugiere más bien tomar la sangre a través del catéter (y no de la sangre capilar) para las mediciones de la glucemia a pie de cama.
8. Manejo complementario:
1) Transfusión de elementos sanguíneos:
a) Concentrado de hematíes, si Hb <7 g/dl (normalmente para alcanzar el nivel 7,0-9,0 g/dl). Excepciones: transfusión de concentrado de hematíes con Hb >7 g/dl cuando existe hipoperfusión tisular, hemorragia activa, hipoxemia importante o enfermedad coronaria significativa.
b) Concentrado de plaquetas: independientemente de otros factores, se utiliza cuando las plaquetas son ≤10 000/µl. La transfusión puede ser beneficiosa cuando el recuento de plaquetas es de 10 000-20 000/µl y existe un riesgo elevado de hemorragia (sepsis o shock séptico incluidos). La realización de procedimientos invasivos puede requerir un recuento de plaquetas ≥50 000/µl.
c) PFC y crioprecipitado: principalmente cuando existe hemorragia activa o se están planeando intervenciones invasivas en enfermos con trastornos de la coagulación.
2) Nutrición: enteral, en la medida de lo posible, en cantidades toleradas por el paciente (en la etapa temprana del tratamiento no es obligatorio satisfacer la demanda calórica completa).
3) Prevención de las úlceras por estrés: IBP o H2-bloqueante en enfermos con factores de riesgo de hemorragia (en enfermos graves los factores más fuertes son la coagulopatía y la ventilación pulmonar mecánica de >48 h).
4) Prevención de enfermedad tromboembólica venosa →Profilaxis primaria de la ETV. Debe aplicarse la profilaxis farmacológica si no existen contraindicaciones por hemorragia o un alto riesgo de su aparición. Se sugiere usar más bien HBPM y no la HNF y además iniciar la profilaxis mecánica, si la profilaxis farmacológica está contraindicada.
5) Manejo durante la ventilación pulmonar mecánica: entre otros, emplear fármacos sedantes en las dosis más bajas posibles que aseguren el nivel de sedación deseado (el menor tolerado). Evitar miorrelajantes, con excepción del SDRA (en caso de SDRA con PaO2/FiO2 <150 mm Hg se sugiere considerar su administración iv. hasta 48 h, de preferencia en inyecciones más bien que en infusión continua). Recomendar mantener la posición de la cabecera de la cama a unos 30-45° para prevenir neumonía asociada a la ventilación mecánica.
6) Tratamiento de la CID →Coagulación intravascular diseminada: el tratamiento causal de la sepsis tiene importancia fundamental.
9. Otras intervenciones: en algunos casos de shock séptico grave se utilizan técnicas de depuración extracorpórea distintas al tratamiento renal sustitutivo: hemoadsorción (hemoperfusión con columnas adsorbentes de citoquinas y endotoxinas, p. ej. LPS) y plasmaféresis (las guías de la SSC sugieren no utilizar la hemoperfusión con polimixina B y no formulan recomendaciones sobre otros métodos; según algunos expertos no hay datos suficientes para utilizar estos métodos fuera de los ensayos clínicos). No se ha demostrado la eficacia de selenio ni de la asociación de vitamina C y tiamina a hidrocortisona. Las guías de la SSC sugieren no administrar vitamina C iv. a los enfermos con sepsis y shock séptico, y no utilizar inmunoglobulinas (esta última recomendación probablemente no se aplica a los enfermos con un déficit de inmunoglobulinas documentado).
TABLAS Y FIGURAS
Definiciones y criterios diagnósticos de sepsis y shock séptico
|
Definiciones y criterios
|
Anteriores (1991, 2001)
|
Actuales (2016)
|
|
Sepsis
|
SRIS secundario a una infección
|
Disfunción orgánica potencialmente mortal causada por una respuesta anómala del sistema a la infección. Dicha respuesta origina un daño tisular y orgánico (corresponde al concepto anterior de “sepsis grave”)
|
|
Sepsis grave
|
Sepsis causante de insuficiencia o disfunción grave de órganos (o de sistemas →más adelante); corresponde a la “sepsis” en la nueva nomenclatura
|
Su equivalente es “sepsis” según se define más arriba
|
|
Criterios diagnósticos de alteraciones de la función sistémica u orgánica
|
Utilizados para el diagnóstico de sepsis grave (→tabla 2)
|
Utilizados para el diagnóstico de sepsis: aumento súbito del resultado en la escala SOFA en ≥2 ptos. (→tabla 3)a, en presencia o sospecha de infección
|
|
Shock séptico
|
Forma grave de sepsis con insuficiencia circulatoria aguda, que se caracteriza por hipotensión persistente (presión arterial sistólica <90 mm Hg, presión media <65 mm Hg o reducción de la presión sistólica en >40 mm Hg), a pesar de una apropiada reposición con fluidos y que por lo tanto requiere la administración de fármacos vasoconstrictores
|
Sepsis, en la que los trastornos de los sistemas cardiovascular, metabólico y a nivel celular son tan profundos que aumenta de manera significativa la mortalidad.
Se diagnostica si, a pesar de una reposición con fluidos adecuada, se mantiene:
1) una hipotensión que requiera la administración de fármacos vasoconstrictores con el fin de conseguir una presión arterial media de ≥65 mm Hg y
2) una concentración de lactato sérico >2 mmol/l (18 mg/dl)
|
|
Escala propuesta para la identificación temprana de enfermos con riesgo de muerteb
|
No se ha precisado. Se han utilizado tanto los criterios SRIS como de las alteraciones de la función orgánica y los criterios ampliados de diagnóstico de sepsis que abarcan dichas alteraciones (→tabla 4)
|
Resultado en la escala QuickSOFA (qSOFA): ≥2 de los siguientes síntomas y signos
1) alteraciones de la concienciac
2) presión sistólica ≤100 mm Hg
3) frecuencia respiratoria ≥22/min
|
|
Estimación de la intensidad de la reacción inflamatoria
|
Usada en la definición de sepsis — SRIS, es decir, ≥2 de los siguientes:
1) temperatura corporal >38 ºC o <36 ºC
2) frecuencia cardíaca >90/mind
3) frecuencia respiratoria >20/min o PaCO2<32 mm Hg
4) leucocitosis >12 000/μl o <4000 /μl o >10 % de formas inmaduras de neutrófilos
|
No se menciona (se asume que la reacción inflamatoria es solo uno, y no el más importante de los aspectos de la reacción sistémica a la infección; se subrayan las alteraciones de la función orgánica, con la suposición de que de manera significativa aumentan la mortalidad)
|
|
a En enfermos sin alteraciones agudas de la función orgánica la puntuación de SOFA suele ser 0.
b No utilizar los criterios SRIS, la escala qSOFA ni otras escalas pronósticas como las únicas herramientas de evaluación.
c Resultado de la valoración de la escala de coma de Glasgow (→tabla 2 en Conciencia, alteraciones) <15 ptos.
d Puede no aparecer en enfermos que reciben β-bloqueantes.
PaCO2 — presión parcial de dióxido de carbono, SRIS — síndrome de respuesta inflamatoria sistémica
A partir de: Intensive Care Med., 2003; 29: 530-538 y JAMA 2016; 315: 801-810. doi: 10.1001/jama.2016.0287
|
Criterios diagnósticos tradicionales de disfunción orgánica asociada a sepsisa
|
1) Hipoperfusión tisular asociada a sepsis, o
2) Alteraciones de la función orgánica o sistémica asociadas a una infección, es decir, ≥1 de las siguientes disfunciones:
a) hipotensión causada por sepsis
b) concentración de lactato >LSN
c) diuresis <0,5 ml/kg/h durante >2 h, a pesar de una reposición apropiada con fluidos
d) PaO2/FiO2 <250 mm Hg, si los pulmones no son el foco infeccioso, o <200 mm Hg, si los pulmones son el foco infeccioso
e) creatininemia >176,8 μmol/l (2 mg/dl)
f) bilirrubinemia >34,2 μmol/l (2 mg/dl)
g) recuento de plaquetas <100 000/μl
h) coagulopatía (INR >1,5)
|
|
a Son los criterios previamente utilizados para el diagnóstico de sepsis grave.
FiO2 — fracción inspirada de oxígeno, LSN — límite superior de la normalidad, PaO2 — presión parcial de oxígeno en la sangre arterial
A partir de las guías de la Campaña para sobrevivir a la sepsis, 2012
|
Escala de disfunción orgánica asociada a sepsis (SOFA)a
|
Órgano o sistema
|
Puntuación
|
|
0
|
1
|
2
|
3
|
4
|
|
Sistema respiratorio
|
|
PaO2/FiO2, mm Hg (kPa)
|
≥400 (53,3)
|
<400 (53,3)
|
<300 (40)
|
<200 (26,7)b
|
<100 (13,3)b
|
|
Coagulación
|
|
Recuento de plaquetas, × 103/μl
|
≥150
|
<150
|
<100
|
<50
|
<20
|
|
Hígado
|
|
Concentración de bilirrubina, μmol/l (mg/dl)
|
<20 (1,2)
|
20-32 (1,2-1,9)
|
33-101 (2,0-5,9)
|
102-204 (6,0-11,9)
|
>204 (12)
|
|
Sistema cardiovascular
|
MAP ≥70 mm Hg
|
MAP <70 mm Hg
|
Dobutamina (cualquier dosis) o dopamina <5c
|
Noradrenalina ≤0,1 o adrenalina ≤0,1, o dopamina 5,1-15c
|
Noradrenalina >0,1 o adrenalina >0,1, o dopamina >15c
|
|
Sistema nervioso
|
|
Escala de coma de Glasgowd
|
15
|
13-14
|
10-12
|
6-9
|
<6
|
|
Riñones
|
|
Concentración de creatinina, μmol/l (mg/dl)
|
<110 (1,2)
|
110-170 (1,2-1,9)
|
171-299 (2,0-3,4)
|
300-440 (3,5-4,9)
|
>440 (5,0)
|
|
o diuresis, ml/d
|
|
|
|
o <500
|
o <200
|
|
a Calculadora en español: https://empendium.com/manualmibe/calculadoras/show.html?id=267373
b Durante la ventilación mecánica.
c Dosis de catecolaminas expresadas en μg/kg/min y administradas durante ≥1 h.
d →tabla 2 en Conciencia, alteraciones.
FiO2 — concentración de oxígeno en la mezcla gaseosa, expresada en decimales; MAP — presión arterial media; PaO2 — presión parcial de oxígeno en sangre arterial
A partir de: Intensive Care Med., 1996; 22: 707-710
|
Criterios ampliados para el diagnóstico de sepsis y consecuencias de la sepsis
|
Infección (confirmada o sospechada) y algunos de los siguientes criterios
|
|
Parámetros generales
– temperatura corporal >38 ºC o <36 ºC
– taquicardia >90/min
– taquipnea >30/min (o ventilación mecánica)
– alteración brusca del nivel de conciencia
– edemas significativos o balance hídrico positivo (>20 ml/kg/d)
– hiperglucemia (>7,7 mmol/l [140 mg/dl]) a pesar de ausencia de diabetes
|
|
Parámetros inflamatorios
– leucocitosis >12 000/µl o leucopenia (recuento de leucocitos <4000/µl)
– presencia de >10 % de formas inmaduras de neutrófilos
– proteína-C reactiva >2 desviaciones estándar del nivel medio
– procalcitonina >2 desviaciones estándar del nivel medio
|
|
Parámetros hemodinámicos y de perfusión tisular
– hipotensión (presión arterial sistólica <90 mm Hg, media <70 mm Hg, o reducción de la presión sistólica >40 mm Hg en personas con hipertensión arterial)
– concentración de lactato sérico >LSN
– llenado capilar retardado
|
|
Aparición o empeoramiento de signos de disfunción de órganos
– hipoxemia (PaO2/FiO2 <300 mm Hg; en caso de enfermedades primarias del aparato respiratorio <200)
– oliguria aguda (diuresis <0,5 ml/kg/h durante >2 h a pesar de hidratación adecuada)
– aumento de la concentración de creatinina >44,2 µmol/l (0,5 mg/dl) en 48 h
– trastornos de la hemostasia (recuento de plaquetas <100 000/µl, INR >1,5, TTPa >60 s)
– concentración de la bilirrubina total en el plasma >70 µmol/l (4 mg/dl)
– íleo paralítico (ausencia de ruidos intestinales)
|
|
A partir de las recomendaciones de la Campaña para sobrevivir a la sepsis 2012, modificado
|
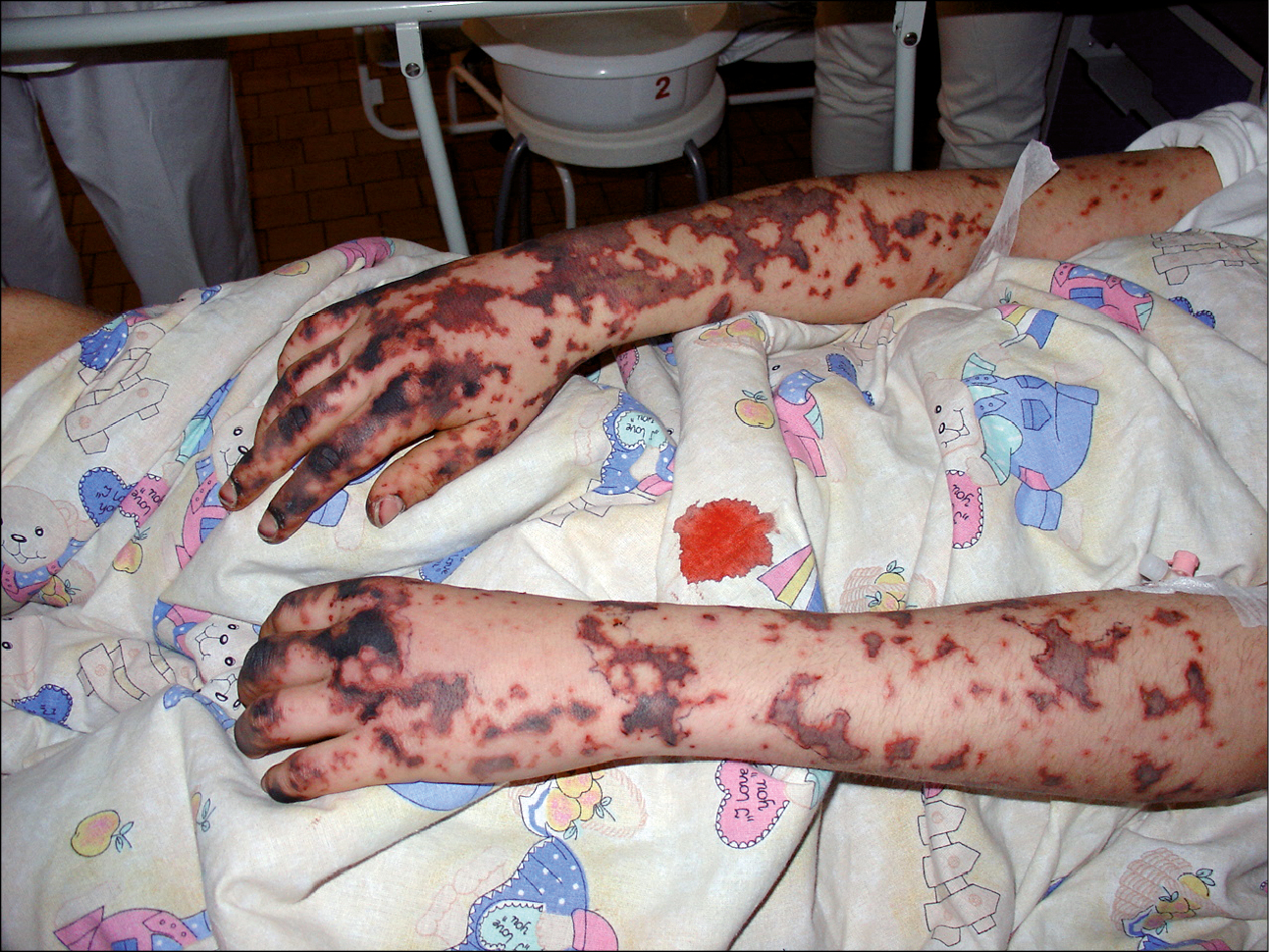
Fig. 19.9-1. Púrpura (petequias y equimosis) en el curso de sepsis meningocócica
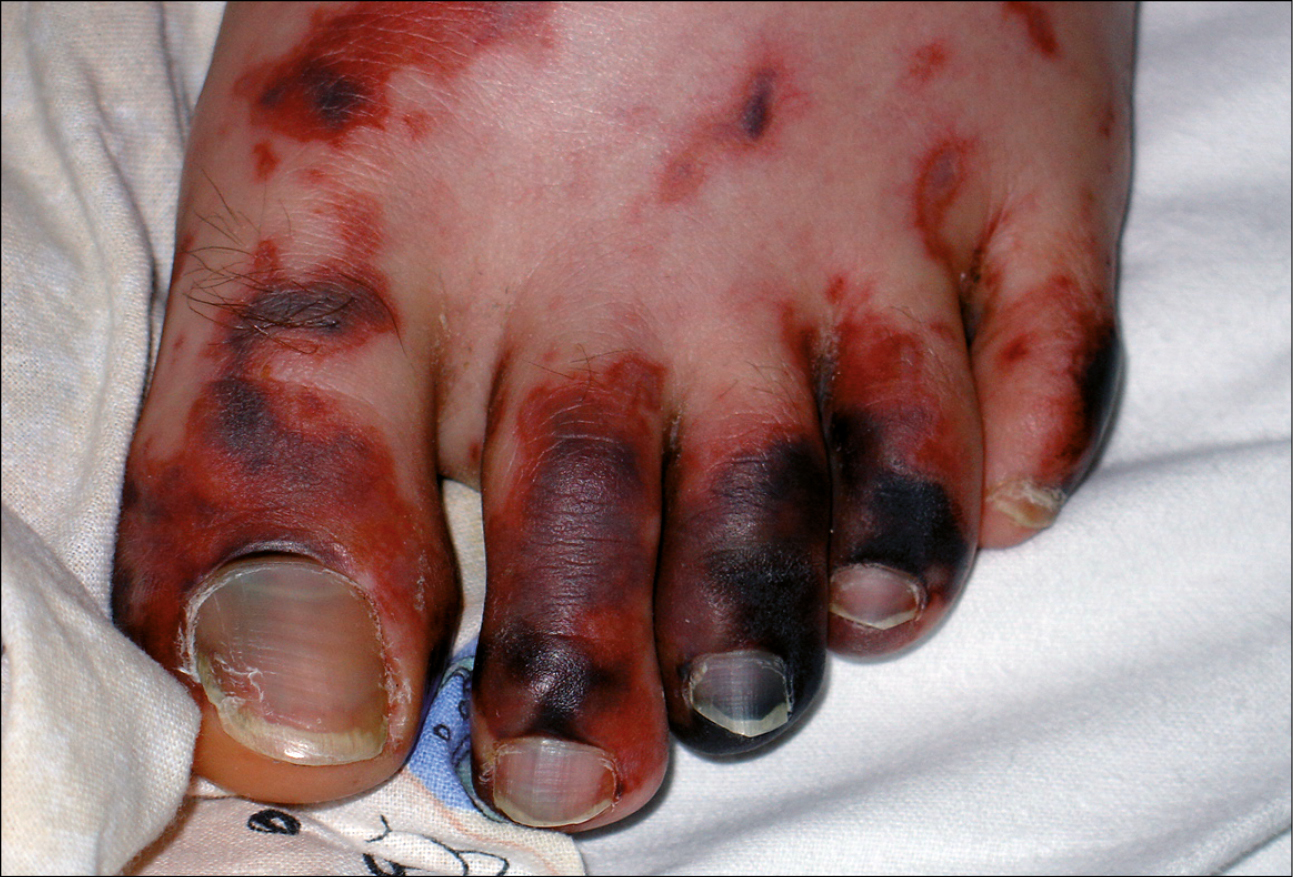
Fig. 19.9-2. Equimosis y necrosis de los dedos de los pies en el curso de sepsis meningocócica
Paquete de medidas según la Campaña para sobrevivir a la sepsis
|
En 1 ha:
1) Determinar la concentración de lactato en sangreb.
2) Tomar muestras de sangre para hemocultivos (antes de administrar antibióticos).
3) Administrar antibióticos de amplio espectro.
4) Realizar una administración rápida de una solución de cristaloides 30 ml/kgc si hay hipotensión o lactatos ≥4 mmol/l (36 mg/dl).
5) Administrar vasoconstrictores en caso de hipotensión que no responde a la fluidoterapia inicial intensiva, para mantener una presión arterial media (MAP) ≥65 mm Hg.
|
|
a Se considera el “momento cero” el momento en el cual se realiza una evaluación del estado del enfermo en la unidad de emergencias o en el cual se anotan síntomas indicadores de sepsis (anteriormente: sepsis grave) en la documentación médica (p. ej. en la ficha de observación) de otro lugar en el que el enfermo obtiene cuidados.
b En 2– 4 h volver a determinar la concentración de lactatos, en caso de concentración inicial >2 mmol/l. El objetivo es la normalización.
c El volumen indicado tiene que infundirse en 1-3 h.
A partir de la actualización realizada en 2018: Levy M.M., Evans L.E., Rhodes A., The Surviving Sepsis Campaign bundle: 2018 update, Intensive Care Med., 2018: https://doi.org/10.1007/s00134-018-5085-0; http://www.survivingsepsis.org/Bundles/Pages/default.aspx
|
Antibioticoterapia dirigida en infecciones por estafilococos
|
Especie/cepa
|
Tratamiento de elección (opciones)
|
Tratamiento alternativo (opciones)
|
|
SASM
|
– Isoxazolilpenicilinas, p. ej., cloxacilina, adultos y niños >40 kg: 1 g cada 6 h, en infecciones graves 1 g cada 4 h; dosis máx. 2 g IM o iv. cada 4 h
– Cefazolina 1-2 g cada 8 h, máx. 2 g iv. cada 6 h
– En caso de contraindicaciones para β-lactámicos: vancomicina 15-20 mg/kg iv. cada 8-12 h
|
– Cefalexina 500 mg VO cada 6 h
– Clindamicina 300 mg VO cada 8 h
– Cotrimoxazol 160/800 mg VO cada 12 h
|
|
SARM (concentración mínima inhibitoria [CMI] para vancomicina ≤2 µg/ml)
|
– Vancomicina 15-20 mg/kg iv. cada 8-12 h (en ausencia de respuesta clínica o microbiológica satisfactoria considerar otros fármacos que la vancomicina; en caso de CMI >2 µg/ml usar otros fármacos que la vancomicina)
– Linezolid 600 mg VO o iv. cada 12 h
– Daptomicina 4-6 mg/kg iv. cada 24 h (en caso de bacteriemia considerar una dosis de 8-12 mg/kg cada 24 h)
|
Teicoplanina, daptomicina, telavancina, dalbavancina, linezolid, cotrimoxazol, minociclina, doxiciclina, ceftarolina, clindamicina
También pueden resultar activos el ácido fusídico, fosfomicina o rifampicina, pero solo pueden usarse en terapia combinada para prevenir el desarrollo de la resistencia
|
|
SAIV (CMI para vancomicina 4-8 µg/ml)
SARV (CMI para vancomicina >8 µg/ml)
|
– Linezolid 600 mg VO o iv. cada 12 h
– Daptomicina 4-6 mg/kg iv. cada 24 h (en bacteriemia considerar 8-12 mg/kg cada 24 h)
– Telavancina (ineficaz en infecciones por SARV) 10 mg/kg iv. cada 24 h
– Ceftarolina 600 mg iv. cada 8 h
|
SAIV: daptomicina, telavancina, dalbavancina, cotrimoxazol, minociclina, doxiciclina, ceftarolina, rifampicina (solo en terapia combinada para prevenir el desarrollo de la resistencia)
SARV: cotrimoxazol, linezolid, minociclina, daptomicina, ceftarolina
|
|
S. epidermidis
|
Cepas sensibles a meticilina
– cloxacilina 2 g iv. cada 4-6 h
– cefazolina 2 g iv. cada 8 h
Cepas resistentes a meticilina
– vancomicina 15-20 mg/kg iv. cada 8 h
– daptomicina 6 mg/kg iv. cada 24 h
Cepas resistentes a meticilina y con sensibilidad intermedia a glucopéptidos
– linezolid 600 mg VO o iv. cada 12 h
– daptomicina 6 mg/kg iv. cada 24 h (si se confirma la sensibilidad)
|
Rifampicina junto con cotrimoxazol o con fluoroquinolona o con ácido fusídico
|
|
S. saprophyticus (infección del tracto urinario)
|
– Cefalexina 500 mg VO cada 12 h
– Amoxicilina con ácido clavulánico 875 + 125 mg VO cada 12 h durante 7 días
– Cotrimoxazol 160/800 mg VO cada 12 h durante 3 días
|
– Levofloxacina 500 mg VO cada 24 h durante 3 días
|
|
S. lugdunensis
|
– Cloxacilina 2 g iv. cada 4-6 h
– Bencilpenicilina 2 mill. de uds. iv. cada 4 h (cepas que no sintetizan β-lactamasas)
|
Cefazolina 2 g iv. cada 8 h o vancomicina 15-20 mg/kg iv. cada 8 h
|
|
S. haemolyticus
|
Cepas sensibles a los glucopéptidos:
– vancomicina 15-20 mg/kg iv. cada 8-12 h
Cepas resistentes a los glucopéptidos:
– daptomicina 6 mg/kg iv. cada 24 h
– linezolid 600 mg VO o iv. cada 12 h (se han reportado casos de resistencia a linezolid)
|
Cepas sensibles a meticilina: cloxacilina o cefazolina
Otros: doxiciclina, cotrimoxazol (después de confirmar la sensibilidad)
|
Clasificación de la gravedad de la lesión renal aguda según el KDIGO 2012
|
Estadio
|
Nivel sérico de creatinina
|
Diuresis
|
|
1
|
Elevación de 1,5-1,9 veces respecto a la concentración basal o en ≥0,3 mg/dl (≥26,5 µmol/l)
|
<0,5 ml/kg/h durante 6-12 h
|
|
2
|
Elevación de 2,0-2,9 veces respecto a la concentración basal
|
<0,5 ml/kg/h durante ≥12 h
|
|
3
|
Elevación de 3 veces respecto a la concentración basal o creatininemia ≥4,0 mg/dl (≥353,6 µmol/l) o inicio de tratamiento renal sustitutivo
|
<0,3 ml/kg/h durante ≥24 h o anuria durante ≥12 h
|
 Español
Español
 English
English
 українська
українська






