EtiopatogeniaArriba
Las causas de insuficiencia cardíaca crónica (ICC) son las enfermedades del corazón que alteran el llenado o la eyección de la sangre desde el ventrículo (o ventrículos).
Mecanismos principales que llevan a la ICC:
1) alteración primaria de la contractilidad: como consecuencia de cardiopatía isquémica o de una miocardiopatía dilatada de etiología diversa, que originan lesión o pérdida de cardiomiocitos (infarto de miocardio, reacciones autoinmunes, infecciones, daño tóxico, depósito de sustancia en los cardiomiocitos [p. ej. hemosiderina, glucógeno], o en el espacio intercelular [p. ej. amiloide], alteraciones hormonales, trastornos de la alimentación, miocardiopatía genética) y/o disminución de la contractilidad en zonas de miocardio viable (isquemia aguda transitoria, miocardio del ventrículo izquierdo "hibernado" en caso de disminución crónica del flujo coronario, miocardio "aturdido" tras un episodio de isquemia aguda)
2) sobrecarga de presión o de volumen de los ventrículos: por hipertensión arterial o cardiopatías
3) alteración de la función diastólica: secundaria a enfermedades del pericardio, hipertrofia miocárdica, o a una miocardiopatía restrictiva o hipertrófica
4) taquiarritmias (con más frecuencia fibrilación auricular) o bradiarritmias.
Causas de HFrEF: cardiopatía isquémica (con mayor frecuencia después de un infarto de miocardio), hipertensión arterial mal controlada, valvulopatías, miocardiopatías. En respuesta a la disminución del gasto cardíaco se activan mecanismos neurohormonales con predominio de factores vasoconstrictores y que provocan retención de sodio y agua. Tras meses o años de acción del factor nocivo en el músculo cardíaco se desarrolla un remodelado del miocardio con dilatación progresiva del ventrículo izquierdo y empeoramiento de la función sistólica. A consecuencia de ello, el gasto cardíaco va disminuyendo y se desencadena un círculo vicioso en el que aumenta la activación neurohormonal.
Causas de HFpEF: hipertensión arterial (es la causa más frecuente, especialmente con hipertrofia del ventrículo izquierdo), cardiopatía isquémica, diabetes mellitus, valvulopatía, miocardiopatía hipertrófica, miocardiopatía restrictiva (p. ej. en la amiloidosis cardíaca), pericarditis constrictiva. Factores predisponentes: edad avanzada, sexo femenino y obesidad.
Constituyen subgrupos diferentes de HFpEF los enfermos:
1) en los cuales se produjo una mejoría de la fracción de eyección, p. ej. por el tratamiento (las guías de AHA, ACC y HFSA [2022] clasifican a estos enfermos como subgrupo de HFrEF)
2) con fracción de eyección aumentada (>65 %), en los que deben tomarse en cuenta causas específicas de la IC, como amiloidosis cardíaca, miocardiopatía hipertrófica, o valvulopatía.
HFmrEF es una forma heterogénea. Incluye a:
1) pacientes con disfunción diastólica predominante y disfunción sistólica ligera concomitante, que muestran además cierta semejanza con HFrEF
2) enfermos con HFrEF en los que se ha producido aumento de FEVI.
Causas de ICC con aumento del gasto cardíaco: estados con circulación hipercinética como embarazo, anemia grave (hemoglobina <8 g/dl), hipertiroidismo, fístulas arteriovenosas grandes en la circulación sistémica (congénitas o adquiridas), cirrosis hepática avanzada, policitemia primaria o secundaria, enfermedad de Paget, beriberi, y en el síndrome carcinoide. En general la ICC se desarrolla cuando la circulación hipercinética coincide con una cardiopatía.
Causas de agudizaciones de la ICC: SCA; control inadecuado de la presión arterial; taquiarritmias (más frecuentemente fibrilación auricular) o bradiarritmias; embolismo pulmonar; endocarditis y miocarditis; estados de circulación hipercinética; infecciones (especialmente neumonía); empeoramiento de la función renal; falta de adhesión a la restricción del consumo de sodio y líquidos, así como de las recomendaciones sobre el tipo de fármacos y su dosificación; yatrogénicas (administración excesiva de sodio y líquidos; uso de fármacos de acción cronotrópica o inotrópica negativa [p. ej. verapamilo, diltiazem, también β-bloqueantes a dosis inadecuadas], cardiotóxicos [p. ej. antraciclinas], retenedores de sodio y agua [p. ej. glucocorticoides, estrógenos, AINE], alteraciones en la función tiroidea [p. ej. por amiodarona]); abuso de alcohol; uso de cocaína.
CUADRO CLÍNICOArriba
Las manifestaciones se deben al fallo retrógrado y anterógrado, y aparecen en combinaciones diferentes en función del ventrículo predominantemente afectado. Se distinguen síntomas más típicos y signos más específicos (más adelante en negrita). La clasificación de la gravedad de la ICC según la New York Heart Association (NYHA) se basa en la evaluación de la presencia de fatiga, disnea y palpitaciones durante el esfuerzo físico →tabla 2.19-1.
1. Manifestaciones de insuficiencia del ventrículo izquierdo (congestión en la circulación pulmonar):
1) síntomas: disnea (en reposo o de esfuerzo), es típica la ortopnea (aparece después de 1-2 min en decúbito y desaparece unos minutos después de sentarse o ponerse de pie) y la disnea paroxística nocturna (a diferencia de la ortopnea aparece mucho más tarde después de acostarse, despierta al enfermo y cede mucho más lentamente, después de ≥30 min); tos (equivalente de la disnea de esfuerzo u ortopnea), que habitualmente es seca, y a veces con expectoración rosácea (en general en edema pulmonar), sibilancias
2) signos: taquipnea, crepitantes (de localización típica basal, pero pueden llegar hasta los ápices), pueden estar acompañadas de sibilancias y roncus (parcialmente relacionados con el edema de la mucosa bronquial).
2. Manifestaciones de insuficiencia del ventrículo derecho (congestión en la circulación sistémica):
1) síntomas: edemas localizados en las partes declives (más a menudo en los pies, en las zonas maleolares y en pacientes encamados en la zona sacrolumbar), dolor o sensación de malestar en el abdomen por hepatomegalia; nicturia; falta de apetito, náuseas y estreñimiento por congestión venosa de la mucosa gastrointestinal y por disminución del gasto cardíaco que puede ocasionar un síndrome de malabsorción y posterior desnutrición e incluso caquexia (en caso de la ICC avanzada)
2) signos: trasudado en las cavidades corporales (derrame pleural [habitualmente bilateral; si unilateral frecuentemente en el lado derecho] y ascitis); hepatomegalia y dolor a la palpación (por distensión de la cápsula hepática; suele aparecer en caso de aumento rápido de la congestión); hígado duro y atrófico en casos de ICC de muchos años de evolución; ictericia leve; ingurgitación yugular, a veces reflujo hepatoyugular y signo de Kussmaul (aumento de la presión venosa yugular durante la inspiración, como en la pericarditis constrictiva).
3. Síntomas y signos comunes y otros (incluidos los de bajo gasto cardíaco):
1) síntomas: reducción de la tolerancia al esfuerzo físico, fatiga, cansancio, prolongación del tiempo de recuperación después del esfuerzo; en caso de ICC más avanzada: oliguria, disnea al inclinarse hacia delante (bendopnea, que aparece hasta 30 s después de haberse inclinado), palpitaciones, síntomas por disminución del flujo cerebral (mareos, síncopes, confusión [especialmente en personas mayores]), depresión, aumento rápido de peso (>2 kg/semana), o bien pérdida de peso (en ICC avanzada)
2) signos: palidez y frialdad en las extremidades, sudoración excesiva, raramente cianosis periférica (signos de activación simpática); taquicardia y auscultación de III tono cardíaco (a menudo en la disfunción sistólica del ventrículo izquierdo) o IV tono cardíaco (más que el III tono sugiere ICC diastólica aislada), aumento del componente pulmonar del II tono cardíaco. A veces puede auscultarse un soplo relacionado con una cardiopatía, que es la causa primaria de la ICC o bien con una afectación valvular secundaria a un aumento del tamaño del corazón; desplazamiento lateral del impulso apical; amplitud reducida de la presión arterial, elevación ligera de la presión arterial diastólica; pulso alternante (en la IC grave), pulso paradójico (raramente, p. ej. en taponamiento cardíaco); respiración de Cheyne-Stokes; a veces febrícula por vasoconstricción cutánea y disminución de la pérdida de calor.
4. Manifestaciones de la ICC con gasto cardíaco aumentado, relacionadas con circulación hipercinética: presión de pulso elevada (descenso de la presión arterial diastólica); latido apical de carácter vivo; pulso saltón; a veces pulsación del lecho ungueal (signo de Quincke); taquicardia; cambios en la auscultación (aumento de los tonos cardíacos, a veces III y IV tono, soplos mesosistólicos de eyección en el borde izquierdo del esternón, a veces soplo mesodiastólico en el foco mitral o tricúspide y zumbido venoso continuo, soplo de flujo acelerado en las arterias carótidas); aumento del calor y enrojecimiento de la piel (no aparece en la anemia; a veces presente solamente de manera local, p. ej. en la enfermedad de Paget o en caso de la fístula arteriovenosa); en caso de fístula arteriovenosa disminución de la frecuencia cardíaca tras presionar sobre la fístula.
5. Las manifestaciones de HFpEF son similares a los de la ICC con disfunción sistólica: disnea de esfuerzo y otras manifestaciones de congestión pulmonar; habitualmente no aparecen signos claros de hipoperfusión periférica. Se puede sospechar ICC con función sistólica preservada en enfermos con hipertensión arterial, obesidad o diabetes mellitus (especialmente en mujeres de edad avanzada), sin dilatación del ventrículo izquierdo en la radiografía, sin signos de antecedentes de infarto de miocardio, con signos de hipertrofia del ventrículo izquierdo en ECG y con IV tono cardíaco.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Pruebas de laboratorio:
1) niveles plasmáticos de péptidos natriuréticos: para descartar la IC:
a) en un enfermo sin empeoramiento agudo de los síntomas la IC es poco probable cuando BNP <35 pg/ml (<105 pg/ml en fibrilación auricular) y NT-pro-BNP <125 pg/ml (<365 pg/ml en fibrilación auricular)
b) en caso de acentuación rápida de los síntomas los puntos de corte son: BNP <100 pg/ml, NT-proBNP <300 pg/ml, MR-proANP <120 pmol/l
2) anemia (que aumenta o provoca la ICC) o hematocrito elevado (p. ej. en EPOC, cardiopatías con cortocircuito derecha-izquierda); la anemia habitualmente es normocítica, y con menos frecuencia microcítica, generalmente por déficit funcional de hierro (su disponibilidad está limitada para la eritropoyesis a pesar de que la cantidad corporal total de hierro es normal)
3) la hipo- o hiperpotasemia y la elevación de la creatinina pueden ser efectos adversos de los fármacos →más adelante
4) la hiponatremia por dilución (con volumen aumentado del agua extracelular; →Hiponatremia) puede aparecer en ICC avanzada sin tratamiento, o en caso de usar dosis demasiado bajas de IECA o ARA-II junto con el uso de diuréticos tiacídicos
5) aumento de los niveles de transaminasas, LDH y bilirrubina plasmática: en enfermos con congestión venosa sistémica con hepatomegalia
6) marcadores de déficit de hierro, más frecuentemente de carácter funcional: reducción de la saturación de transferrina; el descenso de ferritina aparece habitualmente con un déficit absoluto de hierro (puede no observarse si coexiste con un proceso inflamatorio).
PERSPECTIVA LATINOAMERICANA
El MR-proANP es poco utilizado en la práctica clínica en Chile, no está disponible para diagnóstico y seguimiento. En Colombia no se emplea de forma regular.
2. ECG, en general muestra signos de la enfermedad de base: enfermedad cardíaca isquémica, arritmias o alteraciones de la conducción, hipertrofia o sobrecarga.
3. Radiografía de tórax: habitualmente revela cardiomegalia (a excepción de la mayoría de los casos de circulación hipercinética e insuficiencia diastólica), signos de congestión pulmonar.
4. Ecocardiografía: es la prueba principal en el diagnóstico de la ICC. Permite la valoración de:
1) función sistólica del ventrículo izquierdo: mediante el análisis de la contractilidad segmentaria y global del ventrículo izquierdo y la medición de la FEVI (con el método de Simpson; ≤40 % indica una disfunción sistólica importante del ventrículo izquierdo; los valores 41-49 % se consideran la “zona gris” y uno de los factores diagnósticos de HFmrEF: requieren un diagnóstico diferencial profundo de las causas extracardíacas, como en HFpEF)
2) función diastólica del ventrículo izquierdo
3) anomalías anatómicas: hipertrofia, dilatación de las cámaras cardíacas, valvulopatías, cardiopatías congénitas. La valoración adicional de numerosos parámetros estructurales y funcionales del corazón tiene especial importancia en el diagnóstico diferencial, sobre todo en caso de la FEVI ≥40 %. En algunos casos (p. ej. mala ventana ecográfica, sospecha de disfunción de prótesis valvular, búsqueda de trombo en la orejuela izquierda en enfermos con fibrilación auricular, diagnóstico de la endocarditis bacteriana o cardiopatías congénitas) está indicada la ecocardiografía transesofágica. Para establecer la indicación de coronariografía y revascularización coronaria, puede estar indicada una ecocardiografía de estrés con dobutamina.
5. Coronariografía: indicada en caso de sospechar cardiopatía isquémica, después de un paro cardíaco de causa desconocida, en caso de arritmias ventriculares graves, ICC resistente al tratamiento o de etiología no aclarada, y antes de una intervención de cirugía cardíaca planificada.
6. Ergoespirometría: indicada en casos de discrepancia entre la intensidad de los síntomas y los parámetros objetivos del estadio de la enfermedad, para la indicación del trasplante cardíaco o en la inclusión en soporte circulatorio mecánico, así como para diferenciar entre causas cardíacas y pulmonares de la disnea.
7. TC multicorte y RMN: útiles en el diagnóstico de las causas de ICC y en el diagnóstico diferencial, cuando otros métodos (en general ecocardiografía y coronariografía) no permiten establecer el diagnóstico, especialmente para diferenciar las miocardiopatías, en el diagnóstico de tumores cardíacos, de enfermedades del pericardio y de cardiopatías congénitas complejas, así como en el diagnóstico de la viabilidad del miocardio para indicar la revascularización coronaria.
8. Biopsia endomiocárdica: indicada en caso de origen incierto de la IC en situaciones clínicas especiales y de sospecha de una enfermedad que requiere tratamiento específico: miocarditis (de células gigantes o eosinofílica), enfermedades infiltrativas o por almacenamiento (amiloidosis, sarcoidosis, hemocromatosis, enfermedad de Fabry), y para el diagnóstico del rechazo agudo del trasplante cardíaco.
Criterios diagnósticos
Según la definición universal (2021), se diagnostica la insuficiencia cardíaca cuando se presentan síntomas y/o signos típicos que guardan relación causal con las alteraciones funcionales y/o estructurales de corazón (p. ej. FEVI <50 %, cardiomegalia, signos de valvulopatía moderada o grave, o de hipertrofia ventricular izquierda moderada o grave, así como indicadores seleccionados de disfunción diastólica del ventrículo izquierdo [→más adelante]) y ≥1 de los siguientes criterios adicionales:
1) elevación de los péptidos natriuréticos (valores de corte →más arriba)
2) signos objetivos de congestión pulmonar (radiografía de tórax, ecocardiografía que indica una presión de llenado ventricular izquierdo elevada) y/o sistémica (sobre todo dilatación de las venas yugulares), eventualmente signos observados en mediciones invasivas (en la práctica poco utilizadas), en condición de reposo o tras una carga (p. ej. ejercicio físico). Adicionalmente se indicó que los signos de congestión pueden no presentarse en hipovolemia, cuando predominan los signos de disminución de gasto cardíaco. Los signos pueden estar ausentes en la etapa temprana de la enfermedad, sobre todo en HFpEF o HFmrEF, y en enfermos tratados con diuréticos. La mejoría del estado clínico tras aplicar el tratamiento farmacológico típico de la IC es una premisa diagnóstica importante.
El papel de la ecocardiografía en el algoritmo diagnóstico en caso de sospecha de la IC depende de la disponibilidad de los péptidos natriuréticos:
1) es posible una medición rápida → realizar ecocardiografía solamente en los enfermos con nivel elevado de péptidos natriuréticos
2) no está disponible → examen ecocardiográfico en la etapa temprana del diagnóstico.
En la práctica, HFmrEF o HFpEF en general se diagnostican con la presencia de síntomas o signos típicos de IC y contractilidad global del ventrículo izquierdo normal (FEVI ≥50 %) o solo ligeramente deprimida (FEVI 41-49 %), con un tamaño normal del ventrículo izquierdo, cuando no hay valvulopatía significativa ni causas extracardíacas de los síntomas. No es necesario cumplir con los criterios accesorios para establecer el diagnóstico de HFmrEF, siempre y cuando la medición de la FEVI sea fiable, pero su coexistencia hace que el diagnóstico sea más probable. Para establecer el diagnóstico de HFpEF es necesario cumplir ≥1 de los siguientes criterios accesorios: aumento del nivel de los péptidos natriuréticos (BNP >35 pg/ml o NT-proBNP >125 pg/ml; pero en ~20 % de los enfermos con HFpEF confirmada mediante exploraciones invasivas las concentraciones de BNP y NT-proBNP son normales) y confirmación de la disfunción diastólica del ventrículo izquierdo (independientemente de los indicadores tradicionales de influjo mitral por Doppler y el flujo en las venas pulmonares, se prefieren los parámetros obtenidos en la ecocardiografía Doppler tisular, es decir, la velocidad máxima protodiastólica del movimiento del anillo mitral [velocidad promedio de la onda E’ a nivel del anillo medial y lateral <9 cm/s] y el cociente promedio de la amplitud de la onda E del llenado mitral y de la onda E’ del movimiento del anillo [E/E’ promedio a nivel del anillo medial y lateral >13]). En caso de valores ambiguos de los antemencionados parámetros ecocardiográficos de la disfunción diastólica del ventrículo izquierdo se debe confirmar la presencia de anormalidades predisponentes a esa disfunción, es decir, hipertrofia del ventrículo izquierdo (índice de masa del ventrículo izquierdo ≥115 g/m2 en hombres y ≥95 g/m2 en mujeres) o dilatación de la aurícula izquierda (índice de volumen del ventrículo izquierdo >34 ml/m2; >40 ml/m2 en caso de fibrilación auricular).
PERSPECTIVA COLOMBIANA
Actualmente en Colombia para el diagnóstico de HFpEF se utiliza el H2FPEF score, desarrollado por la Mayo Clinic. Utiliza 6 variables clínicas y ecocardiográficas que se aplican a los pacientes que acuden al consultorio debido a disnea. Se evalúa la presencia de: 1) obesidad (H; heavy); 2) hipertensión (H); 3) fibrilación auricular (F); 4) hipertensión pulmonar (P); 5) edad > 60 años (E); y 6) presiones de llenado elevadas del ventrículo izquierdo (F; filling pressure).
Puntuación: 0-9 puntos; 0-1 ptos.: HFpEF descartada; 2-5 ptos.: se requieren pruebas adicionales; 6-9 ptos.: diagnóstico de HFpEF.
Con un área bajo la curva (AUC) de 0,841 (p < 0,0001), este score nos permite discriminar si la disnea de causa no explicada de un paciente se debe a un caso de HFpEF o a causas extracardíacas de disnea.
Diagnóstico diferencial
Causas principales de disnea →Disnea, edemas →Edemas, dilatación de venas yugulares →Venas yugulares, distensión.
TRATAMIENTOArriba
Incluye:
1) tratamiento de la enfermedad de base (p. ej. revascularización coronaria)
2) tratamiento crónico de la ICC →más adelante
3) prevención y tratamiento de las agudizaciones de la ICC →Insuficiencia cardíaca aguda.
Tratamiento no farmacológico
1. En caso de manifestaciones intensificadas que indiquen retención de sodio y de agua en el organismo (NYHA III-IV): limitar el aporte de sodio, en general a 2-3 g/d (<2 g/d si los síntomas persisten, sobre todo en caso de resistencia a diuréticos), y el aporte de líquidos hasta 1,5-2,0 l/d (imprescindible en caso de natremia <130 mmol/l).
2. Control regular del peso corporal:
1) un aumento de peso >2 kg durante 3 días puede indicar retención de agua debida a la ICC
2) reducción de peso en pacientes con obesidad
3) mejoría de la nutrición en enfermos con signos de desnutrición (IMC <22 kg/m2, peso <90 % del peso ideal).
3. Limitación del consumo de alcohol a 10-12 g/d para mujeres y ≤20-25 g/d para hombres. Abstinencia en caso de sospecha de miocardiopatía alcohólica.
4. Abandono del tabaquismo.
5. Evitar (si es posible) algunos fármacos: AINE clásicos y los coxibs (aumentan la retención de agua, reducen los efectos beneficiosos y aumentan el riesgo de efectos adversos de los diuréticos, IECA, ARA-II y antagonistas de la aldosterona), glucocorticoides (aumentan la retención de agua, riesgo de hipopotasemia), antiarrítmicos de clase I (sobre todo Ia y Ic) y antidepresivos tricíclicos (efecto proarrítmico, riesgo de agudización de la ICC e hipotensión; los inhibidores de la recaptación de serotonina son relativamente seguros), dronedarona (aumenta la mortalidad por causas cardiovasculares y el riesgo de agudización de la ICC), sotalol (efecto proarrítmico y aumento de riesgo de muerte), verapamilo y diltiazem (se pueden utilizar en HFpEF; el verapamilo a dosis altas está recomendado en la miocardiopatía hipertrófica), calcioantagonistas dihidropiridínicos (pueden utilizarse solamente los de acción prolongada como amlodipino y felodipino en caso de coexistencia de hipertensión arterial o angina de pecho), α1-bloqueantes (aumentan la retención de agua y el riesgo de hipotensión; en caso de alteración de la micción por la hipertrofia de próstata → sustituirlos por un inhibidor de 5-α-reductasa), moxonidina (aumenta el riesgo de muerte), metformina (en ICA o insuficiencia respiratoria, hepática o renal graves por el riesgo de acidosis láctica; se puede utilizar de forma segura en la ICC estable), derivados de tiazolidinediona (rosiglitasona y pioglitasona; aumentan la retención de agua, contraindicación absoluta en la clase III y IV de NYHA), saxagliptina y alogliptina (aumentan el riesgo de exacerbaciones de la ICC), antraciclinas (contraindicadas en casos con FEVI disminuida; en caso de indicaciones vitales considerar el uso de doxorrubicina en forma liposomal o tras la administración previa de dexrazoxano; monitorizar estrechamente la función del ventrículo izquierdo).
6. Vacunación contra la gripe (anual), el neumococo y la COVID-19.
7. Actividad física regular y moderada; en situación clínica estable se debe realizar entrenamiento físico, en lo posible.
8. Evitar viajes a altitudes >1500 m sobre el nivel del mar, o a regiones calurosas y húmedas. Se prefiere el avión como medio de transporte para evitar las consecuencias de la inmovilización prolongada.
9. Diagnóstico y tratamiento de la depresión mayor.
10. En caso de síndrome de apnea central u obstructiva del sueño considerar el tratamiento con CPAP, pero la servoventilación adaptativa está contraindicada en enfermos con HFrEF y síndrome de apnea central del sueño →Síndrome de apnea e hipopnea obstructivas del sueño.
Tratamiento farmacológico
Tratamiento farmacológico de la ICC con disfunción sistólica del ventrículo izquierdo importante →fig. 2.19-1.
Observaciones generales: iniciar el tratamiento con una dosis baja e ir aumentándola hasta la dosis deseada documentada en ensayos clínicos, o hasta la dosis máxima tolerada.
Se debe instaurar la farmacoterapia estándar de HFrEF lo antes posible tras estabilizar la circulación. Dentro de lo posible, en los enfermos hospitalizados instaurar el tratamiento con β-bloqueante, IECA (eventualmente ARA-II; IECA o ARA-II puede sustituirse por INRA [→más adelante]; en enfermos que antes no recibían IECA o ARA-II, puede considerarse INRA), antagonista de la aldosterona y gliflozina antes del alta hospitalaria. No es necesario optimizar las dosis de IECA (eventualmente de ARA-II), β-bloqueante ni antagonista de la aldosterona antes de asociar gliflozina o INRA.
Para optimizar el tratamiento de HFrEF se debe programar un control ambulatorio periódico de los parámetros hemodinámicos (frecuencia cardíaca, presión arterial, signos de congestión en la circulación menor y mayor, signos de deshidratación) y bioquímicos (niveles séricos de potasio y creatinina) para detectar los eventuales efectos adversos de los fármacos arriba mencionados y eventualmente modificar la dosificación de diuréticos y otros fármacos.
1. IECA: utilizar en todos los enfermos con FEVI ≤40 %, independientemente de los síntomas clínicos. Dosificación →tabla 2.19-2.
Principios de uso:
1) Antes de empezar el tratamiento con IECA evitar forzar excesivamente la diuresis (se puede bajar la dosis del diurético 24 h antes); para reducir el riesgo de hipotensión grave, empezar el tratamiento con IECA por la noche, cuando el enfermo va a la cama, y si el tratamiento empieza por la mañana → observar al paciente y controlar la presión arterial durante las primeras horas después de la primera dosis del medicamento.
2) Considerar aumentar la dosis después de 2-4 semanas del uso de IECA; no aumentar la dosis en caso de empeoramiento significativo de la función renal o hiperpotasemia. En enfermos hospitalizados o controlados estrictamente en otras condiciones se puede aumentar la dosis más rápidamente, si el fármaco es bien tolerado.
3) Esquema de control de la función renal y de los niveles séricos de electrólitos: al inicio → en 1-2 semanas del tratamiento con IECA o tras un aumento de dosis → después de llegar a la dosis de mantenimiento tras 1-2 semanas, a continuación cada 4 meses.
Actuación en caso de reacciones adversas:
1) Empeoramiento de la función renal: después de empezar el tratamiento con IECA se puede observar un aumento de los niveles plasmáticos de urea y de creatinina que no debe considerarse clínicamente importante, salvo que sea rápido y significativo. Comprobar si la causa responsable es hipovolemia, deshidratación, o el consumo de otros fármacos (p. ej. AINE, coxibs, ciclosporina, dosis demasiado altas de diuréticos). Vigilar estrictamente los niveles de creatinina
a) un aumento del nivel de la creatinina en ≤50 % es aceptable si no supera 265 μmol/l (~3 mg/dl)
b) aumento en un 50-100 % o >265 μmol/l, pero ≤310 μmol/l (~3,5 mg/dl) → reducir la dosis de IECA a la mitad
c) aumento en >100 % o hasta >310 μmol/l (~3,5 mg/dl) → suspender el IECA inmediatamente.
2) Hiperpotasemia: verificar si otros fármacos (p. ej. suplementos de potasio, diuréticos ahorradores de potasio) son la causa de la hiperpotasemia y suspenderlos; observar estrictamente el nivel del potasio
a) aumento >5,5 mmol/l → reducir la dosis del IECA a la mitad
b) aumento >6,0 mmol/l → suspender el IECA inmediatamente e iniciar la reducción de la potasemia.
3) Hipotensión sintomática (p. ej. vértigo): a menudo cede con el tiempo de uso de IECA; considerar reducir la dosis de diuréticos y otros fármacos antihipertensivos (excepto aquellos que constituyen un estándar en el tratamiento de HFrEF), eventualmente planificar un esquema diario de administración de fármacos a horas distintas.
4) Tos (en ~10 % de los enfermos): no depende de la dosis del IECA; aparece en general en la primera semana de su uso, pero puede presentarse hasta varios meses más tarde. Habitualmente disminuye a los 3-5 días después de suspender el fármaco, pero puede persistir incluso varios meses. En general reaparece después de introducir otro IECA. Si la tos es persistente y gravosa → cambiar el IECA por un ARA-II.
5) Angioedema (en <1 % de los enfermos) → sustituir el IECA por un ARA-II (muy raramente puede aparecer también con los ARA-II).
2. ARA-II: utilizar en caso de FEVI ≤40 % y NYHA II-IV, y si el enfermo no tolera los IECA (ni INRA) por la tos persistente o angioedema (utilizar ARA-II en vez de IECA; el enfermo también debe recibir β-bloqueante y antagonista de la aldosterona) o cuando los síntomas persisten a pesar del uso de IECA y β-bloqueante (en esta situación añadir ARA-II solamente en caso de intolerancia a antagonistas de la aldosterona; no utilizar conjuntamente IECA, ARA-II y antagonista de la aldosterona u otro diurético ahorrador de potasio). Según las guías norteamericanas, los ARA-II se recomiendan también tras un infarto de miocardio con disfunción sistólica del ventrículo izquierdo asintomática si no se toleran los IECA.
Principios de uso y actuación en caso de reacciones adversas como en el caso de los IECA, salvo la tos. Dosificación →tabla 2.19-2.
3. β-bloqueantes: utilizar con la FEVI ≤40 % y NYHA II-IV, o en disfunción sistólica del VI asintomática después del infarto de miocardio, cuando el paciente normalmente ya toma IECA (o INRA, o eventualmente ARA-II), y su estado clínico es estable (p. ej. no ha precisado últimamente cambio de dosis de diurético). Las guías norteamericanas también recomiendan estos fármacos en disfunción sistólica del ventrículo izquierdo asintomática, sin antecedentes de infarto de miocardio, y además (durante 3 años y a considerar un período más largo) en enfermos tras infarto de miocardio sin disfunción sistólica del ventrículo izquierdo ni síntomas de ICC. Se puede empezar con precaución el tratamiento con β-bloqueante en enfermos con descompensación reciente de la ICC, si su estado clínico ha mejorado con otros fármacos, no se requieren inotrópicos positivos iv. (y de su última administración han pasado varios días) y se puede vigilar al enfermo durante ≥24 h. Dosificación →tabla 2.19-3. Principios de uso. Aumento de la dosis: visitas cada 2-4 semanas para doblar la dosis en cada visita (en algunos enfermos más lentamente). No aumentar la dosis si se presentan síntomas de agudización de la ICC, hipotensión sintomática (p. ej. vértigo) o bradicardia <50/min. Después de iniciar el tratamiento con un β-bloqueante o tras aumentar su dosis, se debe informar al enfermo de la posibilidad de un aumento rápido del peso corporal, para detectar precozmente la agudización de la ICC y aumentar la dosis de diurético.
Actuación en caso de reacciones adversas:
1) hipotensión sintomática: a menudo cede con el tiempo; considerar la reducción de la dosis de otros antihipertensivos (salvo los IECA o ARA-II), p. ej. diurético o nitrato, eventualmente planificar un esquema diario de administración de fármacos a horas distintas.
2) agudización de la ICC → aumentar la dosis de diuréticos (a menudo es suficiente hacerlo de manera temporal) y continuar el tratamiento con un β-bloqueante si es posible (con frecuencia a dosis más baja); si es necesario, suspender el β-bloqueante y considerar la administración de inhibidor de fosfodiesterasa tipo 3 (milrinona →tabla 2.19-3)
3) bradicardia excesiva → realizar ECG (eventualmente Holter ECG) para descartar bloqueo cardíaco; considerar la suspensión de la digoxina si el enfermo la recibe; puede ser necesaria la reducción de la dosis del β-bloqueante o su suspensión.
4. Bloqueantes del receptor de aldosterona (antagonistas de aldosterona: eplerenona, espironolactona): utilizar cuando:
1) FEVI ≤40 % y NYHA II-IV o
2) FEVI ≤40 %, el enfermo ha sufrido recientemente un infarto de miocardio y presenta síntomas clínicos de ICC o diabetes mellitus. En ambos casos el paciente debe recibir IECA (o INRA, o eventualmente ARA-II) y β-bloqueante (pero no IECA + ARA-II). Dosificación →tabla 2.19-4.
Principios de uso:
1) el tratamiento puede iniciarse tras comprobar que los niveles séricos de potasio <5,0 mmol/l, y la concentración de creatinina <220 μmol/l (~2,5 mg/dl), o que la TFGe >30 ml/min/1,73 m2 (según las guías de AHA, ACC y HFSA [2022], las guías de la ESC [2021] indican la necesidad de guardar especial precaución si estas condiciones no se cumplen); considerar la reducción de la dosis inicial y deseada a la mitad si la TFGe <60 ml/min/1,73 m2
2) después de empezar el tratamiento considerar incrementar la dosis al cabo de 4-8 semanas; no aumentar la dosis en caso de un empeoramiento significativo de la función renal o de hiperpotasemia
3) controlar la función renal y los electrólitos séricos al inicio, 1 semana y 4 semanas tras empezar el tratamiento o aumentar la dosis, a continuación, a los 2, 3, 6, 9 y 12 meses, y después cada 4 meses
4) no utilizar en embarazadas.
Actuación en caso de efectos adversos:
1) empeoramiento de la función renal: observar estrictamente los niveles séricos de creatinina:
a) aumento >220 µmol/l (~2,5 mg/dl) → reducir la dosis a la mitad (p. ej. 25 mg cada 2 días)
b) aumento >310 μmol/l (~3,5 mg/dl) → suspender inmediatamente
2) hiperpotasemia: observar estrictamente:
a) aumento >5,5 mmol/l → reducir la dosis a la mitad
b) aumento >6,0 mmol/l → suspender inmediatamente e iniciar la reducción de la potasemia
3) dolor y/o aumento del tamaño de las mamas → sustituir espironolactona por eplerenona.
5. Antagonistas de los receptores tipo 1 de la angiotensina II e inhibidores de la neprilisina (INRA; el primer fármaco de este grupo es la combinación de valsartán y sacubitril en un comprimido): utilizar en lugar de IECA o ARA-II en los enfermos con una FEVI ≤40 % y con síntomas persistentes (clase II-III de NYHA) a pesar del uso de IECA (o ARA-II) y un β-bloqueante y antagonista de la aldosterona a dosis óptimas. También se debe cambiar IECA (o ARA-II) por INRA en los demás enfermos sintomáticos con una FEVI ≤40 %, sobre todo hospitalizados por una exacerbación de la insuficiencia cardíaca; se debe asociar INRA antes del alta hospitalaria tras estabilizar el sistema cardiovascular. En los enfermos que hasta el momento no habían recibido IECA ni ARA-II, se puede considerar el uso de INRA durante la hospitalización por insuficiencia cardíaca recién diagnosticada o exacerbada, pero en este caso no es necesario optimizar previamente la dosificación de los demás fármacos que forman parte de estándar de farmacoterapia de HFrEF. Los expertos estadounidenses (ACC 2021) subrayan más fuertemente la preferencia por INRA frente a IECA y ARA-II, indicando que antes de implementar INRA no es necesario tratar a los pacientes con un antagonista de la aldosterona, pero simultáneamente en estos casos recomiendan guardar especial precaución por los eventuales efectos adversos.
Contraindicaciones: embarazo y lactancia, estenosis bilateral de arterias renales, estenosis de la arteria renal con un riñón único funcionante, o del riñón dominante, angioedema (asociado o no al uso de IECA o a ARA-II) o reacción anafiláctica en relación con el uso de valsartán o INRA, hipotensión asintomática (<100 mm Hg) y sintomática, nivel sérico de potasio >5,4 mmol/l, TFGe <30 ml/min/1,73 m2 (los expertos americanos admiten el uso de INRA siempre y cuando se guarde especial precaución), daño hepático significativo (clase C de Child-Pugh →tabla 7.12-1).
Principios de uso:
1) Antes de introducir el fármaco, es imprescindible suspender IECA ≥36 h (riesgo de angioedema).
2) Dosis inicial 49/51 mg 2 × d (24/26 mg 2 × d en enfermos no tratados con IECA/ARA-II o que reciben IECA/ARA-II a una dosis equivalente a ≤10 mg/d de enalapril o ≤160 mg/d de valsartán, así como en caso de una TFGe <60 ml/min/1,73 m2 [<30 ml/min/1,73 m2 según las guías americanas], disfunción hepática moderada [clase B de Child-Pugh], presión arterial 100-110 mm Hg y en enfermos ≥75 años); dosis objetivo 97/103 mg 2 × d.
3) Considerar un aumento de la dosis a las 2-4 semanas. No se debe incrementar en caso de hipotensión, empeoramiento significativo de la función renal o hiperpotasemia. Nota: debido al riesgo de hipotensión asociado al uso de INRA, en comparación con IECA o ARA-II, guardar especial precaución y aumentar la dosis más lentamente (cada 3-4 semanas) al asociar INRA a los enfermos no tratados con IECA o ARA-II.
4) Esquema de control de la función renal y de los niveles séricos de electrólitos igual que en caso de IECA o ARA-II: indicada una eventual reducción de las dosis de diuréticos con el fin de prevenir la disfunción renal, sobre todo en enfermos con presión arterial baja.
5) Nota: con el uso de INRA, la valoración de la gravedad de la ICC se debe realizar con el NT-proBNP y no el BNP (sustrato de la neprilisina).
6) Antes de reintroducir el IECA por intolerancia a INRA, suspender el INRA por ≥36 h.
6. Utilizar los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2), las denominadas gliflozinas (dapagliflozina, empagliflozina) en enfermos con una FEVI ≤40 % en clase II-IV de NYHA que simultáneamente reciben una terapia de ICC estándar (IECA o INRA [eventualmente ARA-II], β-bloqueante y antagonista de la aldosterona): con o sin una diabetes mellitus tipo 2 coexistente. Antes de asociar gliflozina no es necesario conseguir dosis óptimas de los fármacos básicos utilizados en ICC (→más arriba). También se recomienda utilizar gliflozinas (dapagliflozina, empagliflozina, canagliflozina, sotagliflozina) en enfermos con diabetes mellitus tipo 2 sin IC, pero con síntomas de una enfermedad cardiovascular ateroesclerótica o con otro estado asociado a un riesgo cardiovascular muy alto o alto.
Contraindicaciones: TFGe <20-25 ml/min/1,73 m2, embarazo y lactancia, hipotensión sintomática o asintomática <95 mm Hg, reacciones alérgicas.
Principios de uso de gliflozinas y de prevención de sus efectos adversos:
1) Dosificación. Dapagliflozina y empagliflozina: dosis inicial y deseada de 10 mg 1 × d.
2) La diabetes mellitus tipo 1 no es contraindicación absoluta, pero es necesario actuar con especial precaución por el riesgo de cetoacidosis.
3) Debido al riesgo de cetoacidosis (también euglucémica), es necesaria una especial precaución ante la presencia de factores de riesgo (entre otros, deshidratación, abuso de alcohol, disminución de la dosis de insulina). Suspender el fármaco antes de una cirugía mayor programada o en caso de que se desarrolle una enfermedad aguda grave.
4) Recomendar guardar estrictamente las reglas de higiene con en fin de prevenir infecciones fúngicas de los genitales, vías urinarias y piel.
5) En enfermos tratados con diuréticos (de asa o tiacídicos) o INRA (especialmente de edad avanzada o con síndrome de fragilidad) puede producirse una respuesta diurética intensa, deshidratación, hipotensión y disminución de TFGe: está indicado controlar el balance hídrico, estado de hidratación y función renal, y eventualmente reducir la dosis de diuréticos y/o aumentar la ingesta de líquidos. Nota: el primer mes tras asociar gliflozina a menudo se produce un ligero descenso de TFGe (normalmente en ≤5 ml/min/1,73 m2), y el efecto nefroprotector se manifiesta más tarde (en general el 2.º año del tratamiento).
6) A veces es necesaria la disminución de las dosis de otros fármacos antidiabéticos (sobre todo de insulina y sulfonilureas) para evitar hipoglucemia.
Efectos adversos: →Diabetes mellitus.
7. Diuréticos (de asa, tiacídicos/tipo tiacida, ahorradores de potasio): utilizar cuando existen síntomas de sobrecarga de volumen; posteriormente, administrar a la dosis más baja capaz de prevenir la retención de líquidos. Aseguran el control más rápido de los síntomas de ICC (en unos días tras instaurar el tratamiento). Dosificación →tabla 2.19-4.
Principios de uso:
1) en la mayoría de los enfermos, sobre todo con IC moderada o grave, utilizar diuréticos de asa en lugar de tiacídicos por su mejor eficacia en la eliminación del agua libre; si la TFGe <30 ml/min/1,73 m2 → utilizar diuréticos tiacídicos solamente junto con un diurético de asa
2) ajustar las dosis según las necesidades del enfermo, observar estrictamente el estado clínico y los niveles séricos de potasio, sodio y creatinina (1-2 semanas desde el inicio del tratamiento y después de cada modificación de dosis)
3) aumentar las dosis hasta obtener mejoría de los síntomas y signos de la sobrecarga de volumen (la rapidez recomendada de reducción del peso corporal es de 0,5-1 kg/d); modificar las dosis de diuréticos, especialmente después de conseguir el peso seco deseado, para evitar un deterioro de la función renal y una deshidratación excesiva
4) animar a la automodificación de la dosis según el peso corporal diario y otros síntomas clínicos de retención de líquidos en el organismo
5) en caso de resistencia a los diuréticos → verificar si el paciente ingiere los medicamentos pautados adecuadamente, si no toma AINE, coxibs, glucocorticoides, ciclosporina o estrógenos, cuál es la cantidad de líquidos que bebe → aumentar la dosis de diurético → considerar sustituir la furosemida por otro diurético de asa → añadir antagonista de la aldosterona, si todavía no se utiliza y no está contraindicado → añadir tiacida o acetazolamida, a continuación eventualmente gliflozina, si todavía no se utiliza → administrar diurético de asa 2 × d o en ayunas → considerar un diurético de asa en perfusión iv. de corta duración → considerar dopamina iv. a dosis baja → eventualmente considerar el uso de nesiritida (BNP humano recombinante) iv. (si no hay hipotensión) o de antagonista del receptor de vasopresina VO o iv. (si está disponible) → considerar la ultrafiltración o hemodiálisis.
Actuación en caso de efectos adversos:
1) Hipopotasemia/hipomagnesemia → inmediatamente usar suplementos de potasio o magnesio, considerar aumentar la dosis de IECA, ARA-II, INRA o antagonista de la aldosterona, con el fin de prevenir la hipopotasemia a largo plazo.
2) Hiperpotasemia: puede aparecer cuando se utilizan IECA o ARA-II o INRA junto con los diuréticos ahorradores de potasio, también antagonistas de la aldosterona; no utilizar diuréticos ahorradores de potasio que no sean antagonistas de la aldosterona.
3) Hiponatremia (→Hiponatremia) con hipervolemia → reducir la ingesta de líquidos → suspender el diurético tiacídico y sustituirlo por un diurético de asa (si es posible) → aumentar la dosis de diurético de asa → usar IECA o ARA-II o INRA (si el paciente no los recibía) o aumentar su dosis → considerar antagonista del receptor de vasopresina (si está disponible) → utilizar fármacos inotrópicos iv. → considerar la ultrafiltración.
4) Hiponatremia con hipovolemia → administrar solución de NaCl al 0,9 % iv. (en enfermos con hiponatremia crónica NaCl al 3 % solamente en casos graves [≤120 mmol/l] con manifestaciones clínicas de edema cerebral) → suspender diurético tiacídico o sustituirlo por un diurético de asa (si es posible) → reducir la dosis de diuréticos de asa o suspenderlos (si es posible).
5) Hiperuricemia y gota →Gota, evitar los AINE.
6) Hipovolemia → evaluar el estado de hidratación, considerar reducir la dosis de diuréticos.
7) Insuficiencia renal → verificar la existencia de hipovolemia → descartar el uso de otros fármacos nefrotóxicos (p. ej. AINE) → suspender el antagonista de la aldosterona → si el enfermo toma un diurético de asa junto con diurético tiacídico, suspender el diurético tiacídico → considerar reducir la dosis de IECA/ARA-II → considerar la ultrafiltración.
8) Los diuréticos de asa a dosis demasiado altas pueden tener un efecto ototóxico.
8. Ivabradina: considerar su uso si:
1) FEVI ≤35 %, ritmo sinusal preservado ≥70/min y clase II-III de NYHA a pesar del uso de farmacoterapia de ICC estándar a dosis óptimas
2) los β-bloqueantes están contraindicados o no se toleran.
Principios de uso: dosis inicial 5 mg 2 × d (eventualmente 2,5 mg 2 × d en enfermos de ≥75 años; el fármaco debe utilizarse con comidas), aumentar la dosis a las 2 semanas en 2,5 mg 2 × d (hasta máx. 7,5 mg 2 × d) si la frecuencia del ritmo sinusal es >60/min (el uso de ivabradina no puede ser pretexto para la reducción de la dosis del β-bloqueante sin una justificación importante).
Actuación en caso de reacciones adversas:
1) disminución asintomática de la frecuencia del ritmo sinusal <50/min o bradicardia sintomática → reducir la dosis del fármaco a 2,5 mg 2 × d, y si los síntomas no ceden → suspender el fármaco
2) bradicardia con inestabilidad hemodinámica → suspender el fármaco, considerar la administración de agonista β iv. (p. ej. isoprenalina), y en caso de necesidad, la estimulación cardíaca transitoria
3) alteraciones de la visión (sensación transitoria de luz intensa en una parte del campo visual que puede dificultar la conducción de vehículos), en general aparecen en los 2 primeros meses de tratamiento: ceden espontáneamente en la mayoría de los casos; si la visión empeora considerablemente, se debe considerar la retirada del fármaco.
Nota: un episodio de fibrilación o flutter auricular durante el tratamiento con ivabradina aumenta el riesgo de ritmo ventricular acelerado si el enfermo no recibe simultáneamente un β-bloqueante o lo recibe a dosis bajas. En estos casos, hay que suspender la ivabradina. En caso de que se planee la cardioversión eléctrica, realizarla ≥24 h después de la administración de la última dosis de ivabradina.
9. Digoxina: iv. como fármaco de elección (como alternativa de amiodarona iv. si no se puede realizar la cardioversión), indicada en enfermos con una FEVI ≤40 % y fibrilación o flutter auricular hemodinámicamente inestable (sin vía de conducción accesoria) con función ventricular rápida; tras estabilizar el estado clínico se prefiere asociarla a un β-bloqueante (se debe ajustar las dosis a la frecuencia ventricular; valores objetivo: inicialmente <110/min, a continuación [sobre todo si los síntomas persisten o se presenta la taquicardiomiopatía] eventualmente <80/min en reposo y <110/min durante un esfuerzo moderado). Si el estado del paciente con fibrilación o flutter auricular y una frecuencia ventricular alta es estable, utilizar digoxina VO cuando el β-bloqueante no se tolera, resulta ineficaz o está contraindicado; si el efecto de asociación de digoxina al β-bloqueante no es satisfactorio, se debe reemplazarla por amiodarona, y luego eventualmente se puede considerar la combinación triple de digoxina, β-bloqueante y amiodarona (con especial precaución para evitar bradicardia). Se puede considerar utilizar la digoxina VO (para reducir el riesgo de exacerbación de la ICC) en enfermos en ritmo sinusal, con FEVI ≤45 %, con síntomas de ICC persistentes (NYHA II-IV) a pesar del uso de IECA o INRA (eventualmente ARA-II), β-bloqueante, gliflozina y antagonista de la aldosterona a dosis óptimas (en enfermos con una frecuencia en ritmo sinusal ≥70/min se prefiere el tratamiento con ivabradina). Contraindicaciones: miocardiopatía hipertrófica con obstrucción del tracto de salida, síndrome de preexcitación, hipopotasemia, hipercalcemia, arritmias ventriculares graves, amiloidosis cardíaca (la digoxina se une al amiloide), taquicardia auricular multifocal, previo a la cardioversión eléctrica programada; bradicardia, bloqueo AV de 2.º y 3.er grado, y en la disfunción del nodo sinusal (si el paciente no tiene marcapasos).
Principios de uso:
1) En enfermos mayores con función renal alterada, hipotiroidismo o con bajo peso corporal: 0,0625 o 0,125 mg/d (sin utilizar dosis de carga). Se consiguen niveles séricos estables del fármaco después de ~7 días.
2) En los enfermos con fibrilación o flutter auricular con respuesta ventricular rápida e inestabilidad hemodinámica (sin tratamiento previo con glucósidos digitálicos): dosis inicial 0,25-0,5 mg iv. (hasta alcanzar una dosis de 1 mg en 8-24 h). Después dosis de mantenimiento 0,125-0,25 mg 1 × d VO.
3) En los demás enfermos (con fibrilación o flutter auricular sin inestabilidad clínica y en los enfermos en ritmo sinusal): dosis inicial y de mantenimiento 0,125-0,25 mg/d VO.
4) No hay evidencia de que los controles regulares del nivel sérico de digoxina se relacionen con mejores resultados (rango terapéutico 0,5-1,2 ng/ml; óptimo 0,5-0,9 ng/ml). Eventualmente, se puede considerar determinar sus niveles si es difícil establecer la dosis a partir de los elementos clínicos (con mayor frecuencia ante la insuficiencia renal o con dispositivo de asistencia ventricular).
5) La amiodarona, el diltiazem, el verapamilo, algunos antibióticos (macrólidos, tetraciclinas), los inhibidores de la bomba de protones, los H2-bloqueantes y la quinidina pueden aumentar los niveles de digoxina en sangre.
Actuación en caso de reacciones adversas →Digoxina.
PERSPECTIVA CHILENA
En Chile no existe digoxina iv., solo está disponible el lanatósido C. Dosificación: habitualmente 0,4 mg iv., puede repetirse si es necesario para control de la frecuencia cardíaca (en general no más de 3 dosis en 24 h).
10. Hidralazina con dinitrato de isosorbida: en enfermos con una FEVI ≤40 %, en clase II-IV NYHA se puede considerar como alternativa para IECA, ARA-II e INRA en caso de intolerancia a todos estos fármacos (entonces utilizar también β-bloqueantes y antagonistas de la aldosterona), y también como fármacos adicionales en enfermos de raza negra con una FEVI ≤35 % (o FEVI ≤45 % y dilatación del ventrículo izquierdo), cuando los síntomas intensos de IC (NYHA III-IV) se mantienen a pesar del uso de IECA (o ARA-II o INRA), β-bloqueante y antagonista de la aldosterona. Reacciones adversas: hipotensión sintomática, taquicardia, artralgia, mialgia, lupus inducido por fármacos.
11. Tratamiento anticoagulante: en caso de indicaciones específicas, como la fibrilación o el flutter auricular paroxísticos o persistentes (tratamiento indicado con CHA2DS2-VASc ≥2 ptos. en hombres y ≥3 ptos. en mujeres [considerando su uso en el caso de unos valores de 1 y 2, respectivamente], considerar en enfermos con amiloidosis cardíaca independientemente del valor de CHA2DS2-VASc), trombo intracardíaco, o antecedentes de embolia periférica.
12. Complejo de hierro(III)-carboximaltosa iv.: considerar en enfermos con síntomas de IC y una FEVI ≤45 % (también en los recién hospitalizados por empeoramiento de ICC y con una FEVI <50 %), si aparece déficit de hierro (concentración de ferritina sérica <100 µg/l o 100-299 µg/l y con saturación de transferrina <20 %), independientemente de la coexistencia de anemia.
13. Ácidos grasos polinsaturados n-3: no hay datos concluyentes sobre su eficacia. Puede considerarse la dosis de 1 g 1 × d.
Tratamiento de HFpEF o HFmrEF
1. Tratamiento óptimo de la enfermedad de base: p. ej. control estricto de la presión arterial (bajar <140/90 mm Hg, a continuación opcionalmente hasta <130/80 mm Hg, si esta presión se tolera bien por el enfermo; sin embargo en las guías europeas relativas a la prevención de enfermedades cardiovasculares [ESC 2021] se recomienda una presión objetivo de 120-129/70-79 mm Hg en personas <70 años y de 130-139/70-79 mm Hg en personas ≥70 años), uso preferible de fármacos antihipertensivos en los que se ha documentado el efecto de reducir la progresión o provocar la regresión de la hipertrofia del ventrículo izquierdo (IECA, ARA-II y antagonistas de la aldosterona, con un control insuficiente de la presión arterial se puede asociar un calcioantagonista dihidropiridínico; también se utilizan β-bloqueantes [cuando están indicados] y diuréticos [fármacos de elección ante los síntomas de hiperhidrosis]); farmacoterapia combinada y revascularización en caso de enfermedad coronaria.
Los beneficios clínicos de la farmacoterapia estándar de ICC pueden ser mayores en enfermos con HFmrEF que con HFpEF. En enfermos con HFmrEF o HFpEF, las guías estadounidenses (AHA, ACC y HFSA [2022]) conceden una mayor clase de recomendación al uso de gliflozinas ("se debe considerar") que al uso de INRA, IECA, ARA-II, β-bloqueantes y antagonistas de la aldosterona ("se puede considerar"), mientras que las guías europeas (2021) proponen para HFmrEF una recomendación de "se puede considerar" para IECA, INRA, ARA-II, β-bloqueantes y antagonistas de la aldosterona, sin mencionar gliflozinas en este contexto. En enfermos con HFmrEF o HFpEF, en los cuales se produjo un aumento de la FEVI, y antes se diagnosticó HFrEF, se debe continuar la farmacoterapia estándar de ICC anteriormente implementada; no obstante, no está claro si este tratamiento debe iniciarse sin que se haya utilizado previamente.
2. Restricción del consumo de sodio y de líquidos: como en HFrEF.
3. Fármacos que bajan la frecuencia ventricular: β-bloqueante para mejorar el llenado ventricular izquierdo por prolongación de la diástole (eventualmente a considerar el objetivo de la frecuencia cardíaca en reposo de 60-70/min, sobre todo en enfermos después de infarto de miocardio o con angina de pecho). Nota: como en HFpEF el aumento de la frecuencia cardíaca es el mecanismo principal del aumento del gasto cardíaco durante el esfuerzo, se debe evitar tanto la taquicardia como el enlentecimiento excesivo del ritmo. En caso de contraindicaciones o intolerancia a los β-bloqueantes → verapamilo (a dosis altas en miocardiopatía hipertrófica con síntomas de ICC) o diltiazem (contraindicado en FEVI <50 %). Es necesario actuar con especial precaución (evitar la bradicardia) al asociar β-bloqueantes con verapamilo o diltiazem. La digoxina está indicada en la terapia combinada en enfermos con fibrilación auricular con un ritmo ventricular rápido a pesar de administrar un β-bloqueante, verapamilo o diltiazem en monoterapia (reduce el ritmo ventricular sobre todo en reposo, mientras que los β-bloqueantes durante el esfuerzo). Se debe considerar la posibilidad de revertir a ritmo sinusal.
4. Diuréticos: administrar en caso de síntomas de retención de líquidos. Hay que utilizarlos con precaución para evitar una disminución exagerada del gasto cardíaco e hipotensión (está indicado controlar la presión arterial en decúbito y en bipedestación), así como empeoramiento de la función renal.
5. Tafamidis: se recomienda en enfermos con HFpEF o HFmrEF (clase I-II de NYHA) provocada por una miocardiopatía amiloide por transtiretina.
Tratamiento invasivo
1. Terapia de resincronización cardíaca (TRC): se introducen 2 electrodos para la estimulación del ventrículo derecho y del ventrículo izquierdo, y un electrodo más en la aurícula derecha que sincroniza la estimulación de los ventrículos con el ritmo propio de las aurículas. Mejora la tolerancia al esfuerzo y reduce la frecuencia de las hospitalizaciones por agudización. En los enfermos en ritmo sinusal conservado reduce también el riesgo de muerte.
Criterios de indicación para la TRC (opción TRC-P, es decir, sin función de DAI o TRC-D, con función de DAI):
1) Ritmo sinusal conservado, FEVI ≤35 %, persistencia de síntomas de ICC (NYHA II-IV) a pesar de tratamiento farmacológico óptimo y QRS ≥130 ms con BRI (≥150 ms con morfología distinta al BRI).
2) En caso de fibrilación auricular persistente:
a) si la FEVI es ≤35 %, la NYHA III-IV y los complejos QRS son ≥130 ms, siempre y cuando sea posible obtener una estimulación biventricular cercana al 100 %; si la estimulación biventricular no es plena (<90-95 %), considerar también la ablación del nodo AV
b) si la FEVI es <40 % (y también 41-49 % según las guías de la ESC relativas a la estimulación cardíaca artificial y terapia de resincronización [2021]) y en presencia de las indicaciones de ablación de la unión AV para controlar la frecuencia cardíaca, independientemente de la anchura de los complejos QRS.
3) En caso de indicaciones convencionales para la estimulación del ventrículo derecho por causa de bradiarritmia (tanto en enfermos con el ritmo sinusal preservado como en aquellos con fibrilación auricular) y sin otras indicaciones para el TRC, se recomienda el implante del dispositivo de TRC (y no primero de marcapasos), independientemente de la anchura QRS y presencia de síntomas de ICC con una FEVI ≤40 % (también a considerar en una FEVI 41-49 %) en enfermos con previsión de alto porcentaje de estimulación ventricular. En enfermos con una FEVI inicialmente conservada (≥50 %), está justificada primero la estimulación convencional y más tarde se debe realizar la modificación a la TRC en los enfermos en los que, tarde o temprano, después de empezar la estimulación convencional definitiva del ventrículo derecho, se observe empeoramiento importante de la función del ventrículo izquierdo (p. ej. reducción de la FEVI a <35 %) o empeoramiento de la ICC (NYHA III-IV), si el porcentaje de estimulación ventricular es alto (>20 %).
La condición general es la supervivencia esperada en estado funcional relativamente bueno >1 año. Si es posible, no implantar el dispositivo durante una hospitalización por descompensación aguda de la circulación. El requisito imprescindible para un buen resultado de la TRC es obtener un porcentaje elevado de estimulación biventricular (≥90-95 %, óptimamente ≥98-99 %). Los beneficios esperados de la TRC son mayores en las mujeres, en presencia de BRI, con mayor ensanchamiento del complejo QRS y en la miocardiopatía no isquémica.
Nota: en los candidatos a TRC evaluar la FEVI y la clase NYHA después de ≥3 meses de farmacoterapia óptima, y en caso de cardiopatía isquémica también >40 días después del infarto de miocardio y >3 meses después de una ICP.
Factores que inciden en la elección entre TRC-D y TRC-P:
1) que sugieren la valoración de TRC-D: supervivencia prevista >1 año, ICC estable en la clase II de NYHA, cardiopatía isquémica (resultado bajo o intermedio del índice de riesgo MADIT), área extensa de fibrosis en una RMN cardíaca, sin comorbilidades
2) a favor de TRC-P: ICC avanzada, insuficiencia renal grave o tratamiento con diálisis, comorbilidad grave, demacración, caquexia.
2. Implante de desfibrilador automático (DAI): criterios de clasificación (con un tratamiento farmacológico óptimo durante ≥3 meses y después de una eventual revascularización, si la supervivencia en estado funcional relativamente bueno supera 1 año):
1) antecedente de fibrilación ventricular (FV) o taquicardia ventricular (TV) con pérdida de conciencia o inestabilidad hemodinámica independientemente de la FEVI, si no fueron provocadas por causa transitoria o reversible, p. ej. no en las primeras 48 h del infarto de miocardio (prevención secundaria de la muerte cardíaca súbita)
2) disfunción sistólica del ventrículo izquierdo posinfarto (FEVI ≤35 % valorada >40 días después del infarto y >3 meses después de una eventual revascularización coronaria) en clase II-III de NYHA, especialmente en enfermos con TVNS en el registro de Holter, o FV/TVS inducidas durante un estudio electrofisiológico (prevención primaria de la muerte cardíaca súbita)
3) disfunción sistólica del ventrículo izquierdo (FEVI ≤35 %) por causas distintas de la enfermedad cardíaca isquémica, en clase II-III de la NYHA (prevención primaria de la muerte cardíaca súbita)
4) disfunción sistólica del ventrículo izquierdo asintomática posinfarto (FEVI ≤30 % valorada >40 días después del infarto y >3 meses después de la eventual revascularización coronaria) o por otras causas diferentes a una cardiopatía isquémica (FEVI ≤30 % valorada ≥3 meses después de optimizar la farmacoterapia): prevención primaria de la muerte cardíaca súbita.
En las situaciones referidas, si existen también indicaciones para la TRC, en lugar de implantar un DAI solo, se prefiere un dispositivo con función TRC junto con la de DAI (TRC-D).
En enfermos con las indicaciones para DAI se puede utilizar amiodarona:
1) en el período de espera para la intervención
2) si no se procede al implante a pesar de estar indicado
3) después del implante del DAI cuando se producen frecuentes descargas eléctricas que reducen la calidad de vida del enfermo a pesar de la reprogramación del dispositivo (indicación de ablación del foco arritmogénico).
3. Revascularización coronaria: indicada en pacientes con la ICC secundaria a cardiopatía isquémica, candidatos a este tipo de tratamiento, especialmente cuando coexiste angina de pecho. Si no se presenta dolor anginoso, evaluar las indicaciones de revascularización si se identifica miocardio viable con isquemia provocada por la lesión en una arteria coronaria revascularizable.
4. Si el tratamiento conservador, o eventualmente la revascularización y la electroterapia no son eficaces → considerar el trasplante cardíaco. En el período de espera para el trasplante se puede utilizar de manera transitoria un dispositivo de asistencia para el ventrículo izquierdo, últimamente cada vez con mayor frecuencia utilizado también como terapia de destino.
REHABILITACIÓNArriba
Se aconseja la participación en programas de ejercicios físicos para enfermos con ICC en tratamiento óptimo, independientemente de la FEVI, si el estado clínico es estable (durante ≥4 semanas) y la actividad física no provoca gran agotamiento ni la aparición de otros síntomas. Se prefiere un programa progresivo de entrenamiento, con predominio de ejercicios aeróbicos/de resistencia durante 3-5 días/semana (óptimamente todos los días), de 20-60 min cada uno, con una intensidad objetivo 40-80 % VO2máx en enfermos de clase I-II de la NYHA, y de intensidad basal <40 % VO2máx en enfermos de clase III de la NYHA. Para revertir la pérdida de masa muscular, al inicio se recomiendan ejercicios isométricos/de fuerza 2-3 días/semana, de 10-15 repeticiones, con puntuación de 15 en la escala de Borg.
PRONÓSTICOArriba
En HFrEF se estima una mortalidad anual de un 10-15 %, en HFpEF de un 5-8 %, y en la disfunción del ventrículo izquierdo asintomática de ~5 %. En enfermos >65 años, el riesgo de muerte en ambas formas de ICC es similar. La muerte cardíaca súbita es la causa de ~64 % de las muertes en enfermos con ICC en clase II de la NYHA, de ~59 % en enfermos en clase III de la NYHA y de ~33 % en enfermos en clase IV de la NYHA. Debido a las numerosas comorbilidades, los pacientes con HFpEF tienen una mayor tasa de hospitalización y muerte por causas no cardiovasculares. Se ha observado una mejoría del pronóstico en HFrEF:
1) en enfermos tratados con IECA o ARA-II (su efecto sobre la mortalidad no está claro, probablemente es menor que el de los IECA), β-bloqueantes, antagonista de la aldosterona, INRA, dapagliflozina, en los enfermos de raza negra tratados con hidralazina y dinitrato de isosorbida (los diuréticos utilizados en monoterapia no influyen en la progresión de la enfermedad)
2) en enfermos sometidos a TRC o después del implante de un DAI, y en algunos grupos de enfermos también tras la revascularización coronaria.
TABLAS Y FIGURAS
Clasificación de la insuficiencia cardíaca según la New York Heart Association
|
Clase
|
Capacidad funcional
|
|
I
|
Sin limitaciones: la actividad física ordinaria no provoca fatiga, disnea ni palpitaciones
|
|
II
|
Limitación ligera de la actividad física ordinaria: sin síntomas en reposo, pero la actividad física ordinaria provoca fatiga, palpitaciones o disnea
|
|
III
|
Limitación importante de la actividad física: sin síntomas en reposo, pero una actividad de menor intensidad que la ordinaria provoca síntomas
|
|
IV
|
Cualquier actividad física provoca síntomas, los síntomas de insuficiencia cardíaca aparecen incluso en reposo y cualquier actividad física los aumenta
|
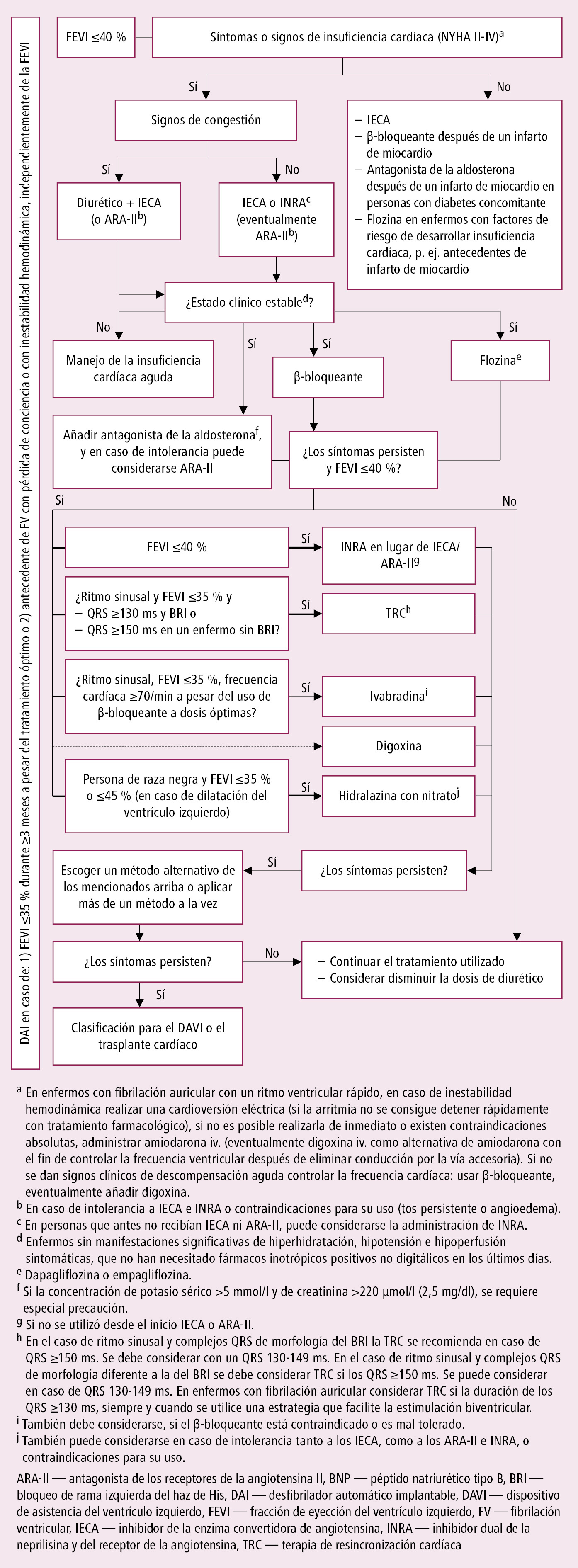
Fig. 2.19-1. Actuación en insuficiencia cardíaca con fracción de eyección reducida (a partir de las guías de la ESC 2021 y las guías de la AHA, ACC y HFSA 2022, modificado)
Dosificación recomendada de IECA y ARA-II en ICC
|
Fármaco
|
Dosis
|
|
inicial
|
diana
|
|
Inhibidores de la enzima convertidora de angiotensina (IECA)
|
|
Enalapril
|
2,5 mg 2 × d
|
10-20 mg 2 × d
|
|
Captopril
|
6,25 mg 3 × d
|
50 mg 3 × d
|
|
Lisinoprilb
|
2,5-5,0 mg 1 × d
|
20-40 mg 1 × d
|
|
Ramiprilb
|
1,25-2,5 mg 1 × d
|
5 mg 2 × d
|
|
Trandolaprilb
|
0,5-1,0 mg 1 × d
|
4 mg 1 × d
|
|
Bloqueantes del receptor de angiotensina II (ARA-II)
|
|
Candesartán
|
4 u 8 mg 1 × d
|
32 mg 1 × d
|
|
Valsartán
|
20-40 mg 2 × d
|
160 mg 2 × d
|
|
Losartána
|
25-50 mg 1 × d
|
150 mg 1 × d
|
|
Preparados →tabla 7 en Hipertensión arterial primaria, contraindicaciones →tabla 6 en Hipertensión arterial primaria
a Mencionado en las guías ESC, pero en el comentario (2016) se subraya que sus beneficios pueden ser menores.
b Fármaco no disponible en Colombia.
|
Dosificación de los β-bloqueantes en la ICC
|
β-bloqueante
|
La primera dosis (mg)a
|
Siguientes dosis hasta la dosis diana (mg)
|
|
Bisoprolol
|
1,25
|
2,5 →3,75 →5 →7,5 →10
|
|
Carvedilol
|
3,125
|
6,25 →12,5 →25 →50
|
|
Succinato de metoprolol CR
|
12,5 o 25
|
25 →50 →100 →200
|
|
Nebivololb,c
|
1,25
|
2,5 →5 →10
|
|
Preparados →tabla 7 en Hipertensión arterial primaria
a El carvedilol se utiliza 2 × d, los demás β-bloqueantes mencionados 1 × d. En la tabla se indican las dosis de cada toma.
b Mencionado en las guías de la ESC, pero en el comentario se subraya que los beneficios de su uso pueden ser menores.
c No mencionado en las guías estadounidenses.
|
Uso de los fármacos inotrópicos positivos de administración intravenosa en la ICA
|
Fármaco y preparados
|
Dosificación
|
Comentarios
|
|
Dopamina
|
1) 3-5 μg/kg/min
2) >5 μg/kg/min (máx. 30 µg/kg/min)
|
– Dosis media (1) → aumenta la contractilidad del miocardio y el gasto cardíaco estimulando los receptores adrenérgicos; dosis alta (2) → aumenta la resistencia periférica estimulando los receptores adrenérgicos α (puede empeorar el estado de los enfermos con ICA, aumentando la poscarga del ventrículo izquierdo y derecho)
– Puede utilizarse en la ICA con la presión arterial baja
– Se utiliza a menudo dopamina a dosis baja junto con dobutamina a dosis más alta
|
|
Dobutamina
|
2-20 μg/kg/min
|
– Utilizar para aumentar el gasto cardíaco
– Estimula los receptores β1, aumenta la contractilidad del miocardio, aumenta la frecuencia cardíaca, a dosis más bajas tiene efecto vasodilatador moderado, a dosis más altas provoca vasoconstricción
– La perfusión mantenida >24-48 h provoca desarrollo de tolerancia y desaparición parcial de los efectos hemodinámicos
– Puede ser difícil suspender el tratamiento a causa de recurrencia de la hipotensión, congestión o insuficiencia renal → reducir la dosis progresivamente (en 2 µg/kg/min cada día) y optimizar el tratamiento vasodilatador (p. ej. utilizando IECA VO)
– Puede provocar arritmias ventriculares y supraventriculares y dolor torácico en enfermos con cardiopatía isquémica
|
|
Milrinonaa
|
Inyección 25-75 µg/kg durante 10-20 min, después 0,375-0,75 µg/kg/min
|
– Inhibidor de fosfodiesterasa (inhibe la degradación de cAMP); tiene efecto inotrópico positivo, facilita la relajación del miocardio y vasodilatación
– Indicado en enfermos normotensos con hipoperfusión periférica, con o sin congestión pulmonar, en los que los diuréticos y vasodilatadores a dosis óptimas no han sido eficaces
– Se puede utilizar en lugar de dopamina en enfermos que reciben β-bloqueantes y en caso de respuesta insuficiente a la dobutamina
– Posible efecto proarrítmico: utilizar con precaución en enfermos con ICC
|
|
Levosimendán
|
3-12 μg/kg en 10 min, a continuación 0,05-0,2 μg/kg/min
|
– Es una alternativa para enfermos que toman β-bloqueantes, ya que el efecto inotrópico positivo no depende de la estimulación del receptor β
– En enfermos con la presión arterial sistólica <100 mm Hg no administrar la dosis de carga, para evitar la hipotensión
|
|
Noradrenalina
|
0,2-1,0 μg/kg/min
|
– Utilizar (con precaución) solamente en caso de shock cardiogénico cuando la presión arterial es <90 mm Hg a pesar de usar inotrópicos y fluidoterapia y la perfusión de los órganos es insuficiente a pesar de mejorar el gasto cardíaco
– Puede estar indicada en los enfermos con ICA y sepsis
– Puede utilizarse con cada fármaco inotrópico mencionado más arriba (con precaución en caso de dopamina); se prefiere sobre la dopamina
|
|
Adrenalina
|
1 mg cada 3-5 min (solamente durante la resucitación);
0,05-0,5 μg/kg/min
|
Utilizar solamente durante la resucitación en el paro cardíaco y eventualmente en caso de resistencia a la dobutamina y persistencia de presión arterial baja
|
|
Digoxina
|
Dosis inicial 0,25-0,5 mg; luego 0,125-0,375 mg/d (control del nivel sérico)
|
Eficaz en la ICA secundaria a taquiarritmia (p. ej. fibrilación auricular); no recomendada en la ICA que complica el infarto de miocardio reciente, por su efecto proarrítmico
|
|
a Fármacos eficaces en los enfermos que están bajo efecto de un β-bloqueante utilizado de manera crónica.
|
Dosificación de los diuréticos VO en la ICC
|
Fármacoa
|
Dosis inicial (mg/d)
|
Dosis típica (mg/d)
|
|
Diuréticos de asa
|
|
Furosemidab
|
20-40
|
40-240
|
|
Torasemidac
|
5-10
|
10-20
|
|
Diuréticos tiacídicos y tipo tiacida
|
|
Clortalidona
|
12,5-25
|
25-100
|
|
Hidroclorotiazida
|
25
|
12,5-100
|
|
Indapamida
|
2,5 (1,5 mg en la forma de liberación prolongada)
|
2,5-5,0
|
|
Diuréticos ahorradores de potasiod
|
|
Amilorida (disponible solamente en forma de preparado compuesto con hidroclorotiazida)
|
2,5 (5)
|
5-10 (10-20)
|
|
Eplerenona
|
25 (50)
|
50 (100-200)
|
|
Espironolactona
|
12,5-25 (50)
|
50 (100-200)
|
|
a Preparados →tabla 7 en Hipertensión arterial primaria.
b El efecto diurético aparece a los 30-60 min, con un pico después de 1-2 h, y desaparece en 6-8 h.
c Fármaco no disponible en Colombia.
d Entre paréntesis dosis para los enfermos que no toman IECA ni ARA-II.
|
Clasificación de Child (modificada por Pugh) de insuficiencia hepática
|
Parámetro
|
Grado de alteración
|
Puntos
|
|
Encefalopatía
|
Ausente
|
1
|
|
Grado 1-2
|
2
|
|
Grado 3
|
3
|
|
Ascitis
|
Ausente
|
1
|
|
Moderada
|
2
|
|
A tensión
|
3
|
|
Bilirrubina (mg/dl [µmol/l])
|
<2 (<35)
|
1
|
|
2-3 (35-50)
|
2
|
|
>3 (>50)
|
3
|
|
Albúmina (g/dl)
|
>3,5
|
1
|
|
2,8-3,5
|
2
|
|
<2,8
|
3
|
|
Tiempo de protrombina
(en s por encima de la norma/INR)
|
<4/<1,7
|
1
|
|
4-6/1,7-2,3
|
2
|
|
>6/>2,3
|
3
|
|
Resultado (clase)
|
Puntuación
|
|
A
|
5-6
|
|
B
|
7-9
|
|
C
|
10-15
|
|
Interpretación:
clase A — cirrosis hepática compensada; no hay indicaciones para el trasplante hepático
clase B y C — cirrosis hepática descompensada; indicaciones para el trasplante hepático
|
|
A partir de: Pugh R.N.H. y cols., Transection of the oesophagus for bleeding oesophageal varices, Brit. J. Surg., 1973, 60: 646-649, modificado
|
 Español
Español
 English
English
 українська
українська





