Definición, clasificación y etiopatogenia
La diabetes mellitus es un grupo de enfermedades metabólicas de diversa etiología y curso variado caracterizadas por hiperglucemia secundaria tanto a un defecto de la secreción como a la acción de la insulina. La hiperglucemia crónica en la diabetes se asocia al daño, alteración funcional e insuficiencia de diversos órganos, en particular el corazón, los vasos sanguíneos, los ojos, los riñones y los nervios.
Clasificación etiológica de la diabetes según la OMS (de 1999, modificada en 2019) →tabla 14.1-1.
1. Diabetes mellitus tipo 1: o bien debida a la destrucción autoinmune de las células β pancreáticas desencadenada por factores ambientales en personas con predisposición genética (en la mayoría de los casos), o bien de origen indeterminado (idiopática), lo que generalmente lleva a una deficiencia absoluta de insulina. En el desarrollo de la enfermedad autoinmune participan autoanticuerpos contra diversos antígenos de las células β. Se pueden detectar biomarcadores del proceso autoinmune durante un tiempo variable con anterioridad a la aparición de los primeros síntomas de la enfermedad. Durante este período se produce una pérdida gradual de las funciones secretoras de las células β, que lleva a la diabetes manifiesta, caracterizada por una deficiencia grave de insulina. Típicamente se manifiesta en niños, adolescentes y en personas <30 años. Tras la aparición de la enfermedad, el proceso de destrucción de las células β continúa hasta la desaparición del péptido C (marcador de la secreción de insulina) del suero. Sigue debatiéndose si la diabetes autoinmune de evolución lenta y con inicio en la edad adulta debe definirse como LADA (latent autoimmune diabetes of adults, diabetes autoinmune latente del adulto) o como diabetes tipo 1. La ADA opta por considerar esta forma como diabetes tipo 1, debido a su etiología común, ya que en el adulto también puede producirse una destrucción autoinmune de las células β pancreáticas. En estos enfermos, incluso si la destrucción progresa lentamente, está indicado iniciar el tratamiento con insulina antes de que se desarrolle una hiperglucemia grave o una cetoacidosis diabética. No obstante, el uso del nombre LADA es común y aceptable.
2. Diabetes mellitus tipo 2: es la forma más frecuente (80-90 %). Se produce por la alteración progresiva de la secreción de insulina en condiciones de insulinorresistencia. Se reconocen también otros mecanismos patogénicos, como la elevación del glucagón y del umbral renal de excreción de glucosa, o la disminución del efecto incretina. Puede estar condicionada genéticamente (con mayor frecuencia herencia poligénica), pero la edad, los factores ambientales y los asociados al estilo de vida desempeñan un papel decisivo (aporte calórico excesivo y obesidad [sobre todo abdominal], escasa actividad física y masa corporal magra reducida). El exceso de grasa visceral tiene una influencia significativa en el desarrollo de la diabetes, incluso en personas sin obesidad definida por el índice de masa corporal (IMC). Un exceso de ácidos grasos libres liberados por el tejido adiposo visceral es responsable de la lipotoxicidad, consistente en un exceso de oxidación de las grasas, que en el músculo inhibe la glucólisis (metabolización de glucosa), mientras que en el hígado favorece la gluconeogénesis y en el páncreas frena la secreción de insulina. Para contrarrestar estos procesos se requiere un aumento compensador de la secreción de insulina, que en personas susceptibles puede provocar el agotamiento gradual de las células β y la elevación de la glucemia. Una vez presente la hiperglucemia, se produce glucotoxicidad junto con la lipotoxicidad, y se deteriora aún más la capacidad secretora de insulina y la sensibilidad a la misma.
3. Diabetes mellitus de etiología conocida: diabetes monogénica asociada a un defecto genético de las células β de la secreción de la insulina (diabetes del adulto de inicio juvenil [MODY], diabetes neonatal permanente, diabetes mitocondrial), defectos genéticos en la acción de la insulina, enfermedades pancreáticas exocrinas (incluida la pancreatitis aguda y crónica, cáncer de páncreas, traumatismo o resección de páncreas, fibrosis quística y hemocromatosis, cuando el daño afecta también los islotes pancreáticos endocrinos), endocrinopatías (por exceso de hormonas contrainsulares, p. ej. síndrome de Cushing, acromegalia, feocromocitoma), diabetes inducida por fármacos (p. ej. glucocorticoides, antipsicóticos atípicos [que favorecen el aumento de peso], interferón α, en menor medida diuréticos tiacídicos) u otras sustancias químicas, infecciones (p. ej. rubéola congénita), formas raras de origen inmunitario, otros síndromes genéticos ocasionalmente relacionados con la diabetes (p. ej. trisomía 21 [síndrome de Down], síndromes de Klinefelter y de Turner).
4. Hiperglucemia detectada por primera vez durante el embarazo (diabetes gestacional): tolerancia a la glucosa alterada que aparece en el curso del embarazo. El aumento de la concentración de las hormonas contrarreguladoras durante el embarazo propicia la insulinorresistencia, incrementando la disponibilidad de glucosa para el feto en desarrollo. Si la capacidad de secreción de la insulina de la madre es insuficiente, aparece la hiperglucemia.
5. Las modificaciones introducidas en el 2019 por la OMS en la clasificación del 1999 comprenden 2 tipos adicionales de diabetes, en los que el diagnóstico clínico no es evidente (la ADA no los incluye):
1) formas híbridas de diabetes:
a) diabetes autoinmune latente del adulto (anteriormente LADA, que en la actualidad se considera diabetes tipo 1)
b) diabetes tipo 2 con propensión a la cetosis
2) diabetes no clasificada: descripción transitoria en casos de diagnóstico no concluyente.
CUADRO CLÍNICO E HISTORIA NATURAL
La historia natural de la enfermedad depende de la velocidad de disminución de la capacidad de secretar insulina y/o de la pérdida de células β. En la diabetes tipo 1 el proceso es rápido y el inicio es brusco. En las fases tempranas de la diabetes tipo 2 disminuye significativamente la secreción precoz de insulina, lo que posteriormente evoluciona a la prediabetes. Esta fase se caracteriza por cifras de glucemia en ayunas alterada (GAA; impaired fasting glucose, IFG) y/o tolerancia a la glucosa alterada (TGA; impaired glucose tolerance, IGT). En fases posteriores se produce la hiperglucemia permanente, que es la señal de la diabetes. Los síntomas son inespecíficos y variados, a menudo se relacionan con el tipo de diabetes y con su forma de evolución. La diabetes tipo 1 suele ser más sintomática que la de tipo 2, y se caracteriza por el riesgo de desarrollar cetoacidosis y coma cetoacidótico. El déficit del control glucémico a largo plazo favorece las complicaciones crónicas de la enfermedad →Complicaciones crónicas de la diabetes mellitus. Estas son responsables de un deterioro de la calidad de vida y de una mayor mortalidad cardiovascular.
Manifestaciones típicas de la diabetes: poliuria (diuresis osmótica a consecuencia de glucosuria), sed (polidipsia), manifestaciones de deshidratación, por lo general moderadas (disminución de la elasticidad de la piel, sequedad de piel y mucosas), debilidad y somnolencia causadas por la deshidratación, adelgazamiento (menos frecuente), cetoacidosis y coma cetoacidótico (en ocasiones es la primera manifestación observada), predisposición a infecciones genitourinarias o cutáneas.
Diabetes tipo 1: en niños y adolescentes es frecuente la presentación aguda (con riesgo de cetoacidosis y coma) debido a la pérdida rápida de la reserva de células β. Un curso lábil de la enfermedad puede acelerar la aparición de complicaciones crónicas a partir del 5.o año tras su debut.
En adultos, por el contrario, los síntomas de la diabetes tipo 1 suelen progresar de forma desapercibida durante mucho tiempo, a veces a lo largo de varios meses, siendo excepcional el coma diabético (aunque en presencia de manifestaciones de cetoacidosis). En la actualidad, la forma de diabetes autoinmune y de evolución lenta en adultos, anteriormente denominada LADA, debido a su etiología se considera diabetes tipo 1. Se caracteriza por un curso prolongado y latente, y el cuadro clínico completo se presenta en la 4.ª o 5.ª década de la vida. Con mayor frecuencia que en la forma clásica de diabetes tipo 1 se presenta el sobrepeso o la obesidad. La hiperglucemia aparentemente leve, pero persistente a lo largo de años, incluso con remisión periódica de alteraciones bioquímicas, favorece el desarrollo insidioso de complicaciones crónicas, cuya presencia requiere un tratamiento con insulina.
Diabetes tipo 2: las manifestaciones típicas son menos frecuentes que en la diabetes tipo 1. En más de la mitad de los casos es asintomática y la hiperglucemia se detecta casualmente o en pruebas de tamizaje. No tratada favorece el desarrollo de complicaciones crónicas, sobre todo cardiovasculares, que son la causa principal de muerte. ~85 % de los enfermos presentan obesidad de predominio abdominal, hipertensión arterial y alteraciones lipídicas. La hiperglucemia puede manifestarse en el curso de otras enfermedades, como infecciones, que aumentan las necesidades de insulina. El progresivo agotamiento de las células β requiere una estrecha vigilancia y ajuste del tratamiento a las necesidades cambiantes.
Diabetes de etiología conocida: el cuadro clínico de la diabetes secundaria depende de la etiología (pancreatitis aguda, pancreatitis crónica, fibrosis quística, hemocromatosis, acromegalia, síndrome de Cushing, tumores secretores de ACTH, feocromocitoma) o del síndrome genético relacionado con la diabetes (→tabla 14.1-1) con manifestaciones características, como retraso de la maduración sexual.
Es importante realizar una anamnesis de los fármacos ingeridos, sobre todo glucocorticoides y antipsicóticos que favorecen el aumento de peso, y en caso de enfermedades genéticas son importantes los antecedentes familiares. La presencia de diabetes en ≥3 generaciones sugiere la necesidad de búsqueda de MODY.
Diabetes monogénica: la diabetes neonatal y mitocondrial se manifiesta en niños pequeños. La MODY es una forma limítrofe que se presenta a edad típica de presentación de la diabetes tipo 1, pero por el cuadro clínico se asemeja a la diabetes tipo 2. Se puede sospechar si:
1) se manifiesta a edad joven, normalmente en la 2.ª o 3.ª década de la vida
2) se presenta en las generaciones consecutivas de una familia (herencia autosómica dominante)
3) su curso es típicamente más leve en comparación con la diabetes tipo 1 (se requiere diagnóstico diferencial)
4) en general no se presenta obesidad ni insulinorresistencia (no participan en la patogenia)
5) los niveles de insulina pueden estar disminuidos.
La MODY se presenta con igual frecuencia en mujeres y en hombres. La localización cromosómica de las mutaciones es variable, por lo que el cuadro clínico también varía.
La diabetes HNF1A MODY generalmente se manifiesta a edad de <25 años, y en la familia del enfermo la diabetes se presenta en ≥3 generaciones, con ≥2 casos de diabetes a edad joven. Al inicio de la enfermedad, la PTGO evidencia un aumento importante de glucemia, siendo esta a menudo normal en ayunas, y los resultados de la determinación de los anticuerpos típicos de diabetes de origen autoinmune son negativos. Típicamente se presenta glucosuria, que es consecuencia de la disminución del umbral renal de la glucosa. Posteriormente, a pesar de que la enfermedad se prolongue durante varios años, el péptido C sigue siendo detectable y no se observa tendencia a la cetoacidosis, lo que diferencia la MODY de la diabetes tipo 1 y permite implementar el tratamiento oral. Debido al agotamiento de la reserva insulínica de las células β y al aumento del riesgo de complicaciones crónicas, es posible que sea necesario sustituir las sulfonilureas por la insulinoterapia.
La diabetes asociada a la mutación del gen de la glucocinasa (GCK-MODY) está presente desde el nacimiento, pero es asintomática, y se caracteriza por un aumento permanente y moderado de la glucemia en ayunas, en general <8,0 mmol/l (144 mg/dl), y un pequeño aumento de la glucemia en PTGO. La presencia de diabetes en uno de los progenitores aumenta el riesgo de la enfermedad hasta el 50 % en cada embarazo. La capacidad secretora de insulina está conservada, pero la mutación del gen de la glucocinasa determina que el umbral para el estímulo de su secreción se eleve moderadamente. El curso de la enfermedad es leve y estable, no se presenta cetoacidosis ni cetosis, y en general no se desarrollan complicaciones tardías de la diabetes. La farmacoterapia suele ser ineficaz y el mejor método de tratamiento es una dieta adecuada sin azúcares simples.
DIAGNÓSTICO
Consiste en una confirmación inequívoca de la hiperglucemia que cumple los criterios diagnósticos de diabetes →tabla 14.1-2. Tras confirmar la diabetes se debe determinar su etiología de acuerdo con la clasificación actual de la OMS →tabla 14.1-1.
Diabetes tipo 1 en adultos: para establecer el diagnóstico definitivo, en caso de cumplir los criterios diagnósticos de diabetes según la glucemia (→tabla 14.1-2), es necesario confirmar la presencia de autoanticuerpos (anticuerpos antislotes) y/o la disminución del péptido C. En primer lugar, determinar los niveles de anticuerpos anti-ácido glutámico descarboxilasa (anti-GAD65). Si el resultado es negativo → determinar los anticuerpos anti tirosina fosfatasa 2 (IA2) y/o contra el transportador de zinc 8 (ZnT8), si es posible.
Diabetes tipo 2: con bastante frecuencia es asintomática (hasta el 20 % de los casos según algunos estudios), por lo que las complicaciones crónicas, especialmente las cardiovasculares —que se desarrollan paralelamente a los trastornos del metabolismo de los hidratos de carbono y son la principal causa de muerte de estos enfermos— pueden permanecer no diagnosticadas y no tratadas por más tiempo. Estas complicaciones también se ven favorecidas por el sobrepeso u obesidad, así como por la prediabetes. Por esta razón, en grupos de riesgo se debe intentar diagnosticar precozmente tanto la prediabetes como la diabetes, para poder introducir lo antes posible un tratamiento multifactorial (del exceso de masa grasa, trastornos del metabolismo de los hidratos de carbono y de los lípidos, así como la hipertensión).
A menudo no es fácil diferenciar la diabetes tipo 1 de la tipo 2 en adultos, y en algunos casos para diagnosticar los casos de diabetes de etiología conocida pueden ser necesarios estudios especializados, también genéticos. La clasificación actual de la OMS toma en cuenta estas dificultades diagnósticas y admite la posibilidad de diagnosticar diabetes no clasificada, en caso de que no sea posible determinar su forma. En algunos casos la determinación del tipo de diabetes se vuelve más fácil con el tiempo. La identificación de las formas mixtas también contempla la posibilidad de alteraciones del metabolismo de los hidratos de carbono con algunas características típicas tanto de la diabetes tipo 1 como de tipo 2.
Criterios diagnósticos de diabetes →tabla 14.1-2.
Numerosos casos cursan de manera asintomática y por ello se recomienda realizar tamizaje (glucemia en ayunas o PTGO →más adelante) cada año en grupos de riesgo elevado de diabetes tipo 2: sobrepeso (IMC 25-29,9 kg/m2) u obesidad (IMC ≥30 kg/m2) o perímetro de cintura >80 cm en mujeres y >90 cm en hombres, antecedentes familiares en padres o hermanos, escasa actividad física, antecedentes de GAA o de TGA, antecedentes de diabetes gestacional, parto previo de un recién nacido con peso corporal >4 kg, hipertensión arterial (≥140/90 mm Hg), C-HDL <1,0 mmol/l (40 mg/dl) o triglicéridos >1,7 mmol/l (150 mg/dl), síndrome del ovario poliquístico, enfermedad ateroesclerótica, fibrosis quística (tamizaje 1 × año a partir de la edad de 10 años en período sin exacerbaciones de la enfermedad broncopulmonar, en los pacientes no tratados con glucocorticoides); y cada 3 años en todas las personas de ≥35 años (según la ADA 2024). Pueden utilizarse también cuestionarios que facilitan la identificación de las personas con riesgo de desarrollar diabetes, p. ej. la escala FINDRISC (Finnish Diabetes Risk Score).
Reglas de tamizaje en embarazadas →Diabetes mellitus diagnosticada durante el embarazo.
Exploraciones complementarias
1. Pruebas de laboratorio:
1) Glucemia: para diagnosticar la diabetes o la GAA se emplea la glucemia plasmática en sangre venosa (normal 4,0-5,5 mmol/l [72-99 mg/dl]), mientras que para vigilar el tratamiento se emplea la glucemia capilar en ayunas (tras ayuno nocturno de 8-14 h) o la glucemia capilar posprandial (a los 60, 90 y 120 min de las comidas). No realizar el diagnóstico durante la fase aguda de cualquier enfermedad, inmediatamente después de un traumatismo o cirugía, tras un período de ayuno ni durante el uso, incluso por corto tiempo, de fármacos que puedan aumentar la glucemia.
2) Hemoglobina glicada (HbA1c): es un índice retrospectivo de la glucemia que se utiliza para vigilar el grado de control metabólico o para el diagnóstico de diabetes (prueba estandarizada certificada por el National Glycohemoglobin Standardization Program [NGSP]). Refleja la glucemia media durante los 3 meses anteriores a la determinación. No se recomienda si existen factores que puedan afectar su interpretación: hemoglobinopatías, anemias, transfusiones, hipertrigliceridemia, hiperbilirrubinemia, insuficiencia renal, diálisis, uso de eritropoyetina, cirrosis hepática, ingesta de salicilatos a dosis elevadas. Algunos laboratorios pueden informar los resultados de HbA1c no en forma de porcentaje, sino en unidades del SI (mmol/mol). Si el resultado de la HbA1c no es fiable, aplicar los criterios de diagnóstico de diabetes basados en la glucosa plasmática.
3) Fructosamina: su concentración refleja la glucemia media en las últimas 3 semanas (vida media de la albúmina). Se emplea raras veces, p. ej. cuando la HbA1c no es fiable (→más arriba), o cuando es necesaria una valoración a corto plazo del control glucémico (p. ej. en embarazadas). En Chile y en México esta prueba no está ampliamente disponible.
4) Glucosa en orina: determinación mediante tira reactiva o un análisis de laboratorio. No es útil para la vigilancia del tratamiento de la diabetes. La detección de glucosuria es una indicación para determinar la glucemia. Debe recordarse que los inhibidores del SGLT2, por su mecanismo de acción, aumentan la excreción urinaria de glucosa sin hiperglucemia acompañante.
5) Autoanticuerpos contra proteínas de la célula β: su determinación es útil para comprobar la etiología autoinmune de la diabetes (solo en caso de que persistan dudas clínicas fundadas; en la mayor parte de los laboratorios en Latinoamérica no se dispone de todos los marcadores):
a) contra varios antígenos citoplasmáticos de las células β (ICA; anticuerpos antislotes), cada vez menos usados, dada su limitada especificidad
b) contra la descarboxilasa del ácido glutámico (anti-GAD65)
c) contra la tirosina fosfatasa (IA-2, IA-2β)
d) contra la insulina endógena (IAA)
e) contra el transportador de zinc 8 (Zn8).
6) Concentración sérica del péptido C: equivale a la concentración de insulina endógena. Está disminuida o es indetectable en la diabetes tipo 1; aumentada en la fase inicial de la diabetes tipo 2, cuando se caracteriza por la insulinorresistencia y secreción aumentada de insulina. Sus niveles disminuyen paralelamente al agotamiento de las reservas de la célula β sin alcanzar el déficit absoluto de la diabetes tipo 1. Actualmente se admite la concentración del péptido C <0,2 nmol/l en condiciones basales como criterio diagnóstico de diabetes tipo 1. Unos niveles muy altos del péptido C en ayunas y tras la estimulación con glucagón pueden indicar hiperinsulinemia en la diabetes tipo 2 o la presencia de un insulinoma →Insulinoma).
7) Cuerpos cetónicos en orina o su concentración sérica elevada indican cetosis o cetoacidosis en diabetes descompensada metabólicamente (en cetoacidosis →Cetoacidosis y coma cetoacidótico, en cetoacidosis euglucémica durante el tratamiento con inhibidores del SGLT2), pueden presentarse en una lipólisis aumentada (en estados de hambre, tras un episodio de hipoglucemia, vómitos o abuso de alcohol). Las tiras reactivas detectan sobre todo el ácido acetoacético. Otros cuerpos cetónicos son la acetona y el ácido β-hidroxibutírico. En algunos países latinoamericanos se dispone de tiras reactivas para detección de acetona (en orina y/o en sangre).
8) Concentración de ácido láctico en suero: aumentada en la acidosis láctica →Acidosis láctica y coma.
2. Pruebas funcionales:
1) Prueba de tolerancia a la glucosa oral (PTGO; oral glucose tolerance test, OGTT) con 75 g de glucosa. Se emplea para el diagnóstico de la diabetes o de la TGA. Se realiza tras 8-14 h de ayuno nocturno, después de un descanso reparador y después de 3 días de una alimentación sin restricciones y equilibrada en su contenido de carbohidratos. Establecer si el paciente toma fármacos que pueden afectar la glucemia (glucocorticoides, diuréticos tiacídicos, algunos β-bloqueantes). Determinar la glucemia en ayunas y 120 min tras la ingesta de una solución con 75 g de glucosa a beber en 5 min (OMS). El uso de solución de glucosa ≤20 % (que se prepara con ≥375 ml de agua o en botellas) permite evitar náuseas y vómitos tras la ingesta. La concentración normal de glucosa en el plasma de sangre venosa a los 120 min es <7,8 mmol/l (140 mg/dl). Indicaciones para la PTGO:
a) glucemia en ayunas 5,6-6,9 mmol/l (100-125 mg/dl) en 1 o 2 determinaciones, o
b) sospecha justificada de TGA o de diabetes a pesar de la glucemia en ayunas normal (<5,6 mmol/l [100 mg/dl]).
2) Prueba de glucagón: sirve para evaluar la reserva insulínica de las células β. En la práctica se utiliza raramente, a veces es útil para diferenciar la diabetes tipo 1 de la tipo 2 cuando existen dudas clínicas. Determinar el péptido C en ayunas y a los 6 min desde la administración iv. de 1 mg de glucagón. Los valores normales en situación basal son de 0,4-1,2 nmol/l (1,2-3,6 µg/l) antes de la administración y 1-4 nmol/l (3,0-12 µg/l) a los 6 min de la administración. Un resultado <0,6 nmol/l tras la estimulación con glucagón se produce en la diabetes tipo 1 (la ausencia de péptido C es un reflejo de la labilidad del curso de la diabetes tipo 1), LADA o diabetes secundaria a pancreatitis. Concentraciones muy elevadas de péptido C en ayunas y tras la estimulación con glucagón se observan durante la fase de hiperinsulinemia de la diabetes tipo 2 o en el insulinoma.
3) Estimación de la sensibilidad a la insulina con el método HOMA: el índice de resistencia a la insulina HOMA-IR se calcula multiplicando la insulinemia en ayunas (en mUI/l) por la glucemia en ayunas (en mmol/l) y dividiendo el resultado por 22,5. Debido a la secreción pulsátil de la insulina, las mediciones deben realizarse 2-4 veces y debe emplearse el valor medio (método no validado en la práctica clínica, por lo que no se recomienda).
Criterios diagnósticos
No realizar el diagnóstico de los estados hiperglucémicos durante la fase aguda de otras enfermedades (p. ej. infecciones o síndrome coronario agudo), inmediatamente después de un traumatismo o cirugía ni durante el tratamiento con fármacos que pueden aumentar la glucemia (glucocorticoides, diuréticos tiacídicos, algunos β-bloqueantes).
1. Prediabetes:
1) glucemia en ayunas alterada (GAA): glucemia en ayunas 5,6-6,9 mmol/l (100-125 mg/dl); es una indicación para realizar una PTGO
2) tolerancia a la glucosa alterada (TGA): glucemia a los 120 min de la PTGO de 7,8-11,0 mmol/l (140-199 mg/dl).
2. La diabetes se diagnostica en las siguientes situaciones (→tabla 14.1-2):
1) manifestaciones típicas de hiperglucemia (polidipsia, poliuria, debilidad) y glucemia casual ≥11,1 mmol/l (200 mg/dl)
2) glucemia en ayunas ≥7,0 mmol/l (126 mg/dl) en 2 mediciones (según las guías de la ADA, las determinaciones de la misma muestra deben realizarse en el espacio más corto de tiempo o la glucemia en ayunas debe determinarse en días distintos)
3) glucemia a los 120 min de la PTGO ≥11,1 mmol/l (200 mg/dl); según las guías de la ADA, si no hay manifestaciones inequívocas de hiperglucemia, es necesario confirmar el diagnóstico: se puede volver a determinar la glucemia o la HbA1c a partir de la misma muestra de sangre o se puede realizar la PTGO otro día
4) HbA1c ≥6,5 % (48 mmol/mol): solo si fue determinada en laboratorio mediante un método certificado por el NGSP, tras descartar estados y enfermedades que alteran la relación entre la HbA1c y la glucemia media (→más arriba); según las guías de la ADA, el resultado debe confirmarse con una segunda determinación de HbA1c o glucemia; si el resultado de HbA1c no es fiable, utilizar los criterios diagnósticos basados en los niveles de glucosa en plasma.
La ADA permite el diagnóstico de diabetes si la HbA1c es >6,5 % (48 mmol/mol) y de prediabetes si la HbA1c es de 5,7-6,4 % (39-46 mmol/mol), siempre que la determinación se realice mediante HPLC (high performance liquid chromatography, cromatografía de líquidos) y esté debidamente estandarizada o con control de calidad. En la mayoría de los países de Latinoamérica no se utiliza la HbA1c para el diagnóstico de diabetes o prediabetes por falta de estandarización de la técnica (en Chile el 43 % de los laboratorios cuenta con técnicas validadas de HPLC para el diagnóstico; en México el 50 % de los laboratorios tiene HbA1c que cumple con los estándares de los EE. UU [DDCT]; en Argentina la técnica de HPLC no está normalizada por falta de estándares).
Según las guías de la ADA (ADA Standards of Medical Care in Diabetes, 2024), en el diagnóstico de diabetes deben cumplirse los siguientes principios:
1) únicamente en presencia de manifestaciones típicas de hiperglucemia y con glucemia ≥11,1 mmol/l (200 mg/dl) se puede diagnosticar diabetes sin realizar una prueba de confirmación
2) en ausencia de manifestaciones de hiperglucemia, es necesario obtener 2 resultados anormales (de la misma muestra de sangre o de otra muestra extraída en un espacio corto de tiempo)
3) la prueba confirmatoria puede ser la misma prueba u otra de las indicadas más arriba (glucemia en ayunas, glucemia a los 120 min de la PTGO o HbA1c) que cumple con los requisitos diagnósticos
4) si los resultados de 2 pruebas diferentes no concuerdan, debe repetirse la prueba cuyo resultado fue anormal.
Criterios diagnósticos de la diabetes en embarazadas →Diabetes mellitus diagnosticada durante el embarazo.
Diagnóstico diferencial
1. Otras enfermedades que cursan con manifestaciones similares a las de la hiperglucemia, p. ej. poliuria en la deficiencia de arginina-vasopresina y resistencia a la arginina-vasopresina (→Deficiencia de arginina-vasopresina y resistencia a la arginina-vasopresina (diabetes insípida)).
2. Diferenciación del tipo de diabetes
Diabetes que se presenta en adultos y se asemeja a la diabetes tipo 2: la diabetes autoinmune latente del adulto (anteriormente LADA) se clasifica en la actualidad como diabetes tipo 1 y tiene sus características propias (etiología y déficit de insulina), pero cursa enmascarada en forma de diabetes tipo 2 (es más frecuente el sobrepeso o la obesidad y/u otras características del síndrome metabólico, se desarrolla durante un período prolongado y se manifiesta en la 4.ª o 5.ª década de la vida); diagnóstico diferencial →tabla 14.1-3. A diferencia de la diabetes tipo 1 en adultos jóvenes, tiene un curso menos lábil gracias a una mayor reserva insulínica de las células β de los islotes pancreáticos, lo que puede llevar erróneamente al uso de antidiabéticos orales en lugar de insulina. Para establecer el diagnóstico definitivo de diabetes autoinmune es necesario identificar los autoanticuerpos típicos (→Diagnóstico).
Diabetes que se presenta en edad joven y se asemeja a la diabetes tipo 1, con historia familiar de diabetes: se presenta en familias con diabetes por alteración de la secreción de insulina, de inicio precoz (edad joven, en la mayoría de los casos no asociada a obesidad) y de herencia autosómica dominante (antecedentes familiares de diabetes en ≥2 generaciones e inicio precoz en ≥2 familiares). En el diagnóstico diferencial se debe contemplar en primer lugar la MODY (→tabla 14.1-1, diagnóstico diferencial →tabla 14.1-4) e identificar mutaciones en los genes responsables. Si la diabetes se diagnostica a los <9 meses de vida, es necesario realizar pruebas dirigidas hacia detectar la diabetes neonatal permanente (también en adultos en los que el examen no se ha realizado hasta ahora), es decir, pruebas de la mutación en el gen KCNJ11, que codifica la proteína Kir6.2; en segundo lugar, hacia la mutación en los genes de insulina, proteína SUR1 y glucocinasa. La búsqueda de mutaciones en otros genes debe ser individualizada y realizarse en centros especializados.
TRATAMIENTO
Objetivos del tratamiento y criterios de control de la diabetes
Independientemente de la etiología de la diabetes, los criterios de su control son similares. El objetivo es disminuir significativamente el riesgo de complicaciones crónicas de la diabetes. Los criterios se refieren a obtener los valores objetivo:
1) de glucemia y, sobre todo, de HbA1c →tabla 14.1-5, así como del tiempo en el que la glucemia se mantiene en el rango objetivo (time in range, TIR), así como por encima y por debajo de este rango en el caso de enfermos que utilizan sistemas automáticos de monitorización continua de glucosa (MCG)
2) de presión arterial →tabla 14.1-6
3) de lípidos en plasma →tabla 14.1-7
4) de peso: según numerosas sociedades científicas (p. ej. ADA, EASD, PTD, AACE, ESC), además del control metabólico óptimo, un objetivo importante es la reducción permanente de la masa grasa corporal. En la posición de la ADA y EASD (2022), y de ADA (2024) relativa a la diabetes tipo 2, se establecen los principios de tratamiento farmacológico, que incluyen este objetivo (→más adelante).
Objetivos del tratamiento de la hiperglucemia: personalizar la intensidad del tratamiento, es decir, los valores objetivo de la glucemia y el ritmo para conseguirlos. No debe optarse por una rápida disminución de la glucemia, que aumenta de manera significativa el riesgo de hipoglucemia, y en enfermos con complicaciones microangiopáticas avanzadas (sobre todo retinopatía) puede provocar su progresión transitoria. De igual manera, en casos de polineuropatía periférica sensitiva, una corrección rápida de la hiperglucemia puede exacerbar el dolor neuropático.
A la hora de establecer los objetivos individuales de glucemia tomar en cuenta: tipo de diabetes, duración de la enfermedad, cooperación y esfuerzos del enfermo, riesgo de hipoglucemia, supervivencia esperada, comorbilidades, complicaciones vasculares, disponibilidad de recursos terapéuticos y sus costes, así como las posibilidades de apoyo al enfermo. En enfermos de edad avanzada o con comorbilidades —y con supervivencia esperada <10 años— los criterios de control glucémico pueden ser menos estrictos y centrarse en mantener la calidad de vida, alcanzando los objetivos de glucemia de manera gradual en 2-3 meses. Si no se logran los valores objetivo, estos deben perseguirse y aproximarse lo máximo posible, teniendo en cuenta los riesgos y beneficios.
Reglas generales
1. El tratamiento de la diabetes incluye:
1) educación terapéutica dirigida al autocontrol de la enfermedad, esencial para el éxito del resto de medidas
2) reducción de la exposición a los factores perjudiciales: evitar el alcohol y el tabaco
3) tratamiento no farmacológico: estilo de vida saludable (terapéutico) que incluye una dieta sana y variada (→más adelante) y actividad física regular, ajustada a la edad, propósito, condición física y comorbilidades; en caso de sobrepeso u obesidad intentar reducir el peso de forma mantenida, tener suficiente descanso nocturno y evitar el estrés crónico
4) tratamiento de la hiperglucemia:
a) en diabetes tipo 2: fármacos no insulínicos (incluidas las incretinas) y tratamiento de la enfermedad cardiovascular (ECV) ateroesclerótica, insuficiencia cardíaca o enfermedad renal crónica (ERC) concomitantes, para evitar su progresión (→más adelante)
b) insulina: en diabetes tipo 1 desde el inicio del tratamiento; en diabetes tipo 2 al agotar otras opciones terapéuticas
5) control de los factores de riesgo de ECV, sobre todo tratamiento de hipertensión arterial (recomendar con >140/90 mm Hg; iniciar la terapia asociando 2 fármacos: un inhibidor de la enzima convertidora de angiotensina [IECA] o un antagonista de los receptores de la angiotensina II [ARA-II] con un calcioantagonista o un diurético tiacídico / tipo tiacida) →tabla 2.20-7; tratamiento de los trastornos del metabolismo de los lípidos →Hipercolesterolemia; en enfermos con ECV concomitante y en enfermos de >40 años con ≥1 factor de riesgo cardiovascular deben introducirse estatinas, independientemente del perfil lipídico en plasma; tratamiento de la obesidad con aplicación de todos los métodos accesibles (modificación del estilo de vida, farmacoterapia, cirugía bariátrica)
6) tratamiento de las complicaciones de la diabetes.
2. En la diabetes tipo 1 es imprescindible la insulina. La diabetes tipo 2 es una enfermedad progresiva, por lo que es necesario modificar el tratamiento con el tiempo. Al inicio aún con mayor frecuencia se utiliza la metformina, y cuando deja de ser eficaz, se asocian otros fármacos seleccionados de manera individual (→más adelante), considerando las indicaciones de cada fármaco según la presencia concomitante de ECV ateroesclerótica, insuficiencia cardíaca o ERC (→fig. 14.1-1). La pérdida de eficacia del tratamiento se produce con la progresión de la enfermedad y es indicación de insulinoterapia. Antes de iniciarla considerar los agonistas del receptor del GLP-1, especialmente en caso de necesidad de controlar también el sobrepeso u obesidad. Todas las decisiones terapéuticas relacionadas con el tratamiento de la diabetes, independientemente de su tipo, deben tomarse junto con el enfermo.
3. Si en el momento del diagnóstico se presenta pérdida de peso, rasgos de deshidratación, cetonuria o acidosis → comenzar con insulina, aunque se sospeche la diabetes tipo 2. HbA1c >9 %, inestabilidad metabólica al diagnóstico e igual valor de HbA1c a los 3 meses de tratamiento con metformina, sin inestabilidad, son también una indicación temprana de insulinoterapia en la diabetes tipo 2. El diagnóstico definitivo del tipo de diabetes y su tratamiento de mantenimiento se establecerán una vez corregidas las alteraciones metabólicas y excluido el origen autoinmune (en los casos sin el cuadro clínico típico de diabetes tipo 2, como obesidad, acantosis nigricans, circunferencia de cintura aumentada).
Tratamiento no farmacológico
Educación terapéutica
1. La educación para el autocontrol terapéutico es de similar relevancia que la terapia nutricional, la actividad física y la farmacoterapia. En la diabetes tipo 2 la educación terapéutica tiene una dirección ligeramente diferente a la implementada en la diabetes tipo 1, puesto que debe enfocarse sobre todo en el fortalecimiento de las capacidades y la motivación del paciente para llevar un estilo de vida saludable, así como en medidas para perder el peso excesivo.
2. El objetivo es la adquisición de las habilidades que le permitan controlar la enfermedad y evitar complicaciones agudas (hipoglucemia e hiperglucemia), así como el desarrollo de hábitos que faciliten la cooperación en el tratamiento multidisciplinario y una mayor adhesión a las recomendaciones terapéuticas; capacitación en el uso de dispositivos para la administración de insulina y monitorización de glucemia.
3. La educación se realiza tanto de forma individual como colectiva. El entrenamiento en grupo es efectivo y complementario al individual, siendo útiles los grupos de apoyo liderados por otras personas con diabetes. La educación individual permite personalizar objetivos del tratamiento y tener en cuenta las dificultades específicas de cada enfermo. Es imprescindible en situaciones especiales (p. ej. bombas de insulina), tras la cirugía bariátrica y en pacientes dializados. Desde el inicio, informar al paciente con diabetes tipo 2 sobre el carácter crónico y progresivo de la enfermedad, y sobre la necesidad de adhesión al tratamiento.
4. Recomendar el uso de aplicaciones móviles, que pueden ser útiles en la educación sobre la dieta, el autocontrol y los valores objetivo de glucemia, el ajuste de dosis de insulina o su modificación según la actividad física (ayudar al paciente a escoger la aplicación adecuada).
5. La educación es continua, con refuerzos periódicos (también en cuanto al uso de dispositivos para administrar insulina y para vigilar la glucemia), y la evaluación de los resultados es permanente. Se dirige no solo a los conocimientos del enfermo, sino, sobre todo, a sus habilidades para controlar la enfermedad.
Tratamiento nutricional
Todos los pacientes con diabetes deben ser entrenados en los principios generales de una nutrición adecuada en el momento del diagnóstico de la diabetes. El entrenamiento debe repetirse si resulta necesario durante las evaluaciones anuales. Las recomendaciones dietéticas específicas deben adaptarse a las necesidades y preferencias de cada paciente, con la posibilidad de elegir libremente la composición de la dieta. La información sobre la necesidad de limitar o eliminar determinados alimentos debe comunicarse a los pacientes solo en casos justificados. En enfermos tratados con insulina es necesario coordinar el horario de comidas y el contenido de los hidratos de carbono con el modelo de insulinoterapia empleado.
1. Horarios regulares y número adecuado de comidas:
1) en la diabetes tipo 2 tratada con dieta y fármacos no insulínicos pueden ser suficientes 3 comidas al día
2) cuando se utilizan insulinas bifásicas (mezclas) se requieren 3 comidas y adicionalmente 1-2 colaciones al día (igual en pacientes con riesgo de hipoglucemia)
3) con insulinas humanas de acción corta, indicadas solo durante el período inicial de hospitalización, se requieren al menos 3 comidas principales y 3 colaciones intermedias, una de ellas antes de dormir; también son posibles 4 comidas principales y 2 colaciones para prevenir la hipoglucemia
4) si se utilizan insulinas de acción intermedia (NPH, neutral protamine Hagedorn), la distribución de las comidas debe considerar su tiempo de acción máxima
5) cuando se utilizan análogos de acción prolongada o ultraprolongada —como glargina, detemir, glargina de alta concentración (300 uds./ml) o degludec (100 y 200 uds./ml)—, o de acción rápida, no resulta necesario fraccionar más que en 3 comidas, excepto cuando las necesidades nutricionales exijan cantidades de carbohidratos >70-80 g en cada comida
6) la bomba de insulina ofrece la mayor libertad en cuanto a los horarios y al número de ingestas, a condición de que la dosis de insulina se ajuste de forma adecuada a las necesidades.
2. Gracias al aporte adecuado de calorías es posible mantener el peso ideal o reducirlo gradualmente en personas con obesidad o sobrepeso.
1) La reducción del peso corporal no debe superar 2 kg/semana. Se considera beneficiosa una reducción de 0,5-1 kg/semana. Una reducción en ≥5 % del peso inicial se asocia a una notable mejoría del control metabólico en personas con diabetes tipo 2 y obesidad. Existen datos que indican que una pérdida del peso inicial en ≥7 % hace regresar la prediabetes, mientras que con una disminución en >15 % puede remitir la diabetes tipo 2, siempre que no sea avanzada.
2) El aporte de energía depende del estilo de vida y del peso ideal. Para calcular el peso ideal, hay que restar 100 de los centímetros de altura, si esta es ≤164 cm; si es de 165-175 cm, restar 105; y si es >175 cm, restar 110. Se recomienda un aporte calórico de 20-25 kcal/kg de peso ideal en caso de trabajo en posición sentada; trabajo con actividad física moderada, 25-30 kcal/kg de peso ideal; trabajo físico intenso, 30-40 kcal/kg de peso ideal (en Chile y en Argentina se usa el IMC [peso en kg/talla2 en m2] ideal: 22,5 correspondiente a la estatura). La ingesta calórica debe ser lo más estable posible en el tiempo. Los enfermos con diabetes y con sobrepeso u obesidad deben reducir el aporte calórico calculado de esta manera en 250-500 kcal/d. Se considera seguro un déficit calórico de ≤500-750 kcal/d. Resulta beneficiosa una reducción gradual de peso en 0,5-1 kg/semana (no más de 2 kg/semana).
3. Composición cualitativa de la dieta. Las personas con diabetes tipo 1 deben saber estimar los carbohidratos de cada comida para ajustar la dosis de insulina prandial. Deben saber también cómo evaluar el efecto glucémico de las proteínas y grasas ingeridas con la comida.
1) Carbohidratos: ya no se recomienda una proporción fija de carbohidratos en la dieta, ya que no hay suficientes datos científicos que permitan definir una cantidad óptima para todos los enfermos. Se recomienda establecer un plan alimentario individual, ajustado p. ej. al nivel de actividad física, a las preferencias alimentarias y al tipo de carbohidratos consumidos. Habitualmente, los carbohidratos deben constituir ~45 % del valor energético de la dieta, aunque si provienen de alimentos con un índice glucémico (IG) bajo y alto contenido en fibra, pueden constituir hasta el 60 % de la demanda calórica. En personas con niveles muy altos de actividad física, las necesidades energéticas están aumentadas, mientras que en personas con actividad física baja, el aporte de calorías de los carbohidratos puede ser menor. El IG permite clasificar los alimentos que contienen carbohidratos en función de su efecto en la glucemia posprandial (cuanto más alto sea el IG, mayor será el efecto del alimento en la glucemia). No obstante, también tiene importancia el método de preparación de las comidas (p. ej. el grado de cocción). Deben recomendarse alimentos que contienen carbohidratos con bajo IG (<55), sobre todo cereales integrales, y eliminarse prácticamente por completo los carbohidratos simples, que se absorben rápidamente y provocan aumentos de la glucemia posprandial rápidos y difíciles de controlar. El IG tiene menor importancia en la selección de verduras y frutas con pocos carbohidratos. La dieta debe contener 25-50 g/d (o 15-20 g en 1000 kcal) de fibra. Se pueden usar edulcorantes a dosis recomendadas por los fabricantes, pero no se debe sustituir el azúcar común (sacarosa) por la fructosa.
2) Proteínas: 15-20 % del aporte energético total de la dieta (1-1,5 g/kg de peso/d). En personas con diabetes tipo 2 y peso excesivo pueden constituir 20-30 % del contenido calórico de una dieta de reducción (no en personas con daño renal). La cantidad máxima en personas con enfermedad renal crónica (ERC) es de 0,8-1,0 g/kg de peso; en embarazadas, de 1,3 g/kg; y durante enfermedades que cursan con fiebre o en período de recuperación, hasta 1 g/kg. Se prefieren las proteínas vegetales, pescados y aves de corral.
3) Grasas: 30-35 % del valor energético total de la dieta, con reducción de las grasas saturadas. El consumo de colesterol debe limitarse a <300 mg/d (<200 mg/d, si el C-LDL ≥2,6 mmol/l [100 mg/dl]) y deben preferirse grasas de origen vegetal.
4) Sal de mesa: ≤5 g/d.
5) Vitaminas y microelementos: no hay indicaciones de uso, si no coexiste una deficiencia, excepto la vitamina B12 en veganos y vegetarianos, el ácido fólico en embarazadas y a veces preparados multivitamínicos en personas de edad avanzada, tras cirugías bariátricas o que siguen una dieta muy baja en calorías.
6) Alcohol: no recomendado en enfermos con diabetes. Puede favorecer la hipoglucemia (inhibe la gluconeogénesis) y debe incluirse en el balance energético.
Actividad física
La actividad física es un componente imprescindible del tratamiento, debido a sus numerosos beneficios en enfermos con diabetes. Debe ser regular y ajustada a las posibilidades del enfermo, realizada ≥2-3 × semana, de preferencia a diario. A todos los enfermos con diabetes sin contraindicaciones para el ejercicio físico se puede recomendar ejercicio aeróbico, realizado hasta quedar sin aliento, y a los enfermos con diabetes tipo 2 adicionalmente elementos de ejercicios de fuerza.
La OMS recomienda a todos los adultos, independientemente de la edad, realizar ≥30-60 min de actividad aeróbica moderada (p. ej. caminata enérgica, baile o labores de casa intensas) ≥5 × semana o, con la misma frecuencia, 15-30 min de ejercicios de intensidad alta (p. ej. trote, escalada, fútbol) y, adicionalmente, ejercicios de fortalecimiento muscular para los principales grupos musculares ≥2 × semana, y en personas >65 años ejercicios que mejoran el equilibrio. Independientemente del tipo e intensidad de actividad física, debe limitarse también el tiempo que el paciente pasa sentado, ya que incluso una actividad física ligera es beneficiosa para la salud. Un episodio de hipoglucemia grave es una contraindicación para realizar ejercicio físico durante las siguientes 24 h. Las personas con diabetes tipo 1 sin complicaciones crónicas importantes pueden realizar ejercicio físico de cualquier tipo, también de máxima intensidad.
1. Recomendaciones para la práctica segura de ejercicio físico en la diabetes tipo 1: es imprescindible la adecuada formación del paciente para que sepa evaluar la intensidad y la duración del ejercicio, así como los requerimientos de insulina y carbohidratos adicionales. Además, en caso de presentación de complicaciones avanzadas de la diabetes, debe evitar un esfuerzo de alta intensidad.
El enfermo debe:
1) controlar la glucemia antes, durante y unas horas después de terminar el ejercicio
2) ingerir carbohidratos adicionales antes, cada hora durante el esfuerzo y además después de terminarlo, en particular si el ejercicio fue más prolongado (20-30 g por cada 30 min de ejercicio)
3) evitar ejercicio intenso en el pico de la acción de insulina
4) no inyectar insulina en la zona que participa muy activamente en el ejercicio (p. ej. en el muslo)
5) en algunos pacientes puede ser necesario disminuir la dosis de insulina antes del ejercicio hasta en un 30-50 %, en función de la intensidad del ejercicio y de la glucemia
6) en caso de glucemia >13,9 mmol/l (250 mg/dl), determinar cuerpos cetónicos en orina o sangre y, en caso de ser detectados, evitar el ejercicio (puede aumentar la hiperglucemia y la cetosis).
2. Recomendaciones para la práctica segura de ejercicio físico en la diabetes tipo 2:
1) el ejercicio físico sistemático y de adecuada intensidad es uno de los métodos básicos del tratamiento de la diabetes tipo 2; su objetivo es disminuir la insulinorresistencia y el peso corporal
2) en enfermos tratados con dieta y fármacos no insulínicos el riesgo de hipoglucemia es bajo (las personas con sobrepeso u obesidad deben evitar la ingesta de los hidratos de carbono adicionales durante el ejercicio)
3) en enfermos tratados con insulina →más arriba
4) el enfermo debe realizar actividad física regularmente, durante ≥30-45 min al día, de moderada intensidad y adaptada a las condiciones de salud del paciente; en personas >65 años y/o con sobrepeso, la forma de actividad física más adecuada es caminar deprisa (hasta quedar sin aliento) 3-5 × semana (~150 min/semana)
5) son de utilidad los ejercicios de resistencia muscular combinados con los aeróbicos
6) la interrupción de la posición sentada con 3 min de movimientos rápidos intensos, cada 2 h, ha mostrado ser práctica y beneficiosa
7) se recomienda realizar ejercicio físico más intenso, si es bien tolerado, varias veces a la semana y no solo ocasionalmente, comenzando y finalizando con ejercicios de menor intensidad durante 5-10 min
8) en caso de glucemia >16,7 mmol/l (300 mg/dl), el enfermo debe determinar con tira reactiva los cuerpos cetónicos en orina o sangre y, en caso de ser detectados, evitar el ejercicio (puede aumentar la hiperglucemia y la cetosis)
9) también pacientes con complicaciones crónicas, como daño de órgano diana por amputaciones, insuficiencia renal o secuelas de ACV, deben realizar ejercicio adecuado y adaptado a su comorbilidad.
Duración y calidad del sueño
El sueño de calidad deficiente o demasiado corto puede empeorar el control metabólico de la diabetes, por lo que un objetivo importante del tratamiento consiste en asegurar la calidad y la duración adecuada del sueño. Por eso es necesario evitar los factores de riesgo de hiper- o hipoglucemia, por lo que es preferible elegir un modelo terapéutico que permita estabilizar y controlar la glucemia por la tarde y en la noche.
Tratamiento farmacológico de la diabetes tipo 1
Insulinoterapia
1. Indicaciones de insulinoterapia: todas las formas de diabetes tipo 1, incluida la LADA, son indicaciones absolutas para la insulinoterapia, debido al déficit de insulina presente desde el diagnóstico.
2. Tipos de insulinas
Clasificación según la composición química: insulina humana y análogos de insulina humana (se obtienen por medio de ingeniería genética).
Clasificación según el tiempo de acción →tabla 14.1-8.
1) Insulina prandial:
a) análogos de insulina de acción rápida: inyectados VSc, con mayor frecuencia antes de las comidas, si bien pueden administrarse durante o después de comer, normalmente 3 × d; también se utilizan VSc en las bombas de insulina; el uso de preparados de acción rápida permite reducir el número de comidas
b) insulina humana de acción corta (insulina neutra): inyectada VSc hasta 30 min antes de las comidas principales, 3 × d; debido a su tiempo de acción más largo (→fig. 14.1-2), los enfermos requieren colaciones adicionales →más arriba; también se utiliza en las bombas de insulina.
2) Insulina basal que imita el patrón natural de liberación de insulina endógena:
a) NPH: inyección VSc, en combinación con una insulina de acción corta 1 × d (por la noche), y en combinación con análogos de acción rápida normalmente 2 × d (por la mañana y por la noche)
b) análogos de insulina de acción prolongada: utilizados normalmente 1 × d VSc (por la mañana o por la noche, a la misma hora); la insulina detemir se inyecta VSc en combinación con análogos de acción rápida 1 o 2 × d (por la mañana y por la noche) en función del requerimiento; su ventaja es una concentración sanguínea uniforme en el tiempo (→fig. 14.1-3), lo que facilita el manejo de la insulinoterapia intensiva; los preparados con análogo de insulina de alta concentración, como glargina (300 UI/ml) y degludec (200 UI/ml), que contienen respectivamente 3 y 2 veces más unidades de insulina en una unidad de volumen que los preparados basales (100 UI/ml), proporcionan mayor reproducibilidad y estabilidad de la glucemia; considerar especialmente en enfermos que utilizan dosis altas de insulina basal (la mayor concentración del fármaco requiere un menor volumen de inyecciones VSc)
c) los análogos de insulina de acción rápida o las insulinas humanas de acción corta también imitan la liberación natural de insulina si se administran iv. en bomba de infusión o VSc mediante bomba de insulina.
3. Selección del tipo de insulina y del modelo de insulinoterapia: debe realizarse de manera individual, teniendo en cuenta el estilo de vida, el grado de actividad y el horario de comidas de cada enfermo.
Insulinoterapia intensiva con inyecciones múltiples de insulina a lo largo de 24 h: la concentración basal de insulina se consigue inyectando 1 × d la insulina isofánica de acción intermedia (NPH) o un análogo de acción prolongada, mientras que los picos posprandiales de insulina se consiguen mediante inyecciones preprandiales de insulinas de acción corta (→fig. 14.1-2) o de análogos de acción rápida 3 × d (→fig. 14.1-3): es el esquema basal-bolo.
El uso de análogos de acción rápida a la hora de comer puede conllevar la necesidad de realizar 2 inyecciones de NPH o de utilizar un análogo de acción prolongada 1 × d.
Ejemplos de esquemas de inyecciones múltiples:
1) 4 inyecciones:
a) insulina de acción corta antes del desayuno (20-25 % de la dosis diaria), antes del almuerzo (15 %) y antes de la cena (20 %)
b) NPH o análogo de acción prolongada antes de dormir, sobre las 22:00 (40 % de la dosis diaria)
2) 5 inyecciones:
a) análogo de acción rápida antes del desayuno (20 % de la dosis diaria), antes del almuerzo (20 %), antes de la primera cena sobre las 17:00-18:00 (10 %)
b) NPH antes del desayuno (25 %) y de la segunda cena (25 %).
Insulinoterapia intensiva funcional: recomendada como tratamiento de elección de la diabetes tipo 1. Es un desarrollo del método anterior o puede emplearse mediante una bomba de insulina. Su funcionalidad consiste en que, según la hora prevista y la composición de la comida (incluido el índice glucémico), así como según la activad física planificada y la glucemia actual, el enfermo adecuadamente educado automodifica el horario de administración y la dosis de insulina. Al usar una bomba de insulina pueden modificarse tanto las infusiones basales como las inyecciones (bolos) prandiales. En enfermos con diabetes tipo 1 es preferible el uso de análogos de insulina, debido a un menor riesgo de hipoglucemia y mejor calidad de vida. En enfermos con diabetes tipo 1 tratados con este modelo de insulinoterapia el uso de MCG es útil para reducir los valores de HbA1c y mantenerlos en el rango deseado.
4. Dispositivos modernos para la administración de insulina
Bombas de insulina: administran el análogo de insulina de acción rápida en infusión continua VSc, se utilizan con cada vez mayor frecuencia. En las nuevas minibombas tanto la infusión basal como los bolos pueden ser modificados de múltiples maneras. En general, la dosis en infusión basal debe ser mayor por la noche para compensar la producción elevada de glucosa por el hígado. Al liberar los bolos prandiales, es posible modificar la dosis de insulina y el ritmo de administración según la composición de la comida y el índice glucémico.
Las bombas de insulina son especialmente útiles en la diabetes lábil y en caso del fenómeno del alba (hiperglucemia por la madrugada y antes del desayuno), así como en situaciones que requieren normoglucemia de manera estricta por un tiempo determinado (p. ej. durante el embarazo o el tratamiento del pie diabético). El uso de bombas de insulina también está indicado en los siguientes casos: necesidad de utilizar insulina a dosis bajas (p. ej. en niños y embarazadas), imposibilidad de conseguir el control metabólico con inyecciones múltiples de insulina, episodios recurrentes e imprevisibles de hipoglucemia, hipoglucemia inadvertida, así como estilo de vida y alimentación irregulares. En el tratamiento es necesario ajustar las dosis de insulina al tipo y la cantidad de los hidratos de carbono consumidos, y además tener en cuenta la actividad física realizada. Resulta útil el software de gestión de la bomba, que incluye p. ej. una calculadora de bolo. Al utilizar las bombas de insulina es necesario tener presente el riesgo asociado a la interrupción de la infusión (la cetoacidosis puede producirse más rápidamente si se utilizan análogos en vez de la insulina humana), riesgo de infección en el lugar de la punción subcutánea y de hipoglucemia (si la dosis administrada en infusión basal es demasiado elevada en relación con el aporte calórico). Es importante la posibilidad de combinar la MCG con bombas de insulina, sobre todo aquellas que tienen la opción de bloqueo automático de infusión de insulina en caso de riesgo de hipoglucemia. Además del uso generalizado de bombas de insulina en la diabetes tipo 1, estas se utilizan con cada vez mayor frecuencia en situaciones especiales en la diabetes tipo 2. Desde el punto de vista de usuario, a la hora de elegir la bomba se deben tener en cuenta: precio y disponibilidad, beneficios esperados del uso, capacidad de manejar el dispositivo por cuenta propia, presencia de la funcionalidad de calculadora de bolos (y capacidad de utilizarla), volumen del contenedor de insulina, rendimiento de la batería (duración del funcionamiento del dispositivo), presencia de la funcionalidad de bloqueo (lo que aumenta la seguridad del tratamiento), longitud o ausencia de tubos, facilidad de uso para zurdos y resistencia al agua.
Bomba de insulina guiada por la glucemia (sistema de asa cerrada): con cada vez mayor frecuencia se utilizan los sistemas híbridos de asa cerrada. La insulina se administra de manera automática en infusión basal, es decir, en la noche y entre comidas, sin intervención del paciente, solo a partir de los datos obtenidos del sistema MCG sincronizado con la bomba (de ahí la denominación "sistema de asa cerrada"). Esto mejora significativamente la calidad de vida y la seguridad de los enfermos, protege de episodios de hipoglucemia inadvertida y previene la hiperglucemia. La eficacia de los sistemas de asa cerrada depende de la calidad y precisión de los algoritmos que controlan la infusión subcutánea de insulina, y de la sensibilidad del sensor del sistema MCG. Las bombas de asa cerrada no son plenamente automáticas y requieren la introducción manual de los datos sobre las cantidades de los hidratos de carbono consumidos con las comidas, lo que es necesario para calcular automáticamente la dosis de bolos prandiales. Por esta razón, se denominan híbridas. El usuario decide por su cuenta sobre la administración de bolos prandiales de insulina, pero la dosis es establecida por la calculadora de bolos a partir de la información ingresada sobre los hidratos de carbono consumidos. También la actividad física realizada influye en la toma de decisiones y modificación del tratamiento, por lo que es necesaria una educación adecuada en esta materia. El sistema de predicción del riesgo de hipoglucemia sigue activo de manera continua y en situaciones de riesgo bloquea temporalmente la infusión de insulina. Cuando el riesgo desaparece, la infusión se reinstaura automáticamente sin la intervención del usuario. Estos dispositivos se siguen investigando y perfeccionando. El uso de estos sistemas permite evitar la hipoglucemia, también la inadvertida y la nocturna, y la cetoacidosis diabética. Esto permite mantener un buen control de la glucemia sin necesidad de medirla de manera continua ni tomar decisiones relativas a la dosis de insulina. Por esta razón, existe un creciente interés en estos sistemas, aunque para muchos enfermos su coste es excesivo.
Sistema de asa cerrada de código abierto (DIY APS, do-it-yourself artificial pancreas system, sistema de páncreas artificial de tipo "hágalo usted mismo"): funciona de manera similar a los sistemas híbridos de asa cerrada; son dispositivos que se basan en la aplicación de código abierto APS (artificial pancreas system), que permite combinar MCG con bomba de insulina en un sistema de asa cerrada (DIY APS), pudiendo mejorar de manera significativa el control metabólico de la diabetes. La configuración y el ajuste de la aplicación a las necesidades individuales requiere un gran compromiso del paciente. Además, estos sistemas, aunque ampliamente disponibles, tienen carácter experimental y no tienen certificados de seguridad pertinentes (por lo que la responsabilidad asociada a su uso recae sobre el paciente). Independientemente del sistema utilizado, los enfermos requieren una educación especial, adecuada a las características de estos dispositivos.
Páncreas biónico iLet: el sistema más reciente y más avanzado de asa cerrada, aprobado por la FDA en mayo de 2023 para las personas de ≥6 años con diabetes tipo 1, que incluye la bomba Beta Bionics iLet ACE y el software iLet Dosing Decision, con monitorización de la glucemia continua integrada (iCGM) compatible. Este nuevo sistema automático de dosificación de insulina requiere recibir información sobre la comida y la cantidad de los hidratos de carbono consumidos: "baja", "moderada" o "alta". Luego, sin intervenciones posteriores del usuario, el sistema controla el aporte de insulina; no es posible cambiar los ajustes del sistema ni programar dosis adicionales de insulina. Este sistema puede reducir de manera radical la carga asociada al tratamiento de la diabetes tipo 1 en muchos enfermos.
5. Métodos alternativos de tratamiento de la diabetes tipo 1:
1) trasplante del páncreas: con mayor frecuencia en enfermos con insuficiencia renal, en los que el riñón se trasplanta junto con el páncreas
2) trasplante de los islotes de Langerhans: se relaciona con un menor riesgo que el trasplante de páncreas y permite obtener normoglucemia completa; sin embargo, la funcionalidad de las células trasplantadas se deteriora con el tiempo
3) bomba de insulina implantable, controlada por glucemia: dispositivo que funciona como asa cerrada, es decir, dosifica la insulina o la insulina y el glucagón, dependiendo de la glucemia actual; en fase de ensayos clínicos.
Tratamiento farmacológico de la diabetes tipo 2
Según los principios modernos de tratamiento de la diabetes, se deben tomar en consideración y tratar todas las alteraciones que la acompañan, sin limitarse solamente al control de la glucemia; sobre todo en la diabetes tipo 2, en la cual, además de las alteraciones del metabolismo de los hidratos de carbono, son igual de frecuentes los trastornos lipídicos, la hipertensión arterial y otras enfermedades cardiovasculares. Los criterios actuales de control de la diabetes obligan a realizar un tratamiento multifactorial (→tabla 14.1-5, →tabla 14.1-6, →tabla 14.1-7). Es necesario intentar disminuir el peso en caso de sobrepeso u obesidad, lo que —desde la publicación de las recomendaciones de la ADA y la EASD (2022)— se ha convertido en un nuevo objetivo de tratamiento de la diabetes tipo 2. El manejo, que incluye el aumento de la actividad física, una dieta adecuada, el uso de fármacos antidiabéticos, así como el tratamiento de la hipertensión arterial y dislipidemia, disminuye el riesgo de complicaciones en enfermos con diabetes tipo 2. Todas las decisiones terapéuticas relativas al tratamiento de la diabetes deben ser personalizadas y tomarse junto con el enfermo. Las estrategias y esquemas terapéuticos deben adaptarse a la realidad regional de cada país, a la disponibilidad y accesibilidad de fármacos, y a la experiencia del profesional responsable.
Fármacos no insulínicos
1. Clasificación en función del mecanismo de acción
Fármacos no insulínicos potenciadores de la secreción de insulina:
1) que actúan sobre las células β del páncreas: sulfonilureas (gliclazida, gliquidona, glimepirida, glipizida; estimulan las células β pancreáticas a aumentar la secreción de insulina al unirse al receptor SUR1; varían según la intensidad y el tiempo de acción)
2) que actúan sobre el sistema incretina: inhibidores de la dipeptidil-peptidasa 4 (DPP-4), las denominadas gliptinas (alogliptina, linagliptina, saxagliptina, sitagliptina y vildagliptina: fuertes inhibidores selectivos de la DPP-4, que inhiben la inactivación de las incretinas endógenas [GLP-1 y GIP], por lo que aumentan sus niveles en sangre, aumentan la sensibilidad de las células β a la glucosa y a la secreción de insulina dependiente de glucosa; se utilizan VO); agonistas del receptor del GLP-1 (dulaglutida, exenatida de liberación prolongada, liraglutida, lixisenatida, semaglutida: activan el receptor del GLP-1, lo que aumenta la secreción de insulina dependiente de glucosa, inhiben la secreción de glucagón, retrasan el vaciamiento gástrico, disminuyen el apetito y favorecen la pérdida de peso (el efecto depende del preparado, el más potente en este contexto es la semaglutida; tanto la liraglutida [VSc 1 × d] como la semaglutida [VSc 1 × semana] se han registrado a dosis mayores como preparados para el tratamiento de la obesidad, independientemente de la coexistencia de diabetes), se caracterizan por la resistencia a la digestión por la DPP-4 específica y tienen una acción mucho más prolongada que el GLP-1 endógeno; requieren la administración VSc (solo la semaglutida está disponible VSc y, con una acción ligeramente menos potente, VO). Adicionalmente se ha demostrado que algunos fármacos de este grupo resultan beneficiosos en pacientes con ECV ateroesclerótica y además frenan la progresión de la ERC (aunque en estos casos en primer lugar se prefieren los inhibidores del SGLT2 seleccionados); el agonista dual de los receptores del GLP-1 y del GIP (tirzepatida) para uso VSc 1 × semana fue aprobado por la FDA y la EMA en 2022 para el tratamiento de la diabetes tipo 2, y en 2023, debido a su eficacia muy alta en la reducción del peso, también para el tratamiento de la obesidad. Actualmente se están llevando a cabo estudios con otros fármacos, incluido el triagonista de los receptores del GLP-1, del GIP y del glucagón (retatrutida) con resultados muy prometedores, especialmente los relativos a sus efectos sobre la reducción de peso.
Fármacos no insulínicos de acción periférica:
1) que disminuyen la insulinorresistencia: biguanidas (metformina; inhibe la producción hepática de glucosa, aumenta la glucólisis anaerobia, aumenta la sensibilidad a la insulina, reduce el peso corporal, mejora el perfil lipídico y disminuye la presión arterial) y tiazolidinadionas (agonistas del receptor nuclear PPAR-γ), las denominadas glitazonas (pioglitazona: disminuye la insulinorresistencia en las células del tejido adiposo, de los músculos esqueléticos y del hígado y, en consecuencia, disminuye la concentración de los ácidos grasos libres y de la glucosa en sangre); aumentan la retención de líquidos y pueden agravar edemas, están contraindicados en pacientes con insuficiencia cardíaca III/IV de la NYHA
2) que aumentan la glucosuria: inhibidores del cotransportador sodio-glucosa tipo 2, responsable de la reabsorción de ~90 % de la glucosa de la orina (inhibidores del SGLT2, las denominadas gliflozinas: dapagliflozina, empagliflozina, ertugliflozina, canagliflozina); limitan la reabsorción de la glucosa en el túbulo proximal de la nefrona, aumentando la excreción de su exceso por la orina (glucosuria sin hiperglucemia concomitante); pueden favorecer moderadamente la pérdida de peso y disminuyen la presión arterial; se ha demostrado que algunos fármacos de este grupo frenan la progresión de la ERC, resultan beneficiosos en la insuficiencia cardíaca y en la ECV ateroesclerótica
3) que enlentecen la digestión de carbohidratos: inhibidores de la α-glucosidasa (acarbosa; tiene una afinidad por la α-glucosidasa [enzima del borde del cepillo de las vellosidades intestinales] ~100 000 veces mayor que los oligosacáridos, provocando una inhibición casi total de su actividad, lo que enlentece la etapa enzimática final de la digestión de polisacáridos, oligosacáridos y algunos disacáridos [maltosa, sacarosa]).
2. Principios de selección de fármacos. Los antidiabéticos se utilizan en monoterapia o en terapia combinada con fármacos de distintos grupos (→tabla 14.1-9, →tabla 14.1-10), o algunos de ellos con insulina, para conseguir el objetivo de glucemia. Con la excepción de los agonistas del receptor del GLP-1, los fármacos no insulínicos son esenciales en el tratamiento de la diabetes tipo 2, junto con los métodos no farmacológicos. A la hora de seleccionarlos, también es necesario valorar sus efectos extraglucémicos, como la influencia en el riesgo de muerte, en enfermedades cardiovasculares, función renal, peso, riesgo de hipoglucemia y metabolismo de los lípidos, y personalizar el tratamiento de manera adecuada (→tabla 14.1-11).
3. Orden de selección de fármacos
Inicio de tratamiento: el primer fármaco oral recomendado desde el momento de diagnóstico de la diabetes tipo 2, si no coexiste enfermedad ateroesclerótica cardiovascular diagnosticada, alto riesgo cardiovascular, insuficiencia cardíaca ni ERC, sigue siendo la metformina. En todas las etapas del tratamiento de la diabetes se debe evaluar el riesgo cardiovascular y la función renal para la elección de los fármacos.
Algoritmo de tratamiento de la diabetes tipo 2 →fig. 14.1-1 y →fig. 14.1-4.
En caso de contraindicaciones para el uso de metformina o su intolerancia, el tratamiento puede iniciarse con una incretina, inhibidor del SGLT2, sulfonilurea o pioglitazona, teniendo en cuenta que en enfermos con alto riesgo de hipoglucemia, obesidad o función renal alterada se prefieren los inhibidores del SGLT2 o los agonistas del receptor del GLP-1, y en segundo lugar las gliptinas. En casos de ECV ateroesclerótica diagnosticada, insuficiencia cardíaca o ERC, o cuando coexisten múltiples factores de riesgo cardiovascular, se puede considerar iniciar la terapia para la diabetes tipo 2 de diagnóstico reciente con 2 fármacos desde el principio: un inhibidor del SGLT2 y metformina, o un agonista del receptor del GLP-1 y metformina. Además, las asociaciones con metformina son posibles incluso con un control glucémico óptimo, con el fin de conseguir objetivos terapéuticos complementarios →fig. 14.1-1. En casos de diabetes ya tratada, alto riesgo cardiovascular y/o rasgos de ERC (disminución de la TFGe y/o proteinuria), a la metformina debe asociarse un inhibidor del SGLT2 (preferido como el primer fármaco en caso de insuficiencia cardíaca o ERC concomitante) o un agonista del receptor del GLP-1 (de preferencia en ECV ateroesclerótica, recomendado en ERC si el inhibidor del SGLT2 no puede utilizarse), incluso si la HbA1c todavía se encuentra en el rango objetivo.
Tratamiento posterior: la diabetes tipo 2 es una enfermedad progresiva, por lo que es necesario modificar el tratamiento con el tiempo. La característica principal del tratamiento moderno de la diabetes es el enfoque individual, tanto en la intensidad y los objetivos del tratamiento como en la selección de fármacos. No aplazar la decisión sobre la modificación del tratamiento. Si a pesar de las modificaciones del estilo de vida (reducción del peso corporal, aumento de la actividad física hasta ≥30-45 min/d) y el uso de metformina (en monoterapia o en combinación con un inhibidor del SGLT2 o un agonista del receptor del GLP-1) se produce un aumento de la glucemia y no se alcanza el control objetivo de la diabetes (valorado mediante la HbA1c), asociar un segundo (o tercer) antidiabético. El tratamiento posterior depende de la presencia de ECV o ERC clínicas →fig. 14.1-1 y →fig. 14.1-4.
4. Tratamiento de la diabetes tipo 2 en enfermos con diagnóstico de ECV, insuficiencia cardíaca y/o ERC: en cada etapa del tratamiento de la diabetes tipo 2 en personas con insuficiencia cardíaca (especialmente con fracción de eyección reducida [HFrEF], incluso en el estadio inicial, así como con fracción de eyección preservada [HFpEF], sin importar su origen) se prefieren los inhibidores del SGLT2, puesto que está demostrado que disminuyen la progresión de la insuficiencia cardíaca y las hospitalizaciones por su causa. Los inhibidores del SGLT2 también son de preferencia en enfermos con ERC (con TFG disminuida y/o albuminuria 30-300 mg/d o proteinuria clínica) porque está demostrado que inhiben la progresión de la ERC, pero no pueden utilizarse en la insuficiencia renal extrema (→tabla 14.4-4). Las guías de la ADA y la KDIGO (2022), y de la ADA (2024) indican los grupos farmacológicos específicos que han demostrado efectos beneficiosos en los estudios realizados (→tabla 14.1-11).
Los agonistas del receptor del GLP-1 se recomiendan especialmente en enfermos con ECV ateroesclerótica o con importantes factores de riesgo de ateroesclerosis, así como en la ERC (de segunda elección, tras los inhibidores del SGLT2), también avanzada (cuando no se pueden usar los inhibidores del SGLT2). Los agonistas del receptor del GLP-1 ofrecen ventajas sobre los inhibidores del SGLT2 en cuanto al efecto beneficioso sobre la ECV ateroesclerótica, pero no retrasan la progresión de la insuficiencia cardíaca. Un beneficio importante relacionado puede ser la reducción del peso excesivo.
Un inhibidor del SGLT2 o un agonista del receptor del GLP-1, independientemente de la complejidad del tratamiento (p. ej. terapia con 3 fármacos o con 4 fármacos, o insulinoterapia intensiva) debe asociarse en todos los enfermos con riesgo cardiovascular muy alto que no han recibido fármacos de estos grupos.
Antes de iniciar la insulinoterapia es importante aprovechar las propiedades antihiperglucemiantes de los agonistas del receptor del GLP-1, que deben utilizarse como primera terapia de inyección en la diabetes tipo 2, siempre y cuando los pacientes puedan permitírselos.
No aplazar la decisión sobre la modificación del tratamiento.
5. Si no se ha diagnosticado una ECV ni una ERC, al tomar la decisión sobre la selección del segundo antidiabético para asociar a la metformina, se deben tener en cuenta las características individuales del paciente y sus preferencias, el perfil de seguridad, la tolerancia, la eficacia para disminuir la glucemia, la facilidad de uso, el coste y el mecanismo patogénico actualmente predominante (insulinorresistencia o alteración en la secreción de insulina) →fig. 14.1-4. Al seleccionar el segundo fármaco en personas con alto riesgo de hipoglucemia, se debe tener preferencia por un inhibidor de la DPP-4, agonista del receptor del GLP-1, inhibidor del SGLT2 o glitazona. Si el objetivo principal es la reducción del peso, se debe tener preferencia por un agonista del receptor del GLP-1 o un inhibidor del SGLT2, aunque los fármacos del primer grupo son más eficaces; las guías de la ADA y la EASD (2022), y de la ADA (2024) indican que los fármacos utilizados en el tratamiento de la diabetes tipo 2 varían según el efecto sobre la reducción del peso:
1) los más potentes: semaglutida y tirzepatida
2) potentes: dulaglutida y liraglutida
3) de potencia moderada: otros fármacos del grupo de agonistas del receptor del GLP-1 e inhibidores del SGLT2
4) neutros: gliptinas y metformina.
Si el coste del tratamiento es una limitación, se prefiere un inhibidor de la DPP-4 (gliptina), una sulfonilurea o una glitazona. En caso de necesidad, asociar un 3.er fármaco con otro mecanismo de acción (está contraindicado combinar los agonistas del receptor del GLP-1 con los inhibidores de la DPP-4). La dosificación de los fármacos debe establecerse de manera individual según el perfil glucémico →Vigilancia. No retrasar la insulinoterapia si está indicada (→más arriba). Principios de asociación de los fármacos no insulínicos con insulina →tabla 14.1-12.
Insulinoterapia
1. Indicaciones:
1) Ineficacia del tratamiento: HbA1c >7 % o mayor que el valor objetivo, a pesar de intensificar el tratamiento farmacológico y conductual (tras descartar los errores dietéticos y otras causas de ineficacia del tratamiento con fármacos no insulínicos, como p. ej. focos de infección). Puede considerarse la insulinoterapia incluso cuando la metformina en monoterapia resulta insuficiente. En caso de dudas, el agotamiento de la reserva insulínica tras la estimulación con glucagón confirma la disminución de la concentración sérica del péptido C (en la práctica esta prueba se requiere raramente).
2) Contraindicaciones de los fármacos no insulínicos.
3) Tratamiento temporal: diabetes tipo 2 de diagnóstico reciente con hiperglucemia significativa (>16,7 mmol/l [300 mg/dl] en ayunas) y sintomática (una vez controlada la glucotoxicidad, la glucemia y el estado metabólico, pueden usarse fármacos no insulínicos o, con menor frecuencia, puede continuarse la insulina asociada a metformina); síndrome coronario agudo, angioplastia coronaria percutánea (idealmente empleando infusión iv. continua de insulina), ACV, procesos inflamatorios agudos, traumatismos y otras emergencias, corticoterapia, cirugía y embarazo.
2. Tipos de insulinas
Elegir de forma individual el preparado y el modelo de insulinoterapia, teniendo en cuenta el estilo de vida y el horario de comidas del enfermo.
Clasificación según la estructura química: insulina humana y análogos de insulina humana.
Clasificación según el tiempo de acción →tabla 14.1-8.
Mezclas de insulinas (insulinas compuestas, bifásicas →tabla 14.1-13):
1) análogo de insulina de acción rápida con suspensión del mismo análogo con protamina de acción prolongada
2) insulina de acción corta con insulina de acción intermedia
3) análogo de acción rápida y análogo de acción prolongada o ultraprolongada.
Cada una de las insulinas integrantes de la mezcla alcanza su pico de acción en diferentes momentos, es decir, con una sola inyección se obtienen 2 picos de insulina en sangre →fig. 14.1-5. La magnitud de estos picos depende de la proporción de los componentes del preparado y de la dosis. El pico relacionado con la acción de la insulina de acción rápida o corta es mayor y su tiempo de duración es más corto.
Las mezclas de insulinas se inyectan 2-3 × d. El enfermo tiene que comer antes de cada pico de acción de la insulina. Se emplean frecuentemente en el tratamiento de la diabetes tipo 2, especialmente en personas mayores y menos hábiles, en las que no es estrictamente obligatorio cumplir los criterios de control de la glucemia.
3. Modelos y tipos de insulinoterapia en enfermos con diabetes tipo 2
No posponer la insulinoterapia, ya que la persistencia de la hiperglucemia y de los niveles elevados de proinsulina acelera el desarrollo de complicaciones de la diabetes. En todos los esquemas de insulinoterapia en la diabetes tipo 2 asociar la metformina, siempre y cuando no esté contraindicada. Principios generales de tratamiento →fig. 14.1-6.
Insulinoterapia simple: tratamiento combinado de fármacos no insulínicos (principios de combinación de los fármacos no insulínicos con insulina →tabla 14.1-12) y 1 inyección de insulina basal, que imita su secreción basal (NPH o análogo de acción prolongada, cuya administración se asocia a un menor riesgo de hipoglucemia nocturna y grave). Se trata de una pauta de manejo de la diabetes tipo 2 habitualmente transitoria (desde unos meses hasta unos años) hasta precisar un esquema completo de administración de insulina. Opcionalmente, puede emplearse también la acarbosa (combinación no recomendada en Chile ni en Argentina).
Comenzar la insulinoterapia cuando fracasa el tratamiento combinado con 2-3 fármacos no insulínicos. El tratamiento con insulina en 1 inyección en combinación con metformina puede considerarse más precozmente, cuando la metformina en monoterapia es ineficaz.
En personas tratadas con insulina administrada 1 × d, simultáneamente pueden utilizarse fármacos no insulínicos, de acuerdo con la ficha técnica. Si coexiste sobrepeso u obesidad, se prefiere la terapia combinada con metformina y un inhibidor del SGLT2 o una incretina (inhibidor de la DPP-4 o agonista del receptor del GLP-1). En caso de normopeso, puede considerarse la terapia combinada con metformina y una sulfonilurea.
1) La dosis inicial de insulina administrada 1 × d puede ser de 10 uds. o de 0,2 uds./kg. Si la hiperglucemia se presenta en ayunas, recomendar la inyección por la noche; y si la glucemia en ayunas es normal y la hiperglucemia se presenta durante el día, la inyección por la mañana.
2) Controlar la glucemia en ayunas, aumentando progresivamente la dosis de insulina, p. ej. en 2-4 uds. cada 4-5 días, hasta conseguir una glucemia dentro del rango terapéutico (p. ej. 3,9-7,2 mmol/l [70-130 mg/dl] o en rango mayor).
3) Si la glucemia en ayunas es >10 mmol/l (180 mg/dl) → aumentar la dosis de insulina basal administrada por la noche, p. ej. en 2 uds. cada 3 días (en tratamiento ambulatorio).
4) En caso de hipoglucemia por la noche o por la mañana (a pesar de una ingesta adecuada de alimentos) o si la glucemia en ayunas es <3,9 mmol/l (70 mg/dl) → disminuir la dosis de insulina basal administrada antes de dormir, p. ej. en 4 uds. o en el 10 % (normalmente el mayor de estos valores).
5) En caso de HbA1c >7 % a pesar de haber intensificado el tratamiento farmacológico y conductual o si las necesidades de NPH administrada 1 × d son >0,3-0,5 uds./kg → considerar un esquema de insulinoterapia intensiva (en forma de 2 inyecciones con insulinas premezcladas, o al añadir a la insulina de acción prolongada inyecciones de insulina de acción corta o de un análogo de acción rápida 1-3 × d antes de la comida; este tratamiento puede instaurarse de manera gradual) y discontinuar los secretagogos de insulina. Si el trastorno principal es la hiperglucemia posprandial (a pesar de la normoglucemia en ayunas), al iniciar la insulinoterapia intensiva deben considerarse en primer lugar varias inyecciones de insulina de acción corta o de un análogo de acción rápida, antes de las comidas.
Insulinoterapia intensiva: uso de ≥2 inyecciones de insulina al día para garantizar que se cubran las necesidades de insulina basal y posprandial.
1) Uso de insulinas premezcladas: modelo básico de insulinoterapia en la diabetes tipo 2 (→fig. 14.1-5). Ventajas: escaso número de inyecciones (normalmente 2), lo que facilita el tratamiento en personas de edad avanzada y con discapacidad. Desventajas: a menudo no permite conseguir los criterios de control recomendados y requiere unos horarios fijos de comidas, sobre todo al mediodía.
a) Elegir la adecuada insulina premezclada →tabla 14.1-13 e individualizar la dosificación.
b) Al cambiar la NPH inyectada 1 × d a 2 inyecciones de insulina bifásica (p. ej. 30:70, con el 30 % de insulina de acción corta), recordar que la dosis total diaria de insulina debe ser ~30 % mayor que la de la NPH utilizada hasta el momento.
c) Distribución inicial de la dosis diaria: por la mañana 60 %, por la noche 40 % →fig. 14.1-5.
d) Planificar visitas frecuentes en el período destinado a establecer la dosificación. En cada visita verificar si el paciente administra la insulina y determina la glucemia con glucómetro de forma correcta.
2) Esquema basal-plus: modelo intermedio de insulinoterapia, que facilita la transición del modelo simple a la insulinoterapia intensiva. En enfermos con diabetes tipo 2 que utilizan insulina basal 1 × d pueden introducirse gradualmente inyecciones de insulina de acción corta o de análogo de acción rápida antes de las comidas, añadiendo inicialmente 1 inyección adicional (de preferencia antes de la comida principal, seguida por el mayor aumento de glucemia), hasta llegar gradualmente a 3 inyecciones de esta insulina antes de todas las comidas principales del día (esquema basal-bolo).
3) Esquema basal-bolo (insulinoterapia intensiva →más arriba, Tratamiento farmacológico de la diabetes tipo 1): en la actualidad es un método menos frecuente en enfermos con diabetes tipo 2 que requieren la insulinoterapia completa, y se considera solo en los pacientes en los que las inyecciones de insulina 4 × d no suponen un problema importante.
En la diabetes tipo 2 se procura simplificar el modelo de tratamiento. La finalidad es limitar la complejidad y las cargas para el paciente asociadas al tratamiento, sobre todo con insulina, y considerar fijar objetivos de glucemia menos estrictos en muchos pacientes con diabetes tipo 2. Este enfoque también puede incluir a los enfermos con alto riesgo de hipoglucemia, con trastornos cognitivos, sin adhesión a las recomendaciones, con esperanza de vida corta o en los que un esquema terapéutico complejo influye en la calidad de vida. Es posible reducir el número de inyecciones y la dosis de insulina, combinándola con fármacos no insulínicos en una terapia personalizada.
Métodos alternativos de tratamiento de la diabetes tipo 2
Cirugía bariátrica: permite obtener efectos metabólicos buenos y duraderos en la diabetes tipo 2 con obesidad asociada. Considerarla en enfermos con IMC >40 kg/m2 o con >35 kg/m2 y enfermedades concomitantes (p. ej. hipertensión arterial, alteraciones del metabolismo lipídico), de 18-65 años. Es necesaria una derivación a centros especializados, donde se evaluará la aptitud para la cirugía bariátrica y se realizará el posterior control a largo plazo (por requerimientos nutricionales especiales después de la cirugía).
VIGILANCIA
1. Valoración del control del metabolismo de los hidratos de carbono
Tipos de mediciones de glucemia a lo largo de 24 h: determinación mediante glucómetro en muestras de sangre capilar completa:
1) determinación casual: generalmente en ayunas
2) perfil glucémico abreviado: por la mañana en ayunas y 60-120 min después de cada comida principal (4 mediciones a lo largo de 24 h)
3) perfil glucémico completo: por la mañana en ayunas, antes de cada comida principal, 60-120 min después de cada comida principal, antes de dormir y p. ej. a las 24:00, y entre las 2:00 y las 4:00 de la madrugada.
La frecuencia de autocontrol recomendado depende del tratamiento y de las necesidades individuales:
1) solo dieta y metformina → perfil glucémico abreviado 1 × mes, eventualmente de manera adicional determinaciones de la glucemia a diferentes horas durante el día 1 × semana
2) fármacos no insulínicos → perfil glucémico abreviado 1 × semana, todos los días 1 determinación de la glucemia a diferentes horas del día
3) insulina a dosis fijas o tratamiento combinado con sulfonilurea e insulina en diabetes tipo 2 → todos los días 1-2 determinaciones de la glucemia, perfil glucémico abreviado 1 × semana, perfil glucémico completo 1 × mes
4) inyecciones múltiples de insulina, insulinoterapia intensiva funcional (independientemente del tipo de diabetes) → determinaciones múltiples a lo largo de 24 h (perfil glucémico completo o mediciones múltiples a lo largo de 24 h en las horas determinadas y según las necesidades del enfermo, también antes y después de las comidas, a la hora de dormir, antes de un esfuerzo físico planificado, ante sospecha de hipoglucemia, y antes de las actividades durante las cuales la hipoglucemia resulta especialmente peligrosa, p. ej. al conducir).
Con independencia del esquema terapéutico, todos los enfermos deben intensificar el control glucémico si experimentan malestar o empeoramiento repentino del estado general.
La valoración más precisa de la glucosa de 24 h se da con el uso de sistemas de monitorización continua de glucosa en tiempo real (MCGtr; real time continuous glucose monitoring, rtCGM) o de monitorización continua de glucosa intermitente (MCGi; intermittently scanned continuous glucose monitoring, isCGM), también denominada monitorización flash (flash glucose monitoring, FGM), que permiten evaluar tales parámetros como el tiempo en el que la glucosa se mantiene en el rango previsto (tiempo en rango; time in range, TIR) y el tiempo en el que la glucemia se mantiene por encima y por debajo de los límites de este rango. Miden la glucosa en el líquido intersticial. Son especialmente útiles en los enfermos con diabetes tipo 1, también de curso lábil con episodios frecuentes de hipoglucemia (sobre todo si son inadvertidos), en aquellos que utilizan bombas de insulina y en embarazadas con diabetes, así como a la hora de introducir cambios en el tratamiento. No existen recomendaciones definitivas sobre el uso de este tipo de monitorización en la diabetes tipo 2. La importancia del uso prolongado de la MCG consiste en la posibilidad de evaluar las tendencias de la glucemia (reducción o aumento) y la velocidad de los cambios, así como en la posibilidad de programar alarmas que advierten al paciente cuando la glucemia se acerca a los valores límite establecidos. Esto permite de forma precoz tomar acciones preventivas ante una hipo- o hiperglucemia.
Para una correcta interpretación, debe tenerse en cuenta que los niveles de glucosa en el líquido intersticial tienen una demora en comparación con los niveles de glucosa sanguínea de unos 15-20 min. Es importante tener en cuenta la posibilidad de emplear conjuntamente la MCGtr y bombas de insulina, en especial aquellas bombas que permiten suspender la infusión de insulina en caso de hipoglucemia, lo que es especialmente útil en la prevención de hipoglucemias nocturnas. La valoración del control glucémico mediante FGM se basa en los mismos criterios que en caso del uso de MCGtr (→tabla 14.1-14). La medición de la glucemia mediante FGM también se realiza en el líquido intersticial, pero los datos no se transmiten en tiempo real al dispositivo, que en la mayoría de los casos es un teléfono. Tras el escaneo, se obtiene el valor actual de la glucemia con la tendencia actual (aumento o reducción) marcada (con flecha) y una curva que muestra los valores de glucemia anteriores. Los datos obtenidos, presentados en forma de diagramas, pueden analizarse posteriormente para modificar el tratamiento. La nueva versión de este sistema permite establecer los valores límite de glucemia. Si se sobrepasan, se generan notificaciones que permiten realizar la lectura y, en casos necesarios, tomar acciones pertinentes según el valor de la glucemia y la tendencia (p. ej. para evitar la hipoglucemia). Esto aumenta la seguridad de uso de estos dispositivos, asemejándolos a MCGtr.
HbA1c: ≥2 × año o con mayor frecuencia (óptimamente 2-4 × año) si no se consigue la HbA1c objetivo.
2. Diagnóstico y control de la hipertensión arterial y de la dislipidemia: medición de la presión arterial durante cada visita, recomendar al paciente mediciones de la presión arterial en casa; lipidograma 1 × año o con mayor frecuencia en caso de vigilancia del tratamiento de alteraciones lipídicas (se puede realizar el lipidograma en pacientes que no están en ayunas, excepto en la hipertrigliceridemia, que requiere un ayuno de 8-12 h desde la última comida).
3. Diagnóstico y tratamiento de las complicaciones tardías de la diabetes:
1) Nefropatía diabética → albuminuria 1 × año si el primer resultado es normal (en enfermos no tratados con IECA ni antagonistas del receptor de angiotensina); examen general de orina con sedimento 1 × año; concentración de creatinina en suero y cálculo de TFGe 1 × año. En enfermos con diabetes tipo 1 a los 5 años de evolución, en diabetes tipo 2 desde el diagnóstico: en caso de detectar niveles elevados de creatinina, se deben realizar controles personalizados junto con determinaciones plasmáticas de sodio, potasio, calcio y fósforo.
2) Retinopatía → control oftalmológico (exploración del fondo de ojo con dilatación pupilar) 1 × año: en enfermos con diabetes tipo 1 a los 5 años de la evolución, en diabetes tipo 2 el primer examen en el momento del diagnóstico. A continuación, en enfermos sin enfermedad ocular diabética, cada 1-2 años. En caso de retinopatía, el oftalmólogo determina la frecuencia necesaria de controles.
3) Síndrome del pie diabético: examinar los pies en cada visita.
4) Búsqueda de neuropatía periférica sensitivomotora, somática y autonómica; búsqueda de hipotensión ortostática; pérdida de la variabilidad fisiológica del ritmo cardíaco; disfunción eréctil.
4. Otras pruebas: el diagnóstico de diabetes constituye una indicación para realizar tamizaje de enfermedades del tiroides: determinación de TSH y anti-TPO en diabetes tipo 1 y LADA, y de TSH en diabetes tipo 2.
5. Organización adecuada de la atención dirigida a las complicaciones: debe adaptarse al sistema de salud local y sus recursos, y requiere una buena comunicación entre todas las partes, para que la información sobre el estado de salud del paciente esté fácilmente disponible para todos los médicos involucrados. En el momento del diagnóstico de la diabetes tipo 2 debe evaluarse el daño de los órganos diana, y deben establecerse las pautas de vigilancia compartida por el médico de atención primaria (de familia) o diabetólogo con los especialistas en cardiología, nefrología, oftalmología, hepatología, etc., lo que mejorará la adhesión a las recomendaciones terapéuticas y permitirá un tratamiento óptimo que abarque la protección de órganos.
SITUACIONES ESPECIALES
Enfermedad concomitante grave
1. Infecciones graves o traumatismos: aumentan las necesidades de insulina. Es un error frecuente y potencialmente grave suspender la insulinoterapia cuando aparecen trastornos digestivos que limitan o impiden la ingesta oral de alimentos. Esta decisión puede desencadenar una cetoacidosis diabética e incluso el coma. Considerar la hospitalización.
1) En la diabetes tipo 1: instruir a los enfermos para que en estas situaciones adapten la ingesta calórica al aumento o (menos frecuente) mantenimiento de la dosis de insulina. En las enfermedades del tracto digestivo con náuseas y vómitos administrar infusión iv. de glucosa que asegure un aporte de 1000-1200 kcal/d, idealmente en combinación con una infusión continua iv. de insulina.
2) En la diabetes tipo 2 tratada con fármacos no insulínicos o solamente con dieta: una infección grave constituye una indicación para la insulinoterapia temporal, idealmente intensiva o, si no se presentan problemas de nutrición, con mezclas de insulinas.
2. Síndrome coronario agudo: medir la glucemia en cada enfermo. En pacientes sin diagnóstico de diabetes y con glucemia >10,0 mmol/l (180 mg/dl) → administrar insulina iv. En los enfermos con diabetes conocida suspender todos los fármacos no insulínicos e iniciar la insulinoterapia iv. en caso de glucemia >7,8 mmol/l (140 mg/dl). Vigilar la glucemia y el potasio sérico.
1) En las primeras 24 h: administración iv. en infusión mediante bombas, que aseguran una velocidad precisa de entrega de insulina a la dosis establecida. El aporte mínimo de glucosa iv. debe ser 150 g/d; si se precisa mayor cantidad, administrar mediante infusiones separadas. Se recomienda mantener la glucemia en un rango de 7,0-10 mmol/l (140-180 mg/dl). La infusión de insulina puede prepararse de la siguiente manera: 100 uds. de insulina de acción corta en 100 ml de solución fisiológica. La velocidad de infusión inicial se calcula, dividiendo la glucemia (en mg/dl) por 100 (p. ej. en caso de glucemia 400 mg/dl → 4 uds./h, es decir, 4 ml/h). Horas siguientes →tabla 14.1-15. Una vez estabilizado el paciente e iniciada la alimentación oral, la transición recomendada a la insulina basal y a bolos prandiales es: 2 h antes de suspender la infusión iv. se inyectará (en forma de NPH o análogo prolongado) el 60 % de la dosis infundida en las últimas 24 h.
2) Tras las primeras 24 h hasta el final de hospitalización: individualizar el tratamiento para garantizar el control óptimo de la glucemia. Si el paciente puede alimentarse, se indican la insulina basal y los bolos prandiales. Al finalizar la hospitalización, si el requerimiento de insulina es ≤30 uds./d, se puede volver al tratamiento oral anterior, siempre que la HbA1c esté en objetivo. En los enfermos sin diagnóstico previo de diabetes, la estrategia debe adecuarse a cada caso. Si los días previos al alta el control glucémico es bueno, dentro de un plazo de 2-4 semanas se puede programar una PTGO →Diagnóstico. En caso contrario, si se presenta hiperglucemia, se debe evaluar el estado del paciente y, en caso de un cuadro clásico, se diagnostica diabetes tipo 2 y se mantiene transitoriamente la insulina. Si no hay contraindicaciones, añadir metformina. Derivar a un diabetólogo para eventualmente diferenciar el tipo de diabetes y aplicar un tratamiento óptimo.
3. ACV: en todos los enfermos con ACV determinar la glucemia: si es >10,0 mmol/l (180 mg/dl) → iniciar insulinoterapia iv. con una bomba de infusión y mantener la glucemia en el rango de 7,8-10 mmol/l (140-180 mg/dl). Evitar cifras <6,1 mmol/l (110 mg/dl) para disminuir el riesgo de hipoglucemia. En la fase aguda de la enfermedad evitar la glucosa iv. Utilizar la insulina en infusión iv. en la solución de NaCl al 0,9 % (y no en una solución con glucosa y potasio). Cuando el enfermo comienza a comer → empezar (~1 h antes de desconectar la bomba de infusión) la insulinoterapia VSc con insulina de acción corta o un análogo de acción rápida. En los casos sin diagnóstico de diabetes, después de la fase aguda y la estabilización del estado clínico, realizar exploraciones dirigidas hacia trastornos del metabolismo de los hidratos de carbono.
Manejo perioperatorio
1. Cirugía programada: en enfermos tratados con dieta y metformina, así como con otros fármacos orales, en los que la suspensión del tratamiento durante 1 día no producirá un aumento de glucemia >180 mg/dl (10 mmol/l), no es necesario asociar insulina en el período preoperatorio. Sin embargo, esto se refiere a pocos enfermos con diabetes bastante reciente y no excluye la necesidad de administrar insulina durante o después de la cirugía. Está indicado administrar insulinoterapia y suspender el tratamiento actual de la diabetes si se planifica cirugía mayor de riesgo elevado de inestabilidad hemodinámica o si la cirugía programada será de larga duración. Para compensar 1 g de glucosa exógena, normalmente se necesitan 0,2-0,3 uds. de insulina. Los enfermos con diabetes tipo 1 bien educados, con buenos resultados terapéuticos antes de la hospitalización, especialmente si utilizan bombas de insulina o MCG, después de la admisión hospitalaria deben tener la posibilidad de continuar por su propia cuenta este tratamiento, siempre que sea eficaz y factible, así como de participar en la toma de decisiones terapéuticas relativas a la diabetes (si su estado general lo permite).
Preparación para la cirugía:
1) si el control metabólico es insuficiente: glucemia >13,9 mmol/l (250 mg/dl), HbA1c >8,5 % o glucosuria con acetonuria concomitante → aplazar la cirugía (si es posible)
2) controlar la diabetes: mantener la glucemia en el período perioperatorio en rango seguro de 5,6-10 mmol/l (100-180 mg/dl)
3) poco antes de la cirugía (2 días) suspender los fármacos no insulínicos e iniciar insulinoterapia intensiva: dosis diaria de insulina ~0,3-0,7 uds./kg, de lo que un 50-60 % lo debe constituir la insulina de acción corta (administrada antes de las comidas principales en la proporción ~50-20-30 %) y un 40-50 % restante lo debe constituir la NPH (en 2 inyecciones: a las 7:00-8:00 el 40 % y a las 22:00-23:00 el 60 % de la dosis) o un análogo de insulina de acción prolongada (1 × d a la misma hora, habitualmente por la noche)
4) controlar (en la medida de lo posible) las complicaciones crónicas de la diabetes.
Idealmente, las preparaciones para la cirugía deben realizarse en unidades de medicina interna, con la excepción de los enfermos que reciben tratamiento eficaz con insulinoterapia intensiva (con glucemia posprandial <10 mmol/l [180 mg/dl]) sometidos a intervenciones ambulatorias. Las intervenciones menores que no precisan cambios en la alimentación (extracción dental no complicada, drenaje de un absceso) no requieren insulinoterapia temporal.
El día de la cirugía:
1) utilizar insulina en infusión continua iv. (solución de 1 ud. de insulina en 1 ml de NaCl al 0,9 %)
2) administrar glucosa en una infusión iv. que aporte ~1000 kcal/d (normalmente solución de glucosa al 10 % o al 5 %, de preferencia cuando es necesario mejorar la hidratación y/o ante una osmolalidad plasmática elevada); otra solución dependiendo del aporte de líquidos requerido, junto con KCl (10-20 mmol)
3) verificar la potasemia y, en caso de necesidad, corregir las deficiencias de potasio
4) durante la cirugía mantener la glucemia en un rango de 5,6-10,0 mmol/l (100-180 mg/dl) →tabla 14.1-16, evitar la hipoglucemia
5) verificar la glucemia durante y después de la intervención.
Después de la cirugía:
1) en el momento de iniciar la alimentación oral empezar de nuevo la insulinoterapia basal: bolos prandiales y, en su caso, corregir el déficit calórico con infusiones de glucosa
2) en pacientes tratados con fármacos no insulínicos antes de la cirugía, tras reinstaurar la alimentación oral se puede tratar la diabetes igual que anteriormente, si la diabetes era bien controlada y no hay contraindicaciones; óptimamente volver a este tratamiento antes del alta hospitalaria.
2. Cirugía de urgencia o emergencia:
1) corregir la glucemia en la medida de lo posible → utilizar insulina en infusión continua iv. y asegurar el aporte de ~1000 kcal/d con infusión iv. de glucosa
2) en caso de cetoacidosis (pH <7,3) →Cetoacidosis y coma cetoacidótico, acidosis láctica →Acidosis láctica y coma o síndrome hiperglucémico hiperosmolar →Síndrome hiperglucémico hiperosmolar → deben controlarse antes de la cirugía; si la cirugía es de emergencia (p. ej. por una hemorragia) → ir corrigiendo la acidosis durante la cirugía
3) si el enfermo ha tomado metformina el día de la intervención de emergencia → administrar iv. 300 mg (1 amp.) de acetilcisteína e hidratar adecuadamente para prevenir la insuficiencia renal aguda.
PREVENCIÓN
1. Diabetes tipo 1: no existen métodos eficaces. Para retrasar la progresión de la enfermedad: teplizumab, registrado por la FDA en 2022.
2. Diabetes tipo 2: resultan eficaces una dieta sana y una actividad física regular que permitan mantener el normopeso o reducir el sobrepeso. En personas con prediabetes (GAA o TGA) se recomienda reducir el peso (en ≥7 %) y mantenerlo con una dieta y actividad física adecuadas. La actividad (≥150 min/semana) debe ser de intensidad ajustada a las posibilidades del enfermo. Si la modificación del estilo de vida no permite reducir el peso de manera suficiente, considerar la farmacoterapia de la obesidad. Se prefieren los agonistas del receptor del GLP-1 con eficacia demostrada para disminuir el riesgo de diabetes tipo 2 (→fig. 14.1-4). En caso de considerar el tratamiento quirúrgico de la obesidad, se recomienda tratar antes con un agonista del receptor del GLP-1 o con un preparado que combina los agonistas de los receptores del GLP-1 y del GIP (registrado para el tratamiento de la diabetes tipo 2 en 2022). La reducción del peso conlleva una disminución del riesgo de diabetes tipo 2 o un retraso en su desarrollo. En personas con alto riesgo de diabetes tipo 2, especialmente con GAA y TGA coexistentes y/o IMC >35 kg/m2, y/o de <60 años, y en mujeres con antecedentes de diabetes gestacional, simultáneamente con la modificación del estilo de vida considerar el uso de metformina para prevenir la diabetes tipo 2. La Sociedad Chilena de Endocrinología y Diabetes (SOCHED) acordó aplicar las recomendaciones de la ADA, las cuales se aplican también en México.
3. Los métodos de diagnóstico precoz de la diabetes pueden permitir alcanzar oportunamente un adecuado control metabólico necesario para prevenir las complicaciones crónicas. Una vez desarrolladas estas, es preciso su adecuado manejo para evitar la progresión. Las personas con prediabetes tienen alto riesgo de desarrollar diabetes: realizar una PTGO de control 1 × año. En los pacientes tratados con metformina retirarla ≥1 semana antes de la PTGO y, dependiendo de los resultados de la prueba:
1) en el caso de diagnosticar diabetes → continuar el tratamiento con metformina a dosis similares o mayores, y continuar el tratamiento y la vigilancia según las normas de manejo de la diabetes
2) en el caso de mantenerse la prediabetes se puede continuar el tratamiento con metformina; repetir la PTGO de control 1 × año
3) en el caso de que se descarten los trastornos del metabolismo de los hidratos de carbono (PTGO normal) → retirar la metformina (no hay indicaciones de usarla); realizar la PTGO de control pasados 6-12 meses.
TABLAS Y FIGURAS
Clasificación etiológica de la diabetes mellitus según la OMS (1999, modificada en 2019)
|
1. Diabetes tipo 1: destrucción autoinmune de las células β pancreáticas, que normalmente lleva al déficit absoluto de insulina (una de sus formas clínicas es la LADA)
|
|
2. Diabetes tipo 2: pérdida progresiva de la capacidad de las células β pancreáticas para la secreción correcta de insulina, con la insulinorresistencia asociada
|
|
3. Formas híbridas de diabetes
|
|
4. Otros tipos específicos de diabetes:
A. Defectos genéticos de la función de las células β
1) Cromosoma 12, HNF-1α: mutaciones en el gen del factor nuclear de hepatocitos 1α (HNF1A MODY, anteriormente MODY 3)
2) Cromosoma 7, GCK: mutaciones en el gen de glucocinasa (GCK MODY, anteriormente MODY 2)
3) Cromosoma 20, HNF-4α (HNF4A MODY, anteriormente MODY 1)
4) Cromosoma 13, IPF1: mutaciones en el factor promotor de la insulina (anteriormente MODY 4)
5) Cromosoma 17, HNF-1β: mutaciones en el gen del factor nuclear de hepatocitos 1β (HNF1B MODY, anteriormente: MODY 5)
6) Cromosoma 2 (NEUROD1, anteriormente MODY 6)
7) ADN mitocondrial (ADNmt 3243 MIDD)
8) Mutaciones en los genes que codifican para algunas proteínas que participan en la regulación de la liberación de insulina (incluidas las mutaciones activadoras de los genes KCNJ11 y ABCC8, que codifican para las subunidades del canal de potasio), así como las mutaciones en el gen que codifica la insulina: pueden causar la diabetes neonatal permanente, que en algunos casos puede cursar con retraso psicomotor y epilepsia (síndrome DEND; developmental delay, epilepsy, neonatal diabetes)
9) Otros
|
|
B. Defectos genéticos de la acción de insulina
1) Insulinorresistencia tipo A (defecto genético del receptor de insulina)
2) Síndrome de Donohue (leprechaunismo)
3) Síndrome de Rabson-Mendenhall
4) Diabetes lipoatrófica
5) Otros
|
|
C. Enfermedades pancreáticas exocrinas
1) Pancreatitis
2) Traumatismo de páncreas, pancreatectomía
3) Neoplasia
4) Fibrosis quística
5) Hemocromatosis hereditaria
6) Pancreatopatía fibrocalculosa
7) Otras
|
|
D. Endocrinopatías
1) Acromegalia
2) Síndrome de Cushing
3) Glucagonoma
4) Feocromocitoma
5) Hipertiroidismo
6) Somatostatinoma
7) Aldosteronoma (síndrome de Conn)
8) Otras
|
|
E. Diabetes inducida por fármacos u otras sustancias químicas
1) Vacor (raticida)
2) Pentamidina
3) Ácido nicotínico
4) Glucocorticoides
5) Hormonas tiroideas
6) Diazóxido
7) Agonistas β
8) Diuréticos tiacídicos
9) Fenitoína
10) Interferón α
11) Otras sustancias
|
|
F. Infecciones
1) Rubéola congénita
2) Citomegalia
3) Otras
|
|
G. Formas raras de origen inmunitario
1) Síndrome de la persona rígida
2) Anticuerpos contra el receptor de insulina (insulinorresistencia tipo B)
3) Otras
|
|
H. Otros síndromes genéticos a veces asociados a la diabetes
1) Trisomía 21 (síndrome de Down)
2) Síndrome de Klinefelter
3) Síndrome de Turner
4) Síndrome de Wolfram
5) Ataxia de Friedreich
6) Enfermedad de Huntington
7) Síndrome de Laurence-Moon-Biedl
8) Distrofia miotónica
9) Porfiria
10) Síndrome de Prader-Willi
11) Otros
|
|
5. Diabetes no clasificada
|
|
6. Hiperglucemia detectada por primera vez durante el embarazo
1) Diabetes en el embarazo
2) Diabetes gestacional
|
Criterios diagnósticos de diabetes mellitus según la OMS
|
Prueba
|
Glucemia en ayunasa
|
Glucemia a las 2 h en PTGO
|
Glucemia casualb
|
HbA1cb,c
|
|
Se diagnostica la diabetes, si se cumple ≥1 de los criterios
|
≥7,0 mmol/l (126 mg/dl): 2 veces (en días distintos)
|
≥11,1 mmol/l (200 mg/dl)
|
≥11,1 mmol/l (200 mg/dl) con manifestaciones típicas de hiperglucemiad
|
≥6,5 % (48 mmol/mol)
|
|
a Si la glucemia (glucosa plasmática) en ayunas es de 5,6-6,9 mmol/l (100-125 mg/dl) → realizar PTGO.
b En cualquier momento del día, no tiene que ser en ayunas.
c HbA1c determinada en laboratorio con el método certificado por el NGSP.
d Polidipsia, poliuria, debilidad; en diabetes tipo 1 posible cetoacidosis diabética.
HbA1c — hemoglobina glicada, NGSP — National Glycohemoglobin Standardization Program, PTGO — prueba de tolerancia a la glucosa oral, con 75 mg de glucosa, determinando la glucemia en ayunas y a las 2 h
|
Diagnóstico diferencial y tratamiento de la diabetes autoinmune latente del adulto (tipo 1, anteriormente LADA) y de la diabetes tipo 2
|
Características diferenciales
|
Diabetes tipo 1 latente
|
Diabetes tipo 2
|
|
Índice de masa corporal (IMC)
|
Como en población general
|
Obesidad o sobrepeso
|
|
Hipertensión arterial
|
No
|
Sí
|
|
Diabetes en familia
|
No
|
Sí
|
|
Enfermedades autoinmunes en enfermo o en familia
|
Sí
|
No
|
|
Anti-GAD65 u otros anticuerpos antislotes
|
Sí
|
No
|
|
Péptido C (test con glucagón)
|
Niveles bajos
|
Niveles normales o inicialmente ↑
|
|
Tratamiento de elección
|
Insulina
|
Al inicio fármacos no insulínicos
|
Diagnóstico diferencial y tratamiento de la MODY y de la diabetes tipo 1
|
Características diferenciales
|
MODY
|
Diabetes tipo 1
|
|
Malformaciones congénitas (sobre todo renales y genitourinarias)
|
Sí/no
|
No
|
|
Antecedentes familiares de diabetes en ≥3 generaciones
|
Sí
|
No
|
|
Enfermedades autoinmunes en familia o en enfermo
|
No
|
Sí
|
|
Anticuerpos antislotes
|
No
|
Sí
|
|
Péptido C (test con glucagón)
|
Inicialmente normal
|
Concentración baja
|
|
Tratamiento de elección
|
Al inicio fármacos no insulínicos
|
Insulina
|
|
Inicio
|
Lento
|
Más frecuentemente agudo
|
Criterios de control del metabolismo de los hidratos de carbono: valores objetivo de la hemoglobina glicada (HbA1c) en el tratamiento de la diabetes y los respectivos valores de la glucemia en el autocontrol
|
Valores objetivo de HbA1c
|
Enfermos a los que aplican los criteriosa
|
|
Criterio general
|
|
|
HbA1c ≤7,0 % (53 mmol/mol)
(objetivo de glucemia: en ayunas y antes de las comidas <7,2 mmol/l [130 mg/dl], 1-2 h después de la comida <10 mmol/l [180 mg/dl]; promedio de concentración de glucosa en plasma ~8,3-8,9 mmol/l [150-160 mg/dl])
|
Todos los enfermos con diabetes para los cuales no se establecieron criterios específicos (→más adelante), incluidos los enfermos con diabetes tipo 2, enfermos con diabetes tipo 1 en los cuales la llegada al valor objetivo de HbA1c ≤6,5 % se asocia a un riesgo elevado de hipoglucemia, y los enfermos de >65 años con una supervivencia esperada de >10 años
|
|
Criterios específicos
|
|
|
HbA1c ≤6,5 % (48 mmol/mol)
(objetivo de glucemia, también en autocontrol: 4,4-6,1 mmol/l [80-110 mg/dl] en ayunas y antes de las comidas, y <7,8 mmol/l [140 mg/dl] a las 2 h después de iniciar la comida)
|
– Enfermos con diabetes tipo 1 en los cuales la llegada a este objetivo no se asocia a un riesgo elevado de hipoglucemia ni al empeoramiento de la calidad de vida
– En la diabetes tipo 2 de corta duración
– En niños y adolescentes (independientemente del tipo de diabetes)
|
|
HbA1c ≤8,0 % (64 mmol/mol)
(promedio de concentración de glucosa en plasma <10,2 mmol/l [183 mg/dl])
|
Enfermos de edad avanzada y/o con diabetes avanzada de muchos años de evolución con complicaciones macroangiopáticas (es decir, después de un infarto de miocardio y/o ACV) y/o con comorbilidades graves; se admite fijar objetivos de tratamiento menos estrictos en enfermos con diabetes tipo 2, si esto permite simplificar el modelo de tratamiento y mejorar la calidad de vida del paciente, sin aumentar de manera significativa el riesgo de complicaciones crónicas
|
|
a Criterios de control de la glucemia en embarazadas →Diabetes mellitus en embarazadas.
|
Criterios de control de la presión arterial: valores objetivo de presión arterial en enfermos con diabetes
|
Valor objetivo
|
Información detallada
|
|
Criterio general
|
|
|
PAS <130 mm Hg y PAD <80 mm Hg
|
– Objetivo terapéutico general en los enfermos con diabetes
– En todos los enfermos con diabetes evitar reducir la PAS <120 mm Hg y la PAD <70 mm Hg
– Los valores objetivo de la presión arterial no dependen de la presencia de proteinuria
|
|
Criterios específicos
|
|
|
>PAS 120-130 mm Hg y PAD <80 mm Hg
|
Óptimos en enfermos <65 años
|
|
PAS 130-140 mm Hg y PAD <80 mm Hg
|
– En enfermos ≥65 años
– En enfermos con enfermedad renal crónica (evitar la disminución de PAS <130 mm Hg)
|
|
PAS 110-139 mm Hg y PAD 81-85 mm Hg
|
En embarazadas con diabetes y sin complicaciones vasculares
|
|
PAS 110-130 mm Hg y PAD 70-80 mm Hg
|
En embarazadas con diabetes y complicaciones vasculares
|
|
PAD — presión arterial diastólica, PAS — presión arterial sistólica
|
Criterios de control del metabolismo de los lípidos: valores objetivo de los parámetros del metabolismo de los lípidos en enfermos con diabetes
|
Riesgo cardiovascular
|
Nivel plasmático objetivo
|
|
Colesterol LDL (objetivo primario)
|
|
|
Extremadamente altoa
|
<40 mg/dl (1,0 mmol/l)
|
|
Muy altob
|
<55 mg/dl (1,4 mmol/l) y disminución en ≥50 % en relación con el valor inicial
|
|
Altoc
|
<70 mg/dl (1,8 mmol/l) y disminución en ≥50 % en relación con el valor inicial
|
|
Moderadod
|
<100 mg/dl (2,6 mmol/l)
|
|
Colesterol no HDL (objetivo secundario)
|
|
|
Extremadamente altoa
|
<70 mg/dl (1,8 mmol/l)
|
|
Muy altob
|
<85 mg/dl (2,2 mmol/l)
|
|
Altoc
|
<100 mg/dl (2,6 mmol/l)
|
|
Colesterol HDL
|
|
|
Independientemente del riesgo
|
En hombres >40 mg/dl (1,0 mmol/l)
En mujeres >50 mg/dl (1,275 mmol/l)
|
|
Triglicéridos
|
|
|
Independientemente del riesgo
|
<150 mg/dl (<1,7 mmol/l)
|
|
a Estado tras un evento coronario agudo en un enfermo con diabetes y ≥1 factor de riesgo adicional: niveles elevados de Lp(a) >50 mg/dl, hsCRP >3 mg/l, enfermedad renal crónica (TFGe <60 ml/min/1,73 m2).
b Diabetes tipo 2 con daño orgánico (presencia de microalbuminuria, retinopatía, neuropatía y/o daño miocárdico del ventrículo izquierdo) o con ≥2 factores de riesgo cardiovascular mayores (edad ≥65 años, hipertensión arterial, dislipidemia, tabaquismo, obesidad) o diabetes tipo 1 de inicio precoz y >20 años de evolución.
c Diabetes sin daño orgánico (independientemente de su duración, excepto en adultos jóvenes [<35 años] con diabetes tipo 1 de <10 años de evolución).
d Diabetes tipo 1 en personas <35 años sin complicaciones crónicas ni otros factores de riesgo cardiovascular, y diabetes tipo 2 en personas <50 años de <10 años de evolución.
HDL — lipoproteínas de alta densidad, hsCRP — proteína C-reactiva de alta sensibilidad, LDL — lipoproteínas de baja densidad, Lp(a) — lipoproteína (a), TFGe — tasa de la filtración glomerular estimada
|
Dosificación típica de los fármacos antihipertensivos orales
|
Fármaco
|
Dosificación
|
|
β-bloqueantes
|
|
Acebutolol
|
400 mg 1 × d o 200 mg 2 × d
|
|
Atenolola
|
25-100 mg 1 × d
|
|
Betaxolol
|
5-20 mg 1 × d
|
|
Bisoprolol
|
2,5-10 mg 1 × d (máx. 20 mg/d)
|
|
Celiprolol
|
100-400 mg 1 × d
|
|
Carvedilol
|
6,25-25 mg 1-2 × d
|
|
Metoprolol preparados de liberación estándar
|
25-100 mg 2 × d
|
|
Preparados de liberación prolongada
|
50-100 mg 1 × d (hasta 200 mg 1 × d)
|
|
Nebivolol
|
5 mg 1 × d
|
|
Propranolol
|
40-80 mg 2-4 × d
|
|
Calcioantagonistas
|
|
Amlodipino
|
2,5-10 mg 1 × d
|
|
Diltiazem preparados de liberación estándar
|
30-60 mg 3 × d
|
|
Preparados de liberación prolongada
|
90-480 mg 1 × d o 90-240 mg 2 × d
|
|
Felodipino
|
5-10 mg 1 ×d
|
|
Lacidipino
|
4-6 mg 1 × d
|
|
Lercanidipino
|
10-20 mg 1 × d
|
|
Nitrendipino
|
10-20 mg 1 × d (máx. 20 mg 2 × d)
|
|
Verapamilo preparados de liberación estándar
|
40-120 mg 3-4 × d
|
|
Preparados de liberación prolongada
|
120-240 mg 1-2 × d
|
|
Diuréticos
|
|
Amilorida preparados combinados con hidroclorotiazida
|
2,5-5 mg 1-2 × d
|
|
Clortalidona
|
12,5-50 mg 1 × d o 50 mg cada 2 días
|
|
Hidroclorotiazida
|
12,5-50 mg 1 × d
|
|
Indapamida preparados de liberación estándar
|
2,5 mg 1 × d
|
|
Preparados de liberación prolongada
|
1,5 mg 1 × d
|
|
Clopamida
|
5-20 mg 1 × d
|
|
Espironolactona
|
25-50 mg 1-2 × d
|
|
Furosemida
|
20-40 mg 1 × d
|
|
Torasemida
|
2,5-10 mg 1 × d
|
|
IECA
|
|
Benazepril
|
5-20 mg 1-2 × d
|
|
Quinapril
|
5-40 mg 1-2 × d
|
|
Cilazapril
|
2,5-5 mg 1 × d
|
|
Enalapril
|
2,5-20 mg 1-2 × d
|
|
Imidapril
|
5-20 mg 1 × d
|
|
Captopril
|
25-50 mg 2-3 × d
|
|
Lisinopril
|
10-40 mg 1 × d
|
|
Perindopril
|
4(5)-8(10) mg 1 × d
|
|
Ramipril
|
2,5-5 mg 1 × d (máx. 10 mg)
|
|
Trandolapril
|
2-4 mg 1 × d
|
|
Zofenopril
|
30 mg 1 × d (máx. 60 mg 1 × d o en 2 dosis divididas)
|
|
Antagonistas de los receptores de la angiotensina II
|
|
Irbesartána
|
150-300 mg 1 × d
|
|
Candesartán
|
8-32 mg 1 × d
|
|
Losartán
|
25-100 mg 1 × d o en 2 dosis divididas
|
|
Olmesartán
|
20-40 mg 1 × d
|
|
Telmisartán
|
20-80 mg 1 × d
|
|
Valsartán
|
80-320 mg 1 × d
|
|
Preparados compuestos
|
|
IECA + calcioantagonista
|
|
|
Enalapril + lercanidipino
|
[10+10 mg] [20+10 mg] [20+20 mg] 1 × d
|
|
Lisinopril + amlodipino
|
[10+5 mg] [20+5 mg] [20+10 mg] 1 × d
|
|
Perindopril + amlodipino
|
[3,5+2,5 mg] [4+5 mg] [4+10 mg] [5+5 mg] [5+10 mg] [7+5 mg] [8+5 mg] [8+10 mg] [10+5 mg] [10+10 mg] 1 × d
|
|
Ramipril + amlodipino
|
[5+5 mg] [10+5 mg] [5+10 mg] [10+10 mg] 1 × d
|
|
Ramipril + felodipino
|
[2,5+2,5 mg] 1-2 compr. 1 × d
[5+5 mg] 1 × d
|
|
Antagonista de los receptores de la angiotensina II + calcioantagonista
|
|
|
Candesartán + amlodipino
|
[8+5 mg] [8+10 mg] [16+5 mg] [16+10 mg] 1 × d
|
|
Losartán + amlodipino
|
[50+5 mg] [100+5 mg]
[50+10 mg] [100+10 mg] 1 × d
|
|
Olmesartán + amlodipino
|
[20+5 mg] [40+5 mg] [40+10 mg] 1 × d
|
|
Telmisartán + amlodipino
|
[40+5 mg] [40+10 mg] [80+5 mg] [80+10 mg] 1 × d
|
|
Valsartán + amlodipino
|
[80+5 mg] [160+5 mg] [160+10 mg] 1 × d
|
|
IECA + diurético tiacídico/tipo tiacida
|
|
|
Cilazapril + hidroclorotiazida
|
[5+12,5 mg] 1 × d
|
|
|
Lisinopril + hidroclorotiazida
|
[10+12,5 mg] 1-2 compr. 1 × d
[20+12,5 mg] [20+25 mg] 1 × d
|
|
|
Perindopril + indapamida
|
[2+0,625 mg] [2,5+0,625 mg] [4+1,25 mg] [5+1,25 mg] [8+2,5 mg] [10+2,5 mg] 1 × d
|
|
|
Ramipril + hidroclorotiazida
|
[2,5+12,5 mg] 1-2 compr. 1 × d
[5+25 mg] 1 × d
|
|
|
|
|
Zofenopril + hidroclorotiazida
|
[30+12,5 mg] 1 × d
|
|
Antagonista de los receptores de la angiotensina II + diurético tiacídico
|
|
|
Candesartán + hidroclorotiazida
|
[8+12,5 mg] [16+12,5 mg] [32+12,5 mg] [32+25 mg] 1 × d
|
|
Losartán + hidroclorotiazida
|
[50+12,5 mg] 1-2 compr. 1 × d
[100+12,5 mg] [100+25 mg] 1 × d
|
|
Olmesartán + hidroclorotiazida
|
[20+12,5 mg] 1 × d
|
|
Telmisartán + hidroclorotiazida
|
[40+12,5 mg] [80+12,5 mg] [80+25 mg] 1 × d
|
|
Valsartán + hidroclorotiazida
|
[80+12,5 mg] [160+12,5 mg] [160+25 mg] [320+12,5 mg] [320+25 mg]1 × d
|
|
Antagonista de los receptores de la angiotensina II + diurético tipo tiacida
|
|
|
Telmisartán + indapamida
|
[80+2,5 mg] 1 × d
|
|
Diurético tipo tiacida + calcioantagonista
|
|
|
Indapamida + amlodipino
|
[1,5+5 mg] [1,5+10 mg] 1 × d
|
|
β-bloqueante + IECA
|
|
|
Bisoprolol + perindopril
|
[5+5 mg] [5+10 mg] [10+5 mg] [10+10 mg] 1 × d
|
|
Bisoprolol + ramipril
|
[2,5+5 mg] [5+5 mg] [5+10 mg] [10+10 mg]1 × d
|
|
β-bloqueante + diurético tiacídico
|
|
|
Nebivolol + hidroclorotiazida
|
[5+12,5 mg] [5+25 mg] 1 × d
|
|
β-bloqueante + calcioantagonista
|
|
|
Bisoprolol + amlodipino
|
[5+5 mg] [10+5 mg] [5+10 mg] [10+10 mg] 1 × d
|
|
β-bloqueante + ácido acetilsalicílico
|
|
|
Bisoprolol + ácido acetilsalicílico
|
[5+75 mg] [10+75 mg] 1 × d
|
|
Calcioantagonista + estatina
|
|
|
Amlodipino + atorvastatina
|
[5+10 mg] [5+20 mg] [10+10 mg] [10+20 mg] 1 × d
|
|
Amlodipino + rosuvastatina
|
[5+10 mg] [5+20 mg] [10+10 mg] [10+20 mg] 1 × d
|
|
Antagonista de los receptores de la angiotensina II + estatina
|
|
|
Valsartán + rosuvastatina
|
[80+10 mg] [80+20 mg] [160+10 mg] [160+20 mg] 1 × d
|
|
IECA + calcioantagonista + estatina
|
|
|
Perindopril + amlodipino + atorvastatina
|
[5+5+10 mg] [5+5+20 mg] [10+5+20 mg] [10+10+20 mg] [10+10+40 mg] 1 × d
|
|
IECA + diurético tipo tiacida + estatina
|
|
|
Perindopril + indapamida + rosuvastatina
|
[4+1,25+10 mg] [4+1,25+20 mg] [8+2,5+10 mg] [8+2,5+20 mg] 1 × d
|
|
3 fármacos hipotensores
|
|
|
Perindopril + indapamida + amlodipino
|
[5+1,25+5 mg] [5+1,25+10 mg] [10+2,5+5 mg] [10+2,5+10 mg] 1 × d
|
|
Perindopril + amlodipino + indapamida
|
[4+5+1,25 mg] [4+10+1,25 mg] [8+5+2,5 mg] [8+10+2,5 mg] 1 × d
|
|
Ramipril + amlodipino + hidroclorotiazida
|
[5+5+12,5 mg] [10+5+25 mg] [10+10+25 mg] 1 × d
|
|
Olmesartán + amlodipino + hidroclorotiazida
|
[40+5+12,5 mg] [40+10+12,5 mg] [40+10+25 mg] 1 × d
|
|
Valsartán + amlodipino + hidroclorotiazida
|
[160+5+12,5 mg] [160+10+12,5 mg] [160+10+25 mg] 1 × d
|
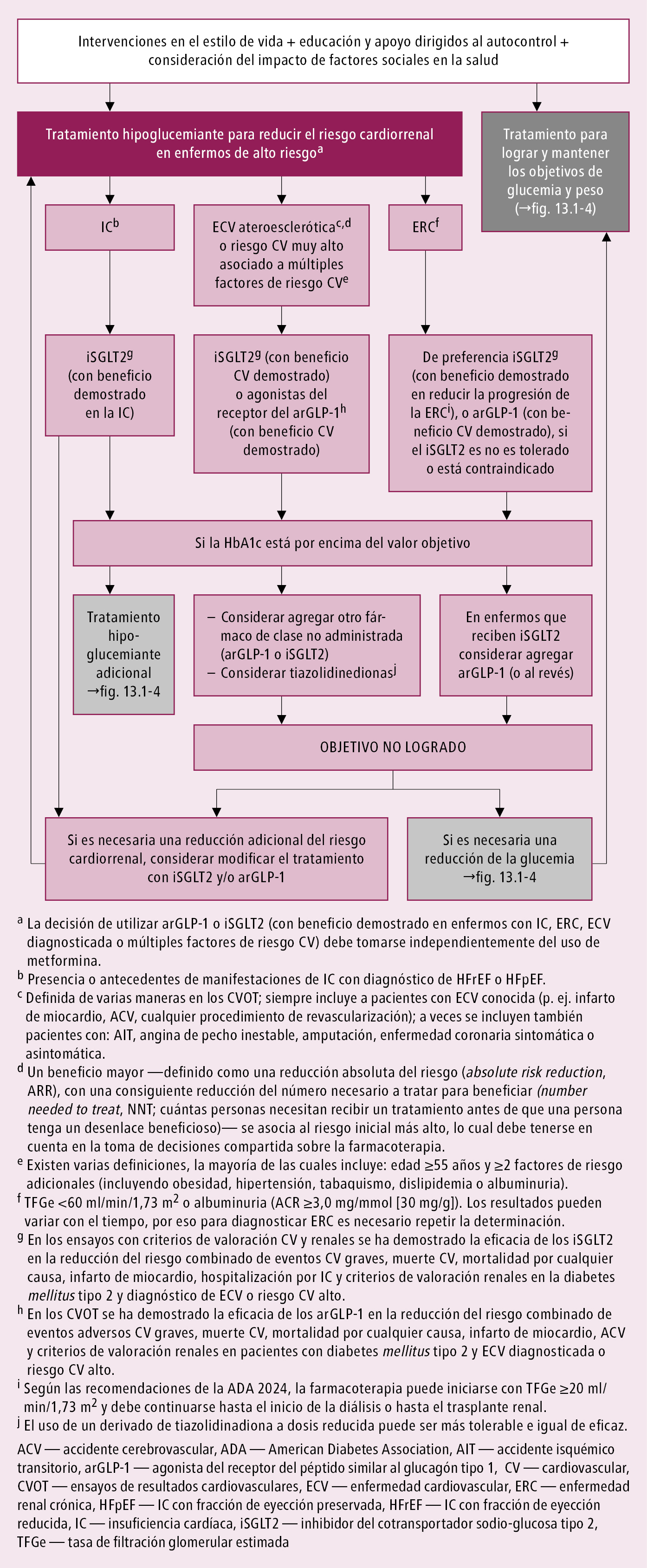
Fig. 14.1-1. Algoritmo de tratamiento hipoglucemiante dirigido hacia la reducción de riesgo cardiorrenal en el grupo de alto riesgo (a partir de la ADA 2024, modificado)
Insulinas humanas y sus análogos
|
Tipos de insulinas y preparadosa
|
Acción
|
|
inicial
|
máxima
|
rango
|
|
Análogos de insulina de acción rápidab
|
Aspart
Fast aspart
|
10-20 min
10 min
|
1-3 h
1-2 h
|
3-5 h
3-4 h
|
|
Glulisina
|
10-20 min
|
1-2 h
|
3-5 h
|
|
Lispro (200 uds./ml)c
|
15 min
|
40-60 min
|
3-5 h
|
|
Insulinas de acción corta
|
Neutral
|
30 min
|
1-3 h
|
6-8 h
|
|
Insulinas de acción intermedia
|
Isofánica (NPH)
|
0,5-1,5 h
|
4-12 h
|
18-20 h
|
|
Análogos de insulina de acción prolongada
|
Detemir
|
1,5-2 h
|
3(4)-14 h
|
≤24 h
|
|
Glargina (300 uds./ml)
|
1,5-2 h
|
Sin pico
|
24 h
|
|
Degludec (100 y 200 uds./ml)
|
|
Sin pico
|
48-72 h
|
|
a Todos los preparados en los que no se ha especificado la concentración están disponibles en concentración 100 uds./ml.
b En Argentina los 3 análogos de insulina de acción rápida están disponibles únicamente en presentación de lapiceros prellenados descartables.
c En Chile y México la insulina lispro está disponible únicamente en concentración 100 uds./ml; en México está disponible también un preparado de insulina lispro de absorción más rápida, que contiene citrato y treprostinil.
|
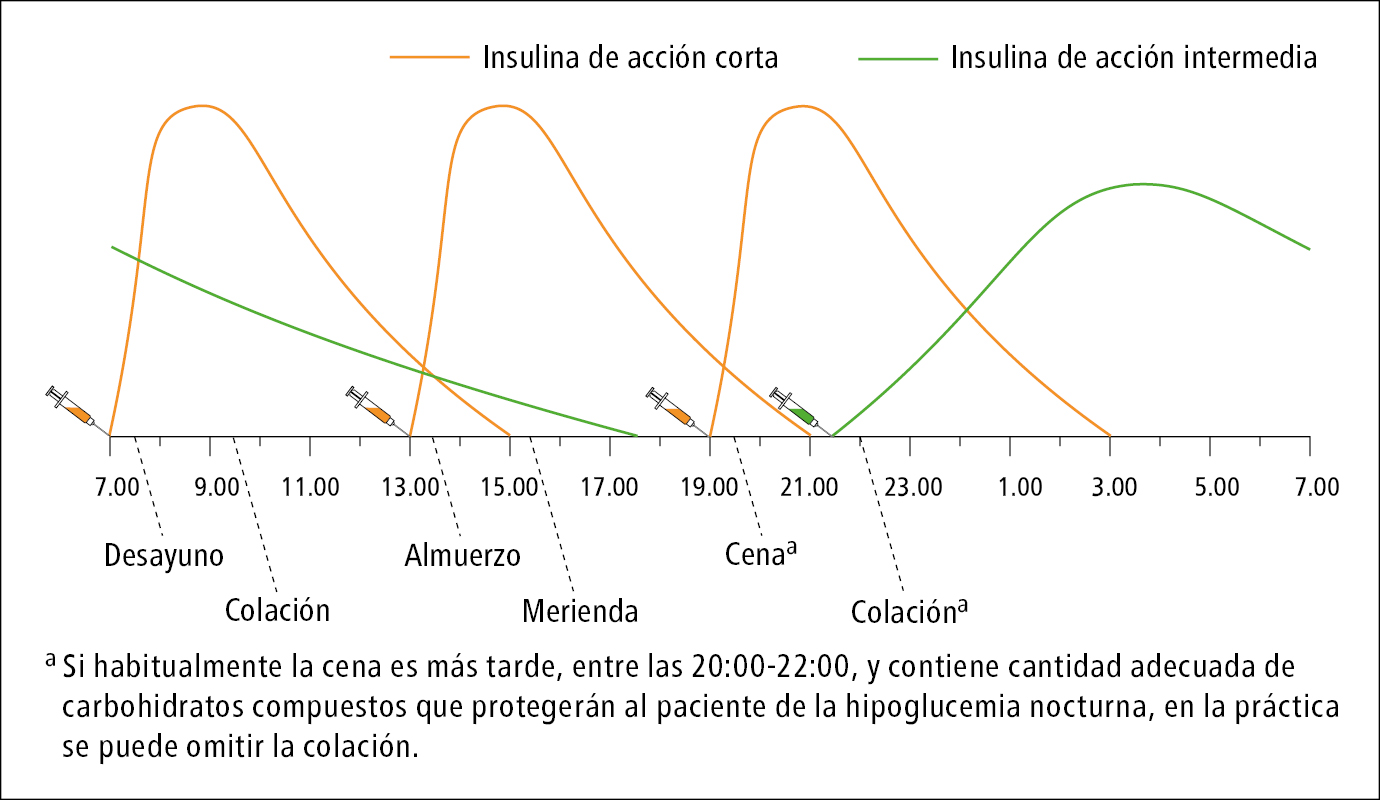
Fig. 14.1-2. Insulinoterapia intensiva en pauta de 4 inyecciones al día: insulina de acción corta en combinación con insulina de acción intermedia (NPH)
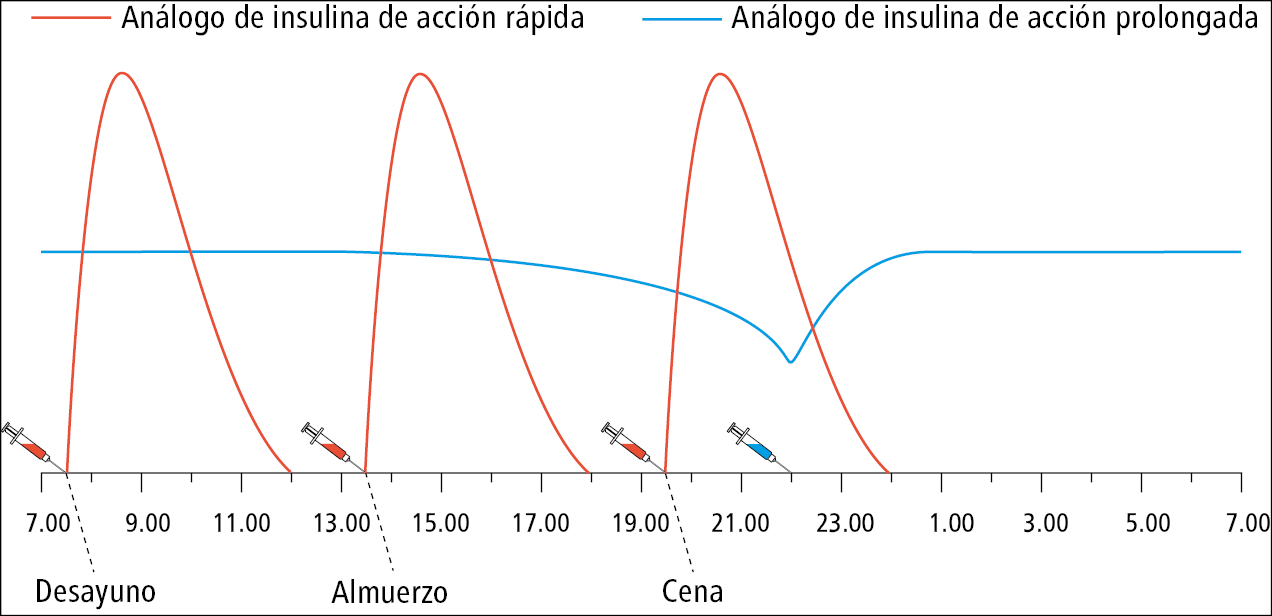
Fig. 14.1-3. Insulinoterapia intensiva en pauta de 4 inyecciones al día: análogo de insulina de acción rápida en combinación con análogo de acción prolongada
Fármacos antidiabéticos no insulínicos utilizados en la diabetes tipo 2
|
Fármacos
|
Dosificación
|
|
Biguanidas (VO)
|
|
Metformina
|
Dosis inicial 0,5 o 0,85 g/d 1 × d, o 0,5 g 2 × d (con la comida por la mañana y por la noche); se puede aumentar en 0,5 g/semana generalmente hasta una dosis de 2 × 1,0 g o 3 × 0,85 g, máx. 3 g/d; en caso de efectos adversos gastrointestinales recomendar tomar el fármaco durante la comida o disminuir la dosis a la anterior bien tolerada (posteriormente se puede volver a intentar aumentar la dosis)
En el caso de preparados de liberación extendida administrar inicialmente 0,5 g 1 × d con la comida por la noche; se puede aumentar la dosis en 0,5 g/semana, hasta un máx. 2 g 1 × d
Dosificación y vigilancia según la función renal:
TFGe: <30 ml/min/1,73 m2 → no utilizar metformina; 30-44 → no iniciar el tratamiento con metformina, pero se puede seguir usando el fármaco a una dosis reducida en el 50 %, vigilando la función renal cada 3 meses; 45-59 → se puede continuar el tratamiento con metformina, vigilando la función renal cada 3-6 meses; ≥60 → vigilar la función renal 1 × año
|
|
Ventajas: no produce aumento de peso ni hipoglucemia, disminuye la insulinorresistencia. Es considerada fármaco que siempre debe considerarse en el tratamiento de la diabetes tipo 2
Desventajas: intolerancia transitoria, habitualmente en las semanas 1-2 de uso; produce diarrea, náuseas, vómitos, distensión abdominal, sabor metálico; existe riesgo de acidosis láctica con el uso inadecuado; riesgo aumentado de déficit de vitamina B12
Contraindicaciones: hipoxemia (insuficiencia respiratoria, insuficiencia cardíaca), isquemia de grandes órganos (ACV, cardiopatía isquémica avanzada e infarto de miocardio, isquemia de extremidades inferiores), insuficiencia renal (dosificación y vigilancia →más arriba), daño hepático (en caso de una elevación moderada de las enzimas hepáticas, p. ej. en esteatosis hepática, se puede utilizar, pero con precaución), abuso de alcohol
|
|
Sulfonilureas (VO)
|
|
Gliclazida, comprimidos de liberación modificada o prolongada
|
80-320 mg/d, en 2 dosis divididas, 30 min antes de las comidas; comprimidos de liberación modificada o prolongada 30 mg 1 × d (durante el desayuno), aumentar la dosis progresivamente (en 30 mg cada 2 semanas), hasta un máx. 120 mg/d
|
|
Gliquidonaa,b,c
|
15-60 mg/d (durante el desayuno); en caso de administrar dosis mayores (generalmente hasta 120 mg/d), dividirlas en 2-3 tomas
|
|
Glimepirida
|
1 mg 1 × d (justo antes del desayuno) y aumentar progresivamente cada 1-2 semanas, generalmente 1-4 mg (máx. 6 mg) 1 × d
|
|
Glipizida
|
2,5-20 mg 1 × d (antes del desayuno); si se administran >15 mg/d dividir en 2 dosis (antes de las comidas principales); comprimidos de liberación modificada (GITS, gastrointestinal therapeutic system) de 5-20 mg/d 1 × d (durante el desayuno)
|
|
Reglas de dosificación: generalmente empezar por la menor dosis, aumentar progresivamente cada 1-2 semanas, en función de la glucemia. Dependiendo del preparado, se administra justo antes de la primera comida principal (preparados utilizados 1 × d) o 2 × d (antes de las comidas principales). Si se ha omitido una dosis, no aumentar la dosis siguiente
Ventajas: acción rápida; fácil dosificación de los preparados de liberación modificada
Desventajas: aumento de peso y riesgo de hipoglucemia (sobre todo en personas mayores, en caso de actividad física excesiva o como consecuencia de interacciones con el AAS, AINE, sulfonamidas, anticoagulantes y alcohol)
|
|
Inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2), las denominadas gliflozinas (VO)
|
|
Dapagliflozina en monoterapia
o en combinación con metformina
o con saxagliptina
|
10 mg 1 × d, independientemente de la comida
1 comprimido (5 mg + 0,85 g o 5 mg + 1,0 g) 2 × d, durante la comida
|
|
Empagliflozina en monoterapia
o en combinación con metformina
|
10 mg 1 × d (máx. 25 mg 1 × d), independientemente de la comida
1 comprimido (12,5 mg + 1 g) 2 × d durante la comida
|
|
Ertugliflozinaa en monoterapia
o en combinación con metformina
o con sitagliptina
|
5-15 mg 1 × d
|
|
Canagliflozina
|
100 mg 1 × d (máx. 300 mg 1 × d), independientemente de la comida
|
|
Ventajas: dosificación fácil, no producen hipoglucemia (utilizados en monoterapia) ni aumento de peso; los fármacos de este grupo (empagliflozina, canagliflozina y dapagliflozina) reducen el riesgo cardiovascular, incluido el riesgo de muerte por causas cardiovasculares (empagliflozina), reducen el riesgo de progresión de insuficiencia cardíaca y frenan la progresión de insuficiencia renal en el curso de diabetes (debido al efecto nefroprotector, están indicados también cuando su efecto antihiperglucémico es mínimo debido a la disminución de la TFGe)
Desventajas: infecciones fúngicas del tracto genitourinario, poliuria, hipotensión, deshidratación, riesgo aumentado de cetoacidosis euglucémica, riesgo aumentado de amputación en enfermos con ulceraciones por pie diabético. No administrar en personas que reciben diuréticos de asa ni en situaciones con riesgo de deshidratación ni cuando una disminución de la presión arterial es indeseable. ≥1 × año evaluar la función renal. Durante el tratamiento asegurar una hidratación adecuada y prevenir el pie diabético
|
|
Agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) (VSc [semaglutida: VSc o VO])
|
|
Exenatida de liberación prolongadaa
|
Se administra a dosis fija de 2 mg 1 × semana VSc en el muslo, abdomen o en la parte superior del brazo, independientemente de las comidas, en cualquier momento del día
|
|
Dulaglutida
|
VSc en el muslo o abdomen a dosis de 0,75 mg 1 × semana (en monoterapia) o 1,5 mg 1 × semana (asociado a otros antidiabéticos)
|
|
Lixisenatidaa
|
Dosis inicial 10 µg VSc 1 × d durante 14 días, a continuación 20 µg/d
|
|
Liraglutida
|
Dosis inicial 0,6 mg VSc 1 × d durante ≥1 semana, a continuación 1,2 mg/d; después de ≥1 semana se puede aumentar la dosis hasta 1,8 mg/d
|
|
Albiglutida
|
Dosis inicial 30 mg 1 × semana VSc, en caso de necesidad se puede aumentar hasta 50 mg/semana
|
|
Semaglutida VSc o VO
|
Preparado VSc: dosis inicial 0,25 mg 1 × semana, transcurridas 4 semanas aumentar hasta 0,5 mg 1 × semana, transcurridas otras ≥4 semanas se puede aumentar hasta 1 mg 1 × semana y, en caso de necesidad, después de otras ≥4 semanas hasta 2 mg 1 × semana
Preparado VO: dosis inicial 3 mg 1 × d, transcurrido un mes aumentar la dosis hasta 7 mg 1 × d, y después de ≥1 mes hasta la dosis máx. de 14 mg/d, en caso de necesidad
|
|
Tirzepatida (agonista de los receptores del GLP-1 y del GIP)a
|
VSc a dosis de 5-15 mg 1 × semana
|
|
Ventajas: favorecen la reducción de peso, no causan hipoglucemia; algunos preparados son de liberación prolongada, por lo que es posible su administración 1 × semana (exenatida de liberación prolongada, albiglutida, dulaglutida y semaglutida); reducen el riesgo cardiovascular y son de preferencia en la ECV ateroesclerótica (liraglutida, semaglutida, albiglutida, dulaglutida), enlentecen la progresión de nefropatía diabética y de complicaciones microangiopáticas, pero no se ha demostrado su eficacia en frenar la progresión de la insuficiencia cardíaca
Desventajas: síntomas gastrointestinales frecuentes, náuseas; muy raramente pancreatitis aguda (ante la sospecha, retirar el fármaco inmediatamente); manifestaciones asociadas a la vesícula biliar (semaglutida); contraindicados en insuficiencia renal grave, requiere vigilancia en pacientes con retinopatía diabética tratados con semaglutida; se ha observado empeoramiento de la retinopatía, posiblemente debido a la corrección rápida de la glucemia
|
|
Inhibidores de la dipeptidil-peptidasa 4 (DPP-4), las denominadas gliptinas (VO)
|
|
Alogliptinaa
|
25 mg 1 × d, independientemente de la comida, en combinación con metformina, tiazolidinadiona, sulfonilurea o insulina, o en terapia triple con metformina y tiazolidinadiona o insulina
|
|
Linagliptina
|
En monoterapia o en tratamiento combinado con metformina, con metformina y sulfonilurea o con insulina, a dosis de 5 mg 1 × d a la misma hora, con la comida o independientemente de las comidas; en tratamiento combinado mantener la dosis de metformina previamente administrada, considerar reducir la dosis de la sulfonilurea o de la insulina para disminuir el riesgo de hipoglucemia
|
|
Saxagliptina
|
En monoterapia o en tratamiento combinado con metformina y/o una sulfonilurea, con tiazolidinadiona o con insulina: 5 mg 1 × d
|
|
Sitagliptina
|
En monoterapia o en tratamiento combinado con metformina y/o una sulfonilurea, o con tiazolidinadiona (también con metformina), o con insulina (con o sin metformina) a dosis de 100 mg 1 × d VO (con las comidas o independientemente de ellas); en el tratamiento combinado mantener la dosis de metformina previamente administrada, considerar disminuir la dosis de la sulfonilurea o de la insulina para disminuir el riesgo de hipoglucemia
|
|
Vildagliptina
|
En monoterapia, si no puede utilizarse la metformina; tratamiento combinado con metformina, con una sulfonilurea y metformina, con una tiazolidinadiona o con insulina (con o sin metformina): 50 mg 2 × d VO (con las comidas o independientemente de ellas); en el tratamiento combinado con sulfonilureas: 50 mg 1 × d (por la mañana); máx. 100 mg/d 1 comprimido 2 × d
|
|
Ventajas: no producen aumento de peso ni hipoglucemia. En caso de vildagliptina está bien documentada la seguridad en personas mayores. La linagliptina es la única gliptina no excretada por la orina, por lo que no requiere suspensión ni cambio de dosificación en caso de insuficiencia renal
Desventajas: náuseas; cefalea y vértigos (con mayor frecuencia con vildagliptina); con menor frecuencia somnolencia excesiva, dolor en el epigastrio, estreñimiento (en tratamiento combinado con sulfonilureas) o diarrea (en tratamiento combinado con sitagliptina y metformina); posible aumento del riesgo de insuficiencia cardíaca (saxagliptina); aumento del riesgo de hipoglucemia (en caso de tratamiento combinado con sulfonilureas o con insulina → al inicio reducir dosis de estos fármacos); en la insuficiencia renal reducir la dosis o retirar el fármaco (excepto la linagliptina); muy raramente reacciones de hipersensibilidad (p. ej. urticaria, angioedema, penfigoide ampollar); pueden provocar intensas artralgias con necesidad de interrumpir el tratamiento
|
|
Tiazolidinadiona (glitazona) (VO)
|
|
Pioglitazonaa
|
Inicialmente 15 o 30 mg/d (máx. 45 mg/d), 1 × d
|
|
Ventajas: disminuye la insulinorresistencia; en monoterapia no produce hipoglucemia; disminuye la concentración de ácidos grasos libres en sangre
Desventajas: puede producir retención de agua y edemas, hay que tener precaución en enfermos con cualquier factor de riesgo de insuficiencia cardíaca congestiva, p. ej. antecedentes de infarto de miocardio o edad avanzada; no utilizar en enfermos con insuficiencia cardíaca ni en enfermos con insuficiencia renal; no usar en caso de cualquier manifestación de hepatopatía ni cuando la actividad de enzimas hepáticas está aumentada (ALT >2,5 × LSN); incrementa el riesgo de fracturas de los huesos largos en mujeres, así como el riesgo de presentación e intensificación del edema macular; se ha observado un leve incremento del riesgo de cáncer de vejiga
|
|
Inhibidor de la α-glucosidasa (VO)
|
|
Acarbosa
|
Inicialmente 1 × d durante 3 días (antes de la cena), posteriormente 50 mg 2 × d durante 3 días (antes del almuerzo y de la cena), a continuación 50 mg 3 × d durante 7 días, luego incrementar gradualmente para administrar la dosis de 100 mg 3 × d o la dosis máxima tolerada a partir de la semana 4-8
|
|
Ventajas: disminución de la glucemia posprandial y de la insulinemia; utilizada en monoterapia no produce hipoglucemia; de forma indirecta disminuye la síntesis de triglicéridos
Desventajas: manifestaciones gastrointestinales frecuentes: meteorismo, dolor abdominal, liberación excesiva de gases, sensación de plenitud, a veces diarrea (se intensifican en caso de falta de adhesión a la dieta). Si se produce hipoglucemia (por otros fármacos), el enfermo debe ingerir glucosa, cuya absorción no está alterada
|
|
a No disponible en Chile.
b No disponible en Colombia.
c No disponible en México.
|
Características principales de los antidiabéticos no insulínicos usados en el tratamiento de la diabetes tipo 2
|
|
Metformina
|
Sulfonilureas
|
Inhibidores del SGLT2 (gliflozinas)
|
Agonistas del receptor del GLP-1
|
Inhibidores de la DPP-4 (gliptinas)
|
Pioglitazona
|
Acarbosa
|
|
Mecanismo
|
Activación de la proteína cinasa dependiente de AMP
|
Cierre de los canales de potasio dependientes de ATP en la membrana celular de células β del páncreas
|
Inhibición fuerte y selectiva del cotransportador 2 de glucosa dependiente de los iones de sodio
|
Activación de receptores GLP-1
|
Inhibición de la actividad de la DPP-4 y aumento de la concentración del GLP-1 y GIP después de las comidas
|
Activación de receptores nucleares específicos PPAR-γ
|
Inhibición de la α-glucosidasa intestinal
|
|
Efecto
|
Disminución de la producción de glucosa en el hígado; mejoría de la sensibilidad periférica a la insulina
|
Aumento de la secreción de insulina
|
Inducción de glucosuria por inhibición de la reabsorción de glucosa en la orina primaria
|
Aumento de la secreción de insulina dependiente del grado de hiperglucemia, inhibición del apetito
|
Aumento de la concentración de insulina secretada en relación con el grado de hiperglucemia
|
Aumento de la sensibilidad de los tejidos a la insulina
|
Enlentecimiento de la digestión de los polisacáridos en el intestino, enlentecimiento de la absorción de los hidratos de carbono
|
|
Potencia hipoglucemiantea
|
Elevada
|
Elevada
|
Elevada
|
Elevada
|
Moderada
|
Elevada
|
Pequeña
|
|
Efecto sobre la insulina en plasma
|
↓
|
↑↑
|
↓
|
↑↑
|
↑
|
↓
|
0
|
|
Riesgo de hipoglucemia
|
0
|
↑
|
0
|
0
|
0
|
0
|
0
|
|
Efecto sobre el peso
|
↓ o 0b
|
↑
|
↓
|
↓↓
|
0
|
↑
|
0
|
|
Efecto sobre el riesgo cardiovascular
|
–
|
–
|
Favorablec
|
Favorablec
|
–
|
–
|
–
|
|
Efectos adversos
|
Alteraciones gastrointestinales, diarreas
|
Hipoglucemia, aumento de peso
|
Infecciones de los genitales externos, riesgo de deshidratación en adultos mayores; raramente cetoacidosis euglucémica
|
Alteraciones gastrointestinales (diarreas, vómitos)
|
Urticaria, angioedema (con poca frecuencia)
|
Retención de agua y edemas, aumento de peso, aumento del riesgo de fracturas de huesos largos
|
Alteraciones intestinales (diarreas, meteorismo)
|
|
Contraindicaciones
|
Coma diabético, insuficiencia de órganos (corazón, cerebro, hígado, riñones, respiratoria), acidosis, hipoxia, abuso de alcohol
|
Coma diabético, insuficiencia de órganos (corazón, hígado, riñones), embarazo
|
Insuficiencia renal terminal y diálisis, cetoacidosis
|
Neuropatía gastrointestinal, falta de reserva de células β
|
Insuficiencia hepática
|
Insuficiencia cardíaca, insuficiencia hepática, cáncer de vejiga o hematuria de diversa etiología
|
Enfermedades del tracto digestivo, embarazo
|
|
↑ — aumento, ↓ — disminución, 0 — sin efecto, AMP — monofosfato de adenosina, ATP — trifosfato de adenosina, DPP-4 — dipeptidil-peptidasa 4, GIP — polipéptido inhibidor gástrico, GLP-1 — péptido similar al glucagón tipo 1, HbA1c — hemoglobina glicada, PPAR‑γ — receptor activado por proliferadores de peroxisomas gamma, SGLT2 — cotransportador sodio-glucosa tipo 2
a El nivel de la reducción de HbA1c depende de la dosis del fármaco y del valor inicial de HbA1c.
b Sin efecto sobre el peso.
c Efecto comprobado en caso de algunos fármacos a partir de resultados de ensayos aleatorizados publicados.
A partir de las guías de la ADA y la EASD 2022, y las guías de la PTD 2023, modificado
|
Información útil a la hora de seleccionar fármacos antihiperglucémicos en enfermos con diabetes tipo 2 y enfermedad renal crónica (ERC), enfermedad cardiovascular (ECV) ateroesclerótica y/o insuficiencia cardíaca (a partir de las guías de la ADA y la KDIGO 2022, y la ADA 2024, modificado)a
|
|
Efecto sobre la progresión de la ERC
|
Efecto sobre la ECV ateroesclerótica
|
Efecto sobre la insuficiencia cardíaca
|
Eficacia del efecto hipoglucemiante
|
Riesgo de hipoglucemia
|
Efecto sobre el peso
|
|
Metformina
|
Neutro
|
Potenciales beneficios
|
Neutro
|
Alta
|
No
|
Neutro (posible una reducción leve)
|
|
iSGLT2 (gliflozinas)
|
Beneficios: canagliflozina, dapagliflozina, empagliflozina
|
Beneficios: canagliflozina, empagliflozina
|
Beneficios: canagliflozina, dapagliflozina, empagliflozina, ertugliflozina
|
Moderada a alta
|
No
|
Disminución (moderada)
|
|
Agonistas del receptor del GLP-1
|
Beneficios (vinculados a la mejora de albuminuria): dulaglutida, liraglutida, semaglutida (VSc)
|
Beneficios: dulaglutida, liraglutida, semaglutida (VSc)
Efecto neutro: exenatida, lixisenatida
|
Neutro
|
Alta a muy alta
|
No
|
Disminución (moderada a muy alta)
|
|
Agonista dual de los receptores del GLP-1 y del GIP
|
En fase de estudios
|
En fase de estudios
|
En fase de estudios
|
Muy alta
|
No
|
Disminución (muy alta)
|
|
iDPP-4 (gliptinas)
|
Neutro
|
Neutro
|
Neutro (potenciales riesgos: saxagliptina)
|
Moderada
|
No
|
Neutro
|
|
Insulina
|
Neutro
|
Neutro
|
Neutro
|
Alta a muy alta
|
Sí
|
Aumento
|
|
Sulfonilureas
|
Neutro
|
Neutro
|
Neutro
|
Alta
|
Sí
|
Aumento
|
|
Tiazolidinadionas (glitazonas)
|
Neutro
|
Potenciales beneficios (pioglitazona)
|
Riesgo elevado
|
Alta
|
No
|
Aumento
|
|
Inhibidores de la α-glucocinasa
|
Neutro
|
Neutro
|
Neutro
|
Moderada
|
No
|
Neutro
|
|
█ falta de datos, fármaco en fase de estudios
█ efecto neutro
█ potenciales beneficios o eficacia moderada en la disminución de la glucemia
█ beneficios (protección de los órganos, alta eficacia, riesgo de hipoglucemia bajo, disminución de peso)
█ potenciales riesgos
█ riesgo elevado de efectos adversos
a Beneficios demostrados en los ensayos clínicos por los datos relativos a los criterios de valoración principales y secundarios. El beneficio o el riesgo dependen del fármaco determinado.
GLP-1 — péptido similar al glucagón tipo 1, iDPP-4 — inhibidor de la dipeptidil-peptidasa 4, iSGLT2 — inhibidor del cotransportador sodio-glucosa tipo 2
|

Fig. 14.1-4. Algoritmo de tratamiento dirigido hacia lograr y mantener el objetivo de glucemia y de peso (a partir de la ADA 2024, modificado)
Reglas de uso de antidiabéticos orales y agonistas del receptor del GLP-1 en función del grado de la función renal (a partir de la ADA y la KDIGO 2022, y la PTD 2023, modificado)
|
Categorías (estadios) de la enfermedad renal crónica según la KDIGO
|
Estadios G1 y G2 (TFGe ≥60 ml/min/1,73 m2)
|
Estadio G3a (TFGe 45-59 ml/min/1,73 m2)
|
Estadio G3b (TFGe 30-44 ml/min/1,73 m2)
|
Estadio G4 (TFGe 15-29 ml/min/1,73 m2)
|
Estadio G5 (TFGe <15 ml/min/1,73 m2)
|
|
Metforminaa
|
|
Control más frecuente de la TFGe si la TFGe es 30-44; reducir la dosis hasta 1000 mg/d
|
|
|
Sulfonilureas
|
|
Aumento del riesgo de hipoglucemia, si la TFGe es <60; considerar reducir la dosis; el fármaco preferido es la gliclazida porque es metabolizada por el hígado
|
|
|
Pioglitazona
|
Evitar su uso en pacientes dializados
|
|
Inhibidores de la DPP-4 (gliptinas)
|
|
Linagliptina
|
|
|
Saxagliptina
|
|
Reducir la dosis a 2,5 mg/d; evitar su uso en pacientes dializados
|
|
Sitagliptina
|
|
Reducir la dosis a 50 mg/d
|
Reducir la dosis a 25 mg/d
|
|
Vildagliptina
|
|
Reducir la dosis a 50 mg/d si la TFGe es <50
|
|
Inhibidores del SGLT2 (gliflozinas)
|
|
Canagliflozina
|
Dosis inicial de 100 mg, aumentar gradualmente hasta 300 mg, si es necesario
|
Iniciar o continuar con 100 mg/d
|
Continuar con 100 mg/d; no iniciar el tratamiento; retirar el fármaco en pacientes dializados
|
|
Dapagliflozinab
|
No es necesario reducir la dosis si la TFGe es ≥25
|
|
|
Empagliflozinac
|
No es necesario reducir la dosis si la TFGe es ≥20
|
|
|
Agonistas del receptor del GLP-1
|
|
Dulaglutida (1 × semana VSc)
|
No es necesario reducir la dosis si la TFGe es ≥15
|
|
|
Exenatida (1 × semana VSc)
|
No es necesario reducir la dosis si la TFGe es ≥30
|
|
|
Liraglutida (1 × d VSc)
|
No es necesario reducir la dosis si la TFGe es ≥30
|
|
|
Lixisenatida (1 × d VSc)
|
No es necesario reducir la dosis si la TFGe es ≥30
|
|
|
Semaglutida (1 × semana VSc)
|
No es necesario reducir la dosis si la TFGe es ≥15
|
|
|
█ Rango de TFGe dentro del cual no es necesario ajustar la dosis del fármaco.
█ Se recomienda ajustar la dosis del fármaco según la TFGe.
█ No se recomienda utilizar el fármaco con la TFGe determinada; en caso de dudas, consultar la ficha técnica del producto para tomar decisiones terapéuticas de acuerdo con la misma.
a Las recomendaciones relativas al uso de metformina según el grado de disminución de la TFGe presentadas en la tabla son de carácter general y se refieren a la metformina (sustancia). Las distintas preparaciones de este fármaco, tanto de acción corta como de acción prolongada, pueden tener indicaciones de uso establecidas por los fabricantes en rangos ligeramente distintos a los presentados en la tabla. En caso de TFGe <30 ml/min/1,73 m2 y ante los beneficios esperados de la continuación del tratamiento con metformina, está indicado evaluar el aclaramiento de creatinina con la ecuación de Cockcroft y Gault (eClCr). En la ficha técnica de la metformina se recomienda ajustar las dosis del fármaco a la función renal estimada a partir del aclaramiento de creatinina. En pacientes con obesidad o sobrepeso, el eClCr será considerablemente más alto que la TFGe calculada con la fórmula MDRD o con la fórmula CKD-EPI recomendada por la PTD.
b El tratamiento con dapagliflozina por indicaciones cardiológicas puede iniciarse con TFGe ≥25 ml/min/1,73 m2.
c El tratamiento con empagliflozina en enfermos con insuficiencia cardíaca puede iniciarse con TFGe ≥20 ml/min/1,73 m2.
DPP-4 — dipeptidilpeptidasa 4, KDIGO — Kidney Disease: Improving Global Outcomes, SGLT2 — cotransportador sodio-glucosa tipo 2, TFGe — tasa de filtración glomerular estimada
|
Principios de la combinación de fármacos no insulínicos con insulina
|
Fármacos no insulínicos
|
Actuación en el momento de iniciar la insulinoterapia
|
|
Metformina
|
Continuar la administración
|
|
Inhibidores del SGLT2
|
Continuar la administración, asociar en presencia de enfermedades cardiovasculares, sobre todo de insuficiencia cardíaca, o de enfermedad renal crónica (precaución por riesgo aumentado de cetoacidosis euglucémica [que cursa sin hiperglucemia importante], sobre todo en caso de reducir marcadamente la dosis de insulina)
|
|
Agonistas del receptor del GLP-1
|
Continuar la administración
|
|
Inhibidores de la DPP-4
|
Continuar la administración
|
|
Sulfonilureas
|
Suspender la administración o reducir la dosis en un 50 % en el momento de iniciar la insulinoterapia; discontinuar en caso de introducir insulina prandial o un modelo con mezclas de insulina
|
|
Pioglitazona
|
Suspender la administración o reducir la dosis en el momento de iniciar la insulinoterapia
|
|
Acarbosa
|
Se puede continuar la administración
|
|
DPP-4 — dipeptidil-peptidasa 4, GLP-1 — péptido similar al glucagón tipo 1, SGLT2 — cotransportador sodio-glucosa tipo 2
|
Tipos de insulinas compuestas (bifásicas), llamadas mezclas de insulina o insulinas premezcladas
|
Tipos de insulinas que componen la mezcla
|
Contenido de insulina de acción rápida o corta
|
|
Insulina aspart con suspensión de aspart con protamina (mezcla de análogos)
|
30 %
|
|
50 %
|
|
Insulina aspart con insulina degludec (mezcla de 2 análogos)
|
30 %
|
|
Insulina lispro con suspensión de lispro con protamina (mezcla de análogos)
|
25 %
|
|
50 %
|
|
Insulina bifásica humana
|
20 %
|
|
25 %
|
|
30 %
|
|
40 %
|
|
50 %
|
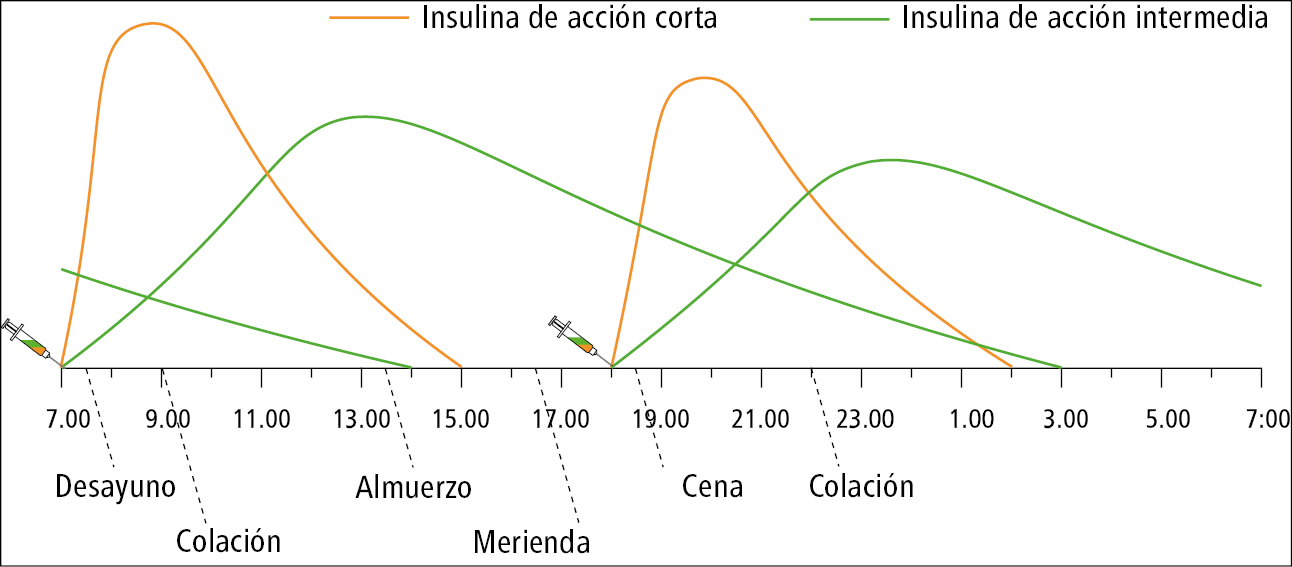
Fig. 14.1-5. Esquema de tratamiento con mezclas de insulinas humanas administradas 2 × d (insulina de acción corta con insulina de acción intermedia)

Fig. 14.1-6. Reglas generales de insulinoterapia en diabetes tipo 2, según las indicaciones
Valores objetivo de la glucemia monitorizada mediante sistemas automatizados MCG en enfermos con diabetes, y tiempo en rango recomendado
|
Categoría de enfermos con diabetes
|
Rango objetivo de la glucemia y tiempo en rango durante 24 h (TIR)
|
Valores de la glucemia por debajo del objetivo y tiempo debajo del rango durante 24 h (TBR)
|
Valores de la glucemia por encima del objetivo y tiempo por encima del rango durante 24 h (TAR)
|
|
Objetivo de glucemia
|
Tiempo/24 h
|
% del tiempo/24 h
|
Glucemia por debajo del objetivo
|
Tiempo/24 h
|
% del tiempo/24 h
|
Glucemia por encima del objetivo
|
Tiempo/24 h
|
% del tiempo/24 h
|
|
Diabetes tipo 1 y diabetes tipo 2
|
70-180 mg/dl (3,9-10 mmol/l)
|
>16 h y 48 min
|
>70 %
|
54-69 mg/dl (3,0-3,8 mmol/l)
|
<1 h
|
<4 %
|
181-250 mg/dl (10,1-13,9 mmol/l)
|
<6 h
|
<25 %
|
|
<54 mg/dl (3,0 mmol/l)
|
<15 min
|
<1 %
|
>250 mg/dl (13,9 mmol/l)
|
<1 h y 12 min
|
<5 %
|
|
Enfermos de edad avanzada o con alto riesgo de hipoglucemia
|
70-180 mg/dl (3,9-10 mmol/l)
|
>12 h
|
>50 %
|
63-69 mg/dl (3,5-3,8 mmol/l)
|
<15 min
|
<1 %
|
>250 mg/dl (13,9 mmol/l)
|
<2 h y 24 min
|
<10 %
|
|
Embarazadas con diabetes tipo 1
|
63-140 mg/dl (3,5-7,8 mmol/l)
|
>16 h y 48 min
|
>70 %
|
<63 mg/dl (3,5 mmol/l)
|
<1 h
|
<4 %
|
>140 mg/dl (7,8 mmol/l)
|
<6 h
|
<25 %
|
|
<54 mg/dl (3,0 mmol/l)
|
<15 min
|
<1 %
|
|
MCG — monitorización continua de glucosa, tanto en tiempo real (MCGtr) como intermitente (FGM)
A partir de: Battelino T. y cols., Diabetes Care, 2019, 42: 1593-1603
|
Velocidad sugerida de infusión de insulina según la glucemia en el síndrome coronario agudo
|
Glucemia
|
Insulina (uds./h) iv.
|
Solución de glucosa al 10 % (ml/h) iv.
|
|
250-300 mg/dl (13,9-17,4 mmol/l)
|
4,0-6,0
|
No administrar glucosa o suspender la infusióna
|
|
180-250 mg/dl (10-13,9 mmol/l)
|
2,0-4,0
|
No administrar glucosa o suspender la infusióna
|
|
140-180 mg/dl (6,7-10 mmol/l)
|
1,0-2,0
|
50
|
|
100-140 mg/dl (5,5-7,8 mmol/l)
|
0,5-1,0
|
50
|
|
<100 mg/dl (<5,5 mmol/l)
|
Interrumpir la infusión durante 15-30 min
|
50
|
|
a Iniciar o reiniciar la infusión de solución de glucosa al 10 % iv. a velocidad de 50 ml/h cuando la glucemia disminuya <180 mg/dl (10 mmol/l).
|
Principios sugeridos de infusión iv. de solución de glucosa al 10 % y al 5 %, y de insulina
|
Glucemia
|
Solución de glucosa al 10 % (flujo en ml/h)
|
Solución de glucosa al 5 % (flujo en ml/h)
|
Insulina en solución de NaCl al 0,9 % 1:1a (flujo en ml/h)
|
|
<90 mg/dl (5,0 mmol/l)
|
50
|
100
|
Interrumpir la infusión durante 15-30 min
|
|
90-120 mg/dl (5,0-6,7 mmol/l)
|
50
|
100
|
0,5-2
|
|
120-180 mg/dl (6,7-10 mmol/l)b
|
50
|
100
|
2-3
|
|
a Solución de 1 ud. de insulina en 1 ml de NaCl al 0,9 %.
b Si la glucemia es más alta, aumentar la velocidad de administración de insulina en 1-2 uds./h por cada 30-50 mg/dl por encima del valor de 180 mg/dl (10,0 mmol/l); en caso de una glucemia >250 mg/dl (13,9 mmol/l), interrumpir la infusión iv. de glucosa hasta reducirla <180 mg/dl (10 mmol/l).
A partir de las recomendaciones de la ADA (2024), los objetivos de glucemia en el período perioperatorio son 100-180 mg/dl (5,6-10 mmol/l)
|
 Español
Español
 English
English
 українська
українська










