Nota: el capítulo impreso refleja los conocimientos actuales a 5 de marzo de 2024. El texto se actualiza al día y puede consultarse en la versión electrónica del libro (Empendium).
ETIOPATOGENIAArriba
1. Agente etiológico: SARS-CoV-2 (coronavirus 2 del síndrome respiratorio agudo grave): virus ARN perteneciente a los betacoronavirus (el mismo subgénero que el SARS-CoV que causó la epidemia de 2002-2003).
El SARS-CoV-2 muta, lo que provoca la aparición de nuevas variantes del virus, incluidas las variantes de preocupación (variants of concern, VOC). La vigilancia genómica del virus es relevante para caracterizar y detectar nuevas variantes o recombinantes con mayor capacidad de evasión del sistema inmune.
PERSPECTIVA LATINOAMERICANA
Durante la mayoría de 2023 en América Latina predominó el linaje XBB.1.5 (de ómicron), pero para fin de 2023 e inicio de 2024 el linaje más frecuente fue JN.1 (de ómicron), con variaciones en algunos países.
2. Patogenia: para penetrar en la célula, el virus utiliza la enzima convertidora de la angiotensina 2 (ECA2), a la que se une por medio de la glucoproteína S que forma las espigas de la envoltura vírica (proteína S). También se han identificado otras proteínas superficiales que desempeñan un papel en la penetración del virus en la célula (proteasa de serina TMPRSS2 y TMPRSS4, furina, proteína GRP70, inductor de las metaloproteinasas de matriz extracelular [CD147]). El carácter complejo y sistémico de la infección se debe, entre otras cosas, a la gran distribución de receptores, a través de los que el virus penetra en la célula. En primer lugar, el virus ataca las células del epitelio de la mucosa nasal y faríngea. Después, se produce la replicación en la zona de penetración. La persona infectada ya es contagiosa, pero la respuesta inmunológica sigue siendo limitada y no se presentan manifestaciones clínicas. A continuación, el virus llega a las vías aéreas superiores, la respuesta inmunológica se manifiesta y aparecen los primeros signos clínicos (fiebre, tos). Si no se ha empezado a combatir la infección en esta fase, el proceso patológico empieza a afectar a los pulmones, donde el virus infecta los neumocitos, que —como respuesta a la infección— liberan una serie de citocinas. Probablemente, también es posible que el virus alcance directamente los pulmones al inhalar aire contaminado, saltándose la infección previa de las vías aéreas superiores. En la mayoría de las personas infectadas, el virus se replica de forma activa hasta el día ~10. La fase de disfunción inmunitaria, responsable p. ej. de las lesiones patológicas respiratorias y las complicaciones, tiene lugar entre los días 8 y 14, o más. La reacción del sistema inmune a la infección es la responsable de las lesiones patológicas en el aparato respiratorio. Uno de los principales mecanismos del desarrollo del síndrome de dificultad respiratoria aguda (SDRA) es la reacción inflamatoria, sistémica e incontrolada, que se produce al liberar por las células inmunitarias una gran cantidad de citocinas proinflamatorias y quimiocinas como respuesta a los antígenos del virus (lo que se conoce como tormenta de citocinas). El virus también puede infectar a otras células, como las células epiteliales de las vías respiratorias y los intestinos, el endotelio, los cardiomiocitos, las células epiteliales de las vías biliares, los macrófagos de alvéolos pulmonares, las células de Sertoli, las células de Leydig, los miocitos, las células sustentaculares del epitelio olfativo y las células gliales. Otras características específicas de la infección por SARS-CoV-2 son: daño grave del endotelio vascular, trombosis extensa, microangiopatía y angiogénesis. Los enfermos pueden desarrollar también miocarditis y complicaciones neurológicas. En pacientes con enfermedad grave y crítica también se desarrolla la linfopenia y anergia (agotamiento) de linfocitos T.
3. Reservorio y vías de transmisión: durante la epidemia actual, los humanos contagiados mantienen la cadena de transmisión del virus. Sin embargo, la transmisión del virus entre especies distintas es muy posible (p. ej. entre humanos y visones y viceversa, humanos y perros, felinos, simios). El virus se transmite por vía inhalatoria, principalmente por gotitas y también por vía aérea (especialmente durante procedimientos médicos asociados a la formación de aerosoles). Fuera de los centros médicos, la transmisión del virus por vía aérea puede producirse p. ej. en lugares cerrados mal ventilados con aglomeraciones. La evidencia que soporta la transmisión de la infección a través de objetos contaminados es limitada, pero se considera que es posible. Las secreciones respiratorias son el material infeccioso.
4. Factores de riesgo de la infección: contacto con una persona contagiada, atención médica directa de una persona infectada, la permanencia en una habitación cerrada (p. ej. aula de escuela, sala de reuniones, sala de espera del hospital) o en medios de transporte colectivo con una persona infectada. Cuanto más prolongado sea el contacto, más alto es el riesgo de infección. Factores de riesgo de curso grave de la infección: edad >65 años (sobre todo edad avanzada), sexo masculino, diabetes mellitus, enfermedades respiratorias y/o cardiovasculares crónicas, enfermedad renal crónica, obesidad (IMC ≥35 kg/m2), neoplasias malignas activas, inmunodeficiencias primarias y secundarias, tabaquismo, embarazo, inhalación de una mayor carga viral (mayor dosis infecciosa), ausencia de vacunación o esquemas incompletos contra la COVID-19. Los residentes en instituciones de cuidado y las personas con discapacidad, sobre todo intelectual, están especialmente expuestos a contraer COVID-19 y a tener un curso grave de la enfermedad. Riesgo en embarazadas →Situaciones especiales.
5. Período de incubación y transmisibilidad: el período de incubación de la cepa silvestre y de las VOC anteriores a ómicron se ha determinado en 2-14 días (un promedio de 5 días, >95 % de los casos se desarrolla hasta el día 11). El período de incubación de la variante ómicron es más corto y es de, en promedio, 3,5 días. Lo más probable es que la excreción viral ocurra justo antes de presentarse los signos clínicos y en los siguientes primeros días (transmisión probable hasta 3 días antes de la aparición de los signos, disminuye 7 días después de su aparición). No se ha determinado inequívocamente cuánto dura el período de transmisión, pero los enfermos con curso grave e inmunosupresión pueden tener una excreción prolongada del virus y ser capaces de contagiar durante más tiempo (los enfermos con inmunodeficiencia grave incluso durante varias semanas). También es posible contagiarse de una persona con infección asintomática. El material genético del SARS-CoV-2 en las vías respiratorias se detecta durante 20 días de media, aunque en algunos casos la excreción de ARN viral puede durar incluso >1 mes. Detectar ARN del SARS-CoV-2 no implica que la persona sea contagiosa. Sin embargo, la persona debe considerarse contagiosa si se detecta el antígeno del virus. Según la OMS, se puede considerar no contagioso a un paciente con COVID-19 si han pasado:
1) ≥10 días desde el inicio de la enfermedad y 3 días más sin manifestaciones clínicas de la enfermedad, tales como: fiebre (sin tomar antipiréticos) y manifestaciones respiratorias (tos, disnea; algunas personas pueden tener tos posinfecciosa que dura más que el período de transmisión)
2) 10 días desde un resultado positivo de una prueba de detección del SARS-CoV-2 en personas asintomáticas.
Estos criterios no se aplican a las personas con factores de riesgo de replicación viral prolongada (p. ej. durante un tratamiento inmunosupresor).
CUADRO CLÍNICO E HISTORIA NATURALArriba
Definición de las formas de COVID-19 en función de la duración de los síntomas (según el NICE):
1) COVID-19 aguda: los síntomas duran hasta 4 semanas desde el inicio de la enfermedad
2) COVID-19 prolongada: los síntomas duran 4–12 semanas
3) COVID-19 persistente: síntomas que se desarrollan durante o después de la COVID-19 y duran >12 semanas y no se deben a otra enfermedad (definición de la COVID-19 persistente según la OMS →más adelante).
En la actualidad también se utiliza el término "COVID-19 persistente" para describir los síntomas que persisten o se desarrollan después de la fase aguda de COVID-19. Incluye tanto la forma prolongada, como la persistente.
El espectro del posible cuadro clínico de la COVID-19 aguda es amplio, desde una infección asintomática hasta un SDRA y shock séptico →tabla 19.1-1 y →tabla 19.1-2.
Infección asintomática o presintomática: resultado positivo de la prueba para la presencia de la infección por SARS-CoV-2 (detección del antígeno o del material genético del virus), pero el paciente no notifica la presencia de síntomas. En algunas personas asintomáticas se observan indicios radiológicos de neumonía.
En la forma leve, pueden presentarse las siguientes manifestaciones: aumento o disminución de la temperatura corporal, tos, dolor de la faringe, rinitis catarral, malestar, cefalea, mialgia, diarrea, conjuntivitis, trastornos del olfato y del gusto (a veces los únicos síntomas de la infección), exantema. En personas mayores o inmunodeprimidas, los síntomas pueden ser atípicos. En personas mayores, la hipotermia, los delirios y las caídas pueden preceder a las manifestaciones respiratorias. Las manifestaciones de la infección por la variante ómicron más comunes son: fiebre, congestión nasal, rinitis, tos, estornudos, cefalea, cansancio y dolor de la faringe.
Las alteraciones cutáneas pueden localizarse en distintas zonas y presentar morfología diversa (exantema eritematoso, livedo reticular, urticaria, lesiones vesiculares y pustulosas, petequias). A veces pueden estar acompañadas de prurito y ser la única manifestación de la COVID-19. No son patognomónicas, pero algunas se han descrito con más frecuencia en enfermos con COVID-19 →fig. 19.1-1. También pueden presentarse manifestaciones del sistema nervioso central o periférico, cardiovasculares y de insuficiencia renal. Asimismo, puede producirse una miocarditis fulminante. El riesgo de complicaciones tromboembólicas es considerablemente elevado. Un 30-80 % de los enfermos refiere molestias indicativas de la COVID-19 persistente. Definición de caso de la COVID-19 persistente (COVID-19 crónico, COVID largo, COVID prolongado) según la OMS (ing. post-COVID condition, long-COVID): afección que presentan personas con infección por SARS-CoV-2 probable o confirmada (normalmente 3 meses desde el inicio de la enfermedad), que persiste durante ≥2 meses sin que pueda explicarse por otra causa. Los síntomas típicos incluyen: cansancio, disnea, trastornos de las funciones cognitivas y otras manifestaciones (dolor abdominal, trastornos de la menstruación, trastornos del olfato y/o del gusto, sensación de ansiedad, trastornos de la visión, dolor torácico, tos, depresión, mareos, fiebre, diarrea o estreñimiento, cefalea, trastornos de la memoria, artralgia, mialgia, neuralgia, alergia de nueva aparición, sensación de hormigueo/picor, malestar después del esfuerzo, falta de aliento, trastornos del sueño, taquicardia y palpitaciones, acúfenos y otros trastornos auditivos) que influyen en el funcionamiento diario. No hay un número mínimo de manifestaciones necesario para diagnosticar COVID-19 persistente. Las manifestaciones pueden reaparecer después de una recuperación inicial de la COVID-19 o persistir después de la enfermedad. Con el tiempo, pueden cambiar o reaparecer.
Otras complicaciones graves de la infección por SARS-CoV-2 son: trastornos neurológicos (incluyendo encefalopatía, neuropatías, encefalitis posinfecciosa, síndrome de Guillain-Barré, mioclonías generalizadas, síndrome de encefalopatía posterior reversible [PRES]), miositis, miocarditis y complicaciones de origen inflamatorio y autoinmune.
Una complicación rara y grave de la COVID-19, que inicialmente se observó en niños, pero que también puede afectar a los adultos (sobre todo los jóvenes), es el síndrome inflamatorio multisistémico (multisystem inflammatory syndrome in adults, MIS-A). En este síndrome, cuya causa se desconoce, se produce una activación y expansión de los macrófagos. La historia clínica se asemeja a la del síndrome inflamatorio multisistémico en niños (MIS-C): los síntomas aparecen entre varios días y 12 semanas desde la infección por SARS-CoV-2 (incluso de curso leve), siempre se presenta fiebre durante varios días y pueden producirse: dolor abdominal, vómitos, diarrea, exantema, conjuntivitis, enrojecimiento y sequedad de los labios, lengua de fresa, edema de manos y pies, debilidad significativa, linfadenopatía, cefalea y dolor de faringe. El cuadro clínico puede recordar al de la enfermedad de Kawasaki, con formación de aneurismas coronarios. Los adultos presentan niveles elevados de marcadores inflamatorios y disfunción multiorgánica (cardíaca incluida). Sin embargo, el proceso patológico no afecta al aparato respiratorio o las alteraciones son leves.
Definición de caso de MIS-A según los CDC →Diagnóstico.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Identificación del agente etiológico (→fig. 19.1-2):
1) Detección del material genético del virus por técnicas de amplificación de ácidos nucleicos (TAAN, RT-PCR [estándar de oro] isotérmicos [técnica LAMP]): detecta una serie de genes del SARS-CoV-2 (p. ej. N, E, S, RdRP, ORF1ab). Material: frotis nasofaríngeo (→Toma de frotis nasofaríngeo), aspirado nasofaríngeo, frotis de garganta y nariz (→Toma de frotis de garganta y nariz), aspirado traqueal o líquido del lavado broncoalveolar, esputo no inducido. En personas en las que no es posible extraer estos materiales, así como en las que se han sometido a repetidas pruebas de tamizaje, el ECDC permite el análisis de saliva. El tiempo de espera por el resultado debe ser ≤24 h. En los pacientes con manifestaciones de la infección y resultado negativo en la primera prueba, esta debe repetirse 24-48 h después en las siguientes situaciones:
a) existe una probabilidad alta de infección (estimada a partir del cuadro clínico, la imagen radiológica o la anamnesis epidemiológica)
b) los síntomas respiratorios han empeorado (la prueba debe realizarse 24-48 h después de la toma de la primera muestra)
c) existe la posibilidad de extraer material de las vías aéreas bajas (paciente que requiere intubación).
No debe realizarse RT-PCR de control para valorar la erradicación del virus.
2) Pruebas de antígenos (pruebas de diagnóstico inmunoquímicas semicuantitativas y cuantitativas [ELISA en versión clásica o modificada] y técnicas de quimioluminiscencia, pruebas inmunocromatográficas cuantitativas [pruebas en casete]): detectan el antígeno del SARS-CoV-2, por lo general el fragmento de la proteína superficial del virus. Se caracterizan por una menor sensibilidad que la RT-PCR, lo que implica cierto riesgo de falsos negativos. Sin embargo, un resultado positivo indica infección activa. Según el ECDC, el tiempo de espera para el resultado de una prueba rápida debería ser ≤40 min. La utilidad diagnóstica de los test de antígenos depende de las circunstancias en las que se realicen y de la fase de la infección (los resultados positivos se obtienen en la fase de mayor replicación viral, es decir, desde 1-3 días antes hasta 7 días después de la aparición de los síntomas →fig. 19.1-2). El momento óptimo para realizar un test rápido de antígenos es justo después de la aparición de los síntomas, ya que entonces la carga viral suele estar al nivel más alto. Según el ECDC, la prueba de antígenos se debe realizar en un plazo de 5 días desde la aparición de los síntomas o 7 días desde la exposición. Si no se sabe cuándo se produjo la exposición, la prueba debe realizarse lo antes posible. Un resultado negativo no descarta la infección. Si hay riesgo o sospecha de infección, se debe confirmar mediante una prueba genética. Algoritmo de diagnóstico de la infección por SARS-CoV-2 mediante pruebas de antígenos →fig. 19.1-3. Muchos expertos aceptan el uso de pruebas de antígenos rápidas en el diagnóstico de la infección por SARS-CoV-2 en pacientes sintomáticos hasta el día 7 de la aparición de los síntomas, y en personas asintomáticas con riesgo o sospecha de infección por SARS-CoV-2 debido al contacto con una persona con la infección por SARS-CoV-2 confirmada (sobre todo en los focos de infección). Un resultado positivo de la prueba de antígenos debe verificarse mediante una RT-PCR. Solo se deben emplear test de antígenos certificados con una sensibilidad diagnóstica ≥90 % y una especificidad ≥97 %.
PERSPECTIVA LATINOAMERICANA
Los países latinoamericanos han adoptado estrategias de diagnóstico del SARS-CoV-2, para superar obstáculos relacionados con limitaciones en la infraestructura de salud, acceso desigual a los recursos tecnológicos y variabilidad en las capacidades de los laboratorios. Se utilizan pruebas genómicas (RT-PCR), con alta especificidad y sensibilidad, pero en gran medida muchos países han implementado el uso de pruebas rápidas de antígeno (que ofrecen la ventaja de producir resultados en un tiempo considerablemente menor, aunque con una sensibilidad menor en comparación con la RT-PCR). Para las variantes circulantes en 2024 tanto la RT-PCR como las pruebas basadas en antígeno siguen ofreciendo alta capacidad diagnóstica, más allá de las mutaciones y variantes del SARS-CoV-2. Cada país ha desarrollado guías de diagnóstico.
3) Pruebas serológicas para la detección de antígenos: determinación de anticuerpos específicos IgG e IgM mediante el método ELISA (o su modificación) o técnicas de quimioluminiscencia mediante un test validado. Estas pruebas deben considerarse complementarias, y no alternativas a las pruebas de detección del virus (moleculares y de antígenos); constituye una excepción el diagnóstico de MIS-A. Indicaciones para la prueba serológica:
a) estudios epidemiológicos poblacionales
b) evaluación de la respuesta a la vacuna en las personas con inmunodeficiencias o en tratamiento inmunosupresor (anticuerpos de clase IgG específicos contra la proteína S del SARS-CoV-2).
Un resultado positivo puede indicar contacto con el coronavirus o la vacunación previa, por lo que no se debe utilizar como base para el diagnóstico o la determinación de la fase de la infección por SARS-CoV-2. Si la prueba molecular y la determinación del antígeno han resultado negativos en una persona con síntomas de COVID-19, la seroconversión (aparición de anticuerpos IgG ± IgM) o el aumento del recuento de anticuerpos IgG en pruebas realizadas con un intervalo de ≥2 semanas puede servir para confirmar la infección por SARS-CoV-2 de forma retrospectiva (especialmente en las personas con síntomas persistentes durante >8-14 días, para tomar decisiones terapéuticas p. ej. en caso de neumonía intersticial). La determinación de anticuerpos anti-SARS-CoV-2 de clase IgG e IgM es uno de los principales métodos de diagnóstico del MIS-C y el MIS-A. No deben usarse test rápidos de casete, ya que no se han validado adecuadamente. Para diferenciar la respuesta a la vacuna de la enfermedad, se utilizan test que diferencian los anticuerpos IgG contra la proteína S y los anticuerpos contra la proteína N →tabla 19.1-3.
4) Determinación de linfocitos T específicos: pruebas IGRA, pruebas T-SPOT. No se recomiendan, pero se pueden usar en personas con trastornos de la respuesta humoral (confirman el contacto del sistema inmune con el antígeno), entre otros para evaluar la respuesta a la vacuna.
PERSPECTIVA LATINOAMERICANA
En algunos países de América Latina el acceso a los test de anticuerpos contra la proteína N es limitado. Se utiliza solo con fines de estudios epidemiológicos.
2. Otras:
1) Pruebas de laboratorio: el hemograma suele revelar leucopenia con linfopenia, pero también puede describirse leucocitosis. En los casos de curso grave, se observan concentraciones elevadas de proteína C-reactiva y procalcitonina (al contrario que otras infecciones víricas frecuentes, lo que dificulta diferenciarla de una infección bacteriana), dímero D, IL-6, ferritina y troponinas cardíacas (cTn), así como una actividad elevada de LDH, aminotransferasas y creatina-cinasa (CK). En los pacientes con neumonía que requieren oxigenoterapia y están en riesgo de progresar a insuficiencia respiratoria de curso grave, se debe determinar la concentración de receptor soluble del activador del plasminógeno de tipo urocinasa (suPAR) para decidir si son aptos para el tratamiento con anakinra. Indicios de laboratorio de COVID-19 grave: dímero D >1000 ng/ml, proteína C-reactiva >100 mg/l, LDH >245 UI/l, cTn >2 × LSN, CK >2 × LSN, ferritina >500 μg/l, linfopenia <800/μl.
2) Pruebas de imagen. En la radiografía de tórax y la TC de tórax (mayor sensibilidad), lesiones por lo general bilaterales, periféricas y con más frecuencia en los lóbulos inferiores: opacidades bilaterales en vidrio deslustrado de distribución periférica, consolidaciones de distribución periférica, lesiones multifocales en varios lóbulos, opacidades lineales, patrón en empedrado, signo de halo invertido; con menos frecuencia lesiones nodulares intralobulillares (patrón en árbol en brote), lesiones de distribución centrolobulillar, lesiones de distribución dominante a lo largo de los haces broncovasculares, formación de cavidades, inflamación de ganglios linfáticos y derrame pleural. La ecografía pulmonar permite detectar lesiones en el parénquima pulmonar y evaluar su dinámica: engrosamiento de líneas septales, afectación parcial de los espacios aéreos, relleno absoluto de los espacios aéreos pulmonares subpleurales y derrame pleural. Ecocardiografía: permite evaluar los trastornos de la contractilidad miocárdica en los enfermos con miocarditis secundaria a COVID-19. Está indicada en aquellos enfermos con sospecha de miocarditis y/o concentración elevada de troponinas cardíacas.
3) Mediciones de la saturación de oxígeno de la hemoglobina en sangre arterial mediante oxímetro de pulso (SpO2) y evaluación en la escala qSOFA (→tabla 19.9-3) para evaluar la gravedad del enfermo, escala SIC (puntaje de coagulopatía inducida por sepsis).
Criterios diagnósticos
Definición de caso para la vigilancia epidemiológica según la OMS →tabla 19.1-4.
Esquema diagnóstico →fig. 19.1-3.
Definición de caso de MIS-A según los CDC: persona ≥21 años (en las más jóvenes se deben usar los criterios de diagnóstico de MIS-C) hospitalizada durante ≥24 h o con una enfermedad mortal, que cumple los siguientes criterios diagnósticos y de laboratorio, en la que se han descartado otras causas que expliquen los síntomas.
Criterios clínicos: fiebre ≥38 ºC o sensación de fiebre durante ≥24 h antes de la hospitalización o durante los 3 primeros días de hospitalización, en una persona que cumple ≥3 criterios clínicos (incluido ≥1 primario) antes del ingreso o en los 3 primeros días de hospitalización:
1) criterios clínicos primarios:
a) enfermedad cardíaca de curso grave: miocarditis, pericarditis, dilatación/aneurisma de arterias coronarias, disfunción ventricular derecha o izquierda de nueva aparición (FEVI <50 %), bloqueo auriculoventricular de II/III grado o taquicardia ventricular (el solo paro cardíaco súbito no cumple este criterio)
b) exantema o conjuntivitis no purulenta
2) criterios clínicos secundarios:
a) nuevo signo neurológico como: encefalopatía en las personas sin trastornos previos de las funciones cognitivas, convulsiones, signos meníngeos o neuropatía periférica (incluido el síndrome de Guillain-Barré)
b) shock o hipotensión no asociados al tratamiento (p. ej. sedación, TRS)
c) dolor abdominal, vómitos o diarrea
d) trombocitopenia (recuento de plaquetas <150 000/μl).
Criterios de laboratorio: marcadores del estado inflamatorio y la infección por SARS-CoV-2:
1) valores elevados de ≥2 parámetros: PCR, ferritina, IL-6, procalcitonina, VHS
2) prueba positiva de infección actual o reciente por SARS-CoV-2: RT-PCR, determinación de antígeno de SARS-CoV-2 y detección de anticuerpos anti-SARS-CoV-2.
Diagnóstico diferencial
Gripe, neumonía atípica, síndrome respiratorio de Oriente Medio (MERS), otras enfermedades víricas del aparato respiratorio (p. ej. infección por VRS), neumocistosis, otras causas de SDRA.
TRATAMIENTOArriba
La elección de fármacos depende de la fase de la enfermedad, el estado clínico, el nivel de insuficiencia respiratoria y la presencia de factores de riesgo de COVID-19 grave. En la fase inicial de la enfermedad (1.ª semana, cuando se produce la replicación viral, en las personas con factores de riesgo de COVID-19 grave se utilizan fármacos de actividad antiviral. En la 2.ª fase de la enfermedad (inmunológica), en las personas con COVID-19 de curso moderado, grave o crítico se utilizan antinflamatorios (inmunomoduladores): glucocorticoides en monoterapia o en combinación con un fármaco anticitocina o un inhibidor de las cinasas.
PERSPECTIVA LATINOAMERICANA
La gran mayoría de los fármacos mencionados no está disponible en los países de América Latina.
Opciones terapéuticas en función de la gravedad de los síntomas de COVID-19 y del lugar de tratamiento →tabla 19.1-5.
Tratamiento causal
1. Tratamiento antiviral administrado al principio de la enfermedad (hasta 5 días desde la aparición de los síntomas), durante la fase de replicación del SARS-CoV-2. Las personas aptas para el tratamiento son principalmente los enfermos con factores de riesgo de progresión a COVID-19 de curso grave →Etiopatogenia. En función del fármaco, también son aptos para el tratamiento ambulatorio los residentes de hogares de asistencia social, las personas dependientes de dispositivos médicos, los enfermos con hipertensión arterial, las personas con anemia drepanocítica y las personas con trastornos del neurodesarrollo.
Análogos de nucleósidos:
1) Molnupiravir: utilizado en el tratamiento de adultos con infección por SARS-CoV-2 confirmada, que no necesiten oxigenoterapia y que presenten factores de riesgo de progresión a COVID-19 grave. Dosificación: 800 mg VO cada 12 h durante 5 días. El tratamiento se debe iniciar en ≤5 días desde la aparición de los síntomas de infección.
2) Remdesivir: autorizado en la UE para tratar la COVID-19 en adultos y jóvenes de ≥12 años de ≥40 kg y neumonía que requiere oxigenoterapia, así como en adultos que no necesitan oxigenoterapia, pero presentan factores de riesgo de progresión a COVID-19 grave. Puede considerarse la administración del fármaco durante 5 días al principio de la enfermedad, durante la fase de replicación del virus, a más tardar 5 días desde la aparición de los primeros síntomas de COVID-19, en un enfermo con neumonía confirmada por radiología y SpO2 ≤94 % al respirar aire atmosférico, sobre todo en los enfermos con riesgo alto de COVID-19 grave. También se puede considerar una terapia de 3 días, iniciada en los 5 días desde la aparición de los primeros síntomas, en los enfermos con infección por SARS-CoV-2 confirmada que no necesitan oxigenoterapia, pero presentan riesgo alto de desarrollar una enfermedad grave. Dosificación: el 1.er día 200 mg iv. en infusión de 30-120 min, después 100 mg iv. cada 24 h los días siguientes. No administrar en enfermos con TFGe <30 ml/min/1,73 m2 y/o actividad de la ALT ≥5 x LSN.
Nirmatrelvir, un inhibidor de la proteasa Mpro (en combinación con ritonavir, un inhibidor del citocromo p450 CYP3A): está autorizado para tratar a las personas con infección por SARS-CoV-2 confirmada que no requieren oxigenoterapia, pero presentan factores de riesgo de progresión a COVID-19 grave. Dosificación: 300/100 mg VO cada 12 h durante 5 días. No usar en enfermos con alteraciones graves de la función hepática y TFGe <30 ml/min/1,73 m2 (reducir la dosis en los pacientes con TFGe <60 ml/min/1,73 m2). La OMS recomienda utilizarlo también en embarazadas. Antes de iniciar el tratamiento, hay que consultar las interacciones con otros fármacos. No debe combinarse con fármacos cuya eliminación del organismo depende del citocromo P450 CYP3A.
Los anticuerpos monoclonales recombinantes humanizados dirigidos contra los distintos epítopos de la proteína S están indicados en los enfermos con COVID-19 que no requieren hospitalización, pero pertenecen al grupo de alto riesgo de enfermedad grave. Estos fármacos se administran al principio de la enfermedad, durante la fase de replicación viral. No se deben usar en enfermos con COVID-19 grave que requieran oxigenoterapia nasal de alto flujo (ONAF) o ventilación mecánica, ni en los casos en los que no se haya confirmado la actividad neutralizante contra la variante predominante del SARS-CoV-2. En la actualidad, debido a la prevalencia de las variantes de ómicron, muchos grupos de expertos, incluidos los NIH, no recomienda utilizar estos fármacos por su ineficacia.
2. Tratamiento inmunomodulador: se utiliza en la fase inmunológica de la COVID-19 para controlar la tormenta de citocinas, normalmente en la 2.ª semana de la enfermedad.
Glucocorticoides: siempre que no haya contraindicaciones, se utilizan en todos los pacientes que necesitan oxigenoterapia o ventilación pulmonar mecánica. Dexametasona VO o iv. 6 mg cada 24 h durante máx. 10 días. Si la dexametasona no está disponible, usar metilprednisolona a 32 mg/d o prednisona a dosis 40 mg/d (aunque no se sabe si ofrecen los mismos efectos beneficiosos que la dexametasona). No usar glucocorticoides VO/iv. en enfermos sin hipoxemia que requiera la administración de oxígeno, ya que hay riesgo de que empeore el pronóstico (posible aumento de la mortalidad). Los NIH recomiendan añadir a la dexametasona un inhibidor de IL-6 o un inhibidor de JAK en casos con un aumento rápido del requerimiento de oxígeno e inflamación sistémica (hospitalizados con COVID-19 de curso moderado, grave y crítico). La OMS admite el uso conjunto de inhibidor de IL-6 y baricitinib además de un glucocorticoide en enfermos con COVID-19 de curso grave o crítico. Algunos expertos han recomendado iniciar un glucocorticoide inhalado de forma temprana (budesonida 800 μg 2 × d) en todos los enfermos con síntomas de COVID-19 de ≥65 años en tratamiento ambulatorio y también los de ≥50 años con enfermedades concomitantes (también puede considerarse en todos los enfermos >18 años con síntomas de COVID-19 en tratamiento ambulatorio). Los pacientes que ya estaban tratados con glucocorticoides inhalados antes de desarrollar COVID-19, deben mantener este tratamiento.
Fármacos anticitocina: se usan de forma adicional a los glucocorticoides:
1) Anakinra (antagonista del receptor de la IL-1): se usa en los enfermos con neumonía secundaria a COVID-19 que requieren oxigenoterapia y con riesgo de desarrollar insuficiencia respiratoria grave, indicado por una concentración plasmática del receptor soluble del activador del plasminógeno de tipo urocinasa (suPAR) ≥6 ng/ml. Fármaco utilizado en lugar del tocilizumab en los enfermos con COVID-19 moderada o grave. Dosificación: 100 mg VSc cada 24 h durante 10 días; no se debe administrar en enfermos con recuento de neutrófilos <1500/l.
2) Sarilumab (inhibidor del receptor de IL-6): según las recomendaciones de los NIH y la IDSA, uso fuera de la ficha técnica si no se puede administrar tocilizumab.
3) Tocilizumab (inhibidor de IL-6): uso fuera de indicación en los enfermos hospitalizados con COVID-19, SpO2 <92 %, inflamación significativa (proteína C-reactiva ≥75 mg/l, sin sobreinfección bacteriana) e insuficiencia respiratoria de progresión rápida. Si el enfermo necesita ventilación mecánica, se ha de empezar el tratamiento a más tardar el 1.er día desde el inicio de la respiración asistida. Dosificación. Dósis única iv. (infusión de 60 min) en función de la masa corporal: >90 kg — 800 mg; >65 y ≤90 kg — 600 mg; >40 y ≤65 kg — 400 mg, ≤40 kg — 8 mg/kg. Si según el médico el estado del paciente no ha mejorado, se puede administrar la 2.ª dosis 8-24 h después de la 1.ª. Las guías de algunos países (p. ej. Polonia) recomiendan determinar previamente la concentración sérica de IL-6.
Según los NIH, el tocilizumab debe administrarse en los enfermos:
1) ingresados en la UCI en las últimas 24 h, que necesitan ventilación mecánica u ONAF, con FiO2 >0,4 o un flujo de oxígeno >30 l/min
2) recién ingresados en el hospital, pero no en la UCI, con un aumento repentino de la necesidad de respiración asistida, que requieren ventilación no invasiva u ONAF y con marcadores inflamatorios de laboratorio elevados.
No debe usarse en los enfermos inmunodeprimidos.
El tratamiento con tocilizumab está asociado a un riesgo de desarrollar infecciones (mayor en los enfermos que simultáneamente reciben glucocorticoides), por lo que en estos casos deben controlarse las posibles sobreinfecciones bacterianas, fúngicas y oportunistas. No se debe administrar este fármaco a pacientes con recuento de neutrófilos <1000/l, recuento de plaquetas <50 000/l o actividad de la ALT >10 × LSN.
Inhibidores de cinasas:
1) Baricitinib (inhibidor de JAK1 y JAK2): uso fuera de la ficha técnica en los enfermos hospitalizados por COVID-19 moderada o grave que no requieran ventilación mecánica ni OMEC, recomendado especialmente en enfermos que requieren oxigenoterapia de alto flujo. Dosificación: 4 mg VO cada 24 h durante un máximo de 14 días. Se puede utilizar en lugar del tocilizumab. No se debe usar en los enfermos con TFGe <30 ml/min/1,73 m2, factores de riesgo de trombosis y embolismo, o con tuberculosis.
2) Tofacitinib (inhibidor de JAK1, JAK2, JAK3 y en menor medida TYK2): uso fuera de la ficha técnica como fármaco alternativo al baricitinib. Se usa en combinación con dexametasona en lugar del tocilizumab. No se debe combinar con tocilizumab ni sarilumab. Dosificación: 10 mg VO cada 12 h hasta 14 días.
3. Otros fármacos: también se recomienda el uso de fluvoxamina (inhibidor selectivo de la recaptación de serotonina). Expertos de algunos países (p. ej. Polonia, Canadá) recomiendan considerar el uso de fluvoxamina a dosis de 100 mg VO cada 12 h en los pacientes con infección por SARS-CoV-2 confirmada y factores de riesgo de COVID-19 grave, en tratamiento ambulatorio en la fase inicial de la enfermedad. No obstante, recomiendan cautela con este fármaco debido a los posibles eventos adversos e interacciones farmacológicas. Los expertos de la OMS no recomiendan utilizar fluvoxamina fuera de ensayos clínicos.
Tratamiento sintomático
1. Oxigenoterapia: en los enfermos con insuficiencia respiratoria (SpO2 <90 %), para alcanzar una SpO2 ≥92 % (en las embarazadas SpO2 ≥95 % o PaO2 >70 mm Hg). Se debe considerar la administración de oxígeno en los enfermos con SpO2 90-92 %. Si la oxigenoterapia pasiva no es suficiente para alcanzar la SpO2 objetivo, en los enfermos sin indicaciones urgentes para la intubación y la ventilación invasiva, administrar oxigenoterapia nasal de alto flujo (ONAF) o ventilación no invasiva (VNI). Se debe vigilar con atención a estos enfermos, ya que puede surgir la necesidad inmediata de intubar en caso de falta de mejoría (especialmente durante 1-2 h desde el inicio de la VNI) o empeoramiento de su estado general. En la SDRA moderada y grave (PaO2/FiO2 ≤200 mm Hg) durante la ventilación invasiva, se sugiere la estrategia de presión positiva al final de la espiración.
2. Tratamiento antitrombótico: los pacientes con COVID-19 diagnosticada que reciben un fármaco anticoagulante o antiplaquetario a causa de una enfermedad concomitante, deben continuar el tratamiento. En los pacientes hospitalizados por COVID-19, debe realizarse una profilaxis de la enfermedad tromboembólica venosa (ETV) según las guías actuales para el resto de los adultos tratados en el hospital. Si no existen otras indicaciones o factores de riesgo de ETV, no debe iniciarse un tratamiento anticoagulante ni antiplaquetario a modo de profilaxis de la ETV en los enfermos con tratamiento ambulatorio por COVID-19. La mayoría de los expertos desaconseja administrar anticoagulantes a dosis terapéuticas a modo de profilaxis antitrombótica primaria. No obstante, se pueden combinar métodos farmacológicos y mecánicos. En caso de incidente tromboembólico o alta sospecha de enfermedad tromboembólica, si no es posible realizar pruebas de imagen con urgencia → administrar un anticoagulante a dosis terapéutica de acuerdo con las guías para los pacientes no infectados por SARS-CoV-2 →Principios generales del tratamiento anticoagulante. En los pacientes que necesitan OMEC o terapia de reemplazo renal continua, o que hayan desarrollado trombosis asociada a catéter o vía extracorpórea, administrar un tratamiento anticoagulante de acuerdo con las normas de manejo de los pacientes no infectados por SARS-CoV-2 →Tromboflebitis superficial.
3. Pronación de los enfermos: se sugiere en los pacientes con ventilación mecánica y PaO2/FiO2 <200 mm Hg. El decúbito prono parece beneficioso también en enfermos con insuficiencia respiratoria que no requiere ventilación mecánica. Considerar la colocación de las embarazadas en posición lateral.
4. La terapia de reemplazo renal se inicia si aparecen indicaciones generales. Como muchos enfermos se colocan en decúbito prono, se prefiere el acceso vascular por vena yugular interna. Al introducir un catéter temporal para la diálisis, también es importante dejar la posibilidad de obtener un acceso separado para la eventual OMEC. El método de anticoagulación óptimo es la anticoagulación regional con citrato.
5. Manejo de la sepsis y del shock séptico →Sepsis y shock séptico.
6. Antibioticoterapia: usar solo en caso de complicaciones bacterianas (atención: las concentraciones altas de proteína C-reactiva y PCT no son buenos marcadores de sobreinfección bacteriana en la COVID-19, y la antibioticoterapia innecesaria empeora el pronóstico).
Tratamiento de las secuelas de la COVID-19
1. MIS-A: el tratamiento de elección son las inmunoglobulinas iv. (IGIV; 2,0 g/kg en dosis única; en caso de insuficiencia cardíaca, la dosis puede dividirse en tomas de 1,0 g/kg/d administradas en 2 días consecutivos) en monoterapia o en combinación con glucocorticoides. El ACR recomienda la adición de un glucocorticoide (metilprednisolona 2 mg/kg/d) en los casos de enfermedad grave o falta de respuesta al tratamiento con IGIV solas. Considerar también la asociación de un glucocorticoide a dosis bajas en los enfermos con MIS-A leve que, a pesar de recibir IGIV, siguen con fiebre y otras manifestaciones. En los pacientes que no responden a la IGIV en combinación con glucocorticoides a dosis bajas o medias se debe considerar la administración de dosis altas de glucocorticoides iv. Se puede considerar la administración de anakinra (>4 mg/kg/d iv. o VSc): en los enfermos con MIS-A resistente a IGIV y glucocorticoides, en los enfermos con rasgos del síndrome de activación macrofágica (SAM) o en caso de contraindicaciones para el uso prolongado de glucocorticoides.
En todos los pacientes con MIS-A (excepto las personas con riesgo de hemorragia o con recuento de plaquetas ≤80 000/μl), se debe administrar ácido acetilsalicílico a dosis bajas durante ≥4 semanas (hasta que se normalice el recuento plaquetario y se descarten complicaciones coronarias). En los pacientes que hayan desarrollado aneurismas coronarios, el ACR recomienda considerar la administración de un tratamiento anticoagulante adicional (heparina de bajo peso molecular o warfarina).
2. COVID-19 persistente: la actuación depende de las anomalías observadas. Después de descartar las complicaciones graves de la COVID-19, se emplea un tratamiento sintomático que apoye la recuperación. Los enfermos que hayan sufrido una COVID-19 grave pueden beneficiarse de la rehabilitación pulmonar. También se recomienda un ejercicio físico ligero. En los enfermos con trastornos de las funciones cognitivas, depresión y trastornos del sueño, considerar iniciar cuanto antes un tratamiento ansiolítico y antidepresivo.
SITUACIONES ESPECIALESArriba
Embarazo y lactancia
Las embarazadas presentan más riesgo de ingresar en la UCI, requerir ventilación mecánica y morir a causa de la COVID-19. El riesgo de infección grave por SARS-CoV-2 en embarazadas es adicionalmente elevado en caso de enfermedades concomitantes, p. ej. obesidad, diabetes mellitus, hipertensión y edad >35 años. Asimismo, la COVID-19 supone un factor de riesgo de parto prematuro. El riesgo de ETV también es más elevado.
Indicaciones para la hospitalización:
1) signos de COVID-19 moderada o grave o SpO2 <95 %
2) enfermedades concomitantes que requieran tratamiento hospitalario
3) fiebre >39 °C que no remite a pesar del uso de paracetamol (sospecha de linfohistiocitosis hemofagocítica o síndrome de liberación de citocinas).
En las embarazadas, se puede considerar la TC como prueba de imagen principal en el diagnóstico de la COVID-19. Si no fuera posible realizar una radiografía ni una TC de tórax, debe realizarse una ecografía pulmonar: permite detectar y vigilar lesiones pulmonares, sin exponer a la embarazada a la radiación ionizante.
La OMS recomienda el uso de nirmatrelvir con ritonavir en embarazadas y mujeres lactantes. El tratamiento con remdesivir debe administrarse igual que en el resto de los pacientes con COVID-19. Las indicaciones para el uso de dexametasona son las mismas que para el resto de los pacientes con COVID-19, pero la SMFM recomienda distintas dosis en función de la madurez pulmonar del feto:
1) si los glucocorticoides están indicados debido al desarrollo pulmonar del feto: 6 mg IM cada 12 h durante 2 días (en total 4 dosis), después 6 mg VO/iv. cada 24 h hasta 10 días
2) en el resto de los casos: como en los demás enfermos.
Durante la lactancia, las mujeres contagiadas deben seguir los métodos estándar de prevención inespecífica de las infecciones transmitidas por vía respiratoria y contacto directo.
Enfermedades cardiovasculares
1. Diagnóstico de enfermedades cardiovasculares (ECV): los síntomas de COVID-19 (disnea, dolor torácico o debilidad general) pueden imitar a los síntomas iniciales de las enfermedades cardíacas, pero los enfermos con COVID-19 también pueden desarrollar complicaciones cardiovasculares agudas (síndrome coronario agudo [SCA] o embolismo pulmonar) de forma repentina. La neumonía se asocia a un aumento considerable del riesgo a corto plazo de eventos cardiovasculares. Hay que estar alerta y valorar el riesgo de SCA y de incidentes tromboembólicos en los enfermos con COVID-19 y antecedentes de ECV. Los enfermos con COVID-19 pueden tener una concentración sérica elevada de troponinas cardíacas (cTn): determinar las cTn solo si los indicios clínicos o una disfunción ventricular izquierda reciente levantan la sospecha de infarto de miocardio tipo 1. No determinar de rutina las concentraciones de cTn ni de BNP/NT-proBNP. Evitar las ecocardiografías si no son absolutamente necesarias. De entre las pruebas no invasivas, la angio-TC es la preferida para el diagnóstico de la enfermedad coronaria y la TC cardíaca para detectar/descartar un trombo intracardíaco antes de la cardioversión.
2. Enfermedad coronaria: en los enfermos con síndrome coronario crónico, mantener el tratamiento anterior y vigilar al paciente con el uso de herramientas de telemedicina. Se deben aplazar los estudios invasivos si no son absolutamente necesarios. En los enfermos con riesgo bajo o medio, aplazar la revascularización. Si es posible, aplazar los tratamientos invasivos de los enfermos infectados por SARS-CoV-2 hasta que se recuperen.
Estrategia de tratamiento de los pacientes con IAMCEST e IAMSEST →tabla 19.1-6.
3. Miocarditis: el SARS-CoV-2 puede provocar miocarditis fulminante, que debe sospecharse en los enfermos con COVID-19 y dolor torácico de inicio agudo, alteraciones del segmento ST, alteraciones del ritmo cardíaco e inestabilidad hemodinámica, así como dilatación y trastornos de la contractilidad del ventrículo izquierdo en la ecocardiografía de cabecera, sobre todo en los enfermos sin antecedentes de ECV.
4. Alteraciones del ritmo y de la conducción:
1) En los enfermos con inestabilidad hemodinámica a causa de fibrilación (FA) o flutter (FLA) auricular de reciente aparición, considerar la cardioversión eléctrica. En los enfermos en estado crítico, la amiodarona iv. es el antiarrítmico de elección para controlar la frecuencia cardíaca. En los enfermos con insuficiencia respiratoria aguda grave, la cardioversión probablemente no ofrecerá beneficios duraderos si al mismo tiempo no se intensifica el tratamiento de la hipoxemia y la inflamación, y no se corrigen otros factores reversibles desencadenantes de la arritmia, como la hipopotasemia, hipomagnesemia, acidosis metabólica, infusión de catecolaminas, hiperhidratación, aumento de la tensión del sistema simpático y sobreinfección bacteriana.
2) En los enfermos hospitalizados con COVID-19 y FA o FLA recurrente o de nueva aparición durante el tratamiento antiviral, pero sin inestabilidad hemodinámica, se prefiere retirar los antiarrítmicos (especialmente el sotalol y la flecainida, probablemente también la amiodarona y la propafenona) e iniciar un control de la frecuencia cardíaca mediante un β-bloqueante (o un calcioantagonista no dihidropiridínico) asociado a digoxina o en monoterapia, para posibilitar el uso seguro de los antivirales.
3) En los enfermos con TV monomorfa sostenida que estén recibiendo fármacos prolongadores del QT en combinación con los fármacos utilizados en COVID-19, considerar la cardioversión eléctrica, sobre todo si el paciente recibe ventilación mecánica. Si el estado del paciente lo permite, en vez de la cardioversión puede considerarse el uso de procainamida iv. o de lidocaína y, en caso de enfermedad estructural cardíaca y disfunción ventricular izquierda, el uso de amiodarona iv., aunque este fármaco funciona lentamente en la cardioversión de la TV (considerar después de valorar las interacciones con los fármacos empleados en el tratamiento de la COVID-19).
4) En los enfermos con COVID-19 en estado crítico y TV sostenida recurrente o FV recurrente (tormenta eléctrica), la amiodarona iv. es el antiarrítmico de elección. Si se sospecha isquemia miocárdica → considerar el uso de lidocaína iv. como fármaco más seguro, aunque menos eficaz, eventualmente con la adición de un β-bloqueante (p. ej. esmolol). También puede considerarse la intubación endotraqueal, la sedación y la ventilación artificial, así como el implante temporal de un estimulador cardíaco, teniendo en cuenta la relación entre beneficio y riesgo asociado al carácter invasivo de la intervención (colocación de electrodo) y a la exposición del personal a la infección.
5. Tratamiento anticoagulante: en los enfermos con COVID-19 e indicaciones para la anticoagulación oral, se ha de evaluar la función renal y hepática, así como las interacciones entre los anticoagulantes orales y los fármacos empleados en la COVID-19. En los enfermos en los que se puedan administrar los ACOD (es decir, sin válvulas cardíacas mecánicas, estenosis mitral moderada ni grave, ni síndrome antifosfolipídico), estos se prefieren sobre los AVK, puesto que son más seguros y pueden administrarse de manera continua sin necesidad de controlar el efecto anticoagulante con las pruebas de laboratorio (es decir, sin un contacto directo con el personal). No obstante, es importante la administración de la dosis adecuada de los ACOD y el cumplimiento de las recomendaciones.
En los enfermos con COVID-19 ingresados en la UCI por estado clínico grave, que ya han recibido un anticoagulante oral por otra causa, este fármaco puede sustituirse por heparina de bajo peso molecular o no fraccionada. En los enfermos con dificultad para deglutir, los ACOD pueden administrarse en forma de comprimido machacado (p. ej. a través de una sonda nasogástrica): apixabán con el estómago vacío o rivaroxabán mezclado con agua o puré de manzana (a excepción del dabigatrán, cuyas cápsulas no pueden abrirse).
6. Embolismo pulmonar (EP) agudo: considerar el tratamiento anticoagulante a dosis profilácticas estándar en todos los enfermos con COVID-19 ingresados, pero teniendo en cuenta el riesgo de complicaciones hemorrágicas. Hay que tener en cuenta que las manifestaciones de la COVID-19 y el EP se solapan. Sospechar un EP agudo en los enfermos con COVID-19 en caso de empeoramiento inesperado de la respiración, taquicardia nueva o inexplicada, disminución de la presión arterial no asociada a taquiarritmia, hipovolemia o sepsis, nuevas alteraciones en la ECG indicativas de EP y síntomas de trombosis venosa profunda de extremidades. El aumento de la concentración de dímero D puede ser secundario a la infección y la inflamación, lo que reduce considerablemente la especificidad de la prueba. Si las lesiones pulmonares detectadas en la TC de tórax no explican la insuficiencia respiratoria → considerar una angio-TC de arterias pulmonares.
7. Hipertensión arterial: durante la pandemia de COVID-19, se debe iniciar el tratamiento antihipertensivo de acuerdo con las guías actuales de la ESC y la ESH. Recordar que en los enfermos con hipertensión arterial el riesgo de alteraciones del ritmo cardíaco puede estar elevado, ya que en la COVID-19 grave la hipopotasemia es más frecuente.
Enfermedades endocrinas
1. Diabetes mellitus tipo 2: en caso de confirmar la infección por SARS-CoV-2, se debe interrumpir el inhibidor del cotransportador sodio-glucosa tipo 2 (gliflozina), pero continuar el tratamiento con inhibidores del DPP-4 o metformina. Si se cumplen ciertas condiciones, también puede mantenerse el tratamiento con un agonista del receptor del péptido similar al glucagón tipo 1 (GLP-1). Modificar el tratamiento en caso de empeorar los síntomas de la COVID-19, especialmente la fiebre. En los enfermos con sospecha o diagnóstico de la infección por SARS-CoV-2, hay que controlar la glucemia y la hidratación del paciente de forma regular, ya que puede aumentar el riesgo de acidosis láctica o cetoacidosis. En tal caso, retirar la metformina y controlar la función renal. En caso de empeoramiento del estado del paciente con COVID-19, es imprescindible el ingreso hospitalario, la interrupción de todos los hipoglucemiantes no insulínicos y la implementación de insulinoterapia. Si antes de desarrollar COVID-19 el enfermo tomaba insulina, esta no debe interrumpirse en ningún caso, pero hay que indicar un control glucémico regular (p. ej. cada 4 h), para modificar la dosis de insulina en caso de necesidad. Recomendar un consumo suficiente de líquidos y de comida, incluso sin apetito. En los enfermos graves que requieran ventilación asistida, es imprescindible administrar insulina iv., debido a la demanda alta de esta hormona (>20 uds./h) y a que esta vía de administración facilita la dosificación precisa del fármaco, adaptada a los requerimientos del enfermo. En este caso, se debe intentar mantener la glucemia en un intervalo de 4-10 mmol/l (70-180 mg/dl).
2. Insuficiencia corticosuprarrenal: en caso de infección por SARS-CoV-2 en los enfermos con insuficiencia corticosuprarrenal, el manejo depende del estado general del paciente. El tratamiento con hidrocortisona VO se mantiene si el paciente se encuentra en buen estado general, permanece en casa y los síntomas se limitan a fiebre moderada y tos. Mantener la dosis doble de glucocorticoides durante ≥2 días. Después, si los síntomas remiten, no hay fiebre y el enfermo se siente mejor, se puede intentar volver a la dosis habitual. Si en 48 h el estado general del enfermo tratado en domicilio no mejora o si ha sido necesario introducir un antibiótico por sospecha de infección bacteriana concomitante y la temperatura corporal ha aumentado ≥40 °C, se debe recomendar multiplicar por 3 la dosis normal de hidrocortisona. Se pasará a un tratamiento con hidrocortisona iv. si el paciente sufre vómitos o si su estado general empeora hasta el punto de requerir hospitalización y soporte vital. En estas situaciones, administrar hidrocortisona iv. o IM: inicialmente 100 mg iv., después en infusión continua iv. 200 mg/24 h; o inicialmente 100 mg IM, después cada 6 h 50 mg IM o iv.; sin olvidarse de una hidratación adecuada. Controlar la eficacia de la hidrocortisona en condiciones hospitalarias determinando la concentración sérica de sodio y potasio, y vigilando la presión arterial. El tratamiento es similar en los pacientes con insuficiencia corticosuprarrenal en situaciones de emergencia, p. ej. cuando es necesaria una cirugía bajo anestesia general, incluidos también los enfermos con infección por SARS-CoV-2 confirmada.
Enfermedades del sistema urinario
1. En los enfermos con enfermedades renales inmunológicas con sospecha o diagnóstico de infección por SARS-CoV-2: interrumpir la administración de los antimetabolitos (micofenolato de mofetilo, azatioprina). Si el paciente está recibiendo un tratamiento de mantenimiento, se puede aplazar la administración de la siguiente dosis de rituximab o ciclofosfamida (en pulsos iv.), si esta decisión no aumenta el riesgo de recurrencia de la enfermedad de base.
2. Enfermos con riñón trasplantado: cuando el riesgo de COVID-19 grave es alto, se puede interrumpir la administración de inmunosupresores o reducir significativamente su dosis durante el período de infección por SARS-CoV-2 sintomática (≤14 días desde el inicio de los síntomas). El tratamiento de mantenimiento con glucocorticoides no puede interrumpirse de forma repentina.
3. Enfermos en hemodiálisis: el riesgo de formación de un foco de epidemia entre los pacientes que reciben diálisis crónica en estaciones de diálisis es alto. Se han de seguir los procedimientos de seguridad para reducir el riesgo de transmisión del SARS-CoV-2 en las estaciones de diálisis: detectar posibles infectados antes de que entren en la estación de diálisis (anamnesis, medición de temperatura), mascarillas obligatorias para los pacientes durante el transporte y la estancia en las estaciones de diálisis, evitar contactos entre pacientes de distintos turnos, dividir al personal en equipos que no tengan contacto mutuo y cumplir estrictamente con las normativas de desinfección de habitaciones, aparatos y medios de transporte. Los pacientes contagiados se envían a una estación de diálisis designada para ello o reciben la diálisis en la estación principal, pero en una sala separada, en el último turno o en uno adicional. Asimismo, mantener la protección individual absoluta del personal y desinfectar adecuadamente la sala y el material después del procedimiento.
Enfermedades reumáticas
Los expertos del ACR han elaborado las siguientes recomendaciones.
1. Tratamiento de los enfermos sin infección por SARS-CoV-2 ni antecedentes de exposición al virus:
1) Se puede continuar con el uso de los fármacos modificadores de la enfermedad convencionales (csFARME): hidroxicloroquina o cloroquina (HCQ/CQ), sulfasalazina (SSZ), metotrexato (MTX), leflunomida (LEF), inmunosupresores (p. ej. tacrólimus, ciclosporina [CSA], MMF, AZA); FARME biológicos (bFARME), inhibidores de JAK, antinflamatorios no esteroideos (AINE).
2) En los enfermos con afectación de órganos vitales secundaria a una enfermedad reumática, no deben reducirse las dosis de inmunosupresores.
3) En los enfermos con artritis de actividad moderada o alta a pesar de un tratamiento óptimo con csFARME, se puede implementar un bFARME.
4) En caso de artritis activa o recién diagnosticada, se puede iniciar o modificar el tratamiento con csFARME; también se puede iniciar un tratamiento con glucocorticoides a dosis bajas (equivalente a ≤10 mg de prednisona) o AINE.
5) En los enfermos con una enfermedad inflamatoria sistémica o que cursa con afectación de órganos vitales (p. ej. nefropatía lúpica o vasculitis), se pueden administrar glucocorticoides a dosis altas o fármacos inmunosupresores.
2. Tratamiento de los enfermos después de la exposición al SARS-CoV-2: puede mantenerse el tratamiento con SSZ y AINE. Interrumpir el tratamiento con HCQ/CQ, el tratamiento inmunosupresor, los bFARME (otros que los inhibidores de la IL-6) y los inhibidores de JAK hasta la negativización de la prueba de detección de SARS-CoV-2 o hasta finalizar 2 semanas de la observación, si en este período no se presentan síntomas de COVID-19 (los expertos han mostrado dudas con respecto a la interrupción de LEF y MTX en esta situación). En situaciones determinadas, se puede continuar con el tratamiento con un inhibidor del receptor de la IL-6, si el enfermo y el médico toman esta decisión conjuntamente.
3. Tratamiento en caso de sospecha o diagnóstico de COVID-19: independientemente de la gravedad de la COVID-19, se debe interrumpir el tratamiento con HCQ/CQ, SSZ, MTX, LEF, inmunosupresores, bFARME (distintos a los inhibidores de la IL-6) e inhibidores de JAK. En situaciones determinadas, puede continuarse el tratamiento con un inhibidor del receptor de la IL-6, si el enfermo y el médico toman esta decisión conjuntamente. En los enfermos con síntomas respiratorios graves, deben retirarse los AINE.
4. Reanudación del tratamiento de la enfermedad reumática (csFARME, inmunosupresores, bFARME, inhibidores de JAK) en los enfermos infectados por SARS-CoV-2:
1) en las personas sin síntomas de COVID-19 con resultado positivo en la RT-PCR, puede considerarse 10-17 días después de la prueba
2) en los enfermos con COVID-19 no complicada (sin neumonía o con neumonía leve que no requiere hospitalización): se puede considerar 7-14 días después de la remisión de los síntomas
3) en los enfermos con COVID-19 grave, debe considerarse de forma individual.
Exposición ocupacional del personal sanitario
En la evaluación del riesgo de infección por SARS-CoV-2, se ha de tener en cuenta la duración de la exposición al material biológico (a más larga, mayor riesgo de infección), los signos clínicos del paciente de origen, si la persona expuesta llevaba la mascarilla (de qué tipo) y usaba otros EPP durante la exposición, si durante el procedimiento médico se pudo formar aerosol, si el profesional está vacunado contra la COVID-19, si ha recibido la pauta completa, o si puede estar inmunodeprimido. Se considera contacto peligroso cualquier contacto directo con una persona infectada, durante el cual el profesional de la salud no estaba protegido por los EPP adecuados.
Procedimiento en caso de exposición de un profesional de la salud a la infección por SARS-CoV-2 según las recomendaciones de los CDC →tabla 19.1-7.
Profesionales de salud independientemente del estado de vacunación tras una fuerte exposición a la infección por SARS-CoV-2: no tienen que dejar de trabajar si son asintomáticos o no han obtenido resultado positivo del test de SARS-CoV-2 en las pruebas de control. Están particularmente expuestos los profesionales que compartieron espacio con los enfermos durante los procedimientos que generan aerosoles.
Los profesionales que presentan cualquier síntoma de COVID-19 deben:
1) dejar de trabajar inmediatamente
2) someterse a una prueba de infección por SARS-CoV-2. En caso del test NAAT es suficiente una sola prueba. Si el resultado es negativo y se sospecha la infección, es necesario repetir la prueba y alejar al profesional del trabajo hasta ese momento. En caso de pruebas de antígenos, si el resultado es negativo se debe repetir la prueba después de 48 h.
Criterios de reinstauración en el trabajo de las personas infectadas por SARS-CoV-2:
1) Profesionales asintomáticos y que no están en inmunosupresión moderada o grave: pueden volver a trabajar después de ≥7 días desde la confirmación de la infección, si el resultado de la prueba de control (NAAT o test de antígenos) fue negativo en las 48 h previas a la reinstauración en el trabajo, y después de ≥10 días, si a los 5-7 días no se realizó la prueba de control o el resultado siguió siendo positivo. Si para las pruebas de control en el 5.º día se utilizó el test de antígenos y el resultado fue negativo, la prueba debe repetirse después de 48 h.
2) Profesionales con COVID-19 leve o moderada y que no están en inmunosupresión moderada o grave: pueden volver a trabajar después de ≥7 días desde la aparición de los síntomas, si el resultado de la prueba de control (NAAT o test de antígenos) fue negativo en las 48 h previas a la reinstauración en el trabajo, la fiebre se resolvió hace ≥24 h y los demás síntomas (tos, disnea) disminuyeron. Si se utilizó el test de antígenos y el 5.º día el resultado fue negativo, la prueba debe repetirse después de 48 h. Si a los 5-7 días de la aparición de los síntomas no se realizó la prueba de control, el profesional puede volver a trabajar después de ≥10 días, si la fiebre se resolvió hace ≥24 h y los demás síntomas (tos, disnea) disminuyeron.
3) Profesionales con COVID-19 grave o crítica y que no están en inmunosupresión moderada o grave: pueden volver a trabajar transcurridos 10-20 días desde la aparición de los primeros síntomas, si la fiebre se resolvió hace ≥24 h y los demás síntomas (tos, disnea) disminuyeron.
4) Los profesionales con COVID-19 en inmunosupresión moderada o grave pueden tener la capacidad de infectar durante >20 días, por lo que la decisión sobre la reinstauración laboral debe basarse en los resultados de las pruebas. Puede ser necesario consultar con un infectólogo.
PERSPECTIVA CHILENA
En Chile la COVID-19 es una enfermedad de tipo ocupacional para el personal de salud, por lo que deben cumplirse los protocolos correspondientes.
PRONÓSTICOArriba
En enfermos con COVID-19 de curso crítico la mortalidad llega a un 50 %. Los índices de mortalidad estimados difieren según el país y las características demográficas de un determinado grupo de enfermos. La mortalidad confirmada en enfermos con COVID-19 es del 1 % a nivel mundial (a junio de 2022) y en algunos países llega al 4-5 % (México, Perú). Sin embargo, estas cifras son aproximadas. En muchos enfermos con una infección por SARS-CoV-2 leve no se realiza el diagnóstico de COVID-19, por lo que el número global de infectados está subestimado.
PREVENCIÓNArriba
Métodos específicos
1. Vacuna preventiva →COVID-19.
2. Profilaxis farmacológica: en la actualidad no está recomendada debido a una gran probabilidad de infectarse con la variante ómicron, en la cual se constató la ineficacia de los anticuerpos monoclonales utilizados en la prevención pre- y posexposición de las infecciones por las variantes anteriores del SARS-CoV-2.
Métodos inespecíficos
1. Recomendaciones generales:
1) mantener ≥2 m de distancia de otras personas
2) evitar tocarse la cara con las manos
3) evitar aglomeraciones
4) en períodos de alta transmisión del virus, usar mascarillas que cubran nariz y boca en espacios públicos (especialmente en lugares cerrados y espacios abiertos hacinados); en estos casos, el ECDC recomienda que las personas con riesgo elevado de COVID-19 grave utilicen mascarillas médicas o filtrantes (FFP2 o FFP3)
5) lavarse con frecuencia las manos con jabón o un desinfectante a base de alcohol.
Adicionalmente, para reducir el riesgo de infectar a otras personas, el ECDC recomienda que los enfermos con COVID-19:
1) se cubran la boca y la nariz con un pañuelo de un solo uso durante la tos y el estornudo (tras desecharlo, seguir con un lavado adecuado de manos)
2) utilicen mascarilla que cubra nariz y boca en caso de contacto cercano con otras personas (sobre todo con riesgo elevado de COVID-19 grave)
3) eviten tocarse la cara, la nariz, los ojos y la boca; si es necesario, deben lavarse las manos (antes y después).
2. Cuarentena: en muchos países se revocó la obligación legal de cuarentena para las personas que conviven con una persona en aislamiento, que han sido derivadas para el diagnóstico de laboratorio debido a la sospecha de COVID-19, y tras volver del extranjero.
3. Aislamiento: en muchos países se revocó el aislamiento automático obligatorio impuesto por la ley para las personas con una infección por SARS-CoV-2.
PERSPECTIVA LATINOAMERICANA
En la actualidad, en Latinoamérica no existen obligaciones legales en torno a la cuarentena ni aislamiento a personas con diagnóstico de COVID-19, sus cuidadores ni viajeros procedentes del extranjero. Sin embargo, en caso de sospecha o confirmación diagnóstica de COVID-19 se siguen recomendando 3-5 días de incapacidad laboral o estudiantil con conservación de las medidas de distanciamiento físico.
4. Equipos de protección personal (EPP): los EPP utilizados durante la atención de los pacientes con COVID-19 al realizar los procedimientos que generan aerosoles deben incluir por lo menos:
1) EPP para las vías respiratorias: mascarillas desechables FFP2 o FFP3
2) EPP para los ojos: gafas protectoras o pantalla
3) EPP para el cuerpo: bata desechable con mangas largas (no se recomiendan los monos)
4) EPP para las manos: guantes.
Los centros médicos deben contar con EPP de varias tallas. Haber recibido la pauta de vacunación completa contra la COVID-19 no exime de la obligación de usar EPP.
Notificación obligatoria
Sí.
TABLAS Y FIGURAS
Clasificación de gravedad de la COVID-19
|
Grado
|
Forma
|
Características
|
Comentarios
|
|
1
|
Asintomática u oligosintomática
|
Leve
|
Sin manifestaciones o con molestias leves en las vías respiratorias altas (fiebre, tos sin disnea), que a veces pueden estar acompañadas de cefalea, mialgias, náuseas, vómitos, diarrea, SpO2 >94 %, estado clínico estable
|
|
|
2
|
Sintomática sin signos de insuficiencia respiratoria (MEWSa <3 ptos.)
|
Moderada
|
Agotamiento, astenia, fiebre >38 °C, tos y disnea, signos clínicos y radiológicos de afectación pulmonar, sin datos clínicos o de laboratorio de insuficiencia respiratoria (SpO2 >90 y <94 %)
|
Debido al riesgo de que empeore su estado clínico, es necesario vigilar al paciente y tomar medidas que aceleren la eliminación de la infección por SARS-CoV-2
|
|
3
|
Neumonía grave con insuficiencia respiratoria/pre-SDRA (MEWS 3-4 ptos.)
|
Grave
|
Manifestaciones clínicas y de laboratorio de empeoramiento de la capacidad respiratoria y el intercambio gaseoso (disnea, aumento de la frecuencia respiratoria >30/min, SpO2 <90 %), manifestaciones agudas de afectación del aparato respiratorio
Sin manifestaciones de SDRA, shock séptico, insuficiencia multiorgánica ni alteraciones de la consciencia
En esta fase se observa hipoxia silenciosa (ing. silent hypoxia)
|
El paciente requiere un control estricto, sobre todo entre el día 5 y 7 desde la aparición de los primeros síntomas, para garantizar los cuidados intensivos en caso de necesidad
Pueden producirse manifestaciones extrapulmonares: ACV isquémico o hemorrágico, trombosis venosa profunda, encefalitis, síndrome de Guillain-Barré, trastornos de la consciencia secundarios a la afectación del SNC por el proceso patológico, crisis epilépticas, cardiopatía isquémica, miocarditis y arritmias
|
|
4
|
SDRA/insuficiencia multiorgánica (MEWS >4 ptos.)
|
Muy grave (crítica)
|
Paciente en estado muy grave, con insuficiencia respiratoria y alteración de otras funciones vitales: SDRA, sepsis/shock séptico, insuficiencia multiorgánica
|
Grados de gravedad de la SDRA (según la definición de Berlín)
– leve: 200 mm Hg <PaO2/FiO2 ≤300 mm Hg (con PEEP o CPAP ≥5 cm H2O, o en los pacientes no ventilados)
– moderado: 100 mm Hg <PaO2/FiO2 ≤200 mm Hg (con PEEP ≥5 cm H2O en los pacientes no ventilados)
– grave: PaO2/FiO2 ≤100 mm Hg (con PEEP ≥5 cm H2O en los pacientes no ventilados)
El riesgo de incidentes tromboembólicos arteriales o venosos es del 31-59 %
|
|
a Escala MEWS →tabla 2 en COVID-19 (enfermedad por coronavirus de 2019).
CPAP — presión positiva continua en las vías respiratorias, FiO2 — fracción inspirada de oxígeno en decimales, MEWS — escala modificada de alerta temprana, PaO2 — presión parcial de oxígeno arterial, PEEP — presión positiva al final de la espiración, SDRA — síndrome de dificultad respiratoria aguda, SNC — sistema nervioso central, SpO2 — saturación de oxígeno de la hemoglobina en sangre arterial medida por oxímetro de pulso
|
Escala modificada de alerta temprana (Modified Early Warning Score, MEWS)
|
Puntos
|
3
|
2
|
1
|
0
|
1
|
2
|
3
|
|
Frecuencia respiratoria (min–1)
|
–
|
≤8
|
–
|
9-14
|
15-20
|
21-29
|
>29
|
|
Pulso
|
|
≤40
|
41-50
|
51-100
|
101-110
|
111-129
|
>129
|
|
Presión arterial sistólica (mm Hg)
|
≤70
|
71-80
|
81-100
|
101-199
|
–
|
≥200
|
–
|
|
Excreción de orina (ml/kg/h)
|
<10
|
<0,5
|
–
|
>0,5
|
–
|
–
|
–
|
|
Temperatura corporal (oC)
|
–
|
≤35
|
35,1-36
|
36,1-38
|
38,1-38,5
|
≥38,6
|
–
|
|
Manifestaciones neurológicas
|
–
|
–
|
–
|
Consciente
|
Reacciona a la voz
|
Reacciona al dolor
|
Sin reacción
|
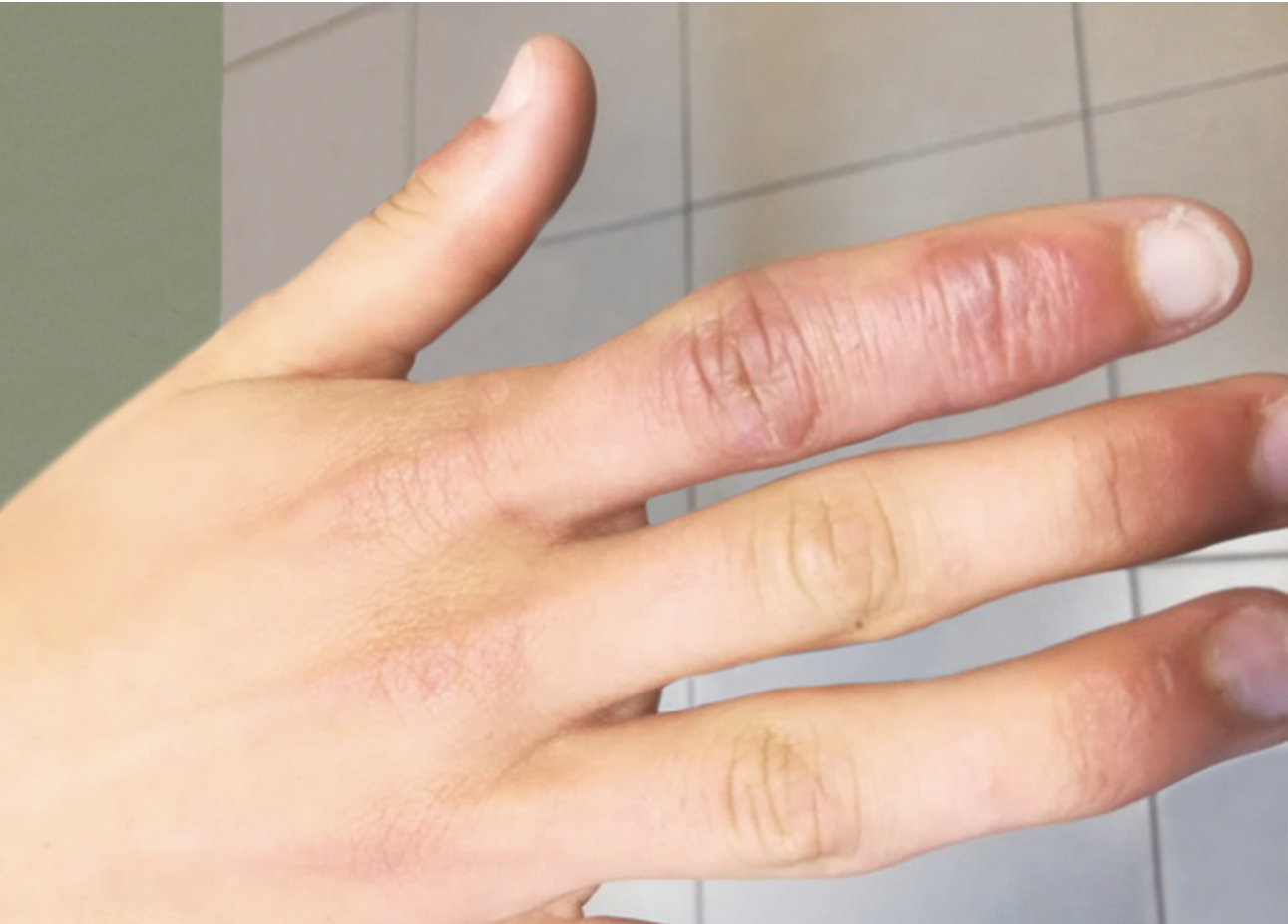
Fig. 19.1-1. Alteraciones cutáneas en las zonas distales de los dedos de las manos secundarias a COVID-19
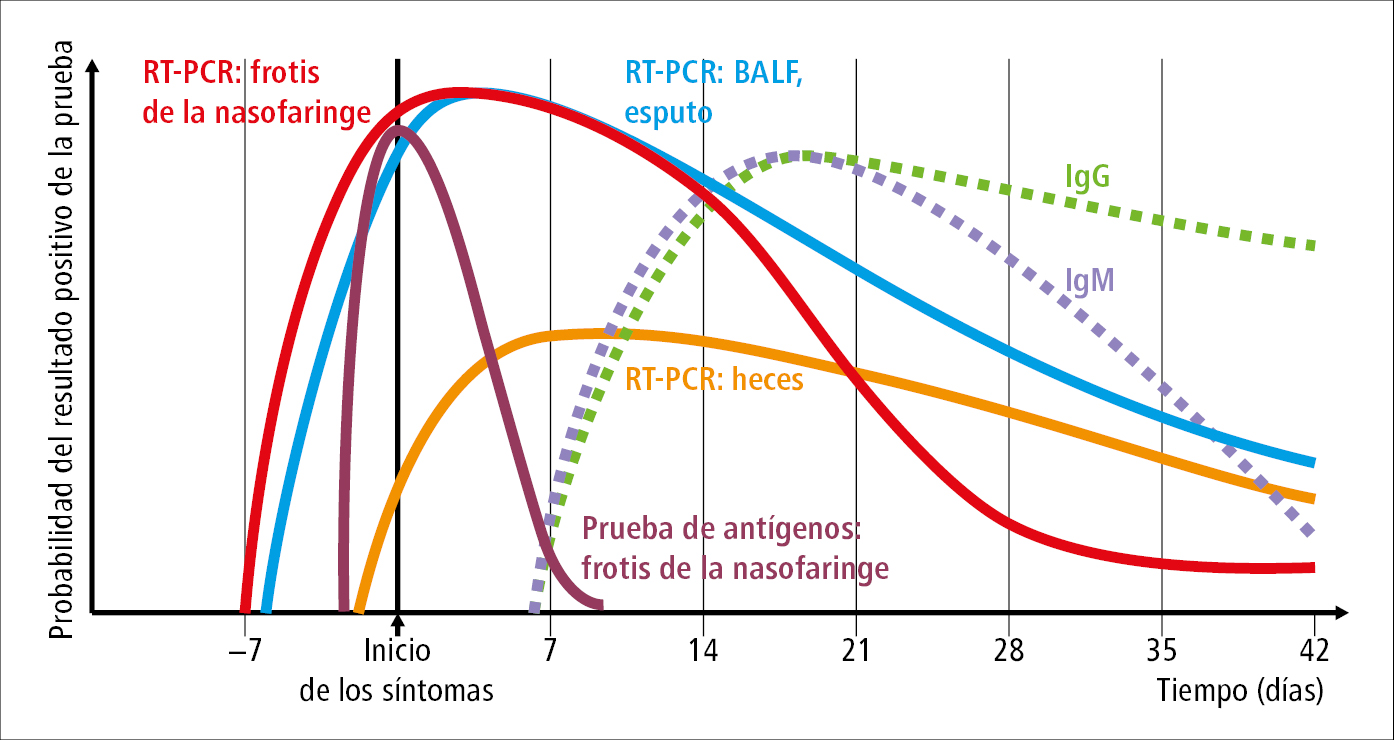
Fig. 19.1-2. Utilidad diagnóstica de las pruebas de laboratorio en cada fase de la infección por SARS-CoV-2 (a partir de: JAMA, 2020; doi: 10.1001/jama.2020.8259, modificado)
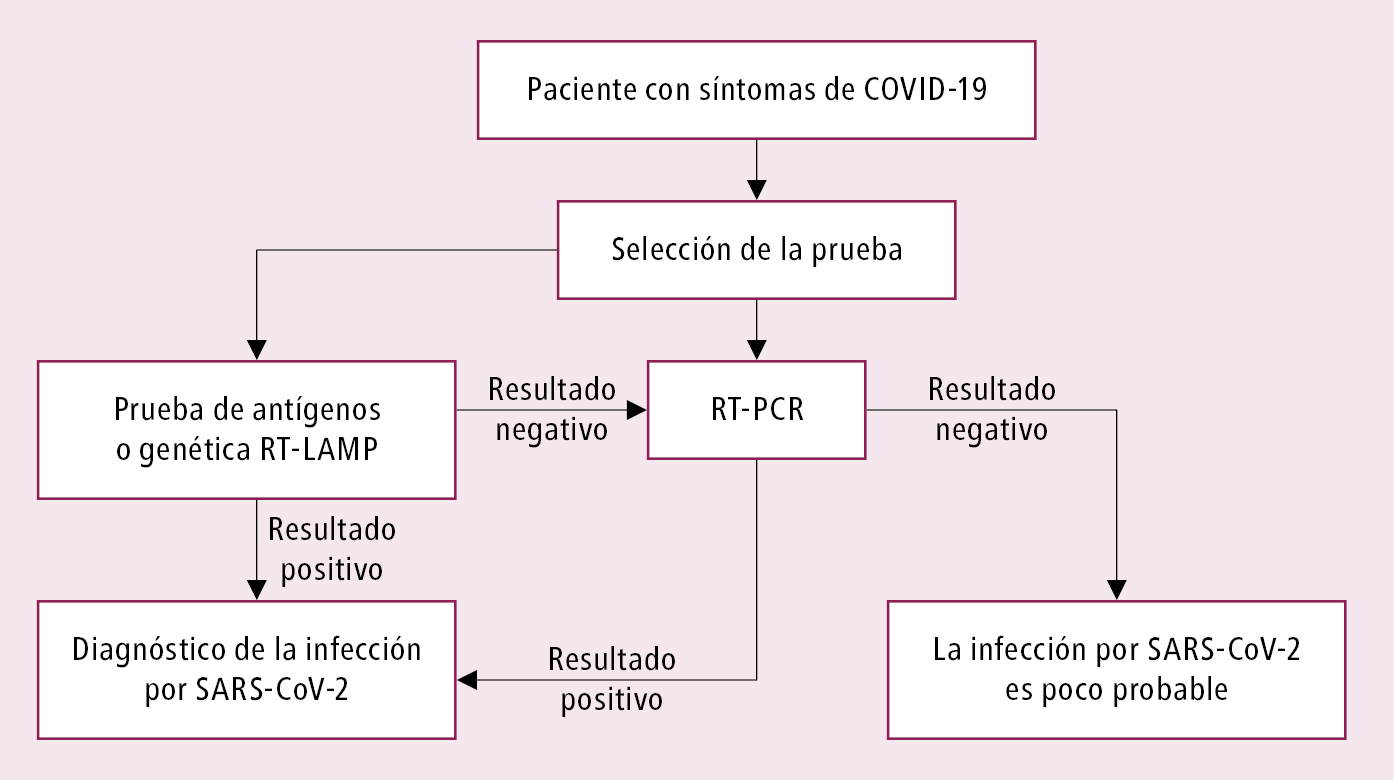
Fig. 19.1-3. Algoritmo diagnóstico de la infección por SARS-CoV-2 utilizando prueba de antígenos
Interpretación de pruebas serológicas de SARS-CoV-2
|
Información sobre la vacuna
|
Anticuerpos anti-S
|
Anticuerpos anti-N
|
Interpretación
|
|
Persona vacunada
|
Presentes
|
Presentes
|
Persona vacunada y recuperada
|
|
Persona vacunada
|
Presentes
|
Ausentes
|
Persona vacunada sin antecedentes de infección
|
|
Persona vacunada
|
Ausentes
|
Ausentes
|
Posible resultado falso negativo o trastornos de la respuesta humoral (sin producción de anticuerpos)
|
|
Persona no vacunada
|
Presentes
|
Presentes
|
Persona recuperada
|
|
Sin datos sobre la vacuna
|
Presentes
|
Presentes
|
Persona recuperada, sin posibilidad de valorar si está vacunada
|
|
Sin datos sobre la vacuna
|
Presentes
|
Ausentes
|
Persona vacunada
|
|
Sin datos sobre la vacuna
|
Ausentes
|
Ausentes
|
Persona sensible a la infección, no ha contraído infección y probablemente no está vacunada
|
Escala de disfunción orgánica asociada a sepsis (SOFA)a
|
Órgano o sistema
|
Puntuación
|
|
0
|
1
|
2
|
3
|
4
|
|
Sistema respiratorio
|
|
PaO2/FiO2, mm Hg (kPa)
|
≥400 (53,3)
|
<400 (53,3)
|
<300 (40)
|
<200 (26,7)b
|
<100 (13,3)b
|
|
Coagulación
|
|
Recuento de plaquetas, × 103/μl
|
≥150
|
<150
|
<100
|
<50
|
<20
|
|
Hígado
|
|
Concentración de bilirrubina, μmol/l (mg/dl)
|
<20 (1,2)
|
20-32 (1,2-1,9)
|
33-101 (2,0-5,9)
|
102-204 (6,0-11,9)
|
>204 (12)
|
|
Sistema cardiovascular
|
MAP ≥70 mm Hg
|
MAP <70 mm Hg
|
Dobutamina (cualquier dosis) o dopamina <5c
|
Noradrenalina ≤0,1 o adrenalina ≤0,1, o dopamina 5,1-15c
|
Noradrenalina >0,1 o adrenalina >0,1, o dopamina >15c
|
|
Sistema nervioso
|
|
Escala de coma de Glasgowd
|
15
|
13-14
|
10-12
|
6-9
|
<6
|
|
Riñones
|
|
Concentración de creatinina, μmol/l (mg/dl)
|
<110 (1,2)
|
110-170 (1,2-1,9)
|
171-299 (2,0-3,4)
|
300-440 (3,5-4,9)
|
>440 (5,0)
|
|
o diuresis, ml/d
|
|
|
|
o <500
|
o <200
|
|
a Calculadora en español: https://empendium.com/manualmibe/calculadoras/show.html?id=267373
b Durante la ventilación mecánica.
c Dosis de catecolaminas expresadas en μg/kg/min y administradas durante ≥1 h.
d →tabla 2 en Conciencia, alteraciones.
FiO2 — concentración de oxígeno en la mezcla gaseosa, expresada en decimales; MAP — presión arterial media; PaO2 — presión parcial de oxígeno en sangre arterial
A partir de: Intensive Care Med., 1996; 22: 707-710
|
Definiciones de casos de COVID-19 según la OMS
|
Caso sospechoso de infección por el SARS-CoV-2
|
|
1) Persona que cumple los criterios clínicos O epidemiológicos
a) criterios clínicos
– aparición súbita de fiebre Y tos, O
– aparición súbita de ≥3 los siguientes signos o síntomas: fiebre, tos, debilidad general/fatigaa, cefalea, mialgia, dolor de faringe, rinitis aguda, disnea, náuseas/diarrea/anorexia
O
b) criterios epidemiológicosb
contacto de caso probable, confirmado o vinculado a un clúster de COVID-19c
2) Persona con enfermedad respiratoria aguda grave (infección respiratoria aguda con antecedentes de fiebre o fiebre medida ≥38 °C; y tos; con inicio en los últimos 10 días; y que requiere hospitalización)
3) Persona sin signos ni síntomas clínicos O que no cumple los criterios epidemiológicos y ha dado positivo en una prueba de diagnóstico rápido de detección de antígenos de uso profesional o autotestd
|
|
Caso probable de infección por el SARS-CoV-2
|
|
1) Persona que cumple los criterios clínicos mencionados anteriormente Y es contacto de un caso probable o confirmado, o está vinculada a un clúster de COVID-19c
2) Muerte, no explicada de otro modo, en un adulto con dificultad respiratoria anterior a la muerte Y que fue contacto de un caso probable o confirmado o vinculado a un clúster de COVID-19c
|
|
Caso confirmado de infección por el SARS-CoV-2
|
|
1) Persona que ha dado positivo en una prueba de amplificación de ácidos nucleicos (TAAN), independientemente de los criterios clínicos O los criterios epidemiológicos
2) Persona que cumple los criterios clínicos Y/O criterios epidemiológicos (→Caso sospechoso 1) y ha dado positivo en una prueba de diagnóstico rápido de detección de antígenos positiva de uso profesional o autotestd
|
|
a Los signos separados por una barra (/) deben considerarse como un solo signo.
b Ante el aumento de la transmisibilidad de las variantes emergentes, así como de la alta probabilidad de que cualquier contacto directo pueda ser infectado, los criterios epidemiológicos se incluyen de manera aislada, con el fin de poder clasificar los contactos asintomáticos para examinarlos, cuando sea posible, en países con capacidad de adaptar estrategias más sensibles de realizar pruebas; es algo particularmente relevante en poblaciones y situaciones de alto riesgo.
c Un conjunto de personas sintomáticas agrupadas en el tiempo, en una misma ubicación geográfica o por una exposición común, entre los cuales hay al menos un caso confirmado mediante una prueba TAAN o al menos dos casos sintomáticos (que cumplen los criterios clínicos de la definición 1 o 2 de caso sospechoso) vinculados epidemiológicamente que han dado positivo en una prueba de diagnóstico rápido de detección de antígenos positiva de uso profesional o autotest (de especificidad ≥97 % y, de ser posible, con una probabilidad >99,9 % de que ≥1 resultado positivo sea verdaderamente positivo).
d Las pruebas de diagnóstico rápido de detección de antígenos están disponibles para su uso por profesionales capacitados o para autotest
– Pruebas de diagnóstico rápido de detección de antígenos para uso profesional: la OMS autorizó en su lista de uso de emergencia (EUL) las pruebas de diagnóstico rápido de detección de antígenos, en las que la toma de muestra, la ejecución de la prueba y su interpretación se realizan por un operador cualificado
– Autotest de diagnóstico rápido de detección de antígenos: la OMS autorizó en su lista de uso de emergencia (EUL) las pruebas de diagnóstico rápido de detección de antígenos, en las que la toma de muestra, la ejecución de la prueba y su interpretación se realizan por los individuos
TAAN — técnicas de amplificación de ácidos nucleicos
Nota: en pacientes que no cumplen estrictamente los criterios clínicos ni epidemiológicos, debe realizarse una evaluación clínica y de salud pública para determinar la necesidad de continuar exploraciones. Las definiciones de casos para la vigilancia no deben usarse como la única base para determinar el manejo clínico.
Organización Mundial de la Salud 2022. Algunos derechos reservados. Esta obra está disponible en virtud de la licencia CC BY-NC-SA 3.0 IGO.
WHO reference number: WHO/2019-nCoV/Surveillance_Case_Definition/2022.1
|
Fármacos utilizados en COVID-19 en función del lugar de tratamiento y de la gravedad de la enfermedad
|
Lugar de tratamiento, gravedad de la enfermedad
|
Tratamiento antiviral (en fase de replicación del SARS-CoV-2)
|
Tratamiento inmunomodulador (en fase inmunológica de la COVID-19)
|
Heparina de bajo peso molecular
|
|
Tratamiento ambulatorio: curso leve y moderado, enfermos sin factores de riesgo de progresión a la forma grave
|
–
|
–
|
–
|
|
Tratamiento ambulatorioa: curso leve y moderado, enfermos con factores de riesgo de progresión a la forma gravec
|
Nirmatrelvir con ritonavir o remdesivirb; si no están disponibles, molnupiravir
|
–
|
–
|
|
Tratamiento hospitalario por causas distintas a la COVID-19 (COVID-19 de curso leve o moderado)
|
Enfermos con factores de riesgo de progresión a la COVID-19 gravec:
Nirmatrelvir con ritonavir o remdesivir; si no están disponibles, molnupiravir
|
–
|
Dosis profiláctica (si no hay contraindicaciones):
– como profilaxis de ETV en pacientes sin indicación de utilizar dosis terapéuticas
– en embarazadas
|
|
Tratamiento hospitalario por COVID-19, enfermos sin requerimiento de oxigenoterapia
|
Enfermos con factores de riesgo de progresión a la COVID-19 grave: remdesivir
|
No utilizar dexametasona ni otros glucocorticoides sistémicosd
|
Dosis profiláctica (si no hay contraindicaciones):
– como profilaxis de ETV en pacientes sin indicación de utilizar dosis terapéuticas
– en embarazadas
|
|
Tratamiento hospitalario por COVID-19, enfermos que requieren oxigenoterapia convencionale
|
Remdesivir asociado a un glucocorticoide
|
Dexametasona; asociar baricitinib (si no está disponible, tofacitinib) o tocilizumab (si no está disponible, sarilumab) si el requerimiento de oxígeno aumenta rápidamente y se presentan signos de inflamación sistémica
|
Dosis terapéuticaf: excepto en embarazadas, cuando el dímero D >LSN y no hay riesgo elevado de sangrado
Dosis profiláctica (si no hay contraindicaciones):
– en pacientes sin indicación de utilizar dosis terapéuticas
– en embarazadas
|
|
Tratamiento hospitalario por COVID-19, enfermos que requieren oxigenoterapia nasal de alto flujo o ventilación no invasiva
|
Remdesivir en algunos enfermosg (no utilizar remdesivir en monoterapia sin inmunomoduladores)
|
Dexametasonab en combinación con baricitinib (si no está disponible, con tofacitinib) o tocilizumab (si no está disponible, con sarilumab)i
|
En enfermos sin indicaciones de utilizar dosis terapéuticas y en embarazadas utilizar heparina a dosis profiláctica (si no está contraindicada) como prevención de ETV
Si el tratamiento con dosis terapéuticas se inició antes de admitir al paciente en la UCI, los expertos de los NIH recomiendan reducir la dosis a la profiláctica, siempre y cuando no se haya diagnosticado ECV
|
|
Tratamiento hospitalario por COVID-19, enfermos que requieren ventilación mecánica u OMEC
|
–j
|
→más arriba
|
→más arribak
|
|
a El objetivo principal de manejo terapéutico en enfermos no hospitalizados consiste en la prevención de la progresión a la forma grave, hospitalización y muerte.
b Fármaco administrado iv.
c Edad >50 años (especialmente >65 años), estado de inmunosupresión asociado al riesgo de no responder a la vacuna, falta de vacunación contra la COVID-19, última dosis de la vacuna recibida >6 meses, obesidad, diabetes mellitus, enfermedades cardiovasculares, respiratorias o renales crónicas.
d No se refiere a la terapia con glucocorticoides por causas distintas a la COVID-19.
e Oxigenoterapia convencional: no incluye oxigenoterapia nasal de alto flujo, ventilación no invasiva, ventilación mecánica ni OMEC.
f La heparina de bajo peso molecular a dosis terapéuticas está contraindicada en enfermos con ≥1 de los siguientes factores: recuento de plaquetas <50 000/µl, Hb <8 g/dl, que en los últimos 30 días acudieron al servicio de emergencias debido al sangrado, con diátesis hemorrágica, en terapia antiplaquetaria doble.
g Algunos de los expertos de NIH aceptan el uso de remdesivir en el tratamiento de los enfermos inmunodeprimidos que requieren oxigenoterapia nasal de alto flujo o ventilación no invasiva, a pesar de que hasta el momento los estudios clínicos no han demostrado beneficios de este manejo de forma concluyente.
h La administración de dexametasona debe iniciarse de inmediato, sin esperar la disponibilidad de otro inmunomodulador.
i Los expertos de las guías de la OMS sobre el tratamiento de la COVID-19 del 13 de enero de 2023 aceptan el uso conjunto de tocilizumab (o sarilumab) y baricitinib además de glucocorticoides en pacientes con COVID-19 grave o crítica.
j En el estudio Solidarity, entre los pacientes que requerían ventilación mecánica u OMEC se observó una tendencia a la mortalidad elevada en el grupo de enfermos tratado con remdesivir. Sin embargo, los expertos de los NIH recomiendan que los enfermos que iniciaron el tratamiento con remdesivir antes de requerir ventilación mecánica u OMEC sigan recibiéndolo hasta concluir el ciclo terapéutico.
k Con mayor frecuencia, en enfermos que requieren OMEC, en lugar de heparina de bajo peso molecular se utiliza heparina no fraccionada a dosis terapéutica en infusión iv. continua para prevenir la coagulación en el circuito extracorpóreo.
ETV — enfermedad tromboembólica venosa, LSN — límite superior de normalidad, OMEC — oxigenación por membrana extracorpórea, UCI — unidad de cuidados intensivos
A partir de los guías de los NIH (National Insitutes of Health. COVID-19 Treatment Guidelines. Nonhospitalized Adults: Therapeutic Management, Hospitalized Adults: Therapeutic Management, última actualización: 20.04.2023, https://www.acpjournals.org/doi/suppl/10.7326/ANNALS-24-00464/suppl_file/annals-24-00464_supplement1.pdf)
|
Varias estrategias de tratamiento de enfermos con IAMCEST e IAMSEST, dependiendo de la coexistencia de la COVID-19
|
IAMCEST
|
IAMSEST
|
|
COVID-19 (+) o diagnóstico en curso
|
COVID-19 (–) o baja probabilidad de la enfermedad
|
COVID-19 (+) o diagnóstico en curso
|
COVID-19 (–) o baja probabilidad de la enfermedad
|
|
– ICPp
– Todos los enfermos —tanto los con COVID-19, como los sin resultados actuales de prueba de detección del SARS-CoV-2— deben ser tratados en servicios de hemodinámica preparados para el manejo de enfermos con COVID-19
– Fibrinólisis como método de elección solo en caso de imposibilidad de realizar ICPp en el tiempo recomendado por limitaciones debidas a la pandemia, así como en caso de falta de contraindicaciones
– En caso de resultado negativo de la prueba de detección del SARS-CoV-2: tratamiento de acuerdo con las recomendaciones actuales de la ESC
|
– IAMSEST de riesgo muy altoa: estrategia invasiva urgente en un servicio de hemodinámica preparado para el manejo de enfermos con COVID-19
– IAMSEST de alto riesgob: transporte del enfermo a un hospital designado y preparado para el tratamiento de enfermos cardiológicos con COVID-19, a continuación una estrategia invasiva precoz (de preferencia en 24 h)
– IAMSEST de riesgo intermedioc o bajod: considerar un diagnóstico no invasivo (angio-TC de arterias coronarias)
– En caso de resultado positivo: transporte del enfermo a un hospital designado y preparado para el tratamiento de enfermos cardiológicos con COVID-19
|
– IAMSEST de riesgo muy alto o alto: de acuerdo con las recomendaciones actuales de la ESC
– IAMSEST de riesgo intermedio o bajo: como enfermos COVID-19 (+)
|
|
a Inestabilidad hemodinámica, shock cardiogénico, dolor anginoso recurrente o persistente a pesar de la farmacoterapia utilizada, arritmia de riesgo vital o paro cardíaco súbito, complicaciones mecánicas de infarto, insuficiencia cardíaca aguda, en el ECG recurrencia de la elevación transitoria del segmento ST.
b Diagnosticado a partir de la dinámica de las alteraciones de cTn y presencia de: cambios dinámicos del segmento ST/T en el ECG y/o manifestaciones recurrentes.
c Diagnosticado a partir de la dinámica de las alteraciones de cTn en enfermos con coexistencia de diabetes mellitus, ERC, FEVI <40 %, IC congestiva, angina precoz posinfarto o antecedentes de ICP o de derivación coronaria quirúrgica.
d Falta de cumplimiento de criterios de IAMSEST de riesgo muy alto, alto o intermedio según la ESC.
cTn — nivel de troponinas cardíacas, ERC — enfermedad renal crónica, FEVI — fracción de eyección del ventrículo izquierdo, IAMCEST — infarto agudo de miocardio con elevación del segmento ST, IAMSEST — infarto agudo de miocardio sin elevación del segmento ST, IC — insuficiencia cardíaca, ICP — intervención coronaria percutánea, ICPp — intervención coronaria percutánea primaria
|
Procedimiento en caso de exposición de un profesional de la salud a la infección por SARS-CoV-2 en función del nivel de riesgo a partir de las recomendaciones de los CDC (23.09.2022)
|
Tipo de exposición
|
Pruebas diagnósticas
|
Observaciones
|
|
Exposiciones de alto riesgo. Contacto prolongadoa y cercanob con una persona infectada por SARS-CoV-2 durante el que:
a) el profesional no llevaba puesta la mascarilla filtrante (o llevaba puesta una mascarilla no filtrante y el paciente fuente no llevaba puesta la mascarilla)
o
2) el profesional no usaba protección de ojos (gafas/pantalla) en una situación en la que
a) el paciente fuente no llevaba puesta la mascarilla
o
b) el profesional no llevaba los EPP adecuados durante un procedimiento en el que se generaron aerosolesc
|
1) Realizar de inmediato una prueba para el diagnóstico de infección por SARS-CoV-2d (pero como mínimo transcurridas 24 h de la exposición), y si el resultado es negativo, repetir el test después de 48 h; si el resultado sigue siendo negativo, repetir después de otras 48 h (generalmente 1, 3 y 5 días desde la exposición)e
2) el profesional no deja de trabajar, pero debe llevar puesta la mascarilla en el trabajo; también tiene la obligación de controlar su estado de salud cada día (medir la temperatura corporal y observar posibles síntomas de COVID-19)
3) en caso de aparecer síntomas que sugieran la infección, el profesional debe aislarse inmediatamente de las personas sanas y notificar a los servicios sanitarios para determinar los siguientes pasos y realizar pruebas
|
El profesional debe dejar de trabajar en los siguientes casos:
1) durante los 10 días siguientes a la exposición no es posible realizar las pruebas diagnósticas ni efectuar el control según las recomendaciones
2) inmunosupresión moderada o grave
3) trabajo con pacientes en inmunosupresión moderada o grave
4) transmisión frecuente de SARS-CoV-2 en el servicio donde trabaja, cuando el control epidemiológico mediante intervenciones básicas resulta ineficaz
El profesional puede reincorporarse a su puesto de trabajo:
1) a los 7 días de la exposición no se presentan síntomas, y los resultados de las pruebas de infección por SARS-CoV-2 son negativos
2) a los 10 días de la exposición, si no se han realizado pruebas de infección por SARS-CoV-2 y no se presentan síntomas
|
|
Viaje o exposición a la infección por SARS-CoV-2 fuera del trabajo
|
Notificar a los servicios sanitarios del centro para determinar los siguientes pasos; en caso de viaje, seguir las normas de cuarentena vigentes en ese momento
En caso de alta exposición extralaboral (p. ej. contacto en casa), se debe proceder igual que en caso de exposición de alto riesgo
|
|
a Exposición ≥15 min (duración total en 24 h) o procedimiento que genere aerosoles, independientemente del tiempo de exposición.
b En relación con la exposición ocupacional, se considera contacto cercano haber estado a <2 m de una persona con infección por SARS-CoV-2 confirmada o haber tenido contacto no protegido con material biológico que contiene virus.
c Reanimación cardiopulmonar, intubación, extubación, broncoscopia, nebulización, inducción de esputo.
d Pruebas de antígenos o NAAT.
e Debido a la dificultad en la interpretación, no se realizan pruebas en los profesionales que padecieron la infección en los últimos 30 días; en los convalecientes que enfermaron hace 31-90 días se deben realizar pruebas de antígenos, y no NAAT.
EPP — equipos de protección personal, NAAT — amplificación de ácidos nucleicos
|
 Español
Español
 English
English
 українська
українська







