Definición y etiopatogeniaArriba
PERSPECTIVA LATINOAMERICANA
En América Latina, además de la guía GOLD, se utiliza la Guía de Práctica Clínica Latinoamericana de EPOC elaborada por la Asociación Latinoamericana de Tórax (ALAT).
En Chile existe el programa GES (Garantías Explícitas de Salud), cuya definición de EPOC se basa en los diagnósticos de CIE-10. Si bien las guías GES se basan en GOLD, solo parte de estas, la epidemiología, han sido actualizadas al 2020. Las recomendaciones se basan principalmente en la capacidad del sistema público de salud de entregar los fármacos, la rehabilitación y los controles necesarios para el paciente con EPOC.
En México se utiliza también la Guía Mexicana de EPOC (GMEPOC 2022).
La EPOC es una enfermedad pulmonar heterogénea que se caracteriza por la presencia de síntomas respiratorios crónicos (disnea, tos, expectoración) secundarios a alteraciones de las vías respiratorias (bronquitis y bronquiolitis) y/o de los alvéolos (enfisema) que provocan obstrucción al flujo aéreo persistente y a menudo progresiva. Se debe a la exposición a polvos o gases dañinos, sobre todo (hasta el 80 % de los casos) al humo de tabaco. Otros factores de riesgo importantes son la exposición a humos, polvos y vapores en el ámbito laboral y la contaminación del aire de interiores mal ventilados, como resultado de la combustión de biomasa. Un factor de riesgo poco frecuente (<1 %) es el déficit de la α1-antitripsina determinado genéticamente. En algunos enfermos se debe a una función pulmonar máxima demasiado baja en la edad joven. El daño pulmonar se debe a una inflamación crónica de las vías respiratorias, parénquima pulmonar y vasos pulmonares, a la proteólisis (efecto del desequilibrio entre la actividad de las proteasas y antiproteasas) y al estrés oxidativo. Los cambios fisiopatológicos se presentan generalmente siguiendo la secuencia:
1) hiperproducción del moco y alteración de la depuración mucociliar: ambos mecanismos contribuyen a los síntomas característicos de la bronquitis crónica; no se presenta en todos los enfermos con EPOC y no tiene que asociarse a la limitación del flujo de aire a través de los pulmones
2) limitación al flujo aéreo en las vías respiratorias a consecuencia de la obstrucción de los bronquios de menor calibre y bronquiolos, y del aumento de la distensibilidad pulmonar; la obstrucción de las vías respiratorias también se debe a una contracción de los músculos lisos bronquiales y a la obstrucción de la luz bronquial por las células inflamatorias, moco y exudado
3) hiperinsuflación pulmonar (por el aumento de la frecuencia respiratoria y la disminución del tiempo de espiración), que aumenta el trabajo respiratorio y empeora la capacidad de esfuerzo, y enfisema, es decir, aumento de los espacios aéreos situados distalmente al bronquiolo terminal, con la destrucción de las paredes de los alvéolos pulmonares, lo que disminuye la elasticidad de los pulmones e implica la necesidad de utilizar los músculos espiratorios
4) alteraciones del intercambio gaseoso
5) desarrollo de hipertensión pulmonar (a consecuencia de la constricción vascular debida a la hipoxemia, de los cambios estructurales en las paredes de arterias pulmonares de pequeño calibre y de la pérdida de capilares pulmonares [a consecuencia del enfisema]) y de cor pulmonale.
La heterogeneidad de la ventilación y de la perfusión (alvéolos perfundidos y no ventilados que forman un cortocircuito venoso no anatómico) origina una alteración de la relación entre la ventilación y la perfusión pulmonar, lo que produce hipoxemia y, a consecuencia de la hipoventilación alveolar, hipercapnia (insuficiencia respiratoria global). El proceso inflamatorio crónico, la hipoxemia y la limitación de la actividad física y los efectos adversos de los fármacos provocan efectos sistémicos, como caquexia, atrofia y alteraciones de la función de los músculos esqueléticos, pérdida de la masa ósea, anemia y trastornos funcionales del SNC. Las enfermedades concomitantes (p. ej. bronquiectasias, hipertensión arterial, cardiopatía isquémica, arritmias, ACV, diabetes y síndrome metabólico, anemia normocítica y trastornos ansioso-depresivos) influyen en el estado clínico del paciente y empeoran el pronóstico. El riesgo de padecer cáncer de pulmón es elevado. Las principales causas de las exacerbaciones de la EPOC son: infecciones respiratorias (generalmente virales o bacterianas), aumento de la contaminación del aire (p. ej. material particulado, dióxido de nitrógeno, dióxido de azufre), interrupción del tratamiento crónico.
CUADRO CLÍNCO E HISTORIA NATURALArriba
La EPOC es una enfermedad progresiva, especialmente cuando persiste la exposición a los factores nocivos para los pulmones (sobre todo el humo de tabaco) y puede tener un curso variable. La mayoría de los enfermos admite en la anamnesis hábito tabáquico de muchos años de duración. El abandono del hábito tabáquico en cualquier etapa del desarrollo de la EPOC disminuye la progresión de la pérdida de función pulmonar. Un porcentaje significativo de personas con EPOC diagnosticada mediante un criterio espirométrico no presenta síntomas clínicos.
1. Síntomas: tos crónica, que se presenta de forma episódica o a diario, a menudo durante todo el día, raramente solo por la noche; expectoración crónica de esputo, que es más abundante al levantarse por la mañana; disnea que generalmente es diaria y al principio asociada al esfuerzo, aumentando con el paso de tiempo hasta hacerse de reposo. Al contrario del asma, estos síntomas tienen poca variabilidad durante el día y de un día a otro. Los enfermos con EPOC grave pueden quejarse de fatiga con poco esfuerzo, pérdida de apetito, adelgazamiento, empeoramiento del ánimo y de otros síntomas de depresión o ansiedad.
2. Signos: dependen de la etapa de la enfermedad (pueden no presentarse en la fase temprana de la EPOC, sobre todo durante la respiración normal) y de otro, si predomina la bronquitis (sibilancias, roncus) o el enfisema (en el enfisema avanzado: tórax en posición inspiratoria [a veces tórax en forma de tonel], movilidad respiratoria del diafragma disminuida, percusión hipersonora, murmullo pulmonar disminuido, espiración prolongada, sobre todo forzada). En la EPOC grave es visible el uso de los músculos respiratorios accesorios, tiraje intercostal durante la inspiración, espiración con “labios fruncidos” y a veces cianosis central. En el caso de cor pulmonale establecido: signos de insuficiencia cardíaca derecha crónica →Insuficiencia cardíaca crónica, con el tiempo caquexia, alteración de la actividad de los músculos esqueléticos, depresión.
3. Exacerbaciones: empeoramiento agudo de los síntomas respiratorios con mayor variabilidad de un día a otro respecto a la situación normal, lo que condiciona el cambio de tratamiento. Normalmente duran 7-10 días, aunque la intensificación de los síntomas puede prolongarse considerablemente (transcurridas 8 semanas, hasta el 20 % de los enfermos se siente peor que antes de la exacerbación). Influyen de manera negativa en el desarrollo de la EPOC.
DIAGNÓSTICOArriba
Exploraciones complementarias
1. Pruebas funcionales:
1) Espirometría: es una prueba necesaria para el diagnóstico de la EPOC y el seguimiento. Para diagnosticar y evaluar la gravedad de obstrucción se utiliza solamente el estudio realizado tras la administración de un broncodilatador inhalado (normalmente 400 µg de salbutamol). El diagnóstico se basa en la evaluación de la relación VEF1/CVF →Criterios diagnósticos, mientras que la VEF1 expresada como porcentaje del valor de referencia permite evaluar la gravedad de obstrucción en la EPOC.
2) Pletismografía (volúmenes pulmonares): aumento del volumen residual, de la capacidad residual funcional, y de la relación entre el volumen residual y la capacidad pulmonar total en caso de hiperinsuflación o enfisema.
3) Prueba de transferencia pulmonar de monóxido de carbono (TLCO) (útil en enfermos con disnea que parece no ser proporcional al grado de obstrucción de las vías respiratoria): disminución de TLCO en el enfisema avanzado.
4) Valoración de la tolerancia al esfuerzo físico, la cual está disminuida en la enfermedad avanzada, y además tiene relación con el estado general de la salud y con el pronóstico:
a) test de la marcha (test de marcha de 6 min o prueba de caminata de carga constante o progresiva) con medición de SpO2
b) prueba de esfuerzo cardiopulmonar utilizando una cinta de correr o un cicloergómetro
c) vigilancia de la actividad con acelerómetros u otros aparatos.
2. Pruebas de imagen. Radiografía de tórax: descenso y aplanamiento de las cúpulas diafragmáticas, aumento del diámetro anteroposterior del tórax, de la transparencia pulmonar y del espacio aéreo retroesternal. En el caso de hipertensión pulmonar se describe la disminución o ausencia de trama vascular en partes periféricas del pulmón, dilatación de las arterias pulmonares y el aumento del ventrículo derecho. La TC de alta resolución es útil en caso de dudas diagnósticas. Permite diagnosticar el tipo de enfisema y determinar la intensidad y la localización de los cambios enfisematosos, el engrosamiento de las paredes bronquiales, así como detectar bronquiectasias asociadas.
3. Pulsioximetría y gasometría arterial: en la insuficiencia respiratoria se observa disminución de la SpO2 y de la SaO2 (<90 %), hipoxemia (PaO2 <60 mm Hg), seguida de hipercapnia (PaCO2 >50 mm Hg) y acidosis respiratoria (pH <7,35). Se deben realizar estas pruebas para evaluar la gravedad de las exacerbaciones de la EPOC, en la insuficiencia respiratoria crónica, y para monitorizar la seguridad del flujo de oxígeno (riesgo de aumento de la hipercapnia).
4. Cultivo del esputo: si es purulento puede revelar los microorganismos responsables de la exacerbación de la EPOC, así como su sensibilidad a los antibióticos.
5. Otros estudios:
1) hemograma de sangre periférica: policitemia (hematocrito a menudo >55 %) en enfermos con hipoxemia, o anemia normocrómica normocítica (anemia de enfermedades crónicas); eosinófilos (proyectan como biomarcadores en la evaluación de la enfermedad)
2) ECG, ecocardiografía: signos de cor pulmonale
3) pruebas dirigidas al diagnóstico del déficit de α1-antitripsina en enfermos de <45 años (sobre todo no fumadores) o con la historia familiar altamente sugestiva.
Criterios diagnósticos
Sospechar la EPOC en cualquier paciente que presente:
1) disnea persistente
2) tos crónica
3) expectoración crónica de esputo, y/o
4) exposición a factores de riesgo de la enfermedad.
Según la guía GOLD el diagnóstico de la EPOC se confirma si el resultado de la espirometría muestra una relación VEF1/CVF <0,7 después de la inhalación del fármaco broncodilatador. Este criterio es ampliamente aceptado, pero se asocia a un riesgo elevado de diagnóstico falso positivo para la obstrucción en personas de edad avanzada, y a un riesgo de resultado falso negativo en los adultos <45 años.
Manejo diagnóstico
En la valoración global de la EPOC que servirá para elegir el tratamiento adecuado, se debe evaluar:
1) el grado de gravedad de la obstrucción en el estudio espirométrico, según el valor de VEF1 (en % del valor de referencia, después de administrar un broncodilatador):
a) ≥80 % — leve (GOLD 1)
b) ≥50 % (<80 %) — moderada (GOLD 2)
c) ≥30 % (<50 %) — grave (GOLD 3)
d) <30 % — muy grave (GOLD 4)
2) el carácter y la intensidad de los síntomas, así como el riesgo de exacerbaciones:
a) la intensidad de los síntomas, que se valorará mediante el test CAT (www.catestonline.org; un resultado ≥10 indica una gran intensidad de los síntomas) o bien con el test CCQ (un resultado >1-1,5 indica una gran intensidad de los síntomas); se puede usar también la escala mMRC (→tabla 1.12-1), pero esta sirve únicamente para valorar la disnea (un resultado ≥2 indica gran intensidad); para evaluar la gravedad de la disnea durante la exacerbación de la EPOC es útil la escala analógica visual VAS (de 1 a 10 [10 significa la mayor gravedad imaginable])
b) el riesgo de exacerbaciones se valora según el número de exacerbaciones moderadas o graves experimentadas en los últimos 12 meses: <2 — riesgo bajo, ≥2 u hospitalización debida a una exacerbación — riesgo alto.
3) la presencia de comorbilidades.
En función de la valoración del agravamiento de los síntomas y el riesgo de exacerbaciones se distinguen 3 grupos de enfermos con EPOC →fig. 3.8-1.
Diagnóstico diferencial
Se enumeran los rasgos diferenciales típicos de los procesos más frecuentes:
1) Asma: frecuentemente se inicia en la infancia. Presenta síntomas de carácter paroxístico y de intensidad variable, que a menudo aparecen por la noche o por la mañana. La limitación del flujo aéreo en las exploraciones funcionales es variable y a menudo reversible. En algunos enfermos la diferenciación entre asma y EPOC puede ser difícil. En algunos pacientes se observan tanto los síntomas de asma como de EPOC y en ese caso se establece el diagnóstico de superposición asma-EPOC →Situaciones especiales y →tabla 3.8-1.
2) Bronquiectasias: abundante expectoración purulenta, estertores pulmonares en la auscultación, dilatación de los bronquios con engrosamiento de sus paredes en la radiografía o en la TC de alta resolución de tórax.
3) Insuficiencia cardíaca izquierda: crepitantes en las bases pulmonares, ensanchamiento de la silueta cardíaca y signos de congestión pulmonar en la radiografía de tórax.
4) Tuberculosis: es infrecuente la disnea, normalmente se identifican lesiones en la radiografía del tórax.
5) Cáncer de pulmón: anamnesis breve, cambio en las características de la tos crónica, pérdida de peso, hemoptisis.
6) Enfermedades menos frecuentes: bronquiolitis obliterante, tumor o cuerpo extraño en las vías respiratorias, hipertensión pulmonar, traqueobroncomalacia; en las personas de raza asiática también la bronquiolitis difusa.
7) Otras causas de tos crónica →Tos. Frecuentemente coexisten enfermedades cardiovasculares. Diagnóstico diferencial de la exacerbación de la EPOC: entre otros, embolismo pulmonar, neumotórax, insuficiencia cardíaca izquierda, exacerbación de las bronquiectasias o del asma, infección de las vías respiratorias bajas.
TratamientoArriba
Tratamiento crónico
Recomendaciones generales
1. Abandono completo del hábito tabáquico, además de evitar el tabaquismo pasivo y la exposición a la contaminación del aire atmosférico y de los espacios interiores. En cada visita se debe recomendar a los enfermos fumadores el abandono del hábito tabáquico y proporcionarles acceso a programas de apoyo o a farmacoterapia →Tabaquismo.
2. Actividad física: recomendada en cada etapa de la EPOC.
3. Rehabilitación: en todos los enfermos (salvo los grupos con baja intensidad de los síntomas y bajo riesgo de exacerbaciones), sobre todo en aquellos en los cuales persiste disnea a pesar del tratamiento óptimo y una limitación de la actividad diaria por disminución de la tolerancia al esfuerzo físico. Los programas más eficaces son programas complejos que incluyen: ejercicios respiratorios, ejercicios que mejoran la condición física general, educación del enfermo y de sus familiares, tratamiento del hábito tabáquico, soporte psíquico, intervenciones psicosociales, consejo y tratamiento nutricional. La duración mínima de un programa de rehabilitación eficaz es de 6 semanas. Cuanto más tiempo dure el programa, mejores serán sus efectos. Tras la finalización del programa, sus efectos desaparecen gradualmente, por lo que se debe alentar a los enfermos que sigan realizando ejercicios y la actividad física. La rehabilitación con equipo de rehabilitación básico no es menos eficaz que los procedimientos realizados con equipo especializado. Ejemplo de programa de ejercicio físico con equipo básico para mejorar la condición general:
1) ejercicios de resistencia (aeróbicos): marcha a distancias progresivamente aumentadas (la distancia inicial debe establecerse según la capacidad observada en el test de la marcha)
2) ejercicios de fuerza: extensión de bandas elásticas y/o ejercicios con pesas, subida al cajón (2-4 series de 8-12 repeticiones).
4. La educación (debe asociarse a métodos de colaboración controlada con el paciente), dependiendo de la gravedad de la EPOC debe abarcar las siguientes cuestiones:
1) en cada enfermo: esencia de la enfermedad, su curso y posibilidades de tratamiento, reducción de la exposición a los factores de riesgo, papel de la actividad física, dieta adecuada, cantidad suficiente de sueño
2) en enfermos con síntomas muy intensificados: métodos del manejo de disnea, métodos de ahorrar energía durante las actividades de cada día, métodos del manejo de estrés
3) en enfermos con alto riesgo de exacerbaciones: evitar los factores que agravan los síntomas, vigilancia de los síntomas y tratamiento en caso de su aparición, significado del plan de acción por escrito
4) en enfermos con síntomas muy intensificados y alto riesgo de exacerbaciones: tratamiento paliativo, temas relacionados con la última etapa de la vida, información que facilite con antelación la toma de decisiones sobre el tratamiento en el estadio avanzado de la enfermedad.
5. Nutrición adecuada: la malnutrición se diagnostica en caso del IMC <21 kg/m2, pérdida de >10 % del peso en los últimos 6 meses o de >5 % en el último mes. El tratamiento alimenticio incluye p. ej. aporte de cantidades suficientes de calorías, p. ej. mediante el consumo de pequeñas y frecuentes raciones de comida durante el día. Si es necesario, la dieta se puede complementar con suplementos alimenticios. Hay que tener en cuenta los factores que puedan dificultar el consumo de alimentos (p. ej. disnea, mal estado de la dentición o problemas con la preparación de las comidas). En enfermos con obesidad aplicar métodos de reducción de peso.
6. Vacunación contra la gripe (todos los enfermos) y vacunación contra infecciones neumocócicas (enfermos de edad ≥65 años [vacunas PCV13 y PPSV23] y en aquellos más jóvenes con enfermedades concomitantes graves, p. ej. una enfermedad cardíaca [vacuna PPSV23]). Puede considerarse la administración de una dosis de refuerzo de la vacuna contra la tosferina (preparado combinado, con los toxoides tetánico y diftérico), herpes zóster y SARS-CoV-2 (según las recomendaciones para la población general).
7. El tratamiento de los enfermos con bronquiectasias coexistentes no se diferencia del llevado a cabo en los demás enfermos con EPOC, pero durante las exacerbaciones pueden requerir antibioticoterapia más intensa y prolongada. Según la necesidad, también pueden requerir rehabilitación y farmacoterapia para facilitar la expectoración de esputo.
8. En los enfermos con EPOC grave en situación de estadio terminal es necesario iniciar cuidados paliativos dirigidos hacia la mejoría de la calidad de vida y de las actividades diarias.
Tratamiento farmacológico
Es fundamental una buena técnica de inhalación de fármacos. A la hora de elegir el tipo de inhalador hay que tener en cuenta la habilidad del enfermo y sus preferencias. Instruir al paciente sobre la técnica adecuada a utilizar con su inhalador, y verificar durante cada consulta si el enfermo emplea el inhalador de manera correcta. Antes de considerar insuficiente el tratamiento actual, siempre se debe evaluar la técnica de inhalación y la adhesión terapéutica (la mayoría de los enfermos no toma sus fármacos de manera totalmente correcta).
La elección inicial de los fármacos depende de la intensidad de los síntomas y del riesgo de exacerbaciones →tabla 3.8-2. En la elección del tratamiento deben tenerse en cuenta también las preferencias del enfermo. El tratamiento posterior debe basarse en una evaluación periódica de los síntomas y del riesgo de exacerbaciones, y en la adherencia a las indicaciones del médico y a la técnica de inhalación. En caso de falta de mejoría primero hay que asegurarse de que el enfermo cumple con las recomendaciones y usa el inhalador de manera correcta. En caso positivo, las modificaciones ulteriores ya no dependen del grupo de la EPOC (A-D), sino de la presencia de síntomas y de exacerbaciones (→tabla 3.8-3 y →tabla 3.8-4). Si el enfermo está sintomático y sufre exacerbaciones, el manejo debe ser igual que en enfermos con exacerbaciones. Si al intensificar el tratamiento, no se reduce la intensidad de los síntomas o la frecuencia de exacerbaciones → considerar la reducción de la intensidad del tratamiento.
1. Fármacos broncodilatadores: básicos en el tratamiento sintomático de la EPOC, reducen la disnea, mejoran la tolerancia al esfuerzo y reducen el riesgo de exacerbaciones. Se utilizan a demanda o de forma regular. La elección del fármaco depende, entre otros, de la reacción individual del enfermo y de la coexistencia de otras enfermedades, sobre todo cardiovasculares (la administración prolongada de LAMA no reduce el riesgo de eventos adversos cardiovasculares graves). El uso de fármacos inhalados de acción prolongada es más eficaz y más cómodo para el enfermo (a excepción de los enfermos con síntomas esporádicos, en el tratamiento crónico no administrar los fármacos de acción corta). El tratamiento combinado con LABA y LAMA es más eficaz que el uso de estos fármacos en monoterapia. En enfermos con obstrucción moderada o grave, en los que en los últimos 12 meses se ha presentado ≥1 exacerbación, los LAMA previenen las siguientes exacerbaciones con mayor eficacia que los LABA. La terapia combinada con LABA + LAMA (en un inhalador) es más eficaz en este contexto que LABA + glucocorticoide inhalado, y la triple terapia (glucocorticoide inhalado + LABA + LAMA) es más eficaz que la terapia con 2 fármacos.
1) Agonistas β2 inhalados:
a) de acción larga (LABA): formoterol y salmeterol (tiempo de acción ~12 h; preparados y dosificación →tabla 3.9-2), indacaterol (150 o 300 μg 1 × d, tiempo de acción 24 h), vilanterol (tiempo de acción ~24 h, disponible en forma de fármaco compuesto con furoato de fluticasona [2 + 92 μg y 22 + 184 µg 1 × d], y en forma de fármaco compuesto con furoato de fluticasona y bromuro de umeclidinio y con umeclidinio [22 + 55 µg 1 × d])
b) de acción corta (SABA): fenoterol y salbutamol, tiempo de acción 4-6 h.
Fármacos y dosificación →tabla 3.9-2.
2) Fármacos anticolinérgicos inhalados:
a) de acción prolongada (LAMA): tiotropio, tiempo de acción ~24 h (DPI 13 µg/inhalación, lo que corresponde a 10 µg/dosis aportada 1 × d; o DPI 18 µg/inhalación, lo que corresponde a 10 µg/dosis aportada 1 × d; o SMI 2,5 µg/dosis medida, 2 inhalaciones 1 × d; o DPI 18 µg/inhalación, lo que corresponde a 10 µg/dosis aportada 1 × d); glicopirronio 44 µg 1 × d, tiempo de acción 24 h; umeclidinio 55 µg 1 × d, tiempo de acción 24 h; bromuro de aclidinio 322 µg 2 × d, tiempo de acción ~12 h, revefenacina 175 µg 1 × d, tiempo de acción 24 h
b) de acción corta (SAMA): ipratropio con tiempo de acción 6-8 h (MDI de 20 µg/dosis: 1-3 dosis 4 × d; solución para nebulización 0,25 mg/ml: 0,4-2 ml 3-4 × d; aerosol para inhalación 20 μg/inhalación); preparados compuestos (SABA + SAMA): fenoterol + ipratropio (MDI 50 + 20 µg/dosis: 1-2 dosis 3-4 × d; solución para nebulización 0,5 + 0,25 mg/ml: 1-2 ml 3-4 × d, a demanda hasta 4 ml); salbutamol + ipratropio (solución para nebulización 2,5 + 0,5 mg/amp.: 1 amp. 3-4 × d, a demanda hasta 2,5 ml); preparados compuestos (LABA + LAMA): indacaterol + glicopirronio 85 + 43 µg 1 × d, vilanterol + umeclidinio 22 + 55 µg 1 × d, olodaterol + tiotropio 2,5 + 2,5 µg 2 inhalaciones 1 × d; preparados compuestos de LAMA + LABA + glucocorticoide inhalado: beclometasona, formoterol y glicopirronio (1 dosis aportada contiene: 87 µg de beclometasona, 5 µg de formoterol y 9 µg de glicopirronio] 2 inhalaciones 2 × d), umeclidinio + vilanterol + furoato de fluticasona: 55 + 22 + 92 µg 1 × d, indacaterol + glicopirronio + mometasona: 150 + 50 + 160 µg 1 × d.
3) Teofilina de acción prolongada. Dosificación: 150-375 mg 2 × d. Fármaco de segunda elección, debido a su menor eficacia en comparación con los fármacos anteriormente mencionados y a los efectos adversos (en dosis ≥10 mg/kg/d): náuseas y vómitos, taquicardia, arritmias, convulsiones. Para prevenir sus efectos adversos hay que monitorizar la concentración de teofilina en plasma manteniendo los valores 5-15 µg/ml. Sin embargo, la cefalea, los trastornos del sueño y las náuseas pueden presentarse también en enfermos con una concentración terapéutica del fármaco. El metabolismo de la teofilina aumenta y por lo tanto hay que aumentar la dosis en caso de: fiebre, embarazo, tabaquismo, rifampicina y fármacos antiepilépticos. Por otra parte, el metabolismo de la teofilina disminuye (hay que disminuir su dosis) en: enfermedades hepáticas, insuficiencia cardíaca, quinolonas, algunos macrólidos y cimetidina.
2. Glucocorticoides inhalados (a dosis moderada o alta →tabla 3.9-2): administrar en enfermos con superposición asma-EPOC y para prevenir exacerbaciones de la EPOC en enfermos con un recuento de eosinófilos en sangre periférica ≥300/µl o ≥100/µl y exacerbaciones. El antecedente de ≥2 exacerbaciones o ≥1 hospitalización debido a la exacerbación en el año anterior aumenta el riesgo de siguientes exacerbaciones y la probabilidad de obtener beneficios con la administración de los glucocorticoides inhalados (la eficacia es menor en fumadores).
Los glucocorticoides inhalados también deben administrarse en enfermos con asma coexistente. Los glucocorticoides aumentan el riesgo de neumonía, especialmente en enfermos ≥55 años, fumadores, con neumonía recurrente, IMC <25 kg/m2 o con disnea grave. Por esta razón, los glucocorticoides inhalados no deben utilizarse en enfermos con neumonía recurrente. Los glucocorticoides inhalados deben utilizarse siempre en combinación con LAMA y/o LABA. El uso de 3 fármacos inhalados (glucocorticoides, LABA, LAMA) mejora la función pulmonar y disminuye los síntomas y la frecuencia de exacerbaciones con mayor eficacia que solo 2 fármacos.
No utilizar corticoterapia sistémica crónica (p. ej. oral), ya que no es eficaz y causa complicaciones graves.
3. Roflumilast: inhibidor de PDE4, se puede considerar añadirlo (250 mg 1 × d durante 28 d, a continuación 500 mg 1 × d) a 1 o 2 broncodilatadores inhalados en enfermos con obstrucción moderada, grave o muy grave con síntomas de bronquitis crónica y exacerbaciones frecuentes a pesar del uso de LABA y glucocorticoides inhalados (grupos C y D). Los efectos adversos (náuseas, pérdida de apetito, pérdida de peso, dolor abdominal, diarrea, trastornos del sueño) son más frecuentes que con los fármacos inhalados. No utilizar roflumilast en enfermos con bajo peso corporal o tratados con teofilina.
4. Otros fármacos:
1) en enfermos jóvenes con déficit de α1-antitripsina confirmado considerar el tratamiento suplementario
2) el uso crónico (1 año) de azitromicina (250 mg 1 × d o 500 mg 3 × semana), o eritromicina (500 mg 2 × d) puede considerarse en enfermos que sufren exacerbaciones a pesar del tratamiento con 3 fármacos inhalados
3) morfina en tratamiento paliativo, para controlar la disnea →tabla 1.12-3
4) fármacos mucolíticos → no utilizarlos de forma rutinaria; en enfermos con EPOC no tratados con glucocorticoides inhalados el uso de altas dosis de N-acetilcisteína (600 mg 2 × d) o de carbocisteína puede reducir la frecuencia de exacerbaciones (sobre todo en exfumadores de tabaco); la erdosteína puede reducir la frecuencia de exacerbaciones leves, independientemente de la administración simultánea de glucocorticoides inhalados
5) los fármacos antitusígenos están contraindicados
6) suplementación con vitamina D en enfermos con deficiencia confirmada (concentración sanguínea <50 nmol/l).
PERSPECTIVA LATINOAMERICANA
Fármacos no disponibles en Argentina: bromuro de aclidinio, bromuro de glicopirronio dipropionato de beclometasona, formoterol y revefenacina.
Fármacos no disponibles en Chile: bromuro de aclidinio, erdosteína y revefenacina.
Tratamiento crónico con oxígeno
Generalmente es necesario en enfermos con:
1) PaO2 ≤55 mm Hg o SpO2 ≤88 %, o
2) PaO2 56-60 mm Hg o SpO2 ~88 %, si se presentan síntomas de hipertensión pulmonar, edemas periféricos que indican la asociación a insuficiencia cardíaca congestiva, o un hematocrito >55 %. El objetivo es mantener la PaO2 ≥60 mm Hg. La decisión sobre el uso de oxigenoterapia crónica domiciliaria (OCD) se debe tomar a base de los valores de PaO2 en el estado de reposo, medidos 2 veces a lo largo de 3 semanas en el enfermo con estado clínico estable. No usar la OCD en enfermos con disnea de esfuerzo que no cumplan los criterios antes mencionados. Después de 2-3 meses evaluar la eficacia de OCD y las indicaciones para su continuación. Reglas de oxigenoterapia →Oxigenoterapia.
Asistencia respiratoria
En los enfermos con obstrucción muy grave e hipercapnia más intensa durante el día a pesar del tratamiento óptimo con fármacos, se debe considerar la asistencia con ventilación no invasiva (VNI) junto con OCD. Los parámetros ventilatorios deben ajustarse para reducir la PaCO2 en ≥20 %. En los enfermos en los que coexiste un síndrome de apnea e hipopnea del sueño, se debe considerar la asistencia de ventilación con presión positiva continua en vías respiratorias (CPAP).
Tratamiento invasivo
1. Resección de las bullas (bulas) enfisematosas (bullectomía [bulectomía]): considerarla cuando la bulla enfisematosa ocupa ≥50 % del volumen del pulmón y claramente comprima el parénquima pulmonar adyacente.
2. Tratamiento de reducción de volumen pulmonar: quirúrgico a considerar en los enfermos con VEF1 >20 % sobre el valor de referencia y cuyo enfisema ocupe sobre todo los lóbulos superiores, o bien con enfisema difuso en enfermos con capacidad física limitada después de la rehabilitación preoperatoria; durante la fibrobroncoscopia con el uso de válvulas o espirales introducidas en los bronquios o por termoablación por vapor (en enfermos adecuadamente seleccionados estos métodos mejoran la capacidad funcional y la función pulmonar, pero tienen un alto riesgo de complicaciones).
3. Trasplante pulmonar. Derivar a un centro especializado en trasplantes en los siguientes casos:
1) progresión de la enfermedad a pesar de la farmacoterapia intensiva, rehabilitación, oxigenoterapia y VNI
2) el enfermo no es apto para someterse a una reducción quirúrgica o endoscópica del volumen pulmonar
3) índice BODE 5-6 con factores de riesgo de muerte, como exacerbaciones frecuentes de EPOC, incremento en el índice BODE en >1 pto. durante 24 meses, relación entre el diámetro de la arteria pulmonar y el diámetro de aorta >1 en la TC, disminución de VEF1 hasta 20-25 % del valor de referencia
4) el paciente no acepta la mala calidad de vida.
Los criterios de aptitud para el trasplante son el índice BODE 7-10 y ≥1 de los siguientes:
1) VEF1 ≤15-20 % del valor de referencia
2) hipertensión pulmonar moderada o grave
3) exacerbación grave de la enfermedad
4) hipercapnia crónica.
Tratamiento de las exacerbaciones
La anamnesis con el objetivo de evaluar las exacerbaciones de la EPOC debe incluir: la duración de los síntomas, el grado de disfunción pulmonar (basado en los resultados de la prueba de espirometría previa; no recomendar esta prueba durante las exacerbaciones), la información sobre exacerbaciones pasadas, las enfermedades concomitantes, el tratamiento habitualmente utilizado y eventualmente sus modificaciones recientes.
Clasificación de las exacerbaciones en función del tratamiento necesario:
1) leves: basta con utilizar broncodilatadores de acción corta
2) moderadas: es necesario utilizar también un antibiótico y/o glucocorticoide VO
3) graves: es necesaria la hospitalización del enfermo o una visita a una unidad de emergencia.
Clasificación de Anthonisen. Según la presencia de 3 criterios: exacerbación de disnea, aumento del volumen de esputo y cambio de su carácter a purulento.
Tipo I: se cumplen todos los criterios.
Tipo II: se cumplen 2 de los 3 criterios.
Tipo III: se cumple solo 1 criterio; adicionalmente ≥1 de los siguientes: infección del aparato respiratorio en los últimos 5 días, fiebre de origen desconocido, exacerbación de sibilancias o de tos, aumento de la frecuencia respiratoria o del pulso en ≥20 %.
Clasificación de las exacerbaciones en enfermos hospitalizados:
1) sin insuficiencia respiratoria: frecuencia respiratoria 20-30/min, sin uso de los músculos respiratorios accesorios, sin alteraciones de la conciencia, con resolución de la hipoxemia tras administrar oxígeno (28-35 %), sin aumento de PaCO2
2) con insuficiencia respiratoria aguda sin compromiso vital: frecuencia respiratoria >30/min, con uso de los músculos respiratorios accesorios, sin alteraciones de la conciencia, con resolución de hipoxemia tras administrar oxígeno (25-30 %) con mascarilla de Venturi, PaCO2 elevada en comparación con el valor inicial o >50 mm Hg
3) con insuficiencia respiratoria aguda potencialmente mortal: frecuencia respiratoria >30/min, con uso de músculos respiratorios accesorios, con alteraciones de la conciencia, sin resolución de hipoxemia tras administrar oxígeno con mascarilla de Venturi o se requiere una FiO2 >40 %, PaCO2 elevada en comparación con el valor inicial o >60 mm Hg, o acidosis (pH <7,35).
Lugar de tratamiento
1. Indicaciones para la valoración o para el tratamiento del enfermo en el hospital: obstrucción grave en la fase estable de la enfermedad o antecedentes de exacerbaciones frecuentes (independientemente de la gravedad de la presente exacerbación), aumento significativo de la gravedad de síntomas (p. ej. disnea de reposo de aparición súbita), síntomas de rápida evolución (p. ej. cianosis, edemas periféricos), falta de mejoría después del tratamiento inicial de una exacerbación moderadamente grave, enfermedades concomitantes graves (p. ej. insuficiencia cardíaca o aparición de arritmias), dudas diagnósticas, enfermo de edad avanzada, cuidado domiciliario insuficiente. En los demás casos el tratamiento puede realizarse en el domicilio.
2. Indicaciones para la admisión del enfermo en la UCI (las primeras 5 situaciones son en general también indicaciones para la intubación endotraqueal y la ventilación mecánica):
1) paro respiratorio o respiración irregular
2) disnea grave (sobre todo ante la utilización de la musculatura respiratoria accesoria y presencia de movimientos respiratorios paradójicos de la pared abdominal, o taquipnea >35/min) que no responde adecuadamente al tratamiento inicial de emergencia, así como ventilación mecánica no invasiva
3) alteraciones de la conciencia (confusión, somnolencia, coma, agitación)
4) hipoxemia sostenida o que empeora (PaO2 <40 mm Hg), hipercapnia grave o que aumenta (PaCO2 >60 mm Hg) o acidosis respiratoria grave o que empeora (pH <7,35) a pesar de oxigenoterapia y de ventilación mecánica no invasiva
5) imposibilidad de utilizar o intolerancia a la ventilación mecánica no invasiva
6) inestabilidad hemodinámica (definida por la necesidad de administrar fármacos vasoconstrictores y bradicardia <50/min con alteraciones de conciencia)
7) otras complicaciones graves (trastornos metabólicos, sepsis, neumonía grave, tromboembolismo pulmonar de alto riesgo, barotrauma pulmonar, neumotórax, derrame pleural masivo, aspiración masiva)
8) control insuficiente y falta de experiencia en los cuidados del enfermo que requiere ventilación mecánica no invasiva fuera de la UCI.
Valoración del enfermo
Tratados en el hospital: gasometría arterial, hemograma, concentración de la proteína C-reactiva y de electrólitos, parámetros de función renal y hepática, ECG, radiografía de tórax. El cultivo del esputo (o del aspirado traqueal en enfermos intubados) se realiza cuando:
1) la exacerbación es de etiología infecciosa y no responde al tratamiento antibiótico inicial
2) la exacerbación es grave o están presentes factores de riesgo que favorecen la ineficacia de la terapia empírica (tratamiento previo con antibióticos o un glucocorticoide oral, >4 exacerbaciones en un año, VEF1 <30 % del valor de referencia, exacerbación prolongada).
No se debe realizar espirometría en casos de exacerbación de EPOC. En enfermos que van a ser tratados en domicilio generalmente es suficiente la determinación de SpO2 con pulsioxímetro.
Tratamiento farmacológico
1. Agonista β2 de acción corta (→más arriba), hasta 8 dosis del inhalador con cámara espaciadora cada 1-2 h o en nebulización (p. ej. salbutamol 2,5-5,0 mg cada 4-6 h). Las dosis y la frecuencia de administración de los fármacos dependen de la respuesta del enfermo al tratamiento. Además, se puede utilizar el bromuro de ipratropio (2-8 dosis del inhalador con cámara espaciadora o 0,25-0,5 mg en nebulización, 4 × d). Se puede administrar el agonista β2 y el fármaco anticolinérgico en forma del preparado combinado (fenoterol + bromuro de ipratropio) hasta 8 dosis del inhalador con cámara espaciadora o 1-2,5 ml (20-50 gotas) en nebulización 4 × d. No utilizar teofilina (baja eficacia, riesgo mayor de efectos adversos).
2. Glucocorticoides: prednisona 40 mg/ d VO (si el enfermo puede tomar fármacos VO → hidrocortisona 100 mg cada 6-8 h o metilprednisolona 40 mg/d) durante 5 días. Alternativa: budesonida 2 mg 4 × d en nebulización.
3. Antibióticos: generalmente se administran durante 5-10 días. Están indicados en caso de sospecha de infección bacteriana, es decir, cuando se observa un carácter más purulento de expectoración y/o un aumento de la disnea, esputo purulento y en los enfermos tratados con ventilación mecánica (invasiva o no invasiva). La decisión sobre la antibioticoterapia es más fácil si se determina la procalcitonina (→tabla 3.13-1; probablemente es seguro no emplear antibiótico en los enfermos tratados ambulatoriamente con concentración de procalcitonina <0,25 ng/l; se debe repetir la determinación después de 6-24 h; este parámetro no puede utilizarse sin tener en cuenta los datos clínicos) o la proteína C-reactiva (considerar no emplear el antibiótico en enfermos tratados ambulatoriamente con concentración de proteína C-reactiva <20 mg/l). Los agentes etiológicos más frecuentes son: Haemophilus influenzae, Streptococcus pneumoniae y Moraxella catarrhalis.
Si la probabilidad de la infección por Pseudomonas aeruginosa es baja:
1) en los enfermos sin factores de riesgo de evolución desfavorable de la agudización (EPOC grave, enfermedades concomitantes graves, agudizaciones frecuentes [>3 × año], uso de fármacos antimicrobianos en los últimos 3 meses) → amoxicilina (antibiótico de elección)
2) en el resto de los enfermos → amoxicilina con ácido clavulánico (2,0 g/d)
3) en alérgicos a penicilinas → macrólidos
4) antibióticos de segunda elección → fluoroquinolona "respiratoria" (levofloxacina, moxifloxacina o cefalosporina de II o III generación).
Si la infección por P. aeruginosa es probable (hospitalización reciente, uso frecuente de antibioticoterapia [≥4 × año], exacerbación grave, P. aeruginosa en cultivo realizado durante la exacerbación anterior o diagnóstico de colonización durante el período estable de la enfermedad):
1) cuando es posible el tratamiento oral → ciprofloxacina VO
2) si es necesario el tratamiento parenteral → ciprofloxacina o antibiótico β-lactámico activo contra P. aeruginosa (p. ej. ceftazidima, cefepima).
Tratamiento de neumonía →Neumonía adquirida en la comunidad.
Oxigenoterapia e intervenciones adicionales
1. Los enfermos con insuficiencia respiratoria hipoxémica deben recibir oxígeno →fig. 3.8-2. En pacientes con insuficiencia respiratoria hipoxémica considerar la oxigenoterapia de alto flujo (→Oxigenoterapia). Si a pesar del tratamiento óptimo y de la oxigenoterapia se desarrolla acidosis (pH ≤7,35) y/o hipercapnia (PaCO2 >45 mm Hg) o persiste la disnea (sobre todo grave, caracterizada por un aumento de trabajo de los músculos respiratorios accesorios y con movimientos respiratorios paradójicos de la pared abdominal o taquipnea >23/min) → utilizar la ventilación mecánica, si anteriormente no se hubiese tomado la decisión de emplearla por estar en la fase terminal de la enfermedad. Si es posible, utilizar la asistencia de ventilación no invasiva, en caso contrario intubar al enfermo y conectarlo al respirador.
2. Intervenciones adicionales en enfermos tratados en el hospital:
1) mantener una hidratación adecuada (bajo control estricto del balance hídrico)
2) nutrición adecuada (sustitutiva, si la disnea intensa no permite comer)
3) profilaxis antitrombótica →Profilaxis primaria de la ETV
4) intervenciones que ayudan a eliminar secreciones de las vías respiratorias (a través de la provocación de la tos y a través de espiraciones forzadas a volumen bajo). En enfermos que expectoran grandes cantidades del esputo, o con atelectasia lobar, pueden ser beneficiosos la percusión torácica manual o mecánica y el drenaje postural →Drenaje postural de los bronquios. En caso de atelectasia → fibrobroncoscopia terapéutica.
Condiciones de alta hospitalaria
1) El enfermo (o su cuidador) entiende plenamente cómo utilizar de manera adecuada los fármacos prescritos y sabe hacerlo.
2) El enfermo no requiere inhalaciones de agonista β2 de acción corta con una frecuencia mayor de cada 4 h.
3) El enfermo que caminaba antes de la admisión al hospital consigue caminar por la habitación.
4) El enfermo es capaz de comer sin ayuda y duerme sin despertares frecuentes por disnea.
5) El estado clínico (incluyendo los resultados de la gasometría) es estable durante 12-24 h.
6) Se han planeado visitas de control y se ha facilitado el cuidado domiciliario (p. ej. visitas del enfermero, suministro de oxígeno, preparación de comidas, etc.).
7) El enfermo, así como su familia y su médico, está convencido de que es capaz de estar solo en su casa.
Valoración del control tras el alta hospitalaria (<4 semanas después del alta)
1) Evaluación de la intensidad de los síntomas (puede servir también el test CAT o la escala mMRC).
2) Valoración de la habilidad del enfermo para manejarse en su entorno, realizar esfuerzo físico y actividades diarias.
3) Valoración de la técnica de inhalación de fármaco.
4) Comprobación de que el enfermo entiende bien el tratamiento recomendado.
5) Valoración de la necesidad de tratamiento crónico con oxígeno en domicilio.
6) Valoración de las enfermedades concomitantes y de su tratamiento.
La espirometría debe realizarse durante la visita de control después de >3 meses.
En los enfermos con hipoxemia durante la exacerbación se debe realizar una gasometría arterial y/o pulsioximetría antes del alta hospitalaria y después de 3 meses.
VIGILANCIAArriba
En cada visita:
1) preguntar sobre cambios en los síntomas desde la última visita (eventualmente utilizar la escala de gravedad de los síntomas) y sobre los síntomas de las eventuales enfermedades concomitantes
2) realizar una exploración física
3) establecer si el paciente fuma; si fuma → recomendar decididamente el abandono del hábito tabáquico y proporcionar el apoyo necesario
4) evaluar el tratamiento actual, la adhesión terapéutica, la técnica de inhalación, la eficacia del tratamiento usado para controlar los síntomas, así como los efectos adversos
5) evaluar la actividad física, y periódicamente también las indicaciones de rehabilitación
6) evaluar las exacerbaciones (su frecuencia, gravedad y posibles causas).
En caso de necesidad evaluar la pertinencia de oxigenoterapia, VNI, así como de tratamiento intervencionista y paliativo. Repetir la espirometría ≥1 × año.
Evaluar la inclusión del enfermo al programa de tamizaje con TC a dosis bajas, con el fin de detectar cáncer de pulmón en estadios tempranos.
ComplicacionesArriba
Hipertensión pulmonar e insuficiencia cardíaca derecha, policitemia secundaria, anemia de enfermedades crónicas, caquexia, ETV, depresión y trastornos de ansiedad, complicaciones de la insuficiencia respiratoria crónica →Insuficiencia respiratoria crónica.
SITUACIONES ESPECIALESArriba
Coexistencia de asma y EPOC
En algunos enfermos, sobre todo de edad avanzada, la diferenciación entre el asma y EPOC es difícil (→tabla 3.8-1). Hay un porcentaje de enfermos en los que las dos enfermedades coexisten. El diagnóstico del solapamiento de asma-EPOC (asthma-COPD overlap, ACO [antes "síndrome de superposición asma-EPOC", asthma-COPD overlap syndrome, ACOS]) requiere la confirmación de la presencia de síntomas de asma y de la obstrucción bronquial persistente (VEF1/CVF <0,7 después de la inhalación del broncodilatador). El resultado de la prueba broncodilatadora muchas veces es positivo. Los enfermos con ACO se caracterizan por tener una calidad de vida más baja y exacerbaciones frecuentes. Además de los broncodilatadores, en el tratamiento deben utilizarse los glucocorticoides inhalados a dosis bajas o intermedias.
Intervenciones quirúrgicas
La EPOC aumenta el riesgo de complicaciones perioperatorias. Es posible disminuirlo a través de la optimización de la función pulmonar antes de la cirugía, a través de la movilización temprana del enfermo después de la cirugía, mediante el empleo de ejercicios respiratorios y del tratamiento eficaz de dolor. Las pruebas pulmonares funcionales (valoración del VEF1, TLCO, VO2max) se requieren solamente antes de las intervenciones torácicas y cardíacas, pero en casos más graves de la EPOC también se indican antes de otras cirugías.
Viajes en avión
Los enfermos con VEF1 <30 % del valor de referencia o que requieren OCD deben consultar con el neumólogo antes del viaje. Los enfermos que utilizan OCD deben mantener durante el vuelo la SpO2 >85 % utilizando aporte de oxígeno por bigoteras nasales (2-4 l/min). La mayoría de las compañías aéreas proporciona el suministro de oxígeno a petición del pasajero, pero hay que informar sobre este tipo de necesidad con antelación.
COVID-19
Las pruebas diagnósticas de COVID-19 deben realizarse en todos los enfermos con EPOC que presenten síntomas sugerentes de la infección por SARS-CoV-2. La infección confirmada por SARS-CoV-2 no descarta la posibilidad de coexistencia de una infección por otro patógeno. La radiografía y la TC de tórax son útiles para evaluar las lesiones pulmonares en el curso de COVID-19 y diferenciarla de otras enfermedades. Los pacientes con COVID-19 deben continuar el tratamiento crónico de la EPOC. En los enfermos con una infección por SARS-CoV-2 confirmada se debe evitar, dentro de lo posible, el uso de fármacos en nebulización. En el período de transmisión elevada de SARS-CoV-2 en la población local, la espirometría debe realizarse solo en casos necesarios. Las exacerbaciones de la EPOC en los pacientes infectados por SARS-CoV-2 se tratan de manera típica.
PRONÓSTICOArriba
El pronóstico puede mejorar sobre todo con el abandono del hábito tabáquico. Las exacerbaciones de la EPOC aumentan el riesgo de muerte. Las causas principales de muerte son las enfermedades cardiovasculares, cáncer de pulmón e insuficiencia respiratoria.
PREVENCIÓNArriba
La manera más eficaz de prevenir la EPOC y la progresión de la enfermedad es no fumar tabaco. Es importante también evitar la exposición a la contaminación ambiental y a otros factores de riesgo.
TABLAS Y FIGURAS
Escala de disnea mMRC (modified Medical Research Council)
|
0
|
La disnea se produce solo con un gran esfuerzo físico
|
|
1
|
La disnea se produce al andar deprisa en llano o al subir una pendiente poco pronunciada
|
|
2
|
La disnea imposibilita mantener el paso de otras personas de la misma edad caminando en llano, u obliga a detenerse o descansar al andar en llano al propio paso
|
|
3
|
Tiene que detenerse a descansar al andar ~100 m o a los pocos minutos de andar en llano
|
|
4
|
La disnea impide al enfermo salir de casa o aparece con actividades tales como vestirse o desvestirse
|
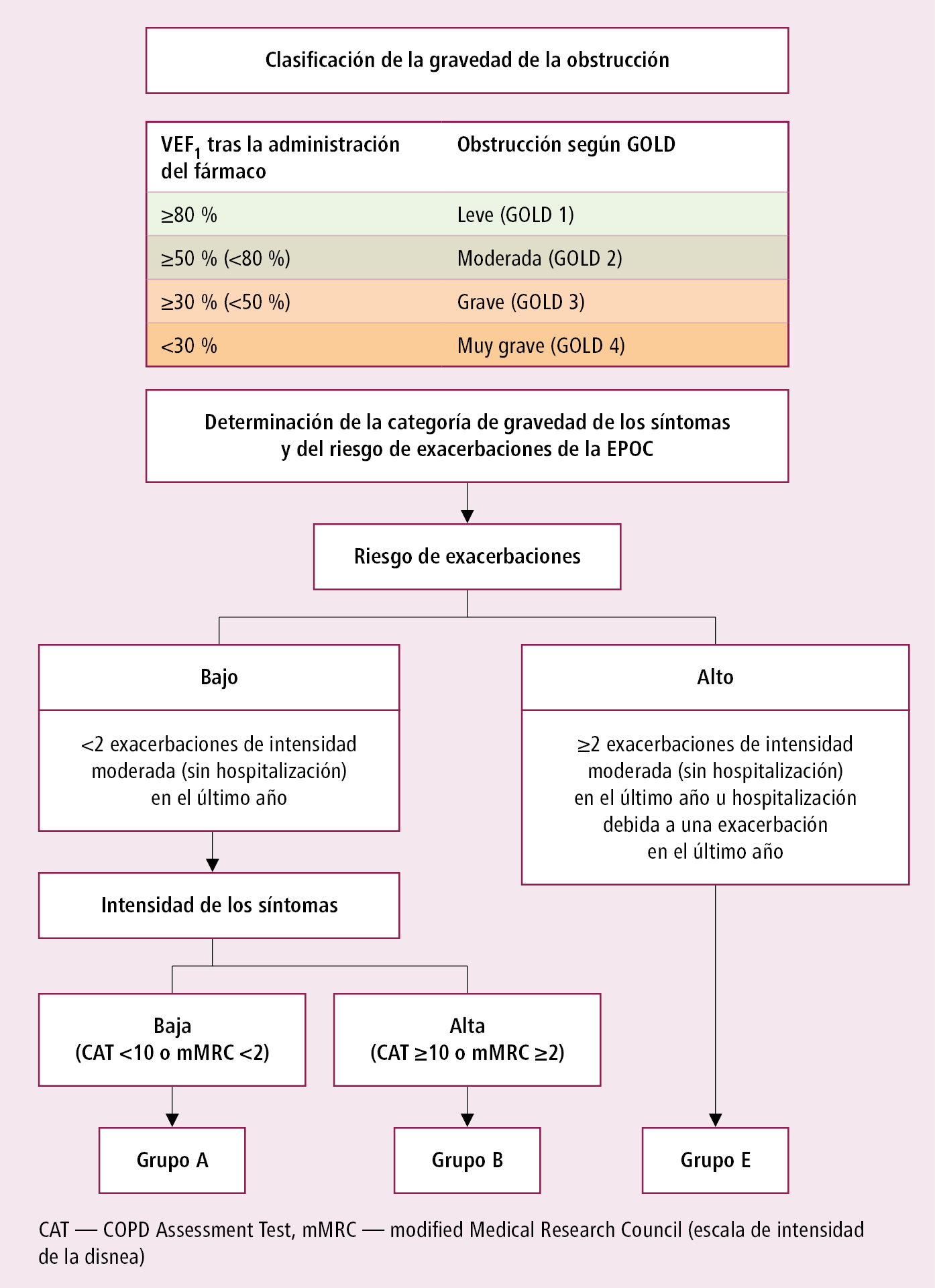
Fig. 3.8-1. Clasificación de los casos de EPOC según la GOLD
Características del asma, EPOC y ACO
|
Característica
|
Asma
|
EPOC
|
ACO
|
Características que sugieren
|
|
asma
|
EPOC
|
|
Inicio de los síntomas
|
Habitualmente en la infancia. Sin embargo, la enfermedad puede aparecer a cualquier edad
|
Habitualmente >40 años
|
Habitualmente a una edad ≥40 años. Sin embargo, los síntomas pueden aparecer en la infancia o juventud
|
Inicio a <20 años
|
Inicio a >40 años
|
|
Características de los síntomas
|
La intensidad de los síntomas puede cambiar en un día o durante un tiempo más largo. Los síntomas frecuentemente limitan la actividad, a menudo están provocados por el esfuerzo físico, emociones (incluso la risa), exposición a partículas o a alérgenos
|
Síntomas crónicos, habitualmente los que se mantienen constantemente, intensificados por el esfuerzo físico. La intensidad de los síntomas puede variar (días "mejores" y "peores")
|
Los síntomas respiratorios (incluida la disnea de esfuerzo) se mantienen constantemente, pero su intensidad puede variar
|
– La intensidad de los síntomas puede variar en unos minutos, horas o días
– Los síntomas se intensifican durante la noche o por la mañana
– Los síntomas están causados por el esfuerzo físico, emociones (incluso la risa), exposición a polvos o a alérgenos
|
– Los síntomas persisten a pesar del tratamiento
– Días "buenos" y "malos", sin embargo, los síntomas persisten cada día y la disnea de esfuerzo se mantiene
– La tos crónica y la expectoración preceden la disnea, los síntomas no dependen de los factores desencadenantes
|
|
Función pulmonar
|
Actualmente y/o en la anamnesis, el enfermo presenta un grado variable de la limitación del flujo aéreo, es decir se da la reversibilidad con broncodilatador, hiperreactividad bronquial
|
El VEF1 puede mejorar con el tratamiento; sin embargo, el valor VEF1/CVF después de la inhalación del fármaco broncodilatador es <0,7
|
Una limitación no totalmente reversible del flujo aéreo por las vías respiratorias, pero a menudo con una intensidad variable de la obstrucción (actualmente o en la anamnesis)
|
Documentado el grado variable de limitación del flujo aéreo por las vías respiratorias (espirometría, cúspide del flujo espiratorio máximo)
|
Documentada la limitación permanente del flujo aéreo (VEF1/CVF posterior a la inhalación de un fármaco broncodilatador <0,7)
|
|
Función pulmonar en el período asintomático
|
Puede ser normal
|
Limitación permanente del flujo aéreo por las vías respiratorias
|
Limitación permanente del flujo aéreo en las vías respiratorias
|
– Función pulmonar normal entre los períodos sintomáticos
– Diagnóstico anterior de asma
|
La función pulmonar en el período asintomático es anormal
|
|
Anamnesis personal y familiar
|
En muchos enfermos se diagnostican alergias y antecedentes de asma en la infancia o en la anamnesis familiar
|
Exposición nociva a partículas y gases (sobre todo hábito tabáquico y uso de combustibles orgánicos)
|
De forma habitual en la anamnesis asma diagnosticada por un médico (actualmente o en el pasado), alergias y asma en la anamnesis familiar y/o exposición a sustancias nocivas
|
– Asma y otras enfermedades alérgicas en la anamnesis familiar
|
– Diagnóstico anterior de EPOC, bronquitis crónica o enfisema
– Exposición importante a los factores de riesgo: hábito tabáquico o uso de combustibles orgánicos
|
|
Curso de la enfermedad
|
Frecuentemente se produce una mejoría espontánea o como resultado del tratamiento. Sin embargo, la enfermedad puede llevar a una obstrucción bronquial permanente
|
Habitualmente la enfermedad progresa lentamente durante años, a pesar del tratamiento
|
El tratamiento puede reducir la intensidad de los síntomas de forma parcial, pero significativa. La enfermedad habitualmente progresa y es necesario un tratamiento más intenso
|
– Los síntomas no empeoran a lo largo del tiempo; la intensidad de los síntomas cambia según la temporada o en los años siguientes
– Puede mejorar espontáneamente o con la administración del broncodilatador (desde el principio) o un glucocorticoide inhalado (en unas semanas)
|
– Los síntomas se intensifican lentamente con el tiempo (la enfermedad progresa durante años)
– La administración de un fármaco broncodilatador de acción rápida solo aporta una mejoría parcial
|
|
Radiografía de tórax
|
En general normal
|
Enfisema pulmonar excesivo y exacerbado y otros cambios típicos de la EPOC
|
De manera similar a la EPOC
|
Normal
|
Hiperinsuflación pulmonar de grado avanzado
|
|
Exacerbaciones
|
Ocurren exacerbaciones, pero su riesgo puede disminuir significativamente con el tratamiento
|
El tratamiento puede reducir la frecuencia de exacerbaciones. Las enfermedades concomitantes pueden empeorar el estado del enfermo
|
Las exacerbaciones pueden ocurrir más frecuentemente que en la EPOC. Sin embargo, el tratamiento reduce su frecuencia. Las enfermedades concomitantes empeoran el estado del enfermo
|
Diagnóstico de las enfermedades respiratorias sobre la base de los síntomas. Cómo utilizar la tabla. En las columnas sombreadas se mencionan las características que permiten diferenciar el asma de la EPOC. En todos los enfermos es necesario calcular los puntos en cada una de las columnas. Si se cumplen ≥3 criterios, es más probable el diagnóstico de asma o de EPOC. Si se marca un número de puntos similar en ambas columnas, se debe considerar el diagnóstico de ACO.
|
|
Rasgos típicos de la inflamación de las vías respiratorias
|
Eosinófilos y/o neutrófilos
|
Neutrófilos en el esputo, linfocitos en las vías respiratorias, puede desarrollarse una inflamación sistémica
|
Eosinófilos y/o neutrófilos en el esputo
|
|
ACO — superposición asma-EPOC, EPOC — enfermedad pulmonar obstructiva crónica
Traducido con el acuerdo de: Global Strategy for the Diagnosis, Management and Prevention of COPD, © Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2016. Todos los derechos reservados. Disponible en: http://www.goldcopd.org (como se retiró el término “síndrome de superposición asma-EPOC” [ACOS], la tabla fue modificada y se introdujo el término “superposición asma-EPOC” [ACO]).
|
Tratamiento farmacológico inicial en función de la intensidad de los síntomas y del riesgo de exacerbaciones de la EPOC
|
Grupo de enfermos
|
Tratamiento
|
Observaciones
|
|
A
(baja intensidad de los síntomas y bajo riesgo de exacerbaciones)
|
Fármaco broncodilatador
|
Se prefieren fármacos de acción larga (excepto en enfermos con disnea esporádica); el tratamiento debe continuarse solo si causa mejoría
|
|
B
(gran intensidad de los síntomas y bajo riesgo de exacerbaciones)
|
LABA + LAMA
|
El uso de ambos fármacos en un solo inhalador es probablemente más eficaz y cómodo para el enfermo
|
|
E
(alto riesgo de exacerbaciones)
|
LABA + LAMA
|
En enfermos con eosinofilia ≥300/µl se debe considerar el uso de LABA + LAMA + glucocorticoide inhalado; el uso de los tres fármacos en un solo inhalador es probablemente más eficaz y cómodo para el enfermo
|
|
LABA — agonista β2 de acción prolongada, LAMA — anticolinérgico de acción prolongada
|
Manejo de los enfermos con EPOC y disnea que persiste a pesar del tratamiento
|
Tratamiento actual
|
Manejo recomendado
|
|
LABA o LAMA
|
LABA + LAMA
|
|
LABA + LAMA
|
– Considerar el cambio del tipo de inhalador o del fármaco utilizado
– Buscar otras causas de disnea y tratarlas
– Utilizar o intensificar el tratamiento no farmacológico
|
|
LABA — agonista β2 de acción prolongada, LAMA — anticolinérgico de acción prolongada
|
Manejo de los enfermos con EPOC y exacerbaciones a pesar del tratamiento
|
Tratamiento actual
|
Manejo recomendado
|
|
LABA o LAMA
|
– Recuento de eosinófilos <300/µl → LABA + LAMA
– Recuento de eosinófilos ≥300/µl → LABA + LAMA + glucocorticoide inhalado
|
|
LABA + LAMA
|
– Recuento de eosinófilos ≥100/µl → LABA + LAMA + glucocorticoide inhalado
– Recuento de eosinófilos <100/µl → roflumilast (en enfermos con VEF1 <50 % y tos crónica con expectoración) o azitromicina (en exfumadores)
|
|
LABA + LAMA + glucocorticoide inhalado
|
– Roflumilast (en enfermos con VEF1 <50 % y tos crónica con expectoración) o azitromicina (en exfumadores)
– LABA + LAMA (considerar en caso de neumonía u otros efectos adversos importantes del uso de glucocorticoides inhalados; en pacientes con eosinofilia ≥300/µl existe un mayor riesgo de exacerbaciones tras la discontinuación de glucocorticoides inhalados)
|
|
LABA — agonista β2 de acción prolongada, LAMA — anticolinérgico de acción prolongada, VEF1 — volumen espiratorio forzado en el primer segundo
|
Fármacos inhalados utilizados en el tratamiento del asma en adultos
|
Fármaco
|
Forma
|
Dosificación
|
|
Agonistas β2 inhalados de acción corta (SABA)
|
|
Fenoterol
|
MDI 100 µg
|
Según demanda: 1-2 dosis
|
|
Salbutamol
|
MDI 100 µg
DPI 100 y 200 µg
Solución para nebulización 1 y 2 mg/ml
|
Según demanda: 1-2 dosis
Dosificación en la exacerbación →texto
|
|
Agonistas β2 inhalados de acción prolongada (LABA)
|
|
Formoterol (fumarato dihidrato)
|
MDI 12 μg
DPI 4,5, 9 y 12 μg
|
1-2 dosis 2 × d (máx. 54 o 72 μg/d →texto)
|
|
Salmeterol
|
MDI 25 µg
DPI 50 µg
|
1-2 dosis 2 × d (máx. 200 μg/d)
|
|
Glucocorticoides inhalados
|
|
Beclometasona
|
MDI 100 y 200 µg
|
50-100 μg 2 × d (dosis baja)
>100-200 μg 2 × d (dosis media)
>200 μg 2 × d (dosis alta)
|
|
Budesonida
|
MDI 200 μg
DPI 100, 200 y 400 μg
Susp. para nebulización 0,125, 0,25 y 0,5 mg/ml
|
100-200 μg 2 × d (dosis baja)
>200-400 μg 2 × d (dosis media)
>400 μg 2 × d (dosis alta)
|
|
Ciclesonida
|
MDI 80 y 160 µg
|
80-160 μg 1 × d (dosis baja)
>160-320 μg 1 × d (dosis media)
>320 μg 1 × d (dosis alta)
|
|
Fluticasona (propionato)
|
MDI 50, 125 y 250 µg
DPI 50, 100, 125, 250 y 500 μg
Susp. para nebulización 0,25 y 1 mg/ml
|
50-125 μg 2 × d (dosis baja)
>125-250 μg 2 × d (dosis media)
>250 μg 2 × d (dosis alta)
|
|
Fluticasona (furoato)
|
Disponible solamente en forma de preparados combinados
|
100 μg 1 × d (dosis baja-media)
200 μg 1 × d (dosis alta)
|
|
Mometasona
|
DPI 400 µg
|
110-220 µg/d (dosis baja)
>220-440 µg/d (dosis media)
>440 µg/d (dosis alta)
|
|
Preparados combinados LABA + glucocorticoides en un inhalador
|
|
Formoterol + budesonida
|
DPI 4,5 µg/80 µg, 4,5 µg/160 µg, 9 µg/320 µg
MDI 4,5 μg/160 μg
|
1-2 dosis 2 × d
|
|
Salmeterol + fluticasona (propionato)
|
MDI 25 μg/50, 125 o 250 μg
DPI 50 μg/100, 250 o 500 μg
|
1-2 dosis 2 × d
|
|
Formoterol + beclometasona
|
MDI 6 μg/100 μg, 6 μg/200 μg
DPI 6 µg/100 µg
|
1-2 dosis 2 × d
|
|
Vilanterol + fluticasona (furoato)
|
DPI 22 μg/92 μg y 22 μg/184 μg
|
1 dosis 1 × d
|
|
Fármacos anticolinérgicos de acción corta (SAMA)
|
|
Ipratropio
|
MDI 20 µg
Solución para nebulización (0,25 mg/ml)
|
En exacerbaciones →texto
|
|
Fármacos anticolinérgicos de acción prolongada (LAMA)
|
|
Tiotropio
|
SMI 2,5 µg
|
2 dosis 1 × d
|
|
Preparados combinados SAMA + SABA en un inhalador
|
|
Ipratropio + fenoterol
|
MDI 20 μg/50 μg
Solución para nebulización
|
En exacerbaciones →texto
|
|
Preparados combinados LABA + LAMA + glucocorticoides en un inhalador
|
|
Formoterol + glicopirronio + beclometasona
|
MDI 6 µg/10 µg/100 µg
|
2 dosis 2 × d
|
|
Indacaterol + glicopirronio + mometasona
|
DPI 150 μg/50 μg/160 μg
|
1 dosis 1 × d
|
|
DPI — inhalador de polvo seco, MDI — inhalador de dosis medida, SMI — inhalador de niebla fina
|
Dosificación propuesta de morfina en el tratamiento sintomático de la disnea en enfermedad oncológica
|
Situación clínica
|
Dosificacióna
|
|
Paciente con disnea moderada o grave en reposo, que todavía no está tratado con opioides: administrar morfina VO
|
1) Dosis inicial de morfina habitualmente 2,5 mg (máx. 5 mg) VO en forma de fármaco de liberación inmediata. Después de la primera dosis se recomienda observar al paciente con el fin de realizar una evaluación completa del efecto (≤60 min). Si es eficaz se recomienda administrar la misma dosis en el caso de que se agraven los síntomas (en caso de necesidad, una parte de los enfermos puede beneficiarse de esta estrategia durante algún tiempo). Si debido a la disnea son necesarias ≥2 dosis al día, considerar tratamiento regular con morfina, y titular la dosis dependiendo del efecto, su duración y efectos adversos
2) En algunos casos (p. ej. en personas con disnea en reposo persistente) desde el principio administrar morfina regularmente (normalmente 2,5 mg VO cada 4-6 h) en forma de un preparado de liberación inmediata, con dosis de rescateb (p. ej. 1-1,5 mg). Tras la dosis inicial seguir las recomendaciones descritas anteriormente. Si es necesario en los siguientes días titular la dosis gradualmente
|
|
Paciente con disnea en reposo que no está tratado con opioides, en el que no es posible administrar medicación VO (p. ej. casos de trastornos de la deglución): administrar morfina VSc o iv.
|
→más arriba; empezar con dosis 2-3 veces menor (p. ej. 1-2 mg VSc o 1 mg iv.)
|
|
Paciente tratado con morfina en preparación de liberación inmediata VO cada 4 h a causa de la disnea, después de establecer el requerimiento
|
Considerar cambiar de fármaco al de liberación controlada + dosis de rescateb
|
|
Paciente con disnea de reposo que hasta ahora no ha recibido opioides potentes: iniciar el tratamiento con una preparación de morfina de liberación controlada
|
Puede usarse este tratamiento, pero empezando por dosis muy bajas (p. ej. 10 mg/dc) y siempre con una vigilancia cuidadosa y un aumento gradual de la dosis (a intervalos de ≥1 semanac), hasta obtener un resultado óptimo (máx. 30 mg/dc)
|
|
Paciente tratado con morfina a causa del dolor (VO o VSc) que se acompaña de disnea
|
En caso de necesidad una dosis adicional de morfina en forma de liberación inmediata (p. ej. inicialmente un 25 % de la dosis previa utilizada regularmente cada 4 h a causa del dolor; después evaluación y titulación de la dosis; en disnea más pronunciada probablemente se requerirá una dosis mayor, p. ej. un 50-100 % de la dosis previa utilizada regularmente cada 4 h a causa del dolor, lo que equivale a 1/12-1/6 de la dosis diaria): en caso de buena respuesta, administrar esta dosis solo en caso de agudización/episodio de disnea (y continuar el tratamiento actual por dolor con dosis regulares de morfina); si es necesario administrar dosis de rescate con frecuencia a causa de disnea, considerar aumentar la dosis basal utilizada regularmente
|
|
Paciente tratado (con buena respuesta) con tramadol a causa de dolor acompañado de disnea
|
Cambiar tramadol por morfina (teniendo en cuenta las dosis de rescate de morfina)
|
|
Paciente tratado a causa de la disnea con morfina VO, en el que se debe cambiar la vía de administración a parenteral (p. ej. si el paciente no consigue deglutir o vomita)
|
Morfina VSc o iv. a dosis diaria reducida en 2-3 veces, p. ej. en infusión continua en la forma de bomba de la infusión (y dosis de rescate)b
Nota: en caso de elegir la administración iv., administrar una dosis diaria reducida en 2-3 veces en infusión continua iv. (titular, si es necesario). Dosis inicial de rescate iv. normalmente 1-2 mg, administrar de manera lenta y, a continuación, titular adecuadamente (en general, la dosis inicial de rescate de morfina iv. no debe calcularse como 1/10-1/16 de la dosis diaria, puesto que puede ser demasiado alta y provocar efectos adversos)
|
|
Paciente con disnea creciente en reposo y con ansiedad (con mayor frecuencia los últimos días de la vida; normalmente no hay posibilidad de tomar fármacos VO)
|
1) Morfina utilizada habitualmente con regularidad y en caso de disnea. Cambiar la administración VO por parenteral, VSc o iv. →más arriba. Si persiste la ansiedad y la disnea, considerar asociar benzodiazepina, p. ej. si el paciente recibe morfina en infusión continua VSc, se le puede añadir midazolam, inicialmente a dosis pequeñas (p. ej. 1-1,5 mg VSc en caso de necesidad y, eventualmente, 5-10 mg/d en infusión continua VSc)d
2) Si el paciente todavía no está tomando opioides, se debe administrar la dosis inicial de morfina por vía parenteral, p. ej. 1-2 mg VSc o 1 mg iv.; planificar la dosificación de morfina en infusión VSc o iv. o en inyecciones VSc habitualmente cada 4 h, siempre proporcionando dosis de rescate. Considerar añadir benzodiazepina (→más arribad); a continuación, titular la dosis de morfina
|
|
Disnea aguda en agonía
|
No hay pautas establecidas de dosificación, es necesaria una individualización, vigilancia continua de los efectos y búsqueda consecuente de la dosis eficaz que consigue la reducción de la disnea. Es fundamental la administración de morfina. En caso de ansiedad intensa considerar añadir midazolam (→más arriba; con mayor frecuencia en forma de infusión continua con dosis de rescate, administradas por vía parenteral).
Una posibilidad es una rápida titulación con pequeñas dosis de morfina parenteral (en condiciones intrahospitalarias); en enfermos no tratados hasta ahora con opioides:
1) administrar morfina en pequeñas dosise, preferiblemente 1 mg iv. cada 10-15 min hasta empezar a aliviar la disnea o los efectos adversos (somnolencia); si no hay acceso iv., es posible administrar VSc, teniendo en cuenta las limitaciones de esta vía en cuanto a la titulación rápida de la dosis en enfermos agonizantes (p. ej. 1-2 mg cada 30 min), debido al riesgo de disminución de la perfusión periférica →más adelante; si no se consiguen los efectos deseados utilizando las dosis iniciales y si la disnea es muy pronunciada, considerar aumentar la dosis única; debido a que el aumento de la concentración del fármaco en el SNC puede retrasarse (absorción lenta por la barrera cerebrovascular) es necesaria una vigilancia continua del paciente
2) en caso de ansiedad intensa, considerar la administración de una benzodiazepina, p. ej. midazolam parenteralf (p. ej. 0,5 mg iv. lentamente, si es necesario: repetir después de 10-15 min; o VSc, normalmente 1,5 mg [en situaciones extremas incluso 2,5 mg] y, si es necesario, volver a repetir a los 20-30 min [30 min en caso de la dosis de 2,5 mg]; a continuación, infusión continua iv. o VSc con posibilidad de administrar dosis de rescate); si el midazolam no está disponible: lorazepam VSl
Notas:
1) En caso de un tratamiento con morfina y midazolam parenteral (especialmente iv.), asegurar el acceso a los fármacos que actúan como antagonistas →texto.
2) En pacientes con alteraciones en la perfusión periférica (p. ej. deshidratación, shock, enfriamiento) la absorción de los fármacos administrados durante una rápida titulación en forma de bolo VSc puede retrasarse y el alivio de la disnea puede resultar menos fuerte. En casos de mejora de la perfusión periférica (hidratación, inversión de la vasoconstricción del tejido subcutáneo, calentamiento) puede producirse una rápida absorción del fármaco del tejido subcutáneo. En tales situaciones, se puede preferir la administración iv.
3) En casos raros de disnea grave en pacientes agonizantes que no se puede aliviar con un tratamiento sintomático adecuado, pueden existir indicaciones para la sedación paliativa.
|
|
a Nota: no hay regímenes de dosificación estrictos; la dosificación es individual, se necesita una vigilancia exacta. Algunas situaciones clínicas no incluidas en la tabla requieren modificaciones en su manejo, p. ej. en función del grado de disfunción renal.
b Las dosis de rescate de morfina en forma de liberación inmediata (VO o VSc) también deben ser tituladas. En situación de demanda diaria estable de morfina suele constituir 1/12– 1/6 de la dosis diaria, y en caso de necesidad pueden administrarse cada 2 h. Una parte de los expertos recomienda que, en el caso de la morfina administrada VO, y si es necesario administrar dosis adicionales, se mantengan los intervalos de ≥60-90 min, mientras que en caso de morfina VSc de 60 min (dicho tiempo puede reducirse si la situación requiere una rápida titulación de la dosis →más arriba). Si es necesario repetir las dosis, hay que estrechar la observación del paciente.
c Las dosis y el manejo como en los ensayos clínicos, de acuerdo con la decisión australiana de registrar la morfina para el tratamiento de disnea crónica.
d En la ficha técnica hay que verificar si el preparado concreto de midazolam puede mezclarse en la misma jeringa con morfina, o si tiene que administrarse por separado.
e Los pacientes de edad avanzada, caquécticos, con coexistencia de EPOC o tratados con benzodiazepinas son más sensibles a la acción de los opioides.
f El fármaco se debe administrar muy lenta y cuidosamente. Los pacientes de edad avanzada, caquécticos, con coexistencia de EPOC o tratados con opioides son más sensibles a la acción de las benzodiazepinas.
|
Uso de la procalcitonina (PCT) en la toma de decisiones sobre el tratamiento antibiótico de la neumonía adquirida en la comunidada
|
Concentración de PCT (µg/l)
|
Probabilidad de infección bacteriana
|
Antibioticoterapia
|
Actuación adicional
|
|
<0,1a
|
Muy baja
|
Nob
|
Considerar repetir la determinación de PCT a las 6-24 h y tomar la decisión sobre el tratamiento según el resultado
|
|
0,1-0,25
|
Baja
|
|
0,25-0,5
|
Alta
|
Síc
|
Actuación según el curso de la enfermedad, considerar repetir la determinación de PCT en días 2-3, 4-5 y 6-8, y opcionalmente 10 del tratamiento
|
|
>0,5
|
Muy alta
|
|
a Algunos autores sugieren utilizar 2 puntos de corte: 0,25 µg/l en enfermos con infecciones leves o moderadas en unidades no quirúrgicas (utilizar escalas qSOFA, MEDS, NEWS) y 0,5 µg/l para enfermos que requieren tratamiento en la UCI. En las guías ATS/IDSA (2019) en los enfermos con sospecha clínica y confirmación radiológica de NAC se recomienda iniciar antibioticoterapia empírica independientemente de la concentración inicial de PCT.
b Considerar la antibioticoterapia a pesar de una concentración baja de PCT en caso de riesgo vital inminente, inestabilidad respiratoria y/o circulatoria, necesidad de tratamiento en UCI, manifestaciones de empiema pleural y resultados positivos de pruebas microbiológicas (p. ej. que detectan antígeno de estreptococo o Legionella).
c Suspender la antibioticoterapia en enfermos tratados en el hospital en un servicio de cuidados no intensivos cuando la concentración de PCT <0,25 µg/l (en UCI <0,5 µg/l). Si la concentración máxima de PCT fue muy alta, considerar la suspensión del tratamiento cuando la concentración de PCT baje un 80-90 %. La persistencia de concentraciones elevadas de PCT indica fracaso del tratamiento.
A partir de: Clin. Chest Med., 2011; 32: 417-430, modificado
|
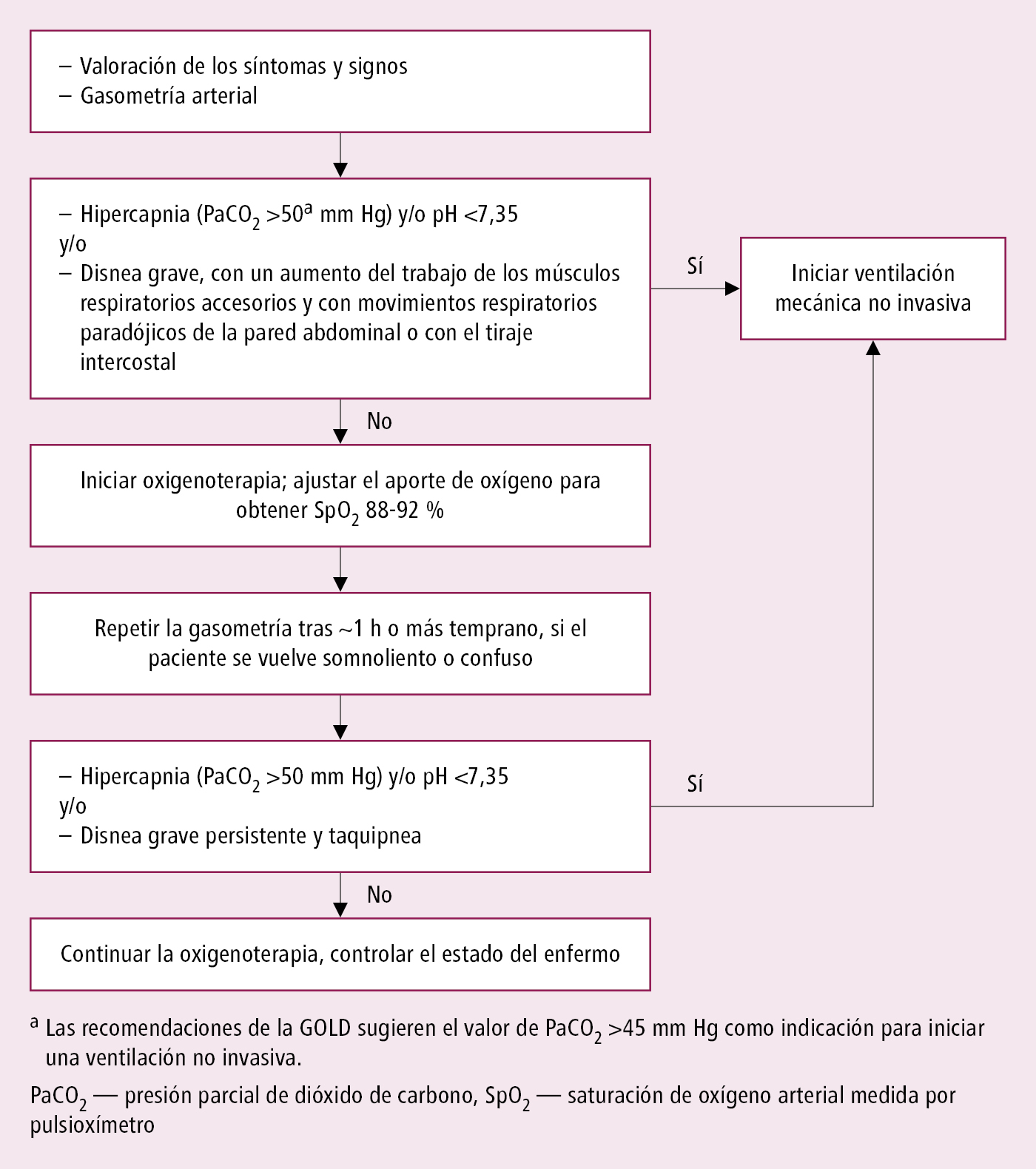
Fig. 3.8-2. Algoritmo de oxigenoterapia en las exacerbaciones de la EPOC
 Español
Español
 English
English
 українська
українська






