Ми прагнемо й надалі безкоштовно надавати цей тип контенту. На жаль, коштів на це більше немає.
Без Вашої допомоги нам доведеться закрити проект до кінця 2024 року.
Зробіть пожертвуВИЗНАЧЕННЯ, КЛАСИФІКАЦІЯ та етіопатогенезвгору
Цукровий діабет (ЦД) — це група метаболічних захворювань різної етіології та різного перебігу, які характеризуються гіперглікемією, що виникає внаслідок дефекту секреції або дії інсуліну. Хронічна гіперглікемія при ЦД пов’язана з пошкодженням, дисфункцією та недостатністю різних органів, особливо серця, кровоносних судин, очей, нирок і нервів.
Етіологічна класифікація цукрового діабету за ВООЗ (1999 р., модифікована у 2019 р.) →табл. 13.1-1e.
|
1. Цукровий діабет 1-го типу — аутоімунна деструкція β-клітин підшлункової залози, що зазвичай призводить до абсолютного дефіциту інсуліну (одна з його клінічних форм — LADA) |
|
2. Цукровий діабет 2-го типу — прогресуюча втрата здатності β-клітин підшлункової залози належним чином виділяти інсулін, що супроводжується резистентністю до інсуліну |
|
3. Гібридні форми цукрового діабету |
|
4. Інші специфічні типи цукрового діабету: A. Генетичні дефекти функції β-клітин 1) хромосома 12, HNF-1α — мутації в гені ядерного фактора 1α гепатоцитів (HNF1A MODY, заст. MODY 3) 2) хромосома 7, GCK — мутації гена глюкокінази (GCK MODY, заст. MODY 2) 3) хромосома 20, HNF-4α (HNF4A MODY, заст. MODY 1) 4) хромосома 13, IPF1 — мутації фактора промотору інсуліну (заст. MODY 4) 5) хромосома 17, HNF-1β — мутації в гені ядерного фактора 1β гепатоцитів (HNF1B MODY, заст. MODY 5) 6) хромосома 2 (NEUROD1, заст. MODY 6) 7) мітохондріальна ДНК (mtDNA 3243 MIDD) 8) мутації в генах, що кодують деякі білки, які відіграють роль у регуляції секреції інсуліну (у т. ч. активаційні мутації в генах KCNJ11 і ABCC8, що кодують субодиниці калієвого каналу), а також мутації в гені, що кодує сам інсулін — можуть викликати перманентний неонатальний цукровий діабет (permanent neonatal diabetes mellitus), який у деяких випадках може протікати із психомоторною відсталістю та епілепсією (синдром DEND; developmental delay, epilepsy, neonatal diabetes mellitus) 9) інші |
|
Б. Генетичні дефекти дії інсуліну 1) інсулінорезистентність типу А (генетичний дефект рецептора інсуліну) 2) карликовість (лепреконізм) 3) синдром Рабсона-Менденхолла 4) ліпоатрофічний діабет 5) інші |
|
В. Захворювання екзокринної частини підшлункової залози 1) панкреатит 2) травма підшлункової залози, панкреатектомія 3) новоутворення 4) муковісцидоз 5) спадковий гемохроматоз 6) фіброкалькульозна панкреатопатія 7) інші |
|
Г. Ендокринопатія 1) акромегалія 2) синдром Іценка-Кушинга 3) глюкагонома 4) феохромоцитома 5) гіпертиреоз 6) соматостатинома 7) альдостеронова пухлина (синдром Кона) 8) інші |
|
Д. Цукровий діабет, викликаний ліками або іншими хімічними речовинами 1) Вакор (щуряча отрута) 2) пентамідин 3) нікотинова кислота 4) глюкокортикостероїди 5) гормони щитоподібної залози 6) діазоксид 7) β-міметики 8) тіазидні діуретики 9) фенітоїн 10) інтерферон-α 11) інші |
|
Е. Інфекції 1) вроджена краснуха 2) цитомегалія 3) інші |
|
Є. Рідкісні форми, викликані імунологічним процесом 1) синдром ригідної людини 2) антитіла проти рецептора інсуліну (інсулінорезистентність типу B) 3) інші |
|
Ж. Інші генетичні синдроми, іноді пов’язані з цукровим діабетом 1) трисомія 21 (синдром Дауна) 2) синдром Клайнфельтера 3) синдром Тернера 4) синдром Вольфрама 5) атаксія Фрідрейха 6) хорея Гентінгтона 7) синдром Лоуренса-Муна-Бідля 8) міотонічна дистрофія 9) порфірія 10) синдром Прадера-Віллі 11) інші |
|
5. Некласифікований цукровий діабет |
|
6. Гіперглікемія, вперше діагностована під час вагітності 1) цукровий діабет під час вагітності 2) гестаційний діабет |
1. ЦД 1-го типу: зумовлений руйнуванням β-клітин підшлункової залози аутоімунним (у більшості випадків) або невизначеним (ідіопатичним) процесом, що зазвичай призводить до абсолютного дефіциту інсуліну; індукований дією тригерних (пов’язаних із середовищем) факторів у осіб із генетичною схильністю. У розвитку захворювання з аутоімунною основою беруть участь антитіла до острівців Лангерганса (до різних антигенів β-клітин), які можуть з’являтись за багато місяців і навіть років до появи симптомів ЦД; протягом цього періоду відбувається поступова втрата секреторної функції β-клітин, котра призводить до маніфестного ЦД, який характеризується абсолютним дефіцитом інсуліну. Як правило, проявляється у дітей і молоді, та в осіб віком <30-ти р. Після маніфестації захворювання процес руйнування β-клітин триває ще впродовж певного часу; зникнення С-пептиду (маркера секреції інсуліну) в сироватці свідчить про їх остаточне знищення. Тривають дебати щодо того, чи ЦД аутоімунного ґенезу, що повільно розвивається і дебютує у дорослому віці, слід класифікувати як LADA (latent autoimmune diabetes of adults), чи як ЦД 1-го типу. ADA та PTD пропонують класифікувати цю форму ЦД як ЦД 1-го типу через їх спільну етіологію — у дорослій популяції також може виникнути аутоімунне руйнування β-клітин острівців підшлункової залози, і навіть якщо прогресування відбувається повільніше, доцільно розпочати лікування інсуліном у цих пацієнтів, щоб не допустити до розвитку тяжкої гіперглікемії або діабетичного кетоацидозу. Тим не менш, використання терміну LADA є поширеним і допустимим.
2. ЦД 2-го типу: найчастіша форма (≈80 %); зумовлена поступовим порушенням секреції інсуліну в умовах інсулінорезистентності. Може бути генетично обумовленим (найчастіше полігенне успадкування), однак ключову роль відіграють фактори середовища (ожиріння [особливо абдомінальне] та низька фізична активність). Надлишок вісцерального жиру має значний діабетогенний ефект, також у людей без ожиріння, визначеного на основі індексу маси тіла (ІМТ). Надмір вільних жирних кислот, які виділяє черевна жирова тканина, викликає «ліпотоксичність» — збільшене окиснення жирів призводить до гальмування гліколізу у м’язах (метаболізму глюкози), а у печінці призводить до посилення глюконеогенезу, що вимагає компенсаційної секреції інсуліну β-клітинами та може призвести до поступового виснаження їх резерву і порушення метаболізму глюкози.
3. ЦД відомої етіології: моногенний діабет, пов’язаний із генетичним дефектом функції β-клітин і, отже, дефектом секреції інсуліну (ЦД дорослого типу у молодих людей [MODY], перманентний неонатальний ЦД, мітохондріальний ЦД), генетичні дефекти дії інсулінy, захворювання екзокринної частини підшлункової залози (у т. ч. гострий і хронічний панкреатит, рак підшлункової залози, стани після травми або резекції підшлункової залози, муковісцидоз і гемохроматоз, ураження також охоплює ендокринні острівці підшлункової залози), ендокринопатії (через надлишок контрінсулярних гормонів, напр., синдром Іценка-Кушинга, акромегалія, феохромоцитома), ятрогенний ЦД, що індукований ліками (напр., ГК, атиповими антипсихотиками [що сприяють збільшенню маси тіла], інтерфероном α, меншою мірою тіазидними діуретиками) чи іншими хімічними речовинами, інфекції (напр., вроджена краснуха), рідкісні форми, що спричинені імунним процесом, інші генетичні синдроми, які іноді асоційовані з ЦД (напр., трисомія 21 (синдроми Дауна), Клайнфельтера, Шерешевського-Тернера).
4. Гіперглікемія, вперше діагностована під час вагітності — гестаційний ЦД або ЦД у вагітної: підвищення концентрації контрінсулярних гормонів, яке виникає під час вагітності, призводить до інсулінорезистентності, збільшення потреби в інсулінi та підвищення доступності глюкози для плоду, який розвивається — внаслідок цих адаптаційних змін зростає ризик порушень вуглеводного обміну у жінок, які досі були здоровими.
5. Зміни, внесені ВООЗ у 2019 році до класифікації 1999 року, полягають у виділенні 2-х додаткових груп ЦД, діагностування яких за клінічною картиною не є однозначним (ADA та PTD їх не враховують):
1) гібридні форми ЦД:
а) ЦД аутоімунного ґенезу, що повільно розвивається і дебютує у дорослих (раніше LADA, тепер вважається ЦД 1-го типу);
б) ЦД 2-го типу зі схильністю до розвитку кетозу;
2) некласифікований ЦД — тимчасовий термін, який використовують у випадках неоднозначного діагнозу.
КЛІНІЧНА КАРТИНА ТА ТИПОВИЙ ПЕРЕБІГвгору
Перебіг захворювання залежить від швидкості втрати β-клітин. Спочатку виникає порушення ранньої фази секреції інсуліну, у подальшому розвивається предіабет (порушення глікемії натще [ПГН], і/або порушена толерантність до глюкози [ПТГ]), а далі — маніфестний ЦД. Суб’єктивні симптоми є неспецифічними і різноманітними, пов’язаними з типом ЦД та динамікою розвитку хвороби, проявляються при ЦД 1-го типу значно частіше, ніж при ЦД 2-го типу, аналогічно, як і кетоацидоз та кетоацидотична кома. У зв’язку з труднощами у досягненні повної корекції ЦД не вдається повністю запобігти розвитку хронічних ускладнень →розд. 13.4, які погіршують якість життя хворих і становлять причину підвищення смертності з приводу захворювань серцево-судинної системи.
Типові симптоми ЦД: поліурія (осмотичний діурез внаслідок глюкозурії), полідипсія (посилена спрага), ознаки дегідратації, які, переважно, є помірно вираженими (зниження еластичності шкіри, сухість шкіри та слизових оболонок), спричинені зневодненням слабкість та сонливість, схуднення (рідше), кетоацидоз та кетоацидотична кома (іноді перший помічений симптом), схильність до гнійних інфекцій шкіри чи інфекцій сечостатевої системи.
ЦД 1-го типу: раптове виснаження секреторних резервів β-клітин підшлункової залози у дітей і молоді є причиною гострого початку захворювання (кетоацидоз та кетоацидотична кома) та лабільного перебігу ЦД, що пришвидшує розвиток хронічних ускладнень (можуть з’являтись вже через 5 років від початку хвороби). Симптоми ЦД 1-го типу у дорослих осіб наростають непомітно впродовж тривалого часу, деколи протягом кількох місяців, зазвичай, хвороба не починається кетоацидотичною комою (хоча з’являються симптоми кетоацидозу). Форма ЦД аутоімунного ґенезу, який повільно розвивається і дебютує у дорослих, яка раніше називалася LADA, в даний час за своєю етіологією вважається ЦД 1-го типу. Для нього характерний тривалий, «тліючий» перебіг, повна клінічна картина маніфестується на 4–5-му десятилітті життя та частіше, ніж при класичній формі ЦД 1-го типу зустрічаються надмірна вага або ожиріння. Багаторічний перебіг, на перший погляд, слабко вираженої гіперглікемії, навіть при періодичному регресі біохімічних порушень, сприяє підступному розвитку хронічних ускладнень — їх діагностування підтверджує необхідність лікування інсуліном.
ЦД 2-го типу: типові симптоми ЦД виникають значно рідше, ніж при ЦД 1-го типу. Більш, ніж половина випадків має безсимптомний перебіг і гіперглікемію виявляють випадково, або під час скринінгових обстежень. Якщо ЦД не лікувати, це зумовлює розвиток хронічних ускладнень, особливо серцево-судинних, котрі є основною причиною смерті. ≈85 % хворих має ожиріння, переважно, абдомінальне; часто виникає артеріальна гіпертензія та ліпідні порушення. Гіперглікемія може вперше проявитись під час перебігу іншого захворювання (напр., інфекції), при якому збільшується потреба в інсуліні. Секреторні резерви β-клітин при ЦД з часом поступово виснажуються (це вимагає моніторингу перебігу захворювання та адаптації лікування до змінних потреб).
ЦД відомої етіології: клінічна картина вторинного ЦД залежить від основного захворювання, в ході якого він розвивається (м. ін. гострий панкреатит, хронічний панкреатит, муковісцидоз, гемохроматоз, акромегалія, синдром Іценка-Кушинга, АКТГ-секретуючі пухлини, феохромоцитома), або генетично детермінованого синдрому, іноді пов’язаного з ЦД (табл. 13.1-1) з характерними симптомами, напр., уповільненим статевим дозріванням.
Важливе значення має анамнез щодо прийнятих ЛЗ, особливо ГК та антипсихотичних препаратів, що сприяють збільшенню маси тіла, а при генетично обумовлених захворюваннях важливий сімейний анамнез — наявність ЦД в ≥3-х поколіннях спонукає до пошуку ЦД MODY.
Моногенний ЦД: неонатальний і мітохондріальний ЦД проявляється у дітей раннього віку. MODY є граничною формою, яка виникає у віці, типовому для діагнозу ЦД 1-го типу, але його клінічний перебіг подібний до ЦД 2-го типу. Його можна запідозрити, якщо:
1) дебютує в молодому віці, зазвичай на 2–3-му десятилітті життя;
2) виникає в наступних поколіннях родини (успадковується за аутосомно-домінантним типом);
3) типово має легкий перебіг порівняно з ЦД 1-го типу (вимагає диференційної діагностики);
4) ожиріння або інсулінорезистентність зазвичай не спостерігаються (не відіграють ролі в патогенезі);
5) концентрація інсуліну в сироватці може бути знижена.
MODY зустрічається у жінок так само часто, як і у чоловіків. Розташування мутації в хромосомах різне, тому й клінічна картина є гетерогенною.
ЦД HNF1A MODY зазвичай дебютує у віці <25 р., а ЦД зустрічається в ≥3-х поколіннях у родині пацієнта, і ≥2-м особам захворювання було діагностовано в молодому віці. На початку захворювання ПГТТ показує значне підвищення глікемії з часто нормальними значеннями глікемії натще, а результати антитіл, типових для ЦД аутоімунного ґенезу, негативні. Як правило, виникає глюкозурія через зниження ниркового порогу для глюкози. У подальшому перебігу, незважаючи на кілька років тривалості захворювання, С-пептид все ще виявляється і немає тенденції до кетоацидозу, що відрізняє MODY від ЦД 1-го типу та дозволяє призначити пероральне лікування. У зв’язку з виснаженням секреторних резервів β-клітин і підвищенням ризику хронічних ускладнень ЦД слід враховувати необхідність припинення лікування похідними сульфонілсечовини та призначення інсулінотерапії.
Цукровий діабет, пов’язаний з мутацією в гені глюкокінази (GCK MODY), виникає з народження, але протікає безсимптомно, і його характерною ознакою є стійке (помірне) підвищення рівня глюкози натщесерце, зазвичай <8,0 ммоль/л (144 мг/дл), і невелике підвищення глікемії ПГТТ. Наявність ЦД в одного з батьків підвищує ймовірність захворювання до 50 % при кожній вагітності. Насправді секреція інсуліну не порушується, але через мутацію в гені глюкокінази вона відбувається на фоні дещо вищої концентрації глюкози в крові. Перебіг захворювання легкий і стабільний, відсутні ацидоз і кетоз, пізні ускладнення ЦД зазвичай не розвиваються. Медикаментозна терапія зазвичай неефективна, і найкращим способом лікування цієї форми ЦД MODY є дотримання відповідної дієти з виключенням простих цукрів.
ДІАГНОСТИКАвгору
Полягає в однозначному підтвердженні гіперглікемії, яка відповідає критеріям діагностики ЦД →табл. 13.1-2, а після встановлення діагнозу ЦД — у визначенні його типу (причини) відповідно до чинної класифікації ВООЗ →табл. 13.1-1e.
ЦД 1-го типу у дорослого: для достовірного діагнозу, якщо відповідає глікемічним критеріям для діагностики ЦД (→табл. 13.1-2), необхідно визначити наявність аутоантитіл (антиострівцевих антитіл) і/або зниження концентрації С-пептиду. Спочатку визначають концентрацію антитіл проти декарбоксилази глутамінової кислоти (анти-GAD65). Якщо результат негативний → визначте антитіла проти тирозинфосфатази 2 (IA2) і/або транспортера цинку 8 (ZnT8), якщо ці тести доступні.
|
Дослідження |
Рівень глюкози в крові натщеa |
Глікемія через 2 год в ПГТТ |
Глікемія при випадковому визначенніб |
HbA1cб,в
|
|
діагноз цукрового діабету, якщо відповідає ≥1 критерію |
≥7,0 ммоль/л (126 мг/дл) — двічі (в інші дні) |
≥11,1 ммоль/л (200 мг/дл) |
≥11,1 ммоль/л (200 мг/дл) із типовими симптомами гіперглікеміїг |
≥6,5 % (48 ммоль/моль) |
|
a Якщо рівень глюкози (концентрація глюкози в плазмі) натще становить 5,6–6,9 ммоль/л (100–125 мг/дл) → виконати ПГТТ. б У будь-який час доби, не обов’язково натщесерце. в HbA1c визначається в лабораторії за допомогою методів, сертифікованих NGSP г спрага, поліурія, слабкість; при цукровому діабеті 1-го типу можливий діабетичний кетоацидоз HbA1c — глікований гемоглобін, ПГТТ — пероральний тест на толерантність до 75 г глюкози з визначенням глікемії натщесерце і через 2 год |
||||
ЦД 2-го типу: досить часто протікає безсимптомно (до 20 % випадків у дослідженні Screen-Pol), але також призводить до розвитку хронічних ускладнень, особливо серцево-судинних, які є основною причиною смерті цих хворих. Їм також сприяють порушення вуглеводного обміну, які передують ЦД. Тому слід докладати зусиль для ранньої діагностики як предіабету, так і ЦД в групах ризику.
Різниця між ЦД 1-го та 2-го типу у дорослих часто нечітка, і для діагностування ЦД визначеної етіології в деяких ситуаціях можуть знадобитися спеціальні тести, включаючи генетичні, щоб однозначно діагностувати ЦД MODY. Сучасна класифікація ВООЗ враховує ці діагностичні труднощі та дозволяє діагностувати некласифікований ЦД, якщо його форму неможливо визначити. У деяких випадках визначити тип ЦД стає легше, коли хвороба прогресує. Виокремлення гібридних форм ЦД також враховує можливість розвитку порушень вуглеводного обміну, що має деякі типові риси як для ЦД 1-го, так і для 2-го типу.
Алгоритм діагностики ЦД →рис. 13.1-1.
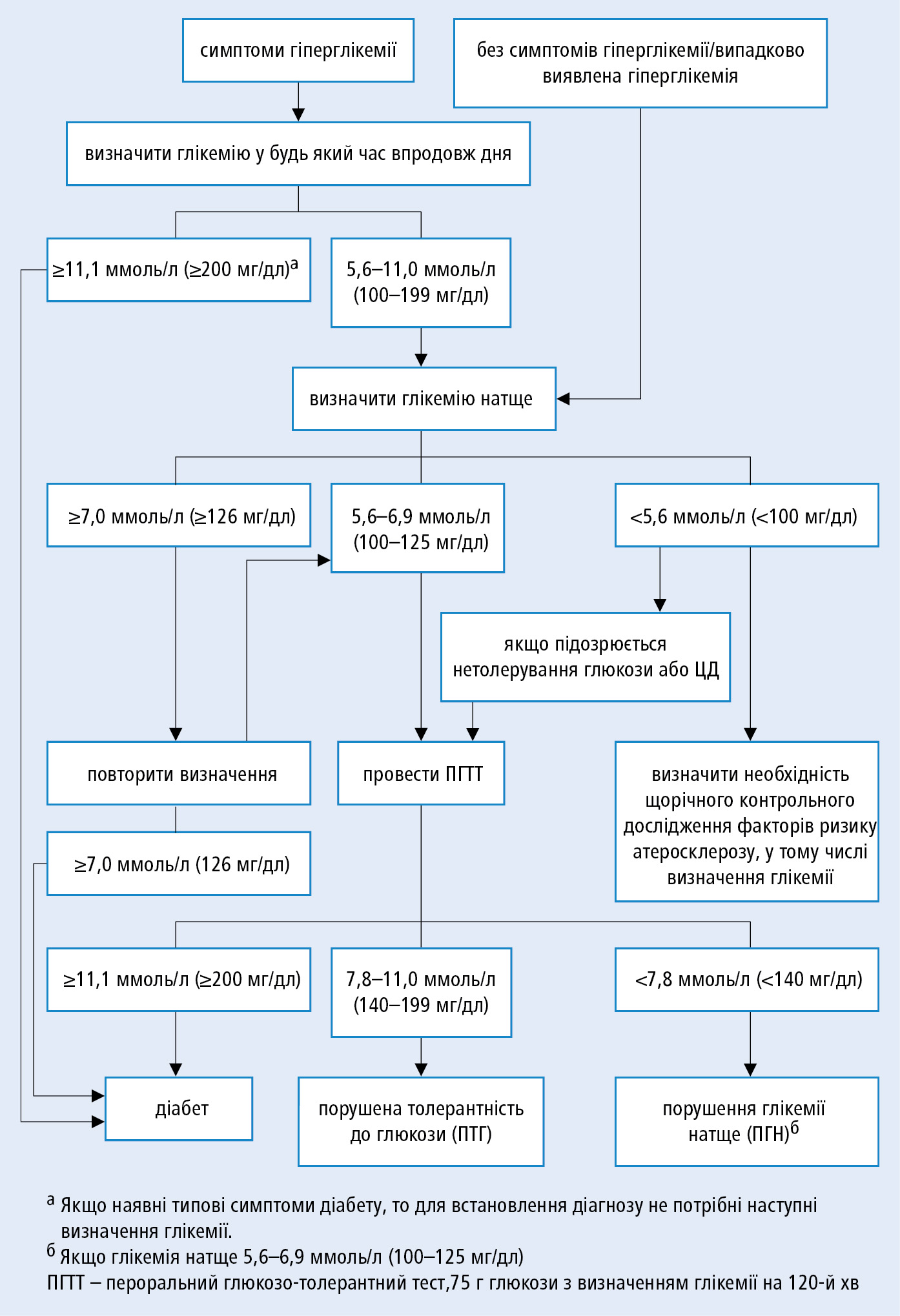
Рисунок 1. Алгоритм діагностики цукрового діабету
Багато випадків ЦД розвиваються безсимптомно, у зв’язку з чим рекомендується виконання скринінгових досліджень (глікемія натще, ПГТТ або HbA1c →нижче) щорічно у групах підвищеного ризику щодо розвитку ЦД 2 типу: надмірна вага (ІМТ 25–29,9 кг/м2) або ожиріння (ІМТ ≥30 кг/м2) або окружність талії >80 см у жінок та >94 см у чоловіків; ЦД у батьків або сибсів; низька фізична активність; порушення вуглеводного обміну в анамнезі — ПГН або ПТГ; перенесений гестаційний діабет; народження дитини вагою >4 кг; артеріальна гіпертензія (≥140/90 мм рт. ст.); ХСЛПВЩ <1,0 ммоль/л (40 мг/дл) або концентрація тригліцеридів >1,7 ммоль/л (250 мг/дл); синдром полікістозних яєчників; захворювання серцево-судинної системи на фоні атеросклерозу; муковісцидоз (обстеження раз на рік з 10-річного віку, у період без загострень бронхолегеневого захворювання, у хворих, які не отримують ГК); і кожні 3 роки у всіх осіб віком ≥45-ти р.
Принципи скринінгових досліджень вагітних жінок →розд. 13.2.2.
1. Лабораторні дослідження:
1) глікемія — концентрація глюкози у плазмі венозної крові натще (норма 4,0–5,5 ммоль/л [72–99 мг/дл]) використовується для діагностики ЦД або ПГН (→розд. 13.1.), а концентрація глюкози у цільній капілярній крові (аналіз за допомогою глюкометра, натще [тобто 8–14 год від останнього прийому їжі] i 90–120 хв після прийому їжі) або в інтерстиціальній рідині за допомогою системи безперервного моніторингу рівня глюкози (CGM) — для моніторингу лікування ЦД. Не виконуйте діагностичний пошук ЦД під час гострої фази будь-якого захворювання, відразу після травми або операції, після періоду голодування або під час навіть короткочасного прийому ліків, які можуть підвищити глікемію.
2) відсоток глікозильованого гемоглобіну (HbA1с) — це ретроспективний індекс рівня глюкози в крові, для оцінки метаболічної корекції ЦД (→розд. 13.1.) або для його діагностики (розд. 13.1., лабораторне дослідження сертифікованим методом NGSP), віддзеркалює середню глікемію впродовж 3-х міс. перед визначенням; не визначайте, якщо присутні інші стани, що впливають на результат або роблять неможливим його інтерпретацію — гемоглобінопатії, анемії, стан після переливання еритроцитарної маси, гіпертригліцеридемія, гіпербілірубінемія, ниркова недостатність, діалізотерапія, застосування еритропоетину, цироз печінки, прийом саліцилатів у великих дозах; лабораторії також можуть виражати результат дослідження HbA1c в одиницях SI (ммоль/моль); якщо результат HbA1c ненадійний, використовуйте критерії діагностики ЦД на основі концентрації глюкози в плазмі;
3) концентрація фруктозаміну — віддзеркалює середню глікемію впродовж останніх 3-х тиж. (період напіврозпаду альбуміну), визначається рідко, напр., коли відсоток HbA1c є невірогідним (→вище), або коли є необхідною короткочасна оцінка компенсації глікемії (напр., у вагітних);
4) глюкоза в сечі — визначення за допомогою тест-смужки, є непридатним для моніторингу при лікуванні ЦД; підтвердження глюкозурії є показанням до визначення глікемії;
5) антитіла до острівців — аналіз використовують для підтвердження аутоімунної етіології ЦД:
а) до різних цитоплазматичних антигенів β-клітин (ICA; друга назва — антитіла до острівцевого апарату), значно рідше визначають з огляду на найнижчу специфічність;
б) до глутаматдекарбоксилази (анти-GAD65);
в) до тирозинфосфатази (IA-2, IA-2β);
г) до ендогенного інсуліну (IAA);
д) до цинку (Zn8);
6) концентрація С-пептиду в сироватці — відповідає концентрації ендогенного інсуліну; знижена або не визначається при ЦД 1-го типу, збільшена у початковій фазі ЦД 2-го типу, коли домінує інсулінорезистентність та зростає секреція інсуліну, натомість, знижена після вичерпання секреторних резервів β-клітин. Позиція ADA та EASD (2021) пропонує значення концентрації С-пептиду <0,2 нмоль/л у базальних умовах як діагностичний критерій ЦД 1-го типу. Дуже висока концентрація С-пептиду натщесерце та після стимуляції глюкагоном може вказувати на гіперінсулінізм при ЦД 2-го типу або інсуліному (→розд. 12.1.1.1).
7) кетонові тіла у сечі або їх підвищена концентрація у сироватці свідчать про кетоз або кетоацидоз при метаболічно декомпенсованому ЦД (при кетоацидозі →розд. 13.3.1, при еуглікемічному кетоацидозі в ході лікування інгібітором SGLT2), може супроводжуватися посиленням ліполізу (у стані голоду, після епізоду гіпоглікемії, блювання або зловживання алкоголем) — тест-смужки визначають, головним чином, ацетооцтову кислоту, решта — це ацетон і β-оксимасляна кислота;
8) концентрація лактату в сироватці — підвищена при лактацидозі →розд. 13.3.3.
2. Функціональні дослідження:
1) пероральний глюкозотолерантний тест (ПГТТ) — застосовують для діагностики ЦД або ПТГ; проводять через 8–14 год після останнього прийому їжі у хворого після відпочинку і нічного сну, після 3-х днів вживання звичайної дієти із нормальним вмістом вуглеводів; необхідно з’ясувати, чи пацієнт не приймає ліків, що можуть підвищувати глікемію (ГК, тіазидні діуретики, деякі β-блокатори); слід визначити глікемію натще та через 120 хв після перорального прийому розчину 75 г глюкози; у нормі концентрація глюкози у плазмі венозної крові через 120 хв <7,8 ммоль/л (140 мг/дл). Показання до ПГТТ: 1) результат 1- або 2-кратного аналізу глікемії натще 5,6–6,9 ммоль/л (100–125 мг/дл) або 2) існує аргументована підозра на порушену толерантність до глюкози або ЦД, незважаючи на нормальний рівень глікемії натще (<5,6 ммоль/л [100 мг/дл]);
2) тест з глюкагоном — застосовують для оцінки секреторних резервів β-клітин підшлункової залози; на практиці використовується дуже рідко, іноді придатний для диференціювання ЦД 1-го і 2-го типу (якщо це необхідно); С-пептид визначається натще та через 6 хв після в/в введення 1 мг глюкагону; межі норми за звичайних умов — 0,4–1,2 нмоль/л (1,2–3,6 мкг/л); через 6 хв після ін’єкції глюкагону — 1–4 нмоль/л (3,0–12 мкг/л); концентрація <0,6 нмоль/л після стимуляції глюкагоном вказує на ЦД 1-го типу (відсутність С-пептиду може пояснювати лабільність його перебігу), або довготривалий ЦД 2-го типу (після виснаження секреторних резервів β-клітин). Дуже високі концентрації С-пептиду натще і після стимуляції глюкагоном можуть свідчити про гіперінсулінізм при ЦД 2-го типу або інсуліному.
3) оцінка чутливості до інсуліну за методом HOMA — індекс інсулінорезистентності HOMA‑IR розраховують за формулою: інсулінемія натще (в мМО/л) × глікемія натще (в ммоль/л)/22,5; у зв’язку з пульсаційною секрецією інсуліну, вимірювання слід провести 3–4 рази та визначити середній показник.
Діагностику гіперглікемічних станів не слід проводити під час гострої фази іншого захворювання (напр., інфекції чи гострого коронарного синдрому), безпосередньо після травми чи оперативного втручання, ані під час прийому ЛЗ, що можуть підвищувати глікемію (глюкокортикостероїди, тіазидні діуретики, деякі β-блокатори).
1. Предіабет або стан підвищеного ризику ЦД діагностують у 2-х ситуаціях:
1) порушення глікемії натще (ПГН) — глікемія натще у межах 5,6–6,9 ммоль/л (100–125 мг/дл); є показанням до виконання ПГТТ;
2) порушена толерантність до глюкози (ПТГ) — глікемія через 120 хв ПГТТ у межах 7,8–11,0 ммоль/л (140–199 мг/дл).
ADA (але не PTD) дозволяє діагностувати предіабет на основі результату HbA1c 5,7–6,4 % (39–46 ммоль/моль).
2. ЦД діагностують у наступних ситуаціях (→табл. 13.1-2):
1) поява типових симптомів гіперглікемії (посилена спрага, поліурія, слабкість) і глікемія при випадковому визначенні ≥11,1 ммоль/л (200 мг/дл);
2) глікемія натще ≥7,0 ммоль/л (126 мг/дл) визначена двічі (в різні дні);
3) глікемія на 120 хв ПГТТ ≥11,1 ммоль/л (200 мг/дл). Відповідно до клінічних настанов ADA, якщо немає явних ознак гіперглікемії, слід підтвердити результат — ви можете повторно визначити глікемію з того самого зразка крові або виконати ПГТТ в інший день.
4) HbA1c ≥6,5 % (48 ммоль/моль) — лише визначена в лабораторії методом, сертифікованим NGSP, після виключення станів і захворювань, які порушують співвідношення між значенням HbA1c і середньою глікемією (→вище); якщо результат HbA1c ненадійний, використовуйте діагностичні критерії на основі концентрації глюкози в плазмі.
Критерії визначення ЦД у вагітних жінок →розд. 13.2.2.
1. Інші причини клінічних симптомів, напр., поліурії (нецукровий діабет).
2. Диференціювання типу ЦД
ЦД, що дебютує у дорослих, нагадує ЦД 2-го типу — одна з цих форм, яка в даний час класифікується як ЦД 1-го типу і має його основні ознаки (етіологія та дефіцит інсуліну), але протікає під «маскою» ЦД 2-го типу (частіше зустрічаються надмірна вага або ожиріння і/або інші ознаки метаболічного синдрому, розвивається впродовж тривалого часу і проявляється на 4–5-му десятилітті життя), є т. зв. ЦД аутоімунного ґенезу у дорослих, який повільно розвивається (заст. назва — LADA); диференційна діагностика →табл. 13.1-3. Від ЦД 1-го типу, що розвивається у молодих людей, зазвичай відрізняється менш лабільним перебігом через збережений більший секреторний резерв β-клітин острівців підшлункової залози, що може призвести до помилкового застосування пероральних цукрознижуючих засобів замість безумовного призначення інсулінотерапії; для надійного діагностування аутоімунного ґенезу ЦД необхідно виявити аутоантитіла, характерні для ЦД 1-го типу (→Діагностика).
|
Диференційні ознаки |
ЦД 1-го типу повільно прогресує
|
ЦД 2-го типу |
|
індекс маси тіла (ІМТ) |
як у загальній популяції |
ожиріння чи надлишкова вага |
|
артеріальна гіпертензія |
ні |
так |
|
ускладнений сімейний анамнез щодо ЦД |
ні |
так |
|
ускладнений сімейний або індивідуальний анамнез щодо аутоімунних захворювань |
так |
ні |
|
анти-GAD65 або інші антитіла до острівців |
так |
ні |
|
С-пептид (тест з глюкагоном) |
низька концентрація |
в нормі або на початку ↑ |
|
лікування першого ряду |
інсулін |
на початку — неінсулінові ЛЗ |
ЦД, що дебютує в молодому віці, нагадує ЦД 1-го типу і ускладнений сімейний анамнез щодо ЦД — у сім’ях, в яких спостерігається ЦД внаслідок порушення секреції інсуліну, з раннім дебютом захворювання (в молодому віці, яке здебільшого не супроводжується ожирінням) і з успадкуванням за аутосомно-домінантним типом (сімейний анамнез щодо ЦД охоплює ≥2 покоління та ранній дебют ЦД у ≥2-х родичів), при диференційній діагностиці спочатку слід враховувати ЦД MODY (→табл. 13.1-1e, диференційна діагностика →табл. 13.1-4) і шукати мутації в генах, відповідальних за його розвиток. Дебют ЦД у віці <9-ти міс. вимагає генетичного тестування на перманентний неонатальний діабет (це також стосується дорослих, якщо вони не проходили такого тестування), тобто пошуку мутацій у гені KCNJ11, що кодує білок Kir6.2, в подальшому пошук мутації в генах інсуліну, білка SUR1 та глюкокінази; рішення про пошук мутацій в інших генах приймається індивідуально в спеціалізованих центрах.
|
Диференційні ознаки |
ЦД MODY |
ЦД 1-го типу |
|
вади розвитку (головним чином нирок та сечостатевої системи) |
так/ні |
ні |
|
ускладнений сімейний анамнез щодо ЦД у ≥3-х поколіннях |
так |
ні |
|
ускладнений сімейний або індивідуальний анамнез щодо аутоімунних захворювань |
ні |
так |
|
антитіла до острівців |
ні |
так |
|
С-пептид (тест з глюкагоном) |
на початку — в нормі |
низька концентрація |
|
лікування першого ряду |
на початку — неінсулінові ЛЗ |
інсулін |
|
початок |
повільний |
скоріше гострий |
ЛІКУВАННЯвгору
Незалежно від етіології ЦД критерії його компенсації схожі і становлять цілі, що забезпечують значуще зниження ризику хронічних ускладнень ЦД. Вони стосуються досягнення цільових значень:
1) глікемії і, перш за все, HbA1c →табл. 13.1-5, а також часу, протягом якого глікемія залишається в межах цільового діапазону (time in range — TIR →табл. 13.1-14), а також вище і нижче цього діапазону у пацієнтів, які використовують автоматичні системи безперервного моніторингу глікемії (CGM);
|
Цільові показники HbA1c |
Пацієнти, яких стосуються критеріїa |
|
|
загальний критерій |
||
|
HbA1c ≤7,0 % (53 ммоль/моль) (пропонована цільова глікемія: натще та препрандіальна <7,2 ммоль/л [130 мг/дл], через 1–2 год після їжі <10 ммоль/л [180 мг/дл]; середня концентрація глюкози в плазмі ≈8,3–8,9 ммоль/л [150–160 мг/дл]) |
усі пацієнти з цукровим діабетом, для яких не визначено детальних критеріїв (→нижче), включаючи пацієнтів з ЦД 2-го типу, пацієнтів з ЦД 1-го типу, у яких досягнення цільового значення HbA1c ≤6,5 % асоціюється з підвищеним ризиком гіпоглікемії, та пацієнтів у віці >65 р., якщо очікувана виживаність складає >10-ти років |
|
|
детальні критерії |
||
|
|
HbA1c ≤6,5 % (48 ммоль/моль) (пропонована цільова глікемія, також при самоконтролі: 3,9–6,1 ммоль/л [70–110 мг/дл] натщесерце і препрандіальна та <7,8 ммоль/л [140 мг/дл] через 2 год після початку їжі) |
– у хворих на ЦД 1-го типу, для яких досягнення цієї мети не пов’язане з підвищенням ризику гіпоглікемії або погіршенням якості життя – при короткостроковому ЦД 2-го типу (<5 років) – у дітей та підлітків (незалежно від типу ЦД), коли досягнення цієї мети не пов’язане з підвищенням ризику гіпоглікемії або погіршенням якості життя |
|
HbA1c 8,0–8,5 % (64–69 ммоль/моль) (середня концентрація глюкози в плазмі натщесерце: 9,8 ммоль/л [178 мг/дл], препрандіальна 9,9 ммоль/л [179 мг/дл], постпрандіальна 11,4 ммоль/л [206 мг/дл]) |
у пацієнтів літнього віку та/або з запущеним ЦД з багаторічним перебігом і макросудинними ускладненнями (тобто після інфаркту міокарда та/або інсульту) та/або з тяжкими супутніми захворюваннями, коли очікувана виживаність становить <10 років |
|
2) АТ →табл. 13.1-6;
|
Цільовий рівень |
Детальна інформація |
|
|
загальний критерій |
||
|
|
САТ ≤130 мм рт. ст. (якщо переноситься, але не <120 мм рт. ст.) і ДАТ <80 мм рт. ст. |
– загальна мета лікування хворих на ЦД – у всіх хворих із ЦД уникайте зниження САТ <120 мм рт. ст. і ДАТ <70 мм рт. ст. – цільові значення артеріального тиску не залежать від наявності протеїнурії |
|
детальні критерії |
||
|
|
САТ 120–130 мм рт. ст. і ДАТ <80 мм рт. ст. |
оптимальний для хворих віком до 65 років |
|
САТ 130–139 мм рт. ст. і ДАТ <80 мм рт. ст.
|
– у хворих віком ≥65 років – у хворих із хронічною хворобою нирок (уникати зниження САТ <130 мм рт. ст.) |
|
|
САТ 110–139 мм рт. ст. і ДАТ 81–85 мм рт. ст. |
у вагітних із ЦД, без судинних ускладнень |
|
|
САТ 110–130 мм рт. ст. і ДАТ 70–80 мм рт. ст. |
у вагітних із ЦД і судинними ускладненнями |
|
|
ДАТ — діастолічний АТ, САТ — систолічний АТ |
||
3) концентрації ліпідів у плазмі →табл. 13.1-7;
4) маси тіла — згідно з PTD (2024), важливою метою терапії при ЦД 2-го типу, крім підтримки оптимального метаболічного контролю, є постійне зниження надмірної маси тіла; у позиції ADA і EASD (2022) та ADA (2024) щодо ЦД 2-го типу визначено принципи фармакологічного лікування, які враховують досягнення цієї мети (→нижче).
Цілі антигіперглікемічного лікування: індивідуалізація інтенсивності лікування, тобто цільові показники глікемії та швидкість їх досягнення. Не знижуйте рівень глікемії різко, оскільки це значно підвищує ризик гіпоглікемії, а у хворих із занедбаними мікроангіопатичними ускладненнями (переважно ретинопатією) може тимчасово призвести до їх прогресування. Встановлюючи індивідуальні цілі глікемії при лікуванні ЦД, враховуйте тип ЦД та тривалість захворювання, співпрацю та зусилля пацієнта, ризик гіпоглікемії, очікуваний час виживання, супутні захворювання, судинні ускладнення, доступність методів лікування та їх вартість, а також можливість забезпечення пацієнта підтримкою. У хворих похилого віку або з супутніми захворюваннями, якщо очікувана виживаність менше 10 років, можна послабити критерії компенсації глікемії до значень, при яких лікування не погіршує якість життя, і досягати цих цільових значень поступово, тобто протягом 2–3 міс. Якщо не вдається досягти цільових значень, необхідно прагнути досягти їх і максимально можливо наблизитися до них.
Лікування ЦД включає:
1) навчання пацієнтів, що є необхідною умовою для успіху лікування;
2) нефармакологічне лікування — здоровий (т. зв. терапевтичний) спосіб життя, який включає різноманітну дієту, регулярну фізичну активність, у разі надмірної ваги або ожиріння, прагнення до тривалого зниження маси тіла, уникнення вживання алкоголю, відмову від цигарок, а також забезпечення оптимальної тривалості сну та уникнення хронічного стресу;
3) гіпоглікемізуюче лікування — при цукровому діабеті 1 типу — інсулін у багаторазовій моделі або за допомогою персональної інсулінової помпи; при цукровому діабеті 2 типу — неінсулінові ЛЗ (включаючи, інкретиноміметики), а при неефективності — інсулін; усі терапевтичні рішення щодо лікування цукрового діабету, незалежно від його типу, приймайте після консультації з пацієнтом. Якщо на момент діагностики гіперглікемії помічається втрата маси тіла, ознаки дегідратації, кетонурію або ацидоз → починайте інсулінотерапію, навіть якщо є підозра на цукровий діабет 2 типу; остаточний діагноз і відповідне хронічне лікування необхідно встановити після усунення метаболічних розладів і виключення аутоімунної основи захворювання;
4) боротьба з факторами ризику серцево-судинних захворювань, особливо лікування артеріальної гіпертензії (рекомендовано при артеріальному тиску >140/90 мм рт. ст.; розпочніть терапію з комбінації 2-х ЛЗ: інгібітора ангіотензинперетворювального ферменту [АПФ] або блокатора рецепторів ангіотензину [БРА] з антагоністом кальцію або тіазидним/тіазидоподібним діуретиком) →табл. 2.20-8 і порушень ліпідного обміну →розд. 2.4.1; у пацієнтів із супутнім захворюванням серцево-судинної системи та у хворих віком >40-ка р. із ≥1-м фактором серцево-судинного ризику слід розпочинати лікування статином, незалежно від ліпідного профілю плазми;
5) лікування ускладнень ЦД.
1. Терапевтичне навчання має подібне значення, як дієтотерапія, фізичне навантаження і фармакотерапія. При ЦД 2-го типу воно здійснюється в дещо іншому напрямку, ніж при ЦД 1-го типу, оскільки має бути спрямоване насамперед на закріплення навичок і мотивацію пацієнта до здорового способу життя та діяльності, спрямованої на зниження надмірної маси тіла, щоб покращити стан здоров’я пацієнта, мінімізувати ризик розвитку ускладнень захворювання та покращити його самопочуття.
2. Мета: отримання навичок, що дозволяють самостійно впоратися із захворюванням, уникнути гострих ускладнень цукрового діабету (гіпоглікемії та гіперглікемії) та тренування таких навичок поведінки, які б полегшили співпрацю при застосуванні командного підходу до лікування і сприяли би більш суворому дотриманню рекомендацій щодо лікування; навчання з користування приладами для введення інсуліну і моніторингу глікемії.
3. При ЦД проводять індивідуальні і групові навчання, найкраще паралельно. Навчання у групі є ефективнішим, ніж індивідуальне, також корисні є т. зв. групи підтримки. Індивідуальне навчання дозволяє сфокусуватись на індивідуальних цілях лікування та врахувати конкретні проблеми окремих пацієнтів; воно є необхідним в особливих ситуаціях, при методах лікування, які рідше використовуються (напр., індивідуальні інсулінові помпи), у хворих після баріатричних операцій та у пацієнтів на програмному діалізі. Пацієнтів з ЦД 2-го типу слід з самого початку захворювання підготувати до його прогресуючого перебігу, що вимагатиме поступових змін у лікуванні.
4. Заохочуйте використання мобільних додатків, які можна застосовувати для навчання у сфері дієти, самоконтролю та цільових значень глікемії, корекції доз інсуліну або їх адаптації до здійснюваної фізичної активності (допомогти пацієнту вибрати відповідний додаток).
5. Необхідно повторювати навчальні заходи (зокрема щодо використання пристроїв для введення інсуліну та контролю рівня глюкози) та постійно контролювати їх ефекти — не лише знання хворого, а передусім, його здатність контролювати хворобу.
Усі хворі на ЦД повинні пройти навчання на тему загальних принципів правильного харчування при ЦД на момент діагностування захворювання та в наступні роки, якщо перевірка знань пацієнта в області дієтичного лікування, що проводиться один раз на рік, свідчить про таку необхідність. Детальні дієтичні рекомендації потрібно пристосовувати до потреб та побажань індивідуальних пацієнтів, надаючи їм можливість вільно обирати та складати свій раціон. Інформацію про необхідність обмеження або виключення окремих дієтичних продуктів слід надавати пацієнтам лише в обґрунтованих випадках. Час прийому їжі та вміст в ній вуглеводів у пацієнтів, які отримують інсулін, слід узгоджувати з типом застосовуваної інсулінотерапії.
1. Регулярний прийом та відповідна кількість прийомів їжі:
1) при ЦД 2-го типу, що лікується дієтою та неінсуліновими ЛЗ, достатніми є 3 прийоми їжі на добу;
2) лікування інсуліном двофазової дії (готовими сумішами) вимагає 5–6-ти прийомів їжі протягом доби;
3) лікування людським інсуліном короткої дії вимагатиме 6-ти прийомів їжі на добу (додаткове вживання другого сніданку, підвечірку та другої вечері запобігає гіпоглікемії);
4) лікування швидкодіючими аналогами інсуліну вимагає не більше, ніж 3 прийомів їжі протягом доби;
5) найбільшу свободу у прийомі їжі надає інсулінова помпа, за умов відповідного підбору дози інсуліну до потреби.
2. Відповідне споживання калорій повинно забезпечити збереження ідеальної маси тіла або поступове зниження маси тіла в осіб з ожирінням чи надлишком ваги:
1) зниження маси тіла не повинно перевищувати 2 кг/тиж., корисним є поступове зниження на 0,5–1 кг/тиж. Зниження маси тіла на ≥5 % відносно вихідної маси асоційоване з помітним покращенням контролю ЦД; існують дані, що вказують на те, що зниження початкової маси тіла на ≥7 % спричиняє зникнення стану преддіабету, а зменшення маси тіла на >15 % може призвести до ремісії ЦД 2-го типу, якщо він не був запущений.
2) постачання енергії залежить від стилю життя і від належної маси тіла (формула: від зросту в см відняти 100 [при зрості ≤164 см], при зрості 165–175 см відняти 105, a при зрості >175 см відняти 110) і становить приблизно: робота у сидячому положенні — 20–25 ккал/кг належної маси тіла; робота, що пов’язана з помірним фізичним навантаженням — 25–30 ккал/кг належної маси тіла; важка фізична праця — 30–40 ккал/кг належної маси тіла. У хворих на ЦД і надмірною вагою або ожирінням розраховане таким чином енергозабезпечення слід зменшити на 250–500 ккал/добу; безпечним вважається дефіцит калорій ≤500–750 ккал/день. Корисно поступово знижувати масу тіла на 0,5–1 кг/тиж. (не більше 2 кг/тиж.).
3. Приблизна калорійність страв кожного дня: особливо важлива для хворих, які приймають інсулін, оскільки це полегшує його дозування.
4. Якісний склад дієти: пацієнти з ЦД 1-го типу повинні вміти розрахувати вміст вуглеводів в порції їжі, що має ключове значення для підбору дози інсуліну на прийом їжі, а також вміти оцінити глікемічний ефект білків і жирів, які надходять з цієї порцією їжі.
1) вуглеводи — все рідше визначають загальний відсотковий вміст вуглеводів у дієті, оскільки є замало доступних наукових даних, які б дозволили визначити їхню оптимальну кількість для усіх хворих; рекомендується індивідуальний план дієти, залежний зокрема від інтенсивності фізичної активності, а також від того, якій їжі пацієнт надає перевагу та від різновиду вуглеводних продуктів у дієті. У середньому вміст вуглеводів у забезпеченні енергетичних потреб повинен складати ≈45 %, та якщо вони походять із продуктів із низьким глікемічним індексом (ГІ) та високим вмістом клітковини, їх споживання може становити навіть 60 % калорійності дієти. Особи з дуже високою фізичною активністю мають збільшену енергетичну потребу, в той час як в осіб із низькою фізичною активністю прийом калорій вуглеводного походження може бути нижчим. ГІ це показник, котрий дозволяє класифікувати харчові продукти, які містять вуглеводи, залежно від їх впливу на постпрандіальну глікемію (чим вищий ГІ, тим більший вплив на глікемію), причому технологія приготування їжі також має значення (напр., коротший час термічної обробки). Слід рекомендувати продукти, що містять вуглеводи з низьким ГІ (<55), у т. ч. перш за все цільнозернові продукти, а практично цілком елімінувати з дієти прості вуглеводи, які дуже швидко всмоктуються і викликають значне постпрандіальне підвищення глікемії, яке складніше контролювати. ГІ відіграє меншу роль при виборі овочів і фруктів, які містять мало вуглеводів. Вміст клітковини у дієті повинен становити 25–50 г/д (або 15–25 г на 1000 ккал). Можна застосовувати підсолоджувачі в рекомендованих виробниками кількостях, але не слід замінювати харчовий цукор (сахарозу) фруктозою.
2) білок — 15–20 % від загальної енергетичної вартості дієти (1–1,5 г/кг м. т./добу); у хворих на ЦД 2-го типу з надмірною масою тіла може складати 20–30 % калорійності дієти (не застосовуйте у хворих із діабетичним захворюванням нирок). Максимальне значення у випадку хворих із хронічним захворюванням нирок складає 0,8–1 г/кг м. т., у вагітних — 1,3 г/кг м. т., a під час захворювання, яке протікає з лихоманкою, чи в період реконвалесценції — до 1 г/кг м. т. Слід надати перевагу білку рослинного походження, рибам та свійській птиці.
3) жири — 30–35 % від загальної енергетичної вартості дієти, з обмеженням насичених жирів; обмежте споживання холестерину до <300 мг/добу (<200 мг/добу, якщо ХС ЛПНЩ ≥2,6 ммоль/л [100 мг/дл]), надавайте перевагу жирам рослинного походження;
4) кухонна сіль — ≤5 г/добу;
5) вітаміни і мікроелементи — відсутні показання для застосування у разі відсутності їх дефіциту, за винятком поповнення вітаміну D (відповідно до рекомендацій для загальної популяції), вітаміну В12 у веганів і вегетаріанців, фолієвої кислоти у вагітних жінок і іноді полівітамінних добавок у людей похилого віку, після баріатричних операцій або при використанні дуже низькокалорійних дієт;
6) алкоголь — у хворих із ЦД споживання алкоголю не показане, може сприяти виникненню гіпоглікемії (гальмує вивільнення глюкози печінкою) і його необхідно враховувати до енергетичного балансу.
З огляду на численні позитивні сторони фізична активність є обов’язковою складовою лікування хворих на ЦД; повинна бути систематичною та пристосованою до можливостей пацієнта, виконуватись ≥2–3 ×/тиж., а найкраще — щодня. Усім хворим на ЦД, які не мають протипоказань до фізичних навантажень, можна рекомендувати аеробні навантаження, які виконуються до моменту появи задишки, а хворим на ЦД 2-го типу — додатково елементи силового навантаження. Виникнення епізоду тяжкої гіпоглікемії є протипоказанням для фізичних вправ протягом наступних 24 год. Особи з ЦД 1-го типу, без значних хронічних ускладнень, можуть виконувати будь-які види фізичних вправ, навіть максимальної інтенсивності.
1. Принципи безпечного виконання фізичного навантаження при ЦД 1-го типу: необхідно добре підготувати пацієнта, щоб він зміг самостійно оцінити ступінь і тривалість навантаження та потребу в інсуліні та додаткових вуглеводах, і уникати форсованого фізичного навантаження, якщо у хворого присутні занедбані ускладнення ЦД. Пацієнт повинен:
1) контролювати глікемію за допомогою:
а) системи CGM (роль терапевтичної групи: допомога у виборі оптимального пристрою, навчання інтерпретації результатів та експлуатації системи, у т. ч. індивідуальне програмування вищих порогів тривоги гіпоглікемії на час фізичної активності) або
б) якщо CGM недоступний, виміряти рівень глюкози в крові: ≈15 хв до фізичного навантаження, потім під час фізичного навантаження та протягом кількох годин після його завершення;
2) приймати додаткові вуглеводи перед навантаженням та щогодини під час навантаження, а також після його завершення, особливо, якщо навантаження тривало довше, в кількості:
а) 1,0–1,5 г/кг маси тіла/год інтенсивного фізичного навантаження під час максимального ефекту болюсу інсуліну, який не було зменшено;
б) 0,2–0,5 г/кг маси тіла/год інтенсивного фізичного навантаження під час максимального ефекту болюсу інсуліну, який було зменшено або введено <2 год після початку фізичної активності;
3) не вводити інсулін в ділянку тіла, яка особливо інтенсивно бере участь у навантаженні (напр., у стегно);
4) зменшити дозу інсуліну перед навантаженням: інсулін короткої дії на 25–75 % (залежно від часу та інтенсивності запланованого фізичного навантаження) та аналог інсуліну швидкої дії, якщо навантаження починається <2 год після його введення і має тривати ≥30 хв; якщо планується тривала вправа на витривалість, подумайте про зменшення дози базального інсуліну;
5) при використанні персональної інсулінової помпи зменшити базальну подачу інсуліну на 20–80 % залежно від інтенсивності та тривалості запланованого навантаження, бажано за 2 год до його початку; також можна відключити інсулінову помпу під час тренування на ≤3 год;
6) якщо глікемія становить >13,9 ммоль/л (250 мг/дл) — визначити кетонові тіла у сечі, а при їх наявності слід уникати навантаження (дуже інтенсивне навантаження може посилити гіперглікемію та кетоз).
2. Принципи безпечного виконання фізичного навантаження при ЦД 2-го типу:
1) систематичне фізичне навантаження з відповідною інтенсивністю є одним із основних методів лікування ЦД 2-го типу — його метою є зниження маси тіла та резистентності тканин до інсуліну;
2) ризик гіпоглікемії у пацієнтів, які застосовують дієту та неінсулінові ЛЗ, є низьким (пацієнтам з надлишком ваги або ожирінням слід уникати вживання додаткових вуглеводів під час навантаження);
3) у хворих на інсулінотерапії →вище;
4) пацієнт повинен систематично (найкраще щоденно, напр., впродовж 30–45 хв) виконувати помірно інтенсивне фізичне навантаження, що пристосоване до загального стану здоров’я та попереднього стилю життя; для пацієнтів у віці >65 років і/або з надмірною вагою відповідною формою фізичного навантаження є прогулянка швидким темпом (до появи задишки) 3–5 × на тиж. (≈150 хв/тиж.);
5) більше фізичне навантаження, якщо пацієнт його добре переносить, є показаним декілька разів на тиждень, а не лише спорадично; повинно починатись та закінчуватись легшими вправами, які виконують протягом 5–10 хв;
6) при рівні глікемії >16,7 ммоль/л (300 мг/дл), пацієнт повинен визначити кетонові тіла у сечі за допомогою тест-смужки, при підтвердженні кетонурії — уникати навантаження (дуже інтенсивне навантаження може посилити гіперглікемію та кетоз).
Невідповідна якість і занадто коротка тривалість сну можуть призвести до погіршення метаболічної компенсації ЦД, тому забезпечення належної якості та тривалості сну стає важливою метою лікування ЦД. Для цього необхідно уникати факторів, що призводять до гіпер- та гіпоглікемії, і віддавати перевагу схемі лікування ЦД, яка забезпечує стабілізацію та компенсацію глікемії у вечірній та нічний час.
1. Показання до інсулінотерапії: всі форми ЦД 1-го типу, в т. ч. LADA, є абсолютним показанням до інсулінотерапії через дефіцит інсулін з моменту дебюту захворювання.
2. Види інсуліну
Поділ за хімічною будовою: людський інсулін та аналоги людського інсуліну (отримані методами генної інженерії).
Поділ за тривалістю дії →табл. 13.1-8
|
Різновиди інсулінівa |
Дія |
|||
|
початкова |
максимальна |
діапазон |
||
|
швидкодіючі аналоги інсуліну |
аспарт ультрашвидкий аспарт |
10–20 хв 10 хв |
1–3 год 1–2 год |
3–5 год 3–4 год |
|
глюлізин |
10–20 хв |
1–2 год |
3–5 год |
|
|
ліспро (зокрема препарат 200 ОД/мл) |
15 хв |
40–60 хв |
3–5 год |
|
|
інсуліни короткої дії |
нейтральний |
30 хв |
1–3 год |
6–8 год |
|
інсуліни середньої тривалості дії |
ізофановий (НПХ) |
0,5–1,5 год |
4–12 год |
18–20 год |
|
aналоги інсуліну пролонгованої дії |
1,5–2 год |
3(4)–14 год |
≤24 год |
|
|
гларгін (зокрема препарат 300 ОД/мл) |
1,5–2 год |
відсутній пік |
24 год |
|
|
деглюдек (препарати 100 і 200 ОД/мл) |
|
відсутній пік |
48–72 год |
|
|
a Всі препарати, де їх концентрація не вказана, мають концентрацію 100 ОД/мл. |
||||
1) прандіальний інсулін:
а) швидкодіючі аналоги інсуліну — вводять п/ш найчастіше безпосередньо перед початком прийому їжі, але можна під час або навіть після їжі, зазвичай 3 × на день; також використовуються п/ш в персональних інсулінових помпах; короткочасність дії дозволяє скоротити кількість прийомів їжі;
б) людський інсулін короткої дії (нейтральний інсулін) — вводять п/ш за 30 хв до основних прийомів їжі, 3 × на день; внаслідок більшої тривалості дії (→рис. 13.1-2) пацієнти потребують додаткових прийомів їжі →вище; також використовується в персональних інсулінових помпах;
2) базальний інсулін, що імітує базальну секрецію ендогенного інсуліну:
а) інсуліни середньої тривалості дії (НПХ) — у поєднанні з інсуліном короткої дії вводять п/ш 1 × на день (ввечері), а в комбінації з швидкодіючими аналогами — зазвичай 2 × на день (вранці і ввечері);
б) аналоги інсуліну тривалої дії — зазвичай застосовують 1 × на день п/ш (вранці або ввечері, у визначений час); інсулін детемір у поєднанні зі швидкодіючими аналогами вводять 1–2 × на день п/ш (вранці та ввечері) залежно від потреб; перевагою є рівномірна в часі концентрація в крові (→рис. 13.1-3), що полегшує ведення інтенсивної інсулінотерапії; більшу повторюваність і стабільність глікемії забезпечують аналоги інсуліну підвищеної концентрації — гларгін (300 МО/мл) і деглюдек (200 МО/мл), що містять відповідно в 3 і 2 рази більше одиниць інсуліну на одиницю об’єму, ніж базові препарати (100 МО/мл); розгляньте можливість їх застосування, особливо у хворих, які приймають високі дози базального інсуліну (вища концентрація препарату дозволяє п/ш вводити менший об’єм розчину);
в) базальну секрецію інсуліну також імітують швидкодіючі аналоги інсуліну або людські інсуліни короткої дії при в/в введенні через інфузомат або при безперервній підшкірній інфузії з використанням персональної інсулінової помпи.
3. Вибір типу інсуліну та режиму інсулінотерапії: здійснюють індивідуально, враховуючи спосіб життя, рівень активності та час прийому їжі в окремих хворих.
Інтенсивна інсулінотерапія з використанням багаторазових ін’єкцій інсуліну на добу: базальна концентрація інсуліну досягається введенням 1 × на день ізофан-інсуліну (neutral protamine Hagedorn — NPH) із середньотривалою (пролонгованою) дією або аналога тривалої дії, при цьому постпрандіальне збільшення інсулінемії забезпечується препрандіальними ін’єкціями інсулінів короткої дії (рис. 13.1-2) або швидкодіючих аналогів 3 × на день (рис. 13.1-3) — це базал-болюсний режим.
Використання швидкодіючих аналогів інсуліну під час їжі може вимагати 2 ін’єкцій інсуліну НПХ або використання аналога інсуліну тривалої дії 1 × на день.
Приклади схем багаторазового введення:
1) 4 ін’єкції:
а) інсулін короткої дії перед сніданком (20–25 % добової дози), перед обідом (15 %) і перед вечерею (20 %);
б) інсулін пролонгованої дії (NPH) або аналог тривалої дії перед сном прибл. о 22:00 (40 % добової дози);
2) 5 ін’єкцій:
а) швидкодіючий аналог перед сніданком (20 % добової дози), перед обідом (20 %), перед першою вечерею прибл. о 17.00–18.00 (10 %);
б) НПХ перед сніданком (25 %) і перед другою вечерею (25 %).
Інтенсивна функціональна інсулінотерапія: є рекомендованим лікуванням ЦД 1-го типу; є розвитком попереднього методу або може проводитися за допомогою персональної інсулінової помпи. Її «функціональність» полягає в тому, що в залежності від передбачуваного часу і складу їжі (з урахуванням її глікемічного індексу), а також запланованих фізичних навантажень і початкової глікемії добре підготовлений пацієнт самостійно змінює час прийому і дозу інсуліну. При використанні персональної інсулінової помпи подібні модифікації можуть застосовуватися як щодо базальної інфузії (бази), так і до прандіальних ін’єкцій (болюсів). У хворих з ЦД 1-го типу перевагу надають аналогам інсуліну через менший ризик гіпоглікемії та кращу якість життя. Використання CGM у хворих з ЦД 1-го типу, які отримують цю модель інсулінотерапії, допомагає знизити показник HbA1c і підтримувати його в бажаному діапазоні.
4. Сучасні пристрої для введення інсуліну
Індивідуальні інсулінові помпи: вводять швидкодіючий аналог інсуліну у безперервній п/ш інфузії, використовуються все частіше (у Польщі підлягають реімбурсації для пацієнтів віком <26 років). У нових мініатюрних помпах як базальна інфузія, так і болюси можуть зазнавати багатьох модифікацій. Базальна інфузійна доза, як правило, повинна бути вищою вночі, щоб компенсувати підвищену продукцію глюкози печінкою. Запускаючи прандіальні болюси, можна змінювати дозу інсуліну та швидкість його введення залежно від складу їжі та її глікемічного індексу.
Індивідуальні інсулінові помпи особливо корисні при лабільному ЦД, при наявності феномену «ранкової зорі» (гіперглікемія раннім ранком і перед сніданком) і в ситуаціях, коли необхідно періодично беззастережно прагнути до нормоглікемії (напр., під час вагітності або під час лікування синдрому діабетичної стопи). Показаннями для використання персональної інсулінової помпи також є: необхідність використання низьких доз інсуліну (напр., у дітей і вагітних), неможливість досягти задовільної метаболічної компенсації за допомогою багатократних ін’єкцій інсуліну, рецидивні непередбачувані епізоди гіпоглікемії або безсимптомні гіпоглікемії, а також нерегулярний спосіб життя і нерегулярне харчування. Лікування вимагає відповідного коригування доз інсуліну відповідно до типу та кількості споживаних вуглеводів і фізичної активності. У цьому допомагає програмне забезпечення помпи, яке зокрема включає «болюс-калькулятор». При застосуванні інсулінових помп необхідно враховувати ризик припинення інфузії (ацидоз може виникнути швидше при застосуванні аналогів, ніж при застосуванні людського інсуліну), інфекції в місці підшкірної ін’єкції та гіпоглікемії (якщо доза, введена шляхом базальної інфузії, є занадто високою по відношенню до споживання калорій).
Важливою є можливість поєднання використання CGM з інсуліновими помпами, особливо з тими, які мають функцію автоматичного припинення інфузії інсуліну в разі ризику гіпоглікемії (так звана гіпоблокада). Окрім широкого використання персональних помп при ЦД 1-го типу, їх все частіше використовують у специфічних ситуаціях при ЦД 2-го типу. З точки зору користувача, при виборі помпи слід враховувати: ціну та наявність в Україні, очікувану користь від використання та здатність самостійно користуватися пристроєм, наявність функції болюс-калькулятора (і вміння ним користуватися), місткість інсулінового контейнера, довговічність батареї (час роботи приладу), наявність згаданої функції гіпоблокади (що підвищує безпеку терапії), довжина дренажів або система без дренажів, зручність використання для лівшів і водонепроникність.
Інсулінова помпа з контролем глікемію (помпа замкнутого циклу): все частіше використовуються гібридні помпи замкнутого циклу, тобто вони автоматично вводять інсулін під час базальної інфузії, тобто вночі та між прийомами їжі, без втручання пацієнта, лише на основі даних, отриманих від пов’язаної з помпою системи CGM (звідси її назва: «помпа замкнутого циклу»), яка значно поліпшує якість життя та безпеку пацієнтів, захищаючи їх від епізодів неусвідомленої гіпоглікемії та запобігаючи гіперглікемії. Ефективність системи замкнутого циклу залежить від якості та точності алгоритмів контролю підшкірної інфузії інсуліну та чутливості датчика системи CGM. Помпа з замкнутим циклом не є повністю автоматичною і потребує ручного введення інформації про кількість вуглеводів, які будуть спожиті під час наступних прийомів їжі, що необхідно для автоматичного розрахунку дози прандіального болюса — звідси її назва: «гібридний». Користувач самостійно вирішує ввести прандіальний болюс інсуліну, розмір якого розраховується болюс-калькулятором на основі наданої інформації про споживані вуглеводи. Крім того, здійснення фізичного навантаження користувачем системи замкнутого циклу вимагає прийняття рішень і модифікацій терапії, що вказує на необхідність окремого навчання щодо цього питання. Система прогнозування ризику гіпоглікемії постійно активна і в такій ситуації короткочасно припиняє інфузію інсуліну, а потім автоматично відновлює її, коли загроза мине. Ця дія відбувається без втручання користувача. Інтенсивні дослідження цих пристроїв ще тривають та їх продовжують вдосконалювати. Їх застосування дозволяє уникнути гіпоглікемії, в тому числі безсимптомної та нічної гіпоглікемії, а також діабетичного кетоацидозу; дозволяє підтримувати задовільну компенсацію глікемії без необхідності постійного її контролю та приймати рішення щодо дозування інсуліну. Це призводить до зростання інтересу до цих систем, проте для багатьох пацієнтів їх висока вартість становить перешкоду.
Помпа замкненого циклу на основі відкритого застосунку APS (do-it-yourself artificial pancreas system — DIY APS): пристроями, що працюють за принципом, подібним до гібридних помп замкнутого циклу, є помпи на основі відкритого застосунку APS (artificial pancreas system), що дозволяє поєднати CGM та інсулінову помпу у замкнуту систему (DIY APS), що може значущо поліпшити метаболічний контроль ЦД. Однак слід підкреслити, що встановлення та адаптація застосунку до індивідуальних потреб вимагає значної участі пацієнта, і що ці системи, хоча й легкодоступні, є експериментальними та не мають відповідних сертифікатів безпеки (отже, пацієнт несе відповідальність за їх використання). Незалежно від типу використовуваної системи, пацієнтам потрібне відповідне модифіковане навчання, яке враховує специфіку цих пристроїв.
Біонічна підшлункова залоза iLet: більш досконала, найсучасніша замкнута система, схвалена FDA у травні 2023 року для людей віком ≥6 років із ЦД 1-го типу, яка включає помпу Beta Bionics iLet ACE та програмне забезпечення iLet Dosing Decision із сумісним інтегрованим постійним моніторингом глікемії (iCGM). Ця нова система автоматичного дозування інсуліну вимагає, щоб сигналізувати про прийом їжі та визначити, чи кількість вуглеводів у їжі «низька», «середня» чи «висока». Без подальшої участі користувача система сама контролює подачу інсуліну; не можна змінити налаштування системи або ввести додаткові дози інсуліну. Ця система може значно зменшити тягар лікування ЦД 1-го типу для багатьох пацієнтів.
5. Альтернативні методи лікування ЦД 1-го типу:
1) трансплантація підшлункової залози — найчастіше у пацієнтів з нирковою недостатністю, яким трансплантують нирку разом із підшлунковою залозою;
2) трансплантація острівців Лангерганса — пов’язана з меншим ризиком, ніж трансплантація підшлункової залози, і дозволяє досягти повної нормоглікемії, але з часом функція трансплантованих клітин порушується;
3) імплантована інсулінова помпа з контролем глікемією — пристрій, що працює за принципом замкнутого циклу, тобто дозування інсуліну або інсуліну та глюкагону в залежності від поточної глікемії — перебуває у фазі клінічних досліджень.
Принцип сучасного лікування ЦД полягає в тому, щоб враховувати та лікувати всі супутні порушення, а не обмежуватися лише контролем глікемії; особливо при лікуванні ЦД 2-го типу, при якому, крім порушень вуглеводного обміну, часто зустрічаються також порушення ліпідного обміну, артеріальна гіпертензія та інші серцево-судинні захворювання. Прийняті на сьогодні критерії компенсації ЦД вимагають здійснення такого різноспрямованого лікування (→табл. 13.1-5, табл. 13.1-6, табл. 13.1-7). Необхідно прагнути до зниження маси тіла у разі надмірної маси тіла або ожиріння, що — відповідно до рекомендацій ADA і EASD (2022) та ADA (2024) — стало новою метою в лікуванні ЦД 2-го типу, а найсильнішими ЛЗ, що сприяють зниженню маси тіла, є семаглутид і тирзепатид. Польське товариство діабетологів — PTD (2024), у своєму цілісному підході до стратегій зниження ризику ускладнень діабету, перераховує нормалізацію маси тіла як рівну нормалізації глікемії, артеріального тиску та ліпідного профілю, а також профілактику серцево-судинних ускладнень, тобто відповідний вибір ліків, але не визначає принципи зниження маси тіла чи цільові значення. Менеджмент, що включає підвищення фізичної активності, відповідну дієту, застосування протидіабетичних препаратів і лікування артеріальної гіпертензії та дисліпідемії, знижує ризик ускладнень у пацієнтів з ЦД 2-го типу. Суттєвою особливістю сучасного лікування цукрового діабету є індивідуальний підхід до кожного пацієнта, як при визначенні інтенсивності лікування та його цілей, так і при виборі препаратів. Усі терапевтичні рішення щодо лікування ЦД слід приймати після консультації з хворим. Підкреслюється необхідність оцінки серцево-судинного ризику та серцевої недостатності, а також функції нирок на кожному етапі лікування цукрового діабету, у т. ч. перед введенням змін у терапію, що використовується. У пацієнтів із задокументованим атеросклеротичним серцево-судинним захворюванням, серцевою недостатністю, хронічною хворобою нирок або співіснуванням кількох серцево-судинних факторів ризику при виборі препаратів слід передусім враховувати їхню серцево-судинну та нефропротекторну дію.
1. Класифікація антигіперглікемічних ЛЗ залежно від механізму дії
Неінсулінові ЛЗ, що підвищують секрецію інсуліну:
1) діють на β-клітини підшлункової залози — похідні сульфонілсечовини (гліклазид, гліквідон, глімепірид, гліпізид — стимулюють β-клітини острівців до збільшення секреції інсуліну шляхом зв’язування з рецептором SUR1; відрізняються силою і тривалістю дії);
2) діють на інкретинову систему
а) інгібітори дипептидилпептидази 4 (ДПП-4), т. з. гліптини (алогліптин, лінагліптин, саксагліптин, ситагліптин і вілдагліптин — сильні селективні інгібітори ДПП-4, пригнічують інактивацію ендогенних інкретинів [ГПП-1 і ГІП], спричиняють підвищення їх концентрації в крові, підвищують чутливість β-клітин до глюкози та глюкозозалежну секрецію інсуліну, використовуються п/о);
б) агоністи рецепторів ГПП-1 (дулаглутид, ексенатид пролонгованої дії [тривалої дії], ліраглутид, ліксисенатид, семаглутид — активують рецептор ГПП-1, що збільшує глюкозозалежну секрецію інсуліну, пригнічують секрецію глюкагону, затримують спорожнення шлунка, знижують апетит і сприяють зниженню маси тіла [ефект залежить від препарату та дози], характеризуються стійкістю до перетравлення специфічною ДПП-4 і діють набагато довше, ніж ГПП-1, потребують п/ш введення, лише семаглутид доступний у п/ш і п/о формах;
в) подвійний агоніст рецепторів GIP і GLP-1 (тирзепатид, новітній препарат із цукрознижувальною дією, що підтримує зниження надлишкової маси тіла з високою ефективністю, застосовується п/ш 1 × на тиж.).
Неінсулінові ЛЗ периферичної дії:
1) що знижують резистентність до інсуліну
а) похідні бігуаніду (метформін — пригнічує виробництво глюкози в печінці, посилює анаеробний метаболізм глюкози, підвищує чутливість до інсуліну, спричиняє зменшення маси тіла, поліпшує ліпідний профіль і знижує артеріальний тиск);
б) похідні тіазолідиндіону (агоністи ядерного рецептора PPAR-γ), т. зв. глітазони (піоглітазон — знижує резистентність до інсуліну в клітинах жирової тканини, скелетних м’язів і печінки, а отже, знижує концентрацію вільних жирних кислот і глюкози в крові);
2) що посилюють глюкозурію — інгібітори натрій-глюкозного котранспортера 2, відповідального за реабсорбцію ≈90 % глюкози з сечі (інгібітори SGLT2, так зв. флозини — дапагліфлозин, емпагліфлозин, ертугліфлозин і канагліфлозин — обмежують реабсорбцію глюкози в проксимальному канальці нефрону і таким чином збільшують екскрецію її надлишку з сечею (глюкозурія без супутньої гіперглікемії), можуть сприяти втраті маси тіла та знижують артеріальний тиск;
3) що уповільнюють перетравлення вуглеводів — інгібітори α-глюкозидази (акарбоза — має в ≈100 000 разів більшу спорідненість до α-глюкозидази [фермент щіткової облямівки кишкових ворсинок], ніж олігосахариди, викликаючи тимчасове майже повне блокування її дії, що уповільнює кінцевий ферментативний етап перетравлення полісахаридів, олігосахаридів і деяких дисахаридів [мальтози, сахарози]).
2. Принципи вибору лікарських засобів
Протидіабетичні ЛЗ застосовують як монотерапію або в комбінованій терапії, поєднуючи ЛЗ різних груп (→табл. 13.1-9, табл. 13.1-10) або окремі з них з інсуліном для досягнення цільової компенсації глікемії. Неінсулінові ЛЗ — це переважно (окрім агоністів рецептора ГПП-1) пероральні протидіабетичні ЛЗ, які, окрім нефармакологічних методів, відіграють основну роль у лікуванні ЦД 2-го типу. При виборі та комбінації також враховуйте їхній вплив на неглікемічні фактори, включаючи ризик смерті, серцево-судинні захворювання, функцію нирок, масу тіла, ризик гіпоглікемії та ліпідний обмін, і відповідно індивідуалізуйте терапію (→табл. 13.1-11).
|
ЛЗ |
Дозування |
|
похідні бігуаніду (п/о) |
|
| метформін |
спочатку 0,5 або 0,85 г/добу 1 × на день, або 0,5 г 2 × на день (з ранковим і вечірнім прийомом їжі); можна збільшити на 0,5 г/тиж. до зазвичай 2 × 1,0 г або 3 × 0,85 г, макс. 3 год/добу; при виникненні побічних ефектів з боку ШКТ рекомендуйте приймати препарат під час їжі або зменшити дозу до попередньої, добре переносимої (згодом можна вкотре спробувати збільшити дозу) препарати з модифікованим двоступеневим вивільненням — спочатку 0,5 г 1 × на день під час вечірнього прийому їжі; можете збільшувати на 0,5 г/тиж., до макс. 2 г 1 × на день дозування та контроль залежно від функції нирок: рШКФ: <30 мл/хв/1,73 м2) → не застосовуйте метформін; 30–44 → не починайте лікування метформіном, але можна продовжити застосування ЛЗ у зниженій на 50 % дозі, з моніторингом функції нирок кожні 3 міс.; 45–59 → можна продовжувати лікування метформіном, з моніторингом функції нирок кожні 3–6 міс.; ≥60 → моніторинг ниркової функції раз на рік |
|
переваги: не призводять до збільшення маси тіла чи гіпоглікемії; зменшують інсулінорезистентність; вважаються ЛЗ першої лінії для хворих на ЦД 2-го типу недоліки: найчастіше транзиторно, зазвичай на 1–2 тиж. застосування, спричиняють діарею, нудоту, блювання, метеоризм, появу металічного присмаку в роті; при невірному застосуванні — ризик лактацидозу; підвищений ризик дефіциту вітаміну B12 протипоказання: гіпоксія (дихальна, серцева недостатність), ішемія великих органів (ішемічний інсульт, занедбана ІХС та інфаркт міокарда, ішемія нижніх кінцівок), ниркова недостатність (дозування та моніторинг →вище), пошкодження печінки (при помірному підвищенні активності печінкових ензимів, напр., при стеатозі печінки, можна застосувати, але з обережністю), зловживання алкоголем |
|
|
похідні сульфонілсечовини (п/о) |
|
|
гліклазид (зокрема у формі таблеток з модифікованим або пролонгованим вивільненням) |
80–320 мг/добу, розділених на 2 прийоми, за 30 хв до їжі; таблетки з модифікованим або пролонгованим вивільненням 30 мг 1 × на день (під час сніданку), збільшувати поступово (на 30 мг кожні 2 тиж.), до макс. 120 мг/добу |
| гліквідон |
15–60 мг/добу (під час сніданку); вищі дози (переважно до 120 мг/добу) — розділені на 2–3 прийоми |
| глімепірид |
1 мг 1 × на день (безпосередньо перед сніданком), поступово збільшуйте кожні 1–2 тиж.; зазвичай, 1–4 мг (макс. 6 мг) 1 × на день |
|
гліпізид |
2,5–20 мг 1 × на день (перед сніданком); >15 мг/добу, розділених на 2 прийоми (перед головними прийомами їжі); таблетки GITS 5–20 мг/добу 1 × на день (під час сніданку) |
|
принципи дозування: переважно починайте від мінімальної дози, поступово збільшуйте кожні 1–2 тиж., залежно від глікемії; залежно від препарату прийом ЛЗ одразу перед першим головним прийомом їжі (препарати, які приймають 1 × на день) або 2 × на день (перед головними прийомами їжі). Якщо пропущено дозу ЛЗ, не слід збільшувати наступну дозу. переваги: швидка дія; просте дозування препаратів з модифікованим вивільненням недоліки: збільшення маси тіла; ризик гіпоглікемії (особливо у пацієнтів старшого віку, або під час надмірного фізичного навантаження чи внаслідок взаємодії з ацетилсаліциловою кислотою, іншими НПЗП, сульфаніламідами, антикоагулянтами та алкоголем) |
|
|
інгібітори натрій-глюкозного котранспортера 2 (SGLT2), т. зв. флозини (п/о) |
|
|
дапагліфлозин (також зареєстрований препарат у комбінації з метформіном) |
10 мг 1 × на день, незалежно від прийому їжі 1 табл. (5 мг + 0,85 г або 5 мг + 1,0 г) 2 × на день під час їжі |
|
емпагліфлозин (також зареєстрований препарат у комбінації з метформіном) |
10 мг 1 × на день (макс. 25 мг 1 × на день), незалежно від прийому їжі 1 табл. (12,5 мг + 1 г) 2 × на день під час їжі |
|
eртугліфлозин (не зареєстрований в Україні) |
5–15 мг 1 × на день |
|
канагліфлозин (не зареєстрований в Україні) |
100 мг 1 × на день (макс. 300 мг 1 × на день), незалежно від прийому їжі |
|
переваги: просте дозування, не викликають гіпоглікемії (при застосуванні в монотерапії), ані приросту маси тіла; ЛЗ цієї групи (емпагліфлозин, канагліфлозин, а також дапагліфлозин) знижують серцево-судинний ризик, у т. ч. ризик смерті від серцево-судинних причин (емпагліфлозин), знижують ризик прогресування серцевої недостатності та гальмують прогресування ниркової недостатності при ЦД (через їх нефропротекторний ефект вони показані навіть тоді, коли їх антигіперглікемічний ефект є вкрай слабким через зниження рШКФ) недоліки: грибкові інфекції статевих органів, поліурія, артеріальна гіпотензія, дегідратація, підвищений ризик еуглікемічного кетоацидозу, підвищений ризик ампутації у хворих на діабетичну виразку стопи; не застосовуйте в осіб, які приймають петльові діуретики, і при всіх станах, коли існує ризик зневоднення або коли зниження артеріального тиску є небажаним; ≥1 × на рік слід оцінити функцію нирок, під час лікування забезпечувати належну гідратацію та запобігати синдрому діабетичної стопи |
|
|
агоністи рецептора глюкагоноподібного пептиду-1 (ГПП‑1) п/ш [семаглутид: п/ш або п/о]) |
|
|
ексенатид пролонгованого вивільнення |
призначають у фіксованій дозі 2 мг 1 × на тиж. п/ш у стегно, живіт або верхню частину плеча, незалежно від прийому їжі, у будь-який час доби |
|
дулаглутид |
п/ш у стегно, живіт або верхню частину плеча у дозі 0,75 мг 1 × на тиж. (як монотерапія) або 1,5 мг 1 × на тиж. (у комбінації з іншими протидіабетичними ЛЗ) |
|
ліксисенатид (комбінований препарат з інсуліном гларгін) |
спочатку 10 мкг п/ш 1 × на день протягом 14 днів, в подальшому 20 мкг/добу комбінований препарат: дозувати індивідуально, не перевищувати початкову дозу ліксисенатиду 10 мкг/добу п/ш. У хворих, які не отримують інсулін, спочатку використовуйте: 10 одиниць інсуліну гларгін і 5 мкг ліксисенатиду. Шприц-ручка 10–40 забезпечує дози в діапазоні 10–40 ОД інсуліну гларгіну та 5–20 мкг ліксисенатиду; шприц-ручка 30–60 забезпечує дозу 30–60 ОД інсуліну гларгін та 10–20 мкг ліксисенатиду |
| ліраглутид |
спочатку 0,6 мг п/ш 1 × на день протягом ≥1 тиж., потім 1,2 мг/добу; після ≥1 тиж. можете збільшити дозу до 1,8 мг/добу |
|
семаглутид п/ш, п/о |
п/ш препарат: спочатку 0,25 мг 1 × на тиж., через 4 тиж. збільшити до 0,5 мг 1 × на тиж., після ≥4 тиж. можна збільшити до 1 мг × на тиж., а за необхідності після ≥4 тиж. до 2 мг 1 × на тиж. п/о препарат: спочатку 3 мг 1 × на день, через місяць збільшити дозу до 7 мг 1 × на день, після ≥1 міс. максимальна доза 14 мг/добу за потреби |
|
переваги: сприяють зниженню маси тіла, не викликають гіпоглікемії; деякі препарати мають пролонговану дію, що дозволяє застосовувати їх 1 × на тиж. (ексенатид пролонгованого вивільнення, альбіглутид, дулаглутид та семаглутид); вони знижують ризик серцево-судинних подій і їм надається перевага при серцево-судинних захворюваннях на фоні атеросклерозу (ліраглутид, семаглутид, альбіглутид, дулаглутид), уповільнюють прогресування діабетичної хвороби нирок, а також мікросудинних ускладнень, але не було доведено, що вони пригнічують прогресування серцевої недостатності недоліки: часті скарги з боку ШКТ, нудота; дуже рідко — гострий панкреатит (при підозрі негайно відмініть ЛЗ); скарги з боку жовчного міхура (семаглутид); протипоказаний пацієнтам із тяжкою нирковою недостатністю, необхідний моніторинг у випадку пацієнтів із діабетичною ретинопатією, які отримують лікування семаглутидом; було помічено погіршення ретинопатії, можливо, через швидку компенсацію глікемії |
|
|
подвійний агоніст рецепторів глюкозозалежного інсулінотропного пептиду (GIP) і ГПП-1 (п/ш) |
|
|
тирзепатид |
п/ш спочатку 2,5 мг 1 × на тиж. протягом 4 тиж., потім по 5 мг 1 × на тиж. протягом ≥4 тиж., потім можна збільшити до 7,5 мг 1 × на тиж., а після ≥4 тиж. до 12,5 мг 1 × на тиж. і ще через ≥4 тиж. до макс. дози — 15 мг 1 × на тиж. (виробник ЛЗ вказує наступні підтримуючі дози — 5, 10 і 15 мг) |
|
переваги: сильний ефект, що сприяє зниженню маси тіла, не викликає гіпоглікемії; має пролонговану дію недоліки: часті скарги з боку ШКТ, нудота; дуже рідко — гострий панкреатит (при підозрі слід негайно відмінити ЛЗ), жовчнокам’яна хвороба, холецистит |
|
|
інгібітори дипептидилпептидази 4 (ДПП-4), т. зв гліптини (п/о) |
|
|
лінагліптин |
при монотерапії або комбінованому лікуванні з метформіном, з метформіном і похідним сульфонілсечовини або з інсуліном — 5 мг 1 × на день в один і той же час, під час їжі або незалежно від прийому їжі; при комбінованій терапії не змінюйте дозу метформіну, розгляньте доцільність зниження дози сульфонілсечовини або інсуліну, щоб зменшити ризик гіпоглікемії |
|
(зокрема в Україні зареєстрований препарат у комбінації з метформіном) |
як монотерапія або в комбінації з метформіном і/або похідним сульфонілсечовини, з похідними тіазолідиндіону або з інсуліном: 5 мг 1 × на день |
|
як монотерапія або в комбінації з метформіном і/або похідним сульфонілсечовини, з похідним тіазолідиндіону (також з метформіном) або з інсуліном (з метформіном або без нього) — 100 мг 1 × на день п/о (під час їжі або незалежно від прийому їжі); при комбінованій терапії не змінюйте дозування метформіну, розгляньте доцільність застосування нижчої дози сульфонілсечовини або інсуліну для зниження ризику гіпоглікемії |
|
|
вілдагліптин
|
як монотерапія, якщо не можна застосовувати метформін; комбінована терапія з метформіном, з похідним сульфонілсечовини та метформіном, з похідним тіазолідиндіону або з інсуліном (з метформіном або без нього): 50 мг 2 × на день п/о (під час їжі або незалежно від прийому їжі); комбіноване лікування з похідними сульфонілсечовини: 50 мг 1 × на день (вранці); макс. 100 мг/добу по 1 табл. 2 × на день |
|
переваги: ЛЗ цієї групи не спричиняють збільшення маси тіла і не викликають гіпоглікемію; вілдагліптин — його застосування у людей похилого віку добре задокументовано; лінагліптин — єдиний гліптин, який не виводиться із сечею, не потребує відміни або зміни дозування у хворих з нирковою недостатністю недоліки: нудота; біль голови і запаморочення (частіше після вілдагліптину); рідше — надмірна сонливість, біль в епігастральній ділянці, закреп (при комбінованій терапії з похідним сульфонілсечовини) або діарея (при комбінованому лікуванні ситагліптином і метформіном); можливе підвищення ризику серцевої недостатності (саксагліптин); підвищений ризик гіпоглікемії (при комбінованому лікуванні похідним сульфонілсечовини або інсуліном → спочатку зменште дози цих ЛЗ); при нирковій недостатності зменште дозу або відмініть ЛЗ (за винятком лінагліптину); дуже рідко реакції гіперчутливості (напр., кропив’янка, ангіоневротичний набряк, бульозний пемфігоїд); можуть спричинити сильний біль у суглобах, у зв’язку з чим необхідно в такому випадку припинити їх застосування |
|
|
похідне тіазолідиндіону (глітазон) (п/о) |
|
|
спочатку 15 або 30 мг/добу (макс. 45 мг/добу) 1 × на день |
|
|
переваги: знижує інсулінорезистентність; при монотерапії не викликає гіпоглікемії; знижує концентрацію вільних жирних кислот у крові недоліки: може спричинити затримку води та набряки, застосовувати з обережністю хворим із будь-яким фактором ризику застійної серцевої недостатності, напр., перенесений інфаркт міокарда, літній вік, не застосовувати у хворих із серцевою недостатністю або нирковою недостатністю; не застосовувати при будь-яких симптомах захворювання печінки або при підвищенні активності печінкових ферментів (АЛТ >2,5 × ВМН); підвищує ризик переломів довгих кісток у жінок та виникнення і посилення макулярного набряку; спостерігалося невелике підвищення ризику розвитку раку сечового міхура |
|
|
інгібітор α-глюкозидази (п/о) |
|
|
акарбоза |
спочатку 1 × на день протягом 3 днів (перед вечерею), потім 50 мг 2 × на день протягом 3 днів (перед обідом і вечерею), потім 50 мг 3 × на день протягом 7 днів і потім поступово збільшувати, щоб з 4–8 тижня вживати 100 мг 3 × на день або максимально переносиму дозу |
|
переваги: знижує постпрандіальну глікемію та інсулінемію, при монотерапії не викликає гіпоглікемії; опосередковано знижує синтез тригліцеридів недоліки: часті скарги з боку ШКТ — метеоризм, біль у животі, підвищене газоутворення, відчуття переповнення, іноді діарея (посилюється при недотриманні дієти); при гіпоглікемії (викликаній іншими ЛЗ) хворий повинен вживати глюкозу, всмоктування якої не порушується |
|
|
|
Метформін |
Інгібітори SGLT2 |
Агоністи рецепторів ГПП-1 |
Подвійний агоніст рецепторів ГІП і ГПП-1 |
Інгібітори ДПП-4 |
Похідні сульфонілсечовини
|
Піоглітазон |
Інгібітор α-глюкозидази |
|
механізм |
активація протеїнкінази через АМФ |
потужне, селективне інгібування котранспортера 2 глюкози, залежного від іонів натрію |
активація рецепторів ГПП-1 |
активація рецепторів ГІПП i ГПП-1 |
гальмування активності ДПП-4 та підвищення концентрації ГПП-1 i ГІП після прийому їжі |
закриття KATФP каналів клітинної мембрани β-клітин підшлункової залози |
стимуляція специфічних ядерних рецепторів PPAR-γ |
гальмування кишкової α-глюкозидази |
|
ефект |
зниження синтезу глюкози у печінці; покращення периферичної чутливості до інсуліну |
індукція глюкозурії шляхом блокування реабсорції глюкози із первинної сечі |
посилення секреції інсуліну, що залежить від наростання гіперглікемії, зниження апетиту |
посилення секреції інсуліну, що залежить від наростання гіперглікемії, зниження апетиту |
підвищення концентрації інсуліну, секреція якого залежить від наростання гіперглікемії |
посилення секреції інсуліну |
збільшення чутливості тканин до інсуліну |
гальмування розщеплення полісахаридів у кишечнику, зниження/затримка всмоктування вуглеводів |
|
вираженість гіпоглікемізуючого ефектуa |
значна |
значна |
значна |
значна |
середня |
значна |
значна |
слабка |
|
вплив на інсулін у плазмі |
↓ |
↓ |
↑↑ |
↑↑ |
↑ |
↑↑ |
↓ |
0 |
|
ризик гіпоглікемії |
0 |
0 |
0 |
0 |
0 |
↑ |
0 |
0 |
|
вплив на масу тіла |
↓ або 0б |
↓ |
↓↓ |
↓↓↓ |
0 |
↑ |
↑ |
0 |
|
вплив на серцево-судинний ризик |
– |
кориснийв |
кориснийв |
– |
– |
– |
– |
– |
|
побічні дії |
шлунково-кишкові розлади, діарея |
інфекція зовнішніх статевих органів, ризик зневоднення в осіб похилого віку; рідко — еуглікемічний кетоацидоз |
шлунково-кишкові розлади (нудота, блювання) |
шлунково-кишкові розлади (нудота, блювання) |
кропив’янка, ангіоневротичний набряк (рідко) |
гіпоглікемія, збільшення маси тіла |
затримка води в організмі і набряки, збільшення маси тіла, підвищення ризику переломів трубчастих кісток |
кишкові розлади (діарея, метеоризм) |
|
протипоказання |
діабетичні коми, органна (серцева, церебральна, печінкова, ниркова, дихальна) недостатність, ацидоз, гіпоксія, зловживання алкоголем |
термінальна ниркова недостатність і діалізна терапія, кетоацидоз |
шлунково-кишкова нейропатія, в анамнезі — гострий панкреатит нез’ясованої етіології |
шлунково-кишкова нейропатія, в анамнезі — гострий панкреатит нез’ясованої етіології |
печінкова недостатність |
діабетичні коми, органна (серцева, печінкова, ниркова) недостатність, вагітність |
серцева недостатність, печінкова недостатність, рак сечового міхура |
захворювання ШКТ, вагітність |
|
↑ — збільшення ↓ — зменшення, 0 — без впливу a Ступінь зниження відсотка HbA1c залежить від дози ЛЗ і від вихідного рівня HbA1c. б без впливу на масу тіла відповідно до клінічних настанов ADA і EASD (2022) та ADA і KDIGO (2022) в ефект, доведений для деяких ЛЗ на основі результатів опублікованих рандомізованих досліджень АМФ — аденозинмонофосфат, АТФ — аденозинтрифосфат, DPP-4 — дипептидилпептидаза 4, ГІП — глюкозозалежний інсулінотропний пептид, ГПП-1 — глюкагоноподібний пептид 1, HbA1c — глікований гемоглобін, KATФ — АТФ-залежні калієві канали, PPAR -γ — рецептор, що активується проліфераторами пероксимів γ-типу, SGLT2 — натрій-глюкозний котранспортер 2 |
||||||||
|
|
Прогресування ХХН |
ССЗ на фоні атеросклерозу |
Серцева недостатність |
Гіпоглікемізуюча ефективність |
Ризик гіпоглікемії |
Вплив на масу тіла |
|
метформін |
нейтральний |
потенційна користь |
потенційна користь |
висока |
низький |
нейтральний |
|
SGLT2i (флозини) |
користьa |
користьб |
користь |
нейтральнa |
низький |
зменшення |
|
агоністи рецепторів ГПП-1 |
користьв |
користьб |
потенційна користь |
висока |
низький |
зменшення |
|
іДПП-4 (гліптини) |
нейтральний |
нейтральний |
потенційний ризикв |
нейтральнa |
низький |
нейтральний |
|
iнсулін |
нейтральний |
нейтральний |
нейтральний |
найбільшa |
високий |
збільшення |
|
похідні сульфонілсечовини |
нейтральний |
нейтральний |
нейтральний |
висока |
високий |
збільшення |
|
похідні тіазолідиндіону (глітазони) |
нейтральний |
потенційна користь (піоглітазон) |
збільшений ризик |
висока |
низький |
збільшення |
|
інгібітори α-глюкозидази |
нейтральний |
нейтральний |
нейтральний |
помірно-вираженa |
низький |
нейтральний |
|
█ нейтральний вплив █ потенційна користь або помірна ефективність у зниженні глікемії █ користь (органопротекція, висока ефективність, низький ризик гіпоглікемії, втрата маси тіла або низька ціна) █ потенційний ризик або висока ціна для пацієнта █ збільшений ризик побічних ефектів a користь підтверджується даними про первинні та вторинні кінцеві точки в клінічних дослідженнях б Користь або ризик залежать від даного ЛЗ. в користь, підтверджена даними про вторинні кінцеві точки в клінічних дослідженнях іДПП-4 — інгібітор дипептидилпептидази 4, ГПП-1 — глюкагоноподібний пептид 1, SGLT2i — інгібітор натрій-глюкозного котранспортера 2 |
||||||
3. Порядок вибору ЛЗ
Початок лікування: першим пероральним ЛЗ, який рекомендується призначити з моменту діагностування ЦД 2-го типу, є метформін, інгібітор SGLT2 або агоніст рецептора GLP-1 (препарат підбирається індивідуально, залежно від супутніх захворювань серцево-судинної системи та нирок, якщо немає протипоказань). На кожному етапі лікування ЦД слід оцінювати серцево-судинний ризик і функцію нирок. PTD (2024) рекомендує, щоб у випадках, коли є: документально підтверджене серцево-судинне захворювання на фоні атеросклерозу, серцева недостатність, хронічна хвороба нирок або співіснування численних серцево-судинних факторів ризику, розглянути доцільність ініціації лікування вперше діагностованого ЦД 2-го типу одразу за допомогою 2-х ЛЗ — метформіну та ЛЗ, що знижує ризик прогресування цих розладів, тобто інгібітора SGLT2 або агоніста рецептора ГПП-1; алгоритм початку лікування ЦД 2 типу →рис. 13.1-4. Якщо пацієнт, який вже лікується з приводу ЦД, має високий серцево-судинний ризик та/або ознаки хронічної хвороби нирок (зниження рШКФта/або наявність протеїнурії), додайте до метформіну інгібітор SGLT2 (бажано як перший ЛЗ у разі супутньої серцевої недостатності або хронічної хвороби нирок) або агоніст рецептора ГПП-1 (віддають перевагу при серцево-судинному захворюванні на фоні атеросклерозу), навіть якщо HbA1c ще міститься в цільовому діапазоні.
Подальше лікування: ЦД 2-го типу є прогресуючою хворобою, тому лікування слід з часом коригувати. Принциповою ознакою сучасного лікування ЦД є індивідуальний підхід до кожного пацієнта, як при прийнятті рішення щодо інтенсивності лікування та його цілей, так і при виборі ЛЗ; алгоритм лікування цукрового діабету 2 типу →рис. 13.1-5. Якщо цільовий контроль діабету не досягнуто або якщо є супутні захворювання, що вимагають застосування інгібітора SGLT2 або агоніста рецептора GLP-1, рішення про зміну лікування не слід відкладати. Коли, незважаючи на впровадження модифікацій способу життя (зменшення маси тіла, збільшення фізичної активності до ≥30–45 хв/день) і застосування метформіну (в монотерапії або в комбінації з інгібітором SGLT-2 або агоністом рецептора ГПП-1), виникає підвищення глікемії та не досягнуто цільової компенсації ЦД (яка оцінюється на основі відсотка HbA1c), додайте другий (або третій) антидіабетичний ЛЗ — схема подальшої терапії залежить від того, чи є у пацієнта клінічно виражене серцево-судинне захворювання або хронічна хвороба нирок →рис. 13.1-4 та рис. 13.1-5.
4. Принципи лікування ЦД 2-го типу у пацієнтів з діагностованим серцево-судинним захворюванням (ССЗ), серцевою недостатністю і/або хронічною хворобою нирок (ХХН): на кожному етапі лікування ЦД 2-го типу людям із серцевою недостатністю (особливо зі зниженою фракцією викиду лівого шлуночка [HFrEF], навіть на початковій стадії, а також зі збереженою фракцією викиду лівого шлуночка [HFpEF], та незалежно від її етіології) перевага віддається інгібіторам SGLT2, оскільки було показано, що вони знижують швидкість прогресування серцевої недостатності та частоту госпіталізацій з її приводу. Інгібіторам SGLT2 також віддають перевагу у випадку пацієнтів із ХХН (зі зниженою ШКФ та/або альбумінурією 30–300 мг/г або явною протеїнурією), оскільки було доведено, що вони пригнічують прогресування ХХН, але їх не можна використовувати у разі термінальної ниркової недостатності (→табл. 13.4-4). Клінічні настанови ADA та KDIGO (2022) вказують на те, що, з огляду на користь для нирок і серцево-судинної системи, лікування дапагліфлозином, емпагліфлозином або канагліфлозином можна продовжувати, за умови задовільної переносимості, до моменту початку діалізної терапії.
Застосування агоністів рецепторів ГПП-1 особливо рекомендовано пацієнтам зі ССЗ на фоні атеросклерозу або зі значущими факторами ризику атеросклерозу та ХХН, також на її пізній стадії (коли не можна застосовувати інгібітори SGLT2). Агоністи рецепторів ГПП-1 мають перевагу над інгібіторами SGLT2 щодо їх сприятливого впливу на ССЗ на фоні атеросклерозу, сприяють зниженню надлишкової маси тіла (ефект від окремих препаратів різний), проте вони не пригнічують прогресування серцевої недостатності.
Якщо у пацієнта діагностовано ХХН, агоністи рецепторів GLP-1 є препаратами другої лінії — перш за все перевага віддається інгібіторам SGLT2. Останнє дослідження (FLOW, 05.2024) вказує на важливість семаглутиду в лікуванні пацієнтів з діабетом 2 типу та ХХН (застосування в дозі 1 мг/тиж. значно знижує ризик ниркової недостатності [діаліз, трансплантація або eGFR <15 мл/хв/1,73 м2], зниження eGFR на ≥50 % або смерті від ниркових або серцево-судинних причин).
Інгібітор SGLT2 або агоніст рецептора ГПП-1 слід додати до лікування (незалежно від ступеня складності його режиму, напр., терапія з 3-ма ЛЗ, терапія з 4-ма ЛЗ або режим комбінованої інсулінотерапії) у кожного хворого з дуже високим серцево-судинним ризиком, який не отримував ЛЗ з цих груп.
5. Якщо не діагностовано серцево-судинного захворювання, серцевої недостатності або хронічної хвороби нирок, то при прийнятті рішення про вибір другого антидіабетичного ЛЗ, який додадуть до лікування метформіном, враховуйте характеристики даного пацієнта та його побажання, профіль безпеки, переносимість, ефективність зниження рівня глікемії, простоту використання, вартість лікування та поточний домінуючий патогенетичний механізм (інсулінорезистентність або порушення секреції інсуліну) →рис. 13.1-5. При виборі другого ЛЗ у людей з високим ризиком гіпоглікемії, віддавайте перевагу інгібітору DPP-4, агоністу рецептора ГПП-1, інгібітору SGLT2 або глітазону. Якщо основною метою є зменшення маси тіла, віддавайте перевагу агоністу рецептора ГПП-1 або інгібітору SGLT2, причому ЛЗ з групи агоністів рецептора ГПП-1 є більш ефективними — клінічні настанови ADA та EASD (2022) показують, що ЛЗ, які використовуються для лікування ЦД 2-го типу, відрізняються за своїм впливом на зниження маси тіла:
1) найпотужніші — семаглутид і тирзепатид;
2) сильні — дулаглутид і ліраглутид;
3) середньої потужності — інші ЛЗ з групи агоністів рецептора ГПП-1 та інгібітори SGLT2;
4) нейтральні — гліптини та метформін.
Правила поєднання неінсулінових препаратів з інсуліном →табл. 13.1-12.
Перед початком інсулінотерапії важливо використовувати антигіперглікемічні можливості агоністів рецепторів GLP-1 або подвійних агоністів GIP і GLP-1 рецепторів, оптимально таких, які дозволять найбільше зменшити надлишок жиру в організмі, якщо це дозволяють фінансові можливості пацієнта. Ці препарати повинні стати першою ін’єкційною терапією при діабеті 2 типу.
|
Неінсулінові ЛЗ |
Менеджмент у разі призначення інсулінотерапії |
|
метформін |
продовжуйте застосування |
|
інгібітори SGLT2 |
продовжуйте застосування, доєднайте при серцево-судинних захворюваннях, особливо серцевій недостатності, або хронічній хворобі нирок (зверніть увагу на підвищений ризик еуглікемічного кетоацидозу (що протікає без значної гіперглікемії), особливо при значному зниженні дози інсуліну) |
|
агоністи рецепторів ГПП-1 |
продовжуйте застосування |
|
агоніст рецепторів ГІП та ГПП-1 |
продовжуйте застосування |
|
інгібітори ДПП-4 |
продовжуйте застосування |
|
похідні сульфонілсечовини |
припиніть застосування або зменште дозу на 50 % при початку інсулінотерапії; відмініть у разі призначення прандіального інсуліну або режиму з використанням сумішей інсулінів |
|
піоглітазон |
припиніть використання або зменште дозу у разі призначення інсулінотерапії |
|
акарбоза |
можете продовжувати застосування |
|
ГІП — глюкозозалежний інсулінотропний пептид, ГПП-1 — глюкоагоноподібний пептид 1, ДПП-4 — дипептидилпептидаза 4, SGLT2 — натрій-глюкозний котранспортер 2 |
|
1. Показання:
1) неефективність лікування — HbA1c >7 % або вище цільового значення, незважаючи на інтенсифікацію фармакологічної (оптимально з використанням агоніста рецептора GLP-1 або подвійного агоніста рецептора GIP і GLP-1) і поведінкової терапії (після елімінації дієтичних помилок та інших причин неефективності неінсулінових ЛЗ, включаючи вогнища інфекції); у разі існування сумнівів, вичерпання секреторних резервів підтверджують зниженою концентрацією С-пептиду у сироватці після стимуляції глюкагоном (на практиці дослідження рідко є необхідним);
2) протипоказання до застосування неінсулінових ЛЗ;
3) тимчасове лікування — щойно діагностований ЦД 2-го типу зі значною гіперглікемією (глікемія натще >16,7 ммоль/л [300 мг/дл]) та її симптомами (після опанування глюкотоксичності, компенсації глікемії та метаболічного стану пацієнта можна застосувати неінсулінові ЛЗ або — рідше — продовжувати інсулінотерапію у комбінації з метформіном); гострий коронарний синдром або процедура черезшкірної коронарної ангіопластики (оптимально — постійна в/в інфузія інсуліну), інсульт, гострі запальні стани, травми та інші невідкладні стани, кортикотерапія, оперативне втручання, вагітність.
2. Різновиди інсулінів
Вибір препарату та режиму інсулінотерапії проводиться індивідуально, зважаючи на стиль життя та притаманний для пацієнта час прийому їжі.
Класифікація на основі хімічної будови: людський інсулін та аналоги людського інсуліну.
Класифікація на основі тривалості дії →табл. 13.1-8.
Інсулінові суміші (комбіновані, двофазні інсуліни →табл. 13.1-13):
1) швидкодіючий аналог інсуліну з протаміновою суспензією цього аналогу з подовженою тривалістю дії;
2) інсулін короткої дії з інсуліном середньої тривалості дії;
3) швидкодіючий аналог та аналог тривалої або ультратривалої дії.
|
Різновиди інсулінів, які входять до складу суміші |
Вміст інсуліну швидкої або короткої дії |
|
інсулін аспарт з протаміновою суспензією інсуліну аспарт (суміш аналогових інсулінів) |
30 % |
|
50 % |
|
|
інсулін аспарт з інсуліном деглюдек (суміш двох аналогів) |
30 % |
|
інсулін ліспро з протаміновою суспензією інсуліну ліспро (суміш аналогових інсулінів) |
25 % |
|
50 % |
|
|
двохфазний людський інсулін |
20 % |
|
25 % |
|
|
30 % |
|
|
40 % |
|
|
50 % |
Кожен з інсулінів у суміші досягає піку своєї дії у різний час, тобто, одна ін’єкція викликає 2 піки концентрації інсуліну у крові →рис. 13.1-6.
Висота цих піків залежить від пропорції складників вибраного препарату та від дози, пік дії швидкодіючого інсуліну чи інсуліну короткої тривалості дії є вищим, а тривалість його дії — коротша. Ін’єкцію інсулінових сумішей слід вводити 2 × на день, перед кожним піком дії інсуліну пацієнт повинен вживати їжу. Суміші часто застосовують для лікування ЦД 2-го типу, особливо у хворих старшого віку та зі зниженою працездатністю, у котрих досягнення критеріїв компенсації ЦД не є абсолютно необхідним.
3. Режими та способи інсулінотерапії у хворих на ЦД 2-го типу
Не можна зволікати з інсулінотерапією — при збереженні гіперглікемії та підвищеної концентрації проінсуліну пришвидшується розвиток ускладнень ЦД. В усіх режимах інсулінотерапії при ЦД 2 типу одночасно необхідно застосовувати метформін (за відсутності протипоказань). Загальні принципи лікування →рис. 13.1-7.
Простий режим інсулінотерапії: комбіноване лікування ЦД неінсуліновими ЛЗ (правила комбінації неінсулінових ЛЗ з інсуліном →табл. 13.1-12) та однією ін’єкцією базального інсуліну, який імітує його базальну секрецію (інсулін середньої тривалості дії [НПХ] або аналог пролонгованої дії, застосування якого пов’язане з нижчим ризиком нічної та тяжкої гіпоглікемії). Це перехідний режим ведення ЦД 2-го типу, який застосовують протягом декількох місяців, а навіть років, перед введенням повної терапії інсуліном. Розпочніть при неефективності комбінованого лікування 2–3-ма неінсуліновими ЛЗ. Вже на етапі неефективності монотерапії метформіном, можна розглядати комбінацію терапії метформіном з 1-ю ін’єкцією інсуліну. У пацієнтів, які отримують інсулін 1 × на добу, одночасно можна застосовувати неінсулінові ЛЗ відповідно до інструкції для медичного застосування; у випадку супутньої надмірної ваги або ожиріння перевага надається комбінованій терапії метформіном з агоністом рецептора ГПП‑1); при нормальній масі тіла можна розглянути комбіновану терапію метформіном і похідним сульфонілсечовини.
1) Початкова дозу інсуліну, що вводиться 1 × на день може становити 10 ОД або 0,2 ОД/кг маси тіла; якщо наявна гіперглікемія натще, рекомендується ін’єкція ввечері, а якщо глікемія натще у межах норми і виникає гіперглікемія впродовж дня — зранку.
2) Контроль глікемії натще та поступове збільшення дози інсуліну, напр., на 2–4 ОД кожні 4–5 днів, доки не буде досягнута глікемія у запланованому діапазоні (напр., 3,9–7,2 ммоль/л [70–130 мг/дл], але може бути й ширшим).
3) Якщо глікемія натще >10 ммоль/л (180 мг/дл) → збільшуйте дозу базального інсуліну, який вводять у вечірню пору, напр., на 4 ОД кожні 3 дні (амбулаторне лікування).
4) Якщо вночі чи зранку виникла гіпоглікемія (a пацієнт адекватно приймав їжу) або якщо глікемія натще <3,9 ммоль/л (70 мг/дл) → зменшіть дозу базального інсуліну, введеного перед сном, напр., на 4 ОД чи на 10 % (зазвичай, на вищий з цих показників).
5) Якщо HbA1c зберігається >7 %, незважаючи на інтенсифікацію фармакологічної та поведінкової терапії, чи потреба в ізофановому інсуліні (НПХ) введеному 1 × на день, складає >0,3–0,5 ОД/кг м. т. → продумайте інтенсифікацію терапії — комбіновану інсулінотерапію (у вигляді 2-х ін’єкцій суміші інсулінів або додаткове призначення до інсуліну пролонгованої дії ін’єкцій інсуліну короткої дії або швидкодіючого аналогу 1–3 × день перед прийомами їжі, причому дане лікування можете впроваджувати поступово) та відмініть ЛЗ, які стимулюють секрецію інсуліну. Якщо основним порушенням є постпрандіальна гіперглікемія (незважаючи на нормоглікемію натще), то на початку комбінованої інсулінотерапії розгляньте передусім можливість багаторазових ін’єкцій інсуліну короткої дії або аналогу інсуліну швидкої дії перед прийомами їжі.
Комбінована інсулінотерапія: використання ≥2 × на день ін’єкцій інсуліну, які забезпечують покриття потреби в інсуліні у базових умовах та після прийомів їжі.
1) Застосування інсулінових сумішей: базовий режим інсулінотерапії при ЦД 2-го типу (→рис. 13.1-6). Переваги — мала кількість ін’єкцій (переважно 2), що полегшує лікування пацієнтів похилого віку та інвалідів; недоліки — часто відсутня можливість досягнення рекомендованих критеріїв компенсації ЦД та необхідність приймати їжу у визначений час, особливо у полудень.
a) Потрібно підібрати відповідну суміш інсулінів →табл. 13.1-13 та в індивідуальному порядку встановити дозування.
б) Змінюючи введення ізофанового інсуліну у схемі 1 × на день на 2 ін’єкції двофазового інсуліну, який, напр., містить 30 % інсуліну короткої дії, не забувайте, що його загальна доза повинна бути на ≈30 % вищою, ніж доза ізофанового інсуліну, який попередньо застосовувався.
в) Початковий поділ добової дози: зранку 60 %, ввечері 40 % →рис. 13.1-6.
г) У період встановлення дози слід запланувати частіші візити; кожного разу необхідно переконатись, чи пацієнт належним чином вводить інсулін та чи правильно визначає глікемію за допомогою глюкометра.
2) Схема базал-плюс: проміжна схема інсулінотерапії, як полегшує перехід між простою та інтенсивною схемами інсулінотерапії — у хворих на ЦД 2-го типу, які приймають базальний інсулін 1 × на день, можете поступово впроваджувати ін’єкції інсуліну короткої дії або швидкодіючого аналогу перед прийомами їжі, призначаючи початково 1 додаткову ін’єкцію (найкраще перед головним прийомом їжі, після якого виникає найбільше зростання глікемії), щоб поступово перейти до 3-х ін’єкцій даного інсуліну перед усіма основними прийомами їжі впродовж дня (базал-болюсний режим).
3) Базал-болюсний режим (інтенсивна інсулінотерапія →вище. Лікування ЦД 1-го типу): метод, який зараз рідше розглядається у хворих на ЦД 2-го типу, що повністю вимагають інсулінотерапії, і лише у тих хворих, для яких не є проблематичним здійснювати ін’єкції інсуліну 4 × на день.
При ЦД 2-го типу прагнуть до спрощення режиму антигіперглікемічного лікування. Мета полягає в тому, щоб зменшити для пацієнта складність і тягар лікування, особливо інсулінотерапії, і розглянути питання про лібералізацію цільового рівня глікемії у багатьох пацієнтів з ЦД 2-го типу. Цей підхід може застосовуватися щодо хворих із високим ризиком гіпоглікемії, когнітивних порушень, які не дотримуються рекомендацій або мають коротку прогнозовану виживаність, або у яких складна схема лікування має негативний вплив на якість життя. Зменшення кількості ін’єкцій і дози введеного інсуліну можна досягти шляхом індивідуально визначеної комбінації з неінсуліновими ЛЗ.
Баріатричні операції: при ЦД 2-го типу, асоційованому з ожирінням, дозволяють отримати добрий і тривалий метаболічний ефект; розгляньте скерування хворих із ІМТ >40 кг/м2 або >35 кг/м2 і з супутніми захворюваннями (напр., артеріальною гіпертензією, розладами ліпідного обміну), у віці 18–65 р., у спеціалізовані центри з метою відбору до баріатричної операції і подальшої довготривалої опіки (з огляду на особливі вимоги щодо харчування у післяопераційному періоді).
МОНІТОРИНГвгору
1. Оцінка компенсації вуглеводного обміну при цукровому діабеті (критерії контролю та цілі лікування →табл. 13.1-5) надає інформацію про ефективність лікування та полегшує його модифікацію — у навченого пацієнта, який використовує інсулінотерапію, точний моніторинг глікемії полегшує якість життя та підтримує його спеціальні рішення щодо дози інсуліну залежно від вмісту вуглеводів у їжі, а також підвищує безпеку під час фізичної активності. Пацієнти потребують початкового та систематичного повторного навчання моніторингу рівня глюкози за допомогою даного пристрою (→нижче), регулярної оцінки техніки вимірювання, отриманих результатів і як використовувати дані для модифікації терапії.
Типи вимірювання глікемії: визначення у цільній капілярній крові за допомогою глюкометра:
1) випадкове визначення — найчастіше, натще;
2) скорочений глікемічний профіль (напівпрофіль) — зранку натще i через 60–120 хв після кожного основного прийому їжі (4 визначення протягом доби);
3) повний добовий глікемічний профіль — зранку натще, перед кожним основним прийомом їжі, через 60–120 хв після кожного основного прийому їжі, перед сном i в індивідуально встановлений час для додаткових вимірювань, напр., о 24.00 год та поміж 2.00 і 4.00 (хоча в такій ситуації краще використовувати CGM →нижче).
Рекомендована частота самоконтролю залежить від призначеного лікування та індивідуальних потреб (всі пацієнти, незалежно від методу лікування, слід частіше контролювати рівень глюкози в крові, якщо вони почуваються погано або стан здоров’я раптово погіршується):
1) виключно дієта і метформін → 1 × на міс. скорочений глікемічний профіль, додатково раз на тиждень визначення глікемії у різний час доби;
2) неінсулінові ЛЗ → 1 × на тиж. скорочений глікемічний профіль, щодня одне визначення глікемії у різний час доби;
3) інсулін у постійних дозах або комбіноване лікування похідними сульфонілсечовини при ЦД 2-го типу → щоденно 1–2 визначення глікемії, 1 × на тиж. скорочений глікемічний профіль, 1 × на міс. повний глікемічний профіль;
4) багаторазові ін’єкції інсуліну (≥3 × на день) i інтенсивна функціональна інсулінотерапія (незалежно від типу ЦД) → традиційно виконується багаторазове визначення глікемії протягом доби з використанням глюкометра (незалежно від типу цукрового діабету ≥4 × на день, рекомендовано 8 × на день) відповідно до індивідуально встановлених принципів моніторингу та до потреб пацієнта, в т. ч. як перед вживанням їжі, так і після, під час сну, перед запланованим фізичним навантаженням, при підозрі на гіпоглікемію та перед діяльністю, під час якої глікемія є особливо небезпечною (напр., водіння автомобіля), але в даний час перевага віддається безперервному контролю глікемії.
Найточнішу оцінку добової глікемії забезпечує безперервний моніторинг глікемії в реальному часі (real time continuous glucose monitoring — rtCGM) або періодично сканований безперервний моніторинг рівня глюкози (intermittently scanned continuous glucose monitoring — isCGM), відомий під назвою flash (flash glucose monitoring — FGM) — який дозволяє оцінити наступні параметри: індекс збереження глікемії в цільовому інтервалі (time in range — TIR), а також показники часу збереження глікемії вище і нижче граничних значень цього інтервалу. Особливо корисний для пацієнтів з ЦД 1-го типу, у т. ч. з нестабільним перебігом та частими епізодами гіпоглікемії (особливо, якщо пацієнт їх не відчуває), у пацієнтів, які використовують індивідуальну інсулінову помпу та у вагітних жінок із супутнім ЦД, і при внесенні змін до лікування; натомість подібні рекомендації щодо контролю ЦД 2-го типу неоднозначні. Значення CGM у разі тривалішого застосування полягає у можливості оцінки трендів глікемії (зниження або наростання) і швидкості прогресування змін, а також можливості програмування сигналів тривоги, які попереджають про те, що глікемія наближається до встановленої граничної межі. Це дозволяє відносно рано провести заходи щодо профілактики небажаної гіпо- або гіперглікемії. Під час інтерпретації результатів визначення концентрації глюкози у тканинній рідині необхідно врахувати її 15–20 хв запізнення у порівнянні з концентрацією глюкози в крові. Важливою є можливість комплексного застосування rtCGM з інсуліновими помпами, особливо такими, що мають функцію переривання інфузії інсуліну у разі тенденції до гіпоглікемії, яка допомагає зокрема запобігти розвитку нічної гіпоглікемії. Оцінка компенсації глікемії при використанні FGM базується на тих же критеріях, що й для використання rtCGM (→табл. 13.1-14). Вимірювання концентрації глюкози за допомогою FGM також проводяться у тканинній рідині, однак дані не передаються до датчика в режимі реального часу, найчастіше телефону. Після сканування отримують поточне значення глікемії з позначеним (стрілкою) трендом його поточної зміни (підвищення або зниження) і кривою, що відповідає значенням глікемії в попередньому періоді. Збережені дані, представлені графічно у вигляді діаграм, можна пізніше проаналізувати та на їх основі змінити лікування. Нова версія цієї системи дозволяє встановлювати порогові значення глікемії, при перевищенні яких генеруються сповіщення, що дозволяє пацієнту зчитати результат та, за необхідності, вжити відповідних заходів залежно від значення глікемії та її тренду (напр., запобігти гіпоглікемії); це підвищує безпеку використання цих пристроїв і наближує їх до rtCGM.
|
Категорія хворих на цукровий діабет |
Цільовий глікемічний діапазон і тривалість глікемії в цьому діапазоні протягом доби (TIR) |
Значення глікемії нижче цільових і тривалість глікемії в цьому діапазоні протягом доби (TBR) |
Значення глікемії вище цільових і тривалість глікемії в цьому діапазоні протягом доби (TAR) |
||||||
|
цільова глікемія |
загальний час/24 год |
% часу/24 год |
глікемія нижче цільового значення |
загальний час/24 год |
% часу/24 год |
глікемія вище цільового значення |
загальний час/24 год |
% часу/24 год |
|
|
цукровий діабет 1-го типу та цукровий діабет 2-го типу |
70–180 мг/дл (3,9–10 ммоль/л) |
>16 год і 48 хв |
>70 % |
54–69 мг/дл (3,0–3,8 ммоль/л) |
<1 год |
<4 % |
181–250 мг/дл (>10,1–13,9 ммоль/л) |
<6 год |
<25 % |
|
<54 мг/дл (<3,0 ммоль/л) |
<15 хв |
<1 % |
>250 мг/дл (>13,9 ммоль/л) |
<1 год i 12 хв |
<5 % |
||||
|
пацієнти літнього віку або особи з високим ризиком гіпоглікемії |
70–180 мг/дл (3,9–10 ммоль/л) |
>12 год |
>50 % |
63–69 мг/дл (<3,5–3,8 ммоль/л) |
<15 хв |
<1 % |
>250 мг/дл (>13,9 ммоль/л) |
<2 год i 24 хв |
<10 % |
|
вагітні жінки з цукровим діабетом 1-го типу |
63–140 мг/дл (3,5–7,8 ммоль/л) |
>16 год i 48 хв |
>70 % |
<63 мг/дл (<3,5 ммоль/л) |
<1 год |
<4 % |
>140 мг/дл (>7,8 ммоль/л) |
<6 год |
<25 % |
|
<54 мг/дл (<3,0 ммоль/л) |
<15 хв |
<1 % |
|||||||
|
CGM (continuous glucose monitoring system) — система безперервного моніторингу глюкози на підставі: Battelino T. i співавт. Diabetes Care, 2019; 42: 1593–1603 i ПTД (2024) |
|||||||||
HbA1c — контролюйте принаймні 1 × на рік, частіше (оптимально 2–4 × на рік) — якщо хворий не досягнув цільового рівня HbA1c.
2. Діагностика та контроль терапії артеріальної гіпертензії: вимірювання артеріального тиску під час кожного прийому, рекомендуйте пацієнтам вимірювання артеріального тиску вдома та оцінюйте, чи досягають вони цільових значень (→табл. 13.1-6);
3. Діагностика та контроль дисліпідемії: ліпідограма — 1 × на рік, або частіше у випадку моніторингу ліпідних порушень (→табл. 13.1-7, визначення ліпідограми можна проводити у пацієнтів, які не є натщесерце, за винятком хворих з гіпертригліцеридемією, яким рекомендовано здійснювати аналіз через 8–12 год після останнього прийому їжі).
4. Контроль маси тіла (також вдома); у пацієнтів із надмірною вагою або ожирінням для оцінки ефективності способу життя/фармакологічного втручання і/або баріатричної хірургії.
5. Дослідження з метою оцінки і лікування віддалених ускладнень ЦД:
1) ХХН → 1 × на рік екскреція альбуміну з сечею (у пацієнтів, котрі не вживають ІАПФ або БРА загальний аналіз сечі з мікроскопією осаду — 1 × на рік; концентрація креатиніну у сироватці та розрахунок швидкості клубочкової фільтрації — 1 × на рік; у пацієнтів з ЦД 1-го типу через 5 років після початку хвороби, у хворих на ЦД 2-го типу від моменту встановлення діагнозу — у випадку підтвердження підвищеної концентрації креатиніну, потрібно проводити визначення концентрації креатиніну, натрію, калію, кальцію та неорганічних фосфатів у сироватці кожні 6 міс.;
2) ретинопатії → офтальмологічний контроль (оцінка очного дна при розширених зіницях) 1 × на рік: у хворих на ЦД 1-го типу — через 5 років від початку захворювання, у хворих на ЦД 2-го типу — перше дослідження в моменті встановлення діагнозу, потім у пацієнтів без діагностованої діабетичної хвороби очей кожні 1–2 роки; у випадку діагностування ретинопатії частоту контрольних обстежень визначає офтальмолог;
3) синдром діабетичної стопи — огляд ніг під час кожного прийому.
6. Інші: наявність діагнозу ЦД є показанням для виконання скринінгового дослідження щодо наявності захворювань щитовидної залози: визначення рівня ТТГ та антитіл проти тиреопероксидази (анти-ТПО) при ЦД 1-го типу, а ТТГ при ЦД 2-го типу.
ОСОБЛИВІ СИТУАЦІЇвгору
1. Тяжкі інфекції чи травми: підвищують потребу в інсуліні. При захворюваннях ШКТ виникає обмеження або абсолютна нездатність приймати їжу — частою помилкою є зниження дози інсуліну, що може призвести до ацидозу та коми.
1) при ЦД 1-го типу — необхідно навчити хворих, щоб у наведених ситуаціях підвищення чи (рідше) збереження дози інсуліну супроводжувалось адекватним постачанням калорій. При хворобах ШКТ з нудотою та блюванням необхідно застосувати в/в інфузію глюкози, яка забезпечить постачання 1000–1200 ккал/добу, найкраще у поєднанні з постійною в/в інфузією інсуліну.
2) при ЦД 2-го типу, який досі був лікований неінсуліновими ЛЗ або виключно дієтою — тяжка інфекція становить показання до тимчасового призначення інсуліну, найкраще — методом інтенсивної інсулінотерапії, або, якщо відсутні перешкоди у прийомі їжі, з використанням інсулінових сумішей.
2. Гострий коронарний синдром: у кожного пацієнта необхідно визначати глікемію — якщо у пацієнта без ЦД у анамнезі глікемія становить >10,0 ммоль/л (180 мг/дл) → використовується інсулін в/в. У пацієнта з ЦД слід відмінити неінсулінові ЛЗ та починати в/в інсулінотерапію при глікемії >7,8 ммоль/л (140 мг/дл). Необхідно здійснювати моніторинг глікемії та концентрації калію у сироватці:
1) у 1-шу добу призначте в окремих в/в інфузіях:
а) інсулін 0,5–6 ОД/год, залежно від глікемії (орієнтаційний перерахунок; →табл. 13.1-15);
|
Глікемія |
Інсулін (ОД/год) в/вa |
10 % розчин глюкози (мл/год) в/в |
|
|
250–300 мг/дл (13,9–17,4 ммоль/л) |
4,0–6,0 |
не вводьте глюкозу або припиняйте її інфузіюб |
|
|
180–250 мг/дл (10–13,9 ммоль/л) |
2,0–4,0 |
не вводьте глюкозу або припиняйте її інфузіюб |
|
|
140–180 мг/дл (6,7–10 ммоль/л) |
1,0–2,0 |
50 |
|
|
100–140 мг/дл (5,5–7,8 ммоль/л) |
0,5–1,0 |
50 |
|
|
<100 мг/дл (<5,5 ммоль/л) |
зупиніть інфузію на 15–30 хв |
50 |
|
|
a Контролюйте рівень глюкози в крові та калію в сироватці під час інфузії інсуліну. б Почніть або відновіть інфузію 10 % глюкози в/в зі швидкістю 50 мл/год, коли рівень глюкози в крові знизиться <180 мг/дл (10 ммоль/л), і одночасно регулюйте швидкість інфузії інсуліну. на підставі рекомендацій ПTД 2024, змодифіковано |
|||
б) 10 % розчин глюкози зі швидкістю ≈50 мл/год (розпочніть лише після зниження глікемії до 11,1–13,9 ммоль/л (200–250 мг/дл); прагніть підтримувати глікемію в межах 5,6–10 ммоль/л (100–180 мг/дл);
в) 10 ммоль хлориду калію (контролюйте концентрацію калію у сироватці і при потребі повторіть інфузію).
У випадку підвищення глікемії >10 ммоль/л (180 мг/дл) тимчасово припиніть інфузію глюкози. Контролюйте рівень глікемії щогодини, а після її стабілізації — кожні 2 год; введення глюкози повинно забезпечувати 800–1000 ккал/добу.
2) з 2-ї доби до кінця госпіталізації — індивідуалізуйте лікування, щоб забезпечити оптимальний контроль глікемії: повинна знаходитись в межах 5,6–10,0 ммоль/л (100–180 мг/дл) впродовж усієї доби; у пацієнтів з ЦД 2-го типу і надмірною вагою або ожирінням можна, за відсутності протипоказань, починаючи з 3-ї доби або безпосередньо перед випискою з лікарні використовувати метформін, інгібітор SGLT2 та/або агоніст рецептора GLP-1; таке лікування вимагатиме зниження дози інсуліну. У випадку запланованої коронарографії для діагностичних або терапевтичних цілей не призначайте метформін за ≥48 год до і 24 год після процедури.
Після завершення госпіталізації, якщо потреба в інсуліні ≤30 ОД/добу, можете повернутись до попереднього перорального лікування. Кожному хворому на цукровий діабет 2 типу після ГКС слід призначити лікування інгібітором SGLT2 та/або агоністом рецептора GLP-1 (через кардіопротекторну дію препаратів цих груп) та/або метформіном, якщо лікування не було змінено раніше та немає протипоказань до застосування цих препаратів. У пацієнтів без раніше діагностованого діабету вимірювати HbA1c (у стаціонарі) або проводити ПГТТ після виписки з лікарні →розд. 13.1.
3. Інсульт: у кожного пацієнта з інсультом потрібно визначати глікемію: якщо рівень становить >10,0 ммоль/л (180 мг/дл) → необхідно розпочати в/в інсулінотерапію за допомогою інсулінової помпи та зберігати глікемію в діапазоні 7,8–10 ммоль/л (140–180 мг/дл); уникайте глікемії <6,1 ммоль/л (110 мг/дл) з метою зниження ризику гіпоглікемії. На гострій стадії захворювання уникайте в/в введення глюкози; застосовуйте інсулін у вигляді в/в інфузії в 0,9 % розчині NaCl (але не в розчині, котрий містить глюкозу і калій). Коли пацієнт починає споживати їжу → розпочніть (≈1 год перед від’єднанням помпи) інсулінотерапію з п/ш введення інсуліну короткої дії або швидкодіючого аналогу інсуліну. У пацієнтів без встановленого раніше діагнозу ЦД, після завершення гострої фази хвороби та після стабілізації клінічного стану, проведіть дослідження в напрямку порушень вуглеводного обміну.
1. Планова хірургічна операція: у пацієнтів, які лікуються дієтою та метформіном, а також іншими пероральними препаратами, для яких призупинення лікування на 1 день не призведе до підвищення рівня глюкози в крові >180 мг/дл (10 ммоль/л), не потрібно призначати інсулін у передопераційному періоді — це, однак, стосується невеликої кількості пацієнтів з відносно короткотривалим ЦД і не виключає необхідності введення інсуліну під час або після процедури. Застосування інсулінотерапії та призупинення досі застосовуваного лікування ЦД показано, якщо планується велика операція з підвищеним ризиком гемодинамічної нестабільності або якщо тривала операція. Зазвичай для збалансування 1 г екзогенної глюкози потрібно 0,2–0,3 ОД інсуліну. Добре навчений пацієнт з ЦД 1-го типу, який досягав задовільних результатів лікування до госпіталізації, особливо користувач персональної інсулінової помпи, CGM або FGM, повинен мати можливість продовжувати самостійне лікування під час госпіталізації, якщо це ефективно та можливо, а також брати участь у прийнятті терапевтичних рішень щодо лікування ЦД (якщо дозволяє його загальний стан).
Підготовка до хірургічної операції:
1) при виявленні недостатнього метаболічного контролю: глікемія >13,9 ммоль/л (250 мг/дл), HbA1c >8,5 % або глюкозурія з ацетонурією → відкладіть термін процедури (за можливості);
2) забезпечте компенсацію ЦД — підтримуйте глікемію у периопераційному періоді в безпечних межах 5,6–10 ммоль/л (100–180 мг/дл);
3) незадовго до процедури (за 2 дні) неінсулінові ЛЗ потрібно відмінити та розпочати інтенсивну інсулінотерапію — добова доза інсуліну ≈0,3–0,7 ОД/кг м. т., у т. ч. 50–60 % інсулін короткої дії (який вводиться перед основними прийомами їжі у пропорціях ≈50–20–30 %), решта — 40–50 % складає НПХ-інсулін (у 2-х ін’єкціях: о 7.00–8.00 год — 40 % i o 22.00–23.00 год — 60 % дози), або аналог інсуліну тривалої дії (1 × на день у один і той сам час, переважно ввечері);
4) контроль (в міру можливостей) хронічних ускладнень ЦД.
Підготовку найкраще проводити у терапевтичному відділенні, за винятком пацієнтів, яких ефективно лікують методом інтенсивної інсулінотерапії (з постпрандіальною глікемією <10 ммоль/л [180 мг/дл]), якщо заплановану операцію можна виконати в режимі хірургії одного дня. Дрібні оперативні втручання без зміни способу харчування (неускладнена екстракція зуба, розтин абсцесу), не вимагають тимчасової інсулінотерапії.
У день операції:
1) застосовуйте інсулін у постійній в/в інфузії (розчин 1 ОД інсуліну в 1 мл 0,9 % NaCl); для збалансування 1 г екзогенної глюкози необхідно 0,2–0,3 ОД інсуліну;
2) введіть глюкозу шляхом в/в інфузії, що забезпечує ≈1000 ккал/добу (зазвичай 10 % або 5 % розчин глюкози — віддають перевагу, коли потрібна краща гідратація та/або у випадку вищої осмоляльності плазми); інший розчин залежно від потреб у рідині, включаючи KCl (10–20 ммоль на кожні 500 мл рідини);
3) перевірте каліємію і, у разі потреби, проведіть поповнення дефіциту калію;
4) контролюйте глікемію під час та після операції (під час інфузії кожну 1 годину, а після стабілізації глікемії, підтвердженої 3 наступними вимірюваннями, можна кожні 2 години); під час операції зберігайте глікемію у межах 5,6–10,0 ммоль/л (100–180 мг/дл) →табл. 13.1-16, уникайте гіпоглікемії.
|
Глікемія |
10 % розчин глюкози (швидкість в мл/год) |
5 % розчин глюкози (швидкість в мл/год)
|
Інсулін в 0,9 % розчині NaCl 1:1a (швидкість в мл/год) |
|
<90 мг/дл (5,0 ммоль/л) |
50 |
100 |
зупиніть інфузію на 15–30 хв |
|
90–120 мг/дл (5,0–6,7 ммоль/л) |
50 |
100 |
0,5–2 |
|
120–180 мг/дл (6,7–10 ммоль/л)б |
50 |
100 |
2–3 |
|
a розчин 1 ОД інсуліну в 1 мл 0,9 % NaCl б При вищій глікемії збільште швидкість введення інсуліну на 1–2 ОД/год на кожні 30–50 мг/дл вище 180 мг/дл (10,0 ммоль/л); у разі глікемії >250 мд/дл (13,9 ммоль/л) припиніть в/в інфузію глюкози, поки вона не знизиться до <180 мг/дл (10 ммоль/л). |
|||
Після операції:
1) з моменту відновлення перорального харчування знову потрібно починати інтенсивну інсулінотерапію, a у разі дефіциту калорій компенсувати його інфузією глюкози;
2) у пацієнтів, які отримували лікування неінсуліновими ЛЗ до операції, після відновлення перорального харчування можна лікувати ЦД так, як і до операції, за умови, що ЦД тоді був задовільно компенсований та немає протипоказань; найкраще повернутися до такого лікування ще до виписки пацієнта з лікарні.
2. Термінова або екстрена операція:
1) максимально можливо компенсуйте глікемію → введіть інсулін у постійній в/в інфузії та забезпечте постачання ≈1000 ккал/добу в/в інфузією глюкози;
2) у разі кетоацидозу (pH <7,3) →розд. 13.3.1 чи лактацидозу →розд. 13.3.3, чи гіперосмолярного синдрому →розд. 13.3.2 → необхідно ліквідувати їх перед операцією; якщо операцію необхідно провести негайно (напр., при кровотечі) → проводьте корекцію ацидозу під час операції;
3) якщо пацієнт вживав метформін у день, в якому проводиться термінова операція → введіть в/в 300 мг (1 амп.) ацетилцистеїну та адекватно наводнюйте хворого з метою попередження розвитку гострої ниркової недостатності.
ПРОФІЛАКТИКАвгору
1. ЦД 1-го типу: ефективні методи відсутні; затримка розвитку хвороби — тепілізумаб, зареєстрований FDA у 2022 р.
2. ЦД 2-го типу: ефективними є збалансована дієта та регулярні фізичні навантаження, що дозволять підтримати належну масу тіла або зменшити надмірну. Пацієнтам із предіабетом (ПГН або ПТГ) рекомендується зменшення маси тіла (на ≥7 % протягом року) та підтримування її за допомогою відповідної дієти та фізичної активності (≥150 хв/тиж.), ступінь якої повинен відповідати можливостям пацієнта. Якщо зміни способу життя не призводять до достатньої втрати маси тіла, розгляньте фармакотерапію ожиріння — перевага надається агоністам рецепторів ГПП-1 із доведеним ефектом щодо зниження ризику ЦД 2-го типу. Якщо розглядаєте хірургічне лікування ожиріння, тоді, згідно з PTD, спочатку слід провести лікування агоністом рецептора ГПП-1 або препаратом, що поєднує агоністи рецептора ГПП-1 та ГІП (реєстрація для лікування ЦД 2-го типу у 2022 р.). Поряд зі зменшенням маси тіла знижується ризик ЦД 2-го типу або його розвиток сповільнюється. В осіб із високим ризиком розвитку ЦД 2-го типу, особливо з супутньою ПГН та ПТГ та/або з ІМТ ≥35 кг/м2, та/або у віці <60 років, а також у жінок після перенесеного гестаційного діабету, одночасно зі зміною способу життя слід розглянути застосування метформіну для профілактики ЦД 2-го типу (незважаючи на його нейтральний вплив на масу тіла [згідно з ADA та EASD 2022]).
3. Активний скринінг ЦД з метою його раннього виявлення та досягнення критеріїв компенсації належить до методів профілактики ускладнень (вторинна профілактика), у разі появи хронічних ускладнень — гальмування їх розвитку та попередження інвалідності є методами третинної профілактики. Пацієнти з діагностованим предіабетом належать до групи підвищеного ризику ЦД — 1 × на рік проводьте ПГТТ або якщо дослідження важко виконати, виміряйте HbA1c. У пацієнтів, які отримують лікування метформіном, припиніть лікування за ≥1 тиж. до ПГТТ. У зв’язку з використанням інгібіторів SGLT2 та агоністів рецепторів GLP-1 також у деяких пацієнтів без попереднього діагностованого діабету, передбачається, що демонстрація значення HbA1c ≥6,5 % (48 ммоль/моль) є достатньою для діагностики діабету без необхідності припинення лікування та підтвердження гіперглікемії, за умови, що результат тесту на HbA1c є надійним.